É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Análise por Citometria de fluxo das células imunológicas Dentro aortas murino
Neste Artigo
Resumo
Este trabalho apresenta um método de citometria de fluxo baseado em investigar a composição imune de aortas. O documento também ilustra uma técnica adicional que permite examinar adventícia circundante e parede do vaso separadamente. Esse método abre possibilidades para realizar análises fenotípica de leucócitos aórtica e aplicar vários ensaios imunológicos para estudos de aterosclerose.
Resumo
A aterosclerose é um processo inflamatório crônico dos vasos de tamanho médio e grande porte que se caracteriza pela formação de placas consistindo em células espumosas, células imunes, vascular células endoteliais e musculares lisas, plaquetas, matriz extracelular, e um núcleo rico em lipídios, com extensa necrose e fibrose dos tecidos circundantes. Os braços uma inata e adaptativa da resposta imune estão envolvidos na iniciação, desenvolvimento e persistência da aterosclerose. 2, 3 Existe um corpo significativo de evidências de que os diversos subgrupos da células do sistema imunológico, tais como macrófagos, dendríticas células, os linfócitos T e B, estão presentes na aorta de ratos saudáveis e aterosclerose propensas a 4. Além disso, as células imunológicas são encontrados na adventícia da aorta ao redor, o que sugere um papel importante deste tecido na aterogênese 2.
Por algum tempo, a detecção quantitativa de diferentes tipos de células do sistema imunológico, o seu estado de ativação e da composição celular dentro da parede da aorta foi limitado pela RT-PCR e métodos de imuno-histoquímica para o estudo da aterosclerose. Foram feitas algumas tentativas para executar a citometria de fluxo utilizando aortas humanas, e uma série de problemas, como um autofluorescência alta, têm sido relatados 5,6. Humana placas ateroscleróticas foram digeridos com colagenase 1 e células livres foram coletadas e coradas para CD14 + / CD11c + para realçar as células de macrófagos derivados de espuma. Neste estudo, um canal de "mock" foi usado para evitar falsos-positivos de coloração. 6 materiais Necrotic acumulando durante o processo de digestão dar origem em uma grande quantidade de detritos que gera uma alta autofluorescência em amostras da aorta. Para resolver esse problema, um painel de controles negativo e positivo tem sido proposto, mas apenas a coloração dupla pode ser aplicado nessas amostras. Nós desenvolvemos um novo método de citometria de fluxo baseado em 7 a analisar a composição das células imunológicas e caracterizar a ativação, proliferação, diferenciação de células do sistema imunológico em aorta saudável e propenso a aterosclerose. Este método permite a investigação da composição das células imunológicas da parede da aorta e abre possibilidades de usar um amplo espectro de métodos imunológicos para investigação de aspectos imunológicos da doença.
Protocolo
1. Isolamento de aortas de camundongos
Aprovação do comitê institucional IACUC do procedimento é necessário para trabalhar com camundongos.
- Prepare heparinzed PBS, acrescentando 1.000 unidades de heparina sódica a 50 ml de PBS e invertendo o tubo para misturar. Prepare um tubo de coleta vazio para o sangue e um tubo de coleta contendo PBS para cada aorta a ser coletado. Manter todos os tubos no gelo.
- Heparinizar uma seringa de sangue de desenho (0,1 ml de Heparina sódica 1.000 U / ml), prepare instrumentos cirúrgicos (dois pares de fórceps curvado, um par de tesouras de dissecação, e um par de microshears), e um estágio de dissecação para a dissecção.
- Euthanize um rato usando dióxido de carbono em uma câmara aprovou seguintes NIH e Institucional políticas comitê IACUC sobre a eutanásia de roedores. Verificar a eficácia antes de transferir o mouse para o estágio de dissecação.
- Brevemente absorver o mouse com etanol 70% e apertar o mouse para o estágio de dissecação. Tirar sangue do rato através de punção cardíaca.
- Abra as cavidades abdominal e torácica. Usando uma seringa de 10 ml com uma agulha de 25 g, completamente perfundir a vasculatura com PBS contendo 2% de heparina para remover completamente sangue dos vasos por punção cardíaca. Certifique-se que não há sangue dentro dos tecidos da aorta. A perfusão deve ser realizada lentamente, com pouca pressão para garantir que todas as placas na parede dos vasos permanecem intactos.
- Dissecar e remover os órgãos viscerais, órgãos geniturinários, o diafragma eo baço, deixando os rins, coração, aorta e intacta.
- Dissecar cuidadosamente os tecidos adiposo e nós linfáticos para-aórticos longe da aorta, deixando a aorta e adventícia intacta. Recolher toda a aorta, incluindo arco aórtico, ascendente, descendente, torácica, abdominal e porções. Coloque a aorta isolada em um tubo de coleta com PBS. Durante o procedimento de isolamento, tente manter a umidade do vaso.
2. Preparação de suspensões única célula
- Criar uma 1X Aorta dissociação Solução estoque de enzimas (ADES) (125 U / ml de colagenase tipo XI, 60 do tipo U / ml Hialuronidase 1-s, 60 U / ml DNase I, e 450 U / ml de colagenase tipo I, em 2,5 ml de PBS, modificado a partir Galkina et al. 7). Todas as enzimas são da Sigma-Aldrich. Coloque a solução enzimática de ações no gelo.
- Remover o PBS do tubo de coleta contendo a aorta. Adicionar 2,5 ml de 1X ADES a cada aorta. Corte o aortas em pedaços pequenos para facilitar a digestão enzimática ou deixar toda a aorta intacta. Incubar as aortas com a solução de enzima 1X por 1 hora a 37 ° C (mais lenta agitação é opcional).
- Após a incubação de 1 hora, preparar suspensões única célula da aorta digerido pelo corte as aortas além e passá-los através de um filtro de células 70 mM em tubos de 5 ml de polipropileno FACS (BD Falcon). Agregar as células por centrifugação (400xg, a 5 minutos, 4 ° C).
- Ressuspender as células em 1 ml de tampão FACS (PBS suplementado com BSA 1% e 0,05% NaN 3) e determinar quantas células estão presentes na suspensão celular aórtica usando azul de tripano, um hemocitômetro, e um microscópio de luz. O número total de células obtidas após a digestão vai depender da idade do mouse e dieta ou a gravidade da aterosclerose.
3. Coloração citometria de fluxo
- Rotular um número apropriado de sondas novas FACS. Em geral, os experimentos de citometria de fluxo deve ter um tubo de controle não-manchado, conjunto de tubos de cor única, apropriada fluorescência-menos-um controles (FMO) 8, controles isotipo apropriado, e um conjunto de tubos experimental. Uma vez que há um número limitado de leucócitos aórtica que podem ser isoladas, os leucócitos do baço pode ser usado para executar a coloração único controle.
- Nós usamos um protocolo de citometria de fluxo padrão para manchar suspensões de células de aorta. Resumidamente, a transferência de uma alíquota de 0,5-1x10 6 células de uma suspensão de células de aorta em um tubo FACS (s). Adicionar 1 ml de tampão FACS e agregar as células por centrifugação. Retire o sobrenadante das células peletizada por decantação.
- Prepare Fc solução bloco e cocktails de anticorpos para os tubos experimental, de fluorescência-menos-um tubos e tubos de isotipo. Adicionar 100μl de Fc bloco na FACS buffer (14.2μg/ml, clone 2.4G2) para todos os tubos e agite suavemente dedo ou vortex para ressuspender as células. Incubar as amostras por 15-20 minutos em temperatura ambiente.
- Prepare coloração de anticorpos, coloração isotipo ou cocktails coloração FMO controle. Determinar a concentração ideal de anticorpos em seus experimentos de titulação preliminar. Na presença de bloqueio de Fc, adicione cocktails de anticorpos (100ul/0.5-1.0x10 6 células) para os tubos de amostra. Incubar por 20-30 min a 4 ° C no escuro.
- Adicionar 1 ml de tampão FACS a cada tubo, vortex para misturar e agregar as células por centrifugação. Repita o procedimento mais uma vez.
- Decantar o sobrenadante e ressuspenderas células peletizadas em 300 ul de PFA 2%. Executar os exemplos em um citômetro de fluxo.
- Nota: Normalmente anticorpo anti-CD45 (marcador de antígeno leucocitário comum) é adicionado a todas as amostras, a fim de portão CD45 + leucócitos depois 7 Além disso, CD45 FMO e controles isotipo deve ser usado inicialmente para colocar o portão CD45 + leucócitos como. CD45 expressão pode variar entre os leucócitos.
- Nota: Para detectar baixa densidade expressar antígenos de superfície ou antígenos evento baixo, use "fluorocromos brilhante" como o R-Ficoeritrina (PE) ou Allophycocyanin (APC). Além disso, eventos raros pode ser detectado por vários pooling aortas combinados juntos, no entanto, se mais de um milhão de células são usadas, a quantidade de anticorpos utilizados para ensaio deve ser aumentado proporcionalmente.
- Nota: Para garantir que não há contaminação de sangue mínima nas aortas isoladas e, consequentemente, a suspensão de células de aorta, em alguns experimentos coloração adicional foi realizada para TER-119, 7 um antígeno expresso por células vermelhas do sangue (RBC). O número de RBC para as células brancas do sangue (WBC) no sangue é de aproximadamente 10x10 6 células / mL para células 8x10 3 / mL. Com base na expressão do TER-119 em amostras de aorta, o percentual de derivados do sangue glóbulos brancos do sangue na amostra pode ser calculada. Normalmente temos menos de 0,02% de derivados do sangue WBC em amostras da aorta. (Fig.1)
- Nota: Como o tratamento enzimático pode afetar a expressão dos antígenos de superfície, a resistência à digestão enzimática deve ser determinada para os antígenos de interesse. Resumidamente, linfonodos periféricos (PLN) ou pequenos pedaços de baço são incubadas com ou sem coquetel de enzimas para 1 hora a 37 ° C. Depois de uma hora, a expressão de antígenos é determinada por citometria de fluxo. O coquetel de enzimas não tem efeito sobre vários antígenos de superfície (Fig.2) 7. Em alguns outros casos, o tratamento enzimático resultaram em uma perda significativa de expressão antigênica. Este problema pode ser contornado utilizando marcadores de células alternativa.
- Nota: coloração viabilidade Live / célula morta pode ser realizada após o passo 4, se desejar. Normalmente usam Live / Morto kit celular fixável Morto Stain (Invitrogen, Molecular Probes). Para manchar as células com corante Live / Dead, criar uma solução 1x Live / Dead by acrescentando 1μl de re-dissolvido corante ao vivo / morto em 1 ml de PBS e vortex para misturar. Adicionar 100-200 mL de corante 1x Live / Dead to ao vivo / morto cocktail, solteiro, FMO e amostras de controle de isotipo. Incubar as amostras com o corante em temperatura ambiente por 10 minutos no escuro. O tubo de controle único para o Live / Dead devem ser incubados a 56 ° C no escuro por 10 minutos para matar as células por choque térmico. Lavar as células com 1 ml de células da PBS e pellet por centrifugação. Resume o protocolo no passo 5.
- Nota: coloração intracelular de antígenos intracelulares e citocinas é compatível com este protocolo. Resumidamente, coloração intracelular pode ser realizada utilizando a fixação de células / reagentes permeabilização da BD PharMingen, eBioscience, ou laboratórios Caltag - dependendo do antígenos de interesse. Para corrigir e permeabilizar as células para a coloração intracelular, realizar a etapa de fixação / permeabilização, seguindo as instruções do fabricante, após a etapa de coloração extracelular (seção 3 passo 5). Após a etapa de lavagem intracelular, retomar nosso protocolo na etapa 6 (passo seção 3 6).
4. Análise de citometria de fluxo de isolados adventícia circundante e parede do vaso
Como leucócitos podem migrar para a adventícia da aorta, assim como placas ateroscleróticas dentro da parede da aorta, para examinar os leucócitos e adventícia da aorta por citometria de fluxo de um protocolo para isolar e realizar citometria de fluxo nestes dois sítios anatômicos foi desenvolvido. 9 Em suma, antes da aortas todo são digeridos com ADES (Seção 2, etapa 2) a adventícia da aorta é parcialmente digerido e removido para o resto do navio. Uma vez que a adventícia é removida e posta de lado, o resto da aorta é digerido com ADES para libertar leucócitos da parede do vaso.
- Adventícia da aorta Isolamento Protocolo
- Após a preparação da 1X ADES (seção 2 passo 1), prepare 2,5 ml / aorta de 1X aórtica solução enzimática digestão adventícia (AADES) (781,25 U colagenase II e 14,0625 U Elastase em 2.5mls PBS (Worthington Corp bioquímicos, Lakewood, NJ )). 9 Coloque a solução estoque em gelo até o uso.
- Remover o PBS do tubo de coleta contendo a aorta. Adicionar 2,5 ml de 1X AADES a cada aorta. Não corte o aortas em pedaços pequenos. Incubar as aortas com a solução de enzima 1X adventícia por 10-20 minutos a 37 ° C.
- Após a digestão 10-20 minutos, a transferência da aorta parcialmente digeridos para fora da 1X AADES a uma placa de Petri com PBS fresco. Com muito cuidado, usando dois pares de fórceps curvos, descascar a camada adventícia longe from a aorta como uma única unidade.
- Nota: Os tempos de digestão mais longos torná-lo mais fácil de remover a adventícia, entretanto, se a adventícia é over-digerida vai rasgar.
- Quando a adventícia foi completamente removido, a transferência da adventícia e da aorta para tubos separados FACS. Adicionar 1 ml de PBS para o tubo adventícia, e colocar o tubo no gelo. Adicionar 2,5 ml de 1X solução enzimática dissociação aorta ao tubo de aorta e incubar a aorta por 40 minutos a 37 ° C.
- Nota: Para facilitar a digestão enzimática, a aorta pode ser dividida em partes menores neste momento.
- Após a digestão 40 minutos, coloque o tubo de aorta no gelo e preparar suspensões única célula da aorta e adventícia pela corte as aortas e adventícia além e passá-los através de um filtro de células 70 mM em tubos de 5 ml de polipropileno FACS (BD Falcon). Agregar as células por centrifugação (400xg, a 5 minutos, 4 ° C). Voltar para seção 4 o passo 2 e retomar o protocolo.
5. Resultados representante
Apresentamos aqui uma série de figuras que demonstra citometria de fluxo coloração para analisar a composição imune de aortas todo, a parede do vaso da aorta e da adventícia da aorta ao redor. Primeiro, nós demonstramos uma trama FACS representante que mostra uma coloração TER-119 no sangue total e suspensão de células isoladas da aorta (Fig. 1). TER-119 positivas células vermelhas do sangue responsáveis por 18% das células em suspensão de células de aorta, o que indica que apenas 0,014% das células isoladas a partir de suspensões de células de aorta são derivados do sangue. Este é um experimento de controle importante que demonstra claramente que os navios digeridos, mas que não circula no sangue periférico é a fonte para a maioria dos leucócitos analisadas em suspensão de células de aorta. Além disso, para validar o método, foram avaliados os efeitos do coquetel de enzimas aorta dissociação de antígenos de superfície esplenócitos (Fig. 2). O coquetel de enzimas não tem efeitos sobre a expressão de vários antígenos, incluindo, CD45, CD19, CD3, TCRαβ, TCRγδ e vários outros antígenos de superfície 7.
CD45 coloração em conjunto com o Live / Morto corante viabilidade e controles apropriado do isotipo são usados para detectar e sub-gate populações de maior interesse e para excluir restos celulares durante a análise. Na Fig.3 aórtica, ao vivo CD45 + leucócitos foram fechadas para determinar a porcentagem de células IFN Υ + T dentro do aortas conjunta de dois jovens ApoE - / - ratos. Para enfatizar a versatilidade deste método, usando o esquema apresentado na Fig.3 gating, apresentamos na Fig.4 coloração representante intracelular de CD68 + CD11b + macrófagos e IFNγ + + TCRαβ células de dois ApoE - / - ratos alimentados com dieta ocidental para 12 semanas. Como esperado, no oeste da dieta alimentar ApoE - / - aortas, a maioria dos leucócitos dentro da aorta são macrófagos (40% CD68 + CD11b +) ou de outras células mielóides (CD11b CD68 + baixa e CD11b CD68 +). Além disso, células Th1 compreendem uma maior porção da aorta se infiltrando TCRαβ células T (Fig.4). Como a percentagem global de leucócitos aórtica e subconjuntos de leucócitos varia dependendo da idade do mouse e gravidade da aterosclerose, a estratégia de propagação ideal para populações de maior interesse deve ser determinada empiricamente
Para demonstrar a viabilidade de isolar adventícia da aorta para a coloração de citometria de fluxo, apresentamos representante CD45 + coloração de leucócitos para suspensões de células aórticas e adventícia (Fig. 5). Resumidamente, três com idades entre ApoE - / - aortas de rato foram digeridos e agrupados como descrito acima (Seções 2 e 4). Infiltrando CD45 + leucócitos foram detectados em ambos os adventícia (18% de suspensão de células) e restante da aorta (11% de suspensão de células).
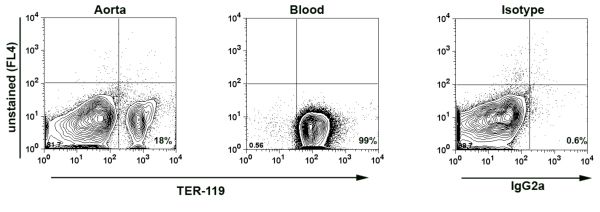
Figura 1. Aorta TER-119 coloração em suspensão digerida aórtica celular. Perfundidos foi por punção cardíaca com PBS contendo heparina de 2%. Em seguida, a aorta foi digerido com o coquetel de enzimas para 1 hora a 37 ° C. Suspensão de células aórticas e amostra de sangue (como um controle positivo) foram coradas com anti-TER-119-PE Abs e analisadas por citometria de fluxo. TER-119-positivos vermelhas do sangue conta as células por 18% de todas as células em suspensão de células de aorta indicando que apenas 0,014% de todos os leucócitos isolados de aorta é provável que sejam derivados do sangue leucócitos.

Figura 2. Enzyme-cocktail de tratamento não tem efeitos sobre a CD45 (top) ou CD19 (baixo) expressão em linfócitos. a partir de suspensões de células não tratadas (A, B) e tratados com a enzima cocktail (C, D) LN foram obtidos e corados com APC-Cy7-conjugados anti-CD45 e APC-conjugados anti-CD19 mAbs. (A, C) Os números representam as percentagens de leucócitos CD45 + no gate R1. (B, D) Os números representam a porcentagem de CD45 + / CD19 + linfócitos. Os perfis são delimitação de leucócitos CD45 +.
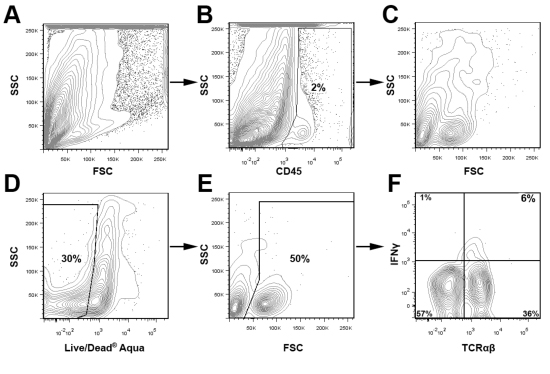
Figura 3 Gating estratégia para a análise de leucócitos aórtica Dois aortas foram isolados e agrupados de ApoE propensas aterosclerótica -.. / - Ratos e suspensões de células de aorta foram preparadas como descrito acima. As suspensões de células foram coradas para CD45 (PerCP), TCRαβ (FITC), IFNγ (eFluor 450), e ao vivo / morto Aqua, e analisados utilizando um Cytek DXP 8 Cor atualizado BD FACS Calibur. Resumidamente, CD45 + Leucócitos foram gated (B) e depois analisados (CF). Células mortas foram retiradas da análise baseada no Live / Dead coloração Aqua (D) e parcelas FSC (E). Leucócitos ao vivo aórtica foram então examinadas para TCRαβ e IFNγ expressão (F).
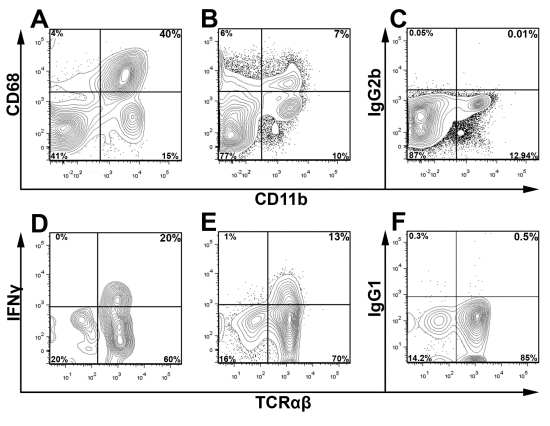
.. Suspensões de células Figura 4 coloração intracelular de antígenos intracelulares e citocinas foram preparados a partir de um conjunto ApoE - / - aorta e do baço como descrito. Aórtica (A) e suspensões de células esplênicas (B, C) foram coradas para CD45, CD11b, CD68 e ou um controle isotipo usando BD Cytofix / Cytoperm Kit ™ (BD Biosciences). Células foram fechadas em leucócitos CD45 + e detritos foi excluído com base nos perfis de dispersão para a frente e lateral. Para a coloração de IFNγ intracelular, suspensões de células aórticas e baço foram cultivados por cinco horas em RPMI 1640 suplementado com Golgi parar, PMA, e C Ionomicina, como descrito anteriormente 9. Stimulated aórtica única (D) e baço (E, F) As suspensões celulares foram posteriormente corados com CD45 (PerCP), TCRαβ (FITC), CD3 (APC-Cy7), Live Aqua Morto, e IFNγ (eFluor 450; E) ou um isotipo (IgG1-eF450, F). Células T (DF) foram fechadas ao vivo a partir de CD45 + CD3 + leucócitos (CD45 + Live / Aqua-Morto) e examinados para TCRαβ e IFNγ.
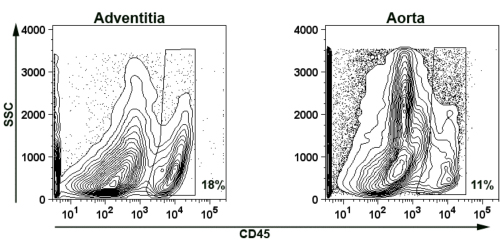
.. Figura 5 Imagem representativa de isolados de camundongos e adventícia da aorta parede do vaso da aorta Representante enredo citometria de fluxo contra demonstra a presença de células CD45 + T na adventícia e na parede da aorta de idade ApoE - / - ratos. SSC lado de dispersão. Para eliminar autofluorescência de detritos e tecidos necróticos, parcelas foram fechadas para FSC> 750. Para evitar autofluorescência adicionais de doublets os portões foram também estabelecidas como FSC <3500, SSC <3500. As percentagens indicam células CD45 + nas portas.
Discussão
Aqui, apresentamos um método de citometria de fluxo baseada na investigação da composição das células imunológicas de aortas de camundongos. A principal vantagem deste método é a capacidade de analisar aórtica células do sistema imunológico em uma única célula e níveis para caracterizar o status de ativação de leucócitos aórtica. Este método não é restrito a aortas de camundongos e nós (dados não publicados) e outros 10 usado essa abordagem para analisar amostras humanas, tais como art...
Divulgações
Agradecimentos
Este trabalho foi financiado pelo National Institutes of Health subvenção: PO1 HL55798 (para KL) e American Heart Association Scientist Desenvolvimento Grant 0525532U (para EG).
Materiais
| Name | Company | Catalog Number | Comments |
| Material | Número de catálogo | Companhia | |
| Colagenase XI | C7657 | Sigma-Aldrich | |
| Hialuronidase | H3506 | Sigma-Aldrich | |
| DNase I, tipo 2 | D4527 | Sigma-Aldrich | |
| Colagenase I | C0130 | Sigma-Aldrich | |
| Colagenase II | LS004174 | Worthington Corporação Bioquímica | |
| Elastase | LS002292 | Worthington Corporação Bioquímica |
Referências
- Lusis, A. J. Atherosclerosis. Nature. 407, 233-2341 (2000).
- Galkina, E., Ley, K. Immune and inflammatory mechanisms of atherosclerosis. Annu Rev Immunol. 27, 165-197 (2009).
- Hansson, G. K., Libby, P. The immune response in atherosclerosis: a double-edged sword. Nat Rev Immunol. 6, 508-519 (2006).
- Galkina, E., Ley, K. Leukocyte influx in atherosclerosis. Curr Drug Targets. 812, 1239-1248 (2007).
- Bonanno, E., Mauriello, A., Partenzi, A., Anemona, L., Spagnoli, L. G. Flow cytometry analysis of atherosclerotic plaque cells from human carotids: a validation study. Cytometry. 39, 158-165 (2000).
- Liu-Wu, Y., Svenningsson, A., Stemme, S., Holm, J., Wiklund, O. Identification and analysis of macrophage-derived foam cells from human atherosclerotic lesions by using a "mock" FL3 channel in flow cytometry. Cytometry. 29, 155-164 (1997).
- Galkina, E., Kadl, A., Sanders, J., Varughese, D., Sarembock, I. J., Ley, K. Lymphocyte recruitment into the aortic wall before and during development of atherosclerosis is partially L-selectin dependent. J Exp Med. 203, 1273-1282 (2006).
- Tung, J. W., Parks, D. R., Moore, W. A., Herzenberg, L. A., Herzenberg, L. A. New approaches to fluorescence compensation and visualization of FACS data. Clin Immunol. 110, 277-283 (2004).
- Smith, E., Prasad, K. M., Butcher, M. Blockade of interleukin-17A results in reduced atherosclerosis in apolipoprotein E-deficient mice. Circulation. 121, 1746-1755 (2010).
- Eid, R. E., Rao, D. A., Zhou, J. Interleukin-17 and interferon-gamma are produced concomitantly by human coronary artery-infiltrating T cells and act synergistically on vascular smooth muscle cells. Circulation. 119, 1424-1432 (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados