Method Article
Ex Infecção Vivo de tecido vivo com Vírus Oncolíticos
Neste Artigo
Resumo
Oncolíticos vírus são promissores para o câncer de terapêutica. A capacidade de determinar a infectability de amostras de tecido vivo obtidos de pacientes antes do tratamento é uma vantagem exclusiva dessa abordagem terapêutica. Este protocolo descreve como processo de tecidos para Ex vivo Infecção com o vírus oncolytic e quantificação viral subseqüente.
Resumo
Vírus Oncolíticos (OVS) são novas terapêuticas que, seletivamente, replicar e matar as células tumorais 1. Vários ensaios clínicos avaliando a eficácia de uma variedade de plataformas, incluindo oncolytic HSV, reovírus e OVS Vaccinia como tratamento de câncer estão atualmente em andamento 2-5. Uma característica chave do vírus oncolytic é que eles podem ser geneticamente modificados para expressar transgenes repórter que torna possível visualizar a infecção dos tecidos por microscopia ou bio-luminescência de imagens 6,7. Isto oferece uma vantagem única vez que é possível infectar os tecidos de pacientes ex vivo antes da terapia, a fim de verificar a probabilidade de sucesso virotherapy oncolytic 8. Para este fim, é fundamental para adequada amostra de tecido para compensar a heterogeneidade do tecido e avaliar a viabilidade do tecido, particularmente antes da infecção 9. Também é importante seguir a replicação viral utilizando transgenes repórter se expressa pela plataforma oncolytic, bem como por titulação direta de tecidos após a homogeneização, a fim de discriminar entre infecção abortiva e produtivo. O objeto deste protocolo é para abordar estas questões e aqui descreve um. A amostragem ea preparação do tecido tumoral para cultura de células 2. A avaliação da viabilidade tecidual utilizando o corante alamar blue metabólica 3. Infecção ex vivo de tecidos cultivados com o vírus vaccinia expressando GFP ou seja firefly luciferase 4. Detecção da expressão do transgene por microscopia de fluorescência ou usando um In Vivo Imaging System (IVIS) 5. Quantificação do vírus por ensaios de placa. Este método abrangente apresenta várias vantagens, incluindo a facilidade de processamento de tecidos, a compensação para heterogeneidade de tecidos, o controle da viabilidade tecidual, ea discriminação entre a infecção abortiva e replicação viral fide osso.
Protocolo
1. Processamento de tecidos
- Para melhores resultados, este protocolo deve ser realizado com recém-tecido isolado depositados em media DMEM contendo 10% FBS, 1% de solução Pennicilin / estreptomicina e 0,1% Anfotericina B solução imediatamente após a cirurgia antes do processamento. Se isso não for possível, os tecidos podem ser deixados durante a noite neste meio a 4 graus antes do processamento.
- Antes do processamento da amostra, esterilizar pinças de metal e lâminas descartáveis, colocando-os em uma solução de etanol 70% por pelo menos 5 minutos. Também preparar uma placa de 24 poços com 2 ml de DMEM mídia contendo 10% FBS, 1% de solução Pennicilin / estreptomicina e 0,1% Anfotericina B.
- Coletar a amostra de tecido em um fluxo laminar de cultura de células usando uma pinça esterilizada e depositar o tecido em um prato de 15 centímetros vazio petri, mantendo a tampa ao lado, o lado estéril para cima.
- Na capa de cultura de células, use de 2 mm biópsia com punch de obter diferentes cores de uma variedade de regiões dentro do tecido como na Figura 1. Depósito dos núcleos na tampa do petri de 15 cm com a ajuda de uma pinça, deixando espaço suficiente entre cada núcleo, para que possam ser facilmente cortados ao longo do eixo horizontal.
- Dividir cada núcleo em 4 / 4, mesmo usando uma lâmina de barbear esterilizados, conforme a Figura 1.
- Usando a ponta da pipeta, coloque cada trimestre do núcleo de um núcleo em um dado bem diferente de A1 a A4 como na figura 1, já contendo 1,5 ml de DMEM contendo 10% FBS, 1% de solução Pennicilin / estreptomicina e 0,1% Anfotericina solução B . Repita o procedimento para cada núcleo. Isso deve permitir uma amostragem representativa do tumor, minimizando viés de um bem dado / condição. Para uma melhor representação, aumentar o número de núcleos.
2. Avaliação da viabilidade tecidual
- Processamento de tecidos seguir, adicione 25μl Alamar blue para o bem # A1 e A2 #, como mostrado na figura 1 e incubar por 1 hora a 37 graus em uma incubadora umidificada com 5% de CO 2.
- Após a incubação com alamar azul, remova 3 vezes 100 l de cada A1 e A2 bem e transferir a 6 diferentes poços de uma placa de 96 poços. Ler o sinal através de um leitor de placas de fluorescência (excitação 530, 590 emissões) e manter os dados em seus registros.
- Depois de Alamar sinal azul foi lido, a transferência de todas as peças de tecido usando uma ponta da pipeta, de bem A1 a C1 que contém DMEM, FBS 10% + PS + AmphoB. Tenha cuidado para não transferir uma quantidade excessiva de meios de comunicação de bem A1.
- Infectar poços A3 e A4, respectivamente com 10 PFU 6 de GFP-luciferase expressar e expressar-vírus vaccinia diluída em 25 mL de mídia. Bem A2 pode ser infectado com um vírus que que expressa qualquer transgene dada incluindo nenhum.
- 72 horas depois, adicionar 25 mL Alamar blue aos poços C1 e D1 e repita o passo 2,2
3. Visualização de GFP expressão do transgene por microscopia de fluorescência
- Remova toda a mídia de cultura de células que cobrem os pedaços de tecido a fim de ter bom imagens de fluorescência.
- Usando um microscópio de fluorescência dissecção com capacidade, primeiro dar uma imagem de contraste de fase em uma resolução apropriada
- Alternar para o modo de fluorescência e tirar uma foto usando o filtro apropriado para visualizar o transgene de interesse, neste caso GFP.
- Use um filtro de fluorescência para outro comprimento de onda até um possível daquela do transgene de interesse (como RFP) para tirar uma foto de fluorescência de fundo
4. Visualização de expressão usando um luciferase In Vivo Imaging System (IVIS)
- Certifique-se que o IVIS é inicializado antes de começar.
- Em poços A4 e B4, adicionar 5 mL de substrato luciferina 10 mg / ml, misture bem e incubar por 5 minutos em temperatura ambiente.
- Definir o tempo de exposição IVIS a 5 segundos e tirar uma foto de seus poços. Se a imagem está saturado, repetir com menor tempo de exposição. Se não houver nenhum sinal, aumentar o tempo de exposição.
- Usando o software de imagem IVIS, você pode remover fundo usando o sinal de bem B4 e selecione a região de interesse para quantificar o sinal de luminescência.
5. Avaliar os títulos viral através do teste de placa
- Antes de quantificação viral títulos, os tecidos devem primeiro ser homogeneizadas para liberar partículas virais. Isto pode ser feito alguns meses mais tarde nas amostras de tecidos infectados são armazenadas a -80
- Pesar a amostra que deve ser homogeneizada utilizando uma balança analítica. Neste caso, vamos usar a amostra coletada a partir de A2 bem.
- Coloque o tecido está em 5 ml de poliestireno de fundo redondo de tubo falcon e adicionar 1 ml de PBS. Homogeneizar o tecido usando um homogeneizador de tecidos. Se necessário, armazenar a -80 o homogeneizado para avaliação dos títulos viral em um momento posterior.
- A titulação do vírus vaccinia, primeira placa 1 milhão de células em um prato U2OS 6-bem e incubar durante a noite em um grau 37, 5% de CO 2 úmidoified incubadora de tal forma que eles tenham atingido cerca de 95% a confluência dia seguinte.
- Use soro de mídia livre para fazer diluições seriadas do vírus, certificando-se de mudar dicas entre cada etapa de diluição. Normalmente fazemos uma em 10 diluições e uso 100 l para transferir para 900 mL. Quantas diluições são feitas depende do rendimento de vírus previsto.
- Após fazer as diluições, remova a mídia que cobre as células U20S banhado em seguida, adicione 500 mL de estoque vírus diluído (para cada diluição) para infectar as células U2OS. Incubar as células de um minuto hora a 37 graus Celsius em 5% incubadora de CO 2 umidificado.
- Durante esse tempo, aquecer o X 2 concentrada DMEM contendo 20% FBS, ea solução a 3% CMC em banho-maria 37 graus.
- Após a incubação de 1 hora, retire os meios de comunicação que cobrem as células infectadas U2OS. Mix 01:01 volumes de 3% CMC: 2X DMEM, 20% FBS juntos e usar 2 ml desta mistura para cobrir cada poço das células infectadas U2OS.
- Coloque as células de volta em um 37 graus 5% incubadora de CO 2 umidificado por mais 48 horas.
- Após 48 horas, adicionar 2 ml de metanol-ácido acético fixador em cima da sobreposição CMC em cada poço e incubar à temperatura ambiente por 10 minutos em uma capa de cultura de células.
- Descartar a sobreposição fixa e lavar restante fora dos poços com água da torneira.
- Mancha as células fixas U2OS com 2 ml de solução de azul de Coomassie por poço e incubar por 30 minutos em temperatura ambiente em baixa velocidade em uma placa de shaker.
- Remova a mancha coomassie dos poços e lavar os pratos com água da torneira. Deixe secar com tampa off por aproximadamente uma hora.
- As placas resultante viral pode ser facilmente visualizado na figura 2C. As placas podem ser armazenadas indefinidamente nesta fase.
- Contagem de placas na etapa de diluição, onde entre 10 e 100 placas são visíveis.
- Multiplicar o número de placas contados pela diluição usada e multiplicar o número resultante por 2 a dar um título em PFU / ml. Por exemplo, se 25 placas são contados no poço onde uma diluição milhão de vezes foi utilizado, a título de amostra inicial não diluída é de 25 multiplicado por um milhão multiplicado por 2 ou 50 milhões de PFU / ml. Dividir ainda mais este número pelo peso inicialmente medida para a amostra de relatório títulos em UFP / g
6. Resultados representativos:
, A fim de determinar com precisão se uma amostra de tecido obtidas cirurgicamente normal / tumor é ou não é infectáveis com o vírus, é preciso primeiro garantir que a amostra de tecido é pelo menos viável. Fig. 1A mostra que a viabilidade pode ser avaliada utilizando um corante metabólica (Alamar blue) e que o tecido normal e tumor pode permanecer metabolicamente ativas durante um período de pelo menos 72h. Isto sugere que os tecidos ex vivo de cultura pode suportar a replicação viral. Uma vantagem significativa de vírus oncolytic é que eles podem ser projetados para expressar transgenes terapêuticos ou de imagem. Fig. 2D-E mostra que a GFP ou luciferase podem ser detectados a partir de tecidos infectados ex vivo, um maior apoio que esses tecidos são viáveis e também infectáveis. Embora a expressão do transgene aumento é geralmente associado com a replicação viral, não necessariamente equivale a um ciclo de vida produtiva viral que leva à auto-ampliação e disseminação, o que é pensado para ser importante para a atividade terapêutica. Por esta razão, é necessário determinar se mais vírus é produzido do que o que inicialmente foi usada para infectar o tecido. Fig. 2B mostra que após a quantificação viral pelo ensaio de placa, mais vírus é obtida após 72 horas depois da infecção dos tecidos coletados imediatamente após a infecção. Em geral, estes dados mostram que o tecido do tumor extirpado cirurgicamente podem permanecer viáveis em cultura de células por um período de pelo menos 72 horas, durante o qual a replicação viral tempo pode ser suportada.

Figura 1. Visão geral do tecido amostragem / secção de protocolo. Amostra de tecido é processado através da remoção de vários núcleos de 2 mm, que são posteriormente divididos em quatro quartos, que são distribuídos aleatoriamente em poços A1-A4. Os códigos de cores indicam os reagentes utilizados em cada poço. Os quadrados cinza sombreado dentro dos poços representam cada trimestre a partir da 6 núcleos individuais descritos. O tecido em bem A1 é transferido para um novo poço (C1) com a mídia após a leitura inicial alamar azul. A segunda leitura é feita no final da incubação de 72 horas com vírus. Wells A4 e B4 são complementados com Luciferina após a incubação 72 horas pós-infecção
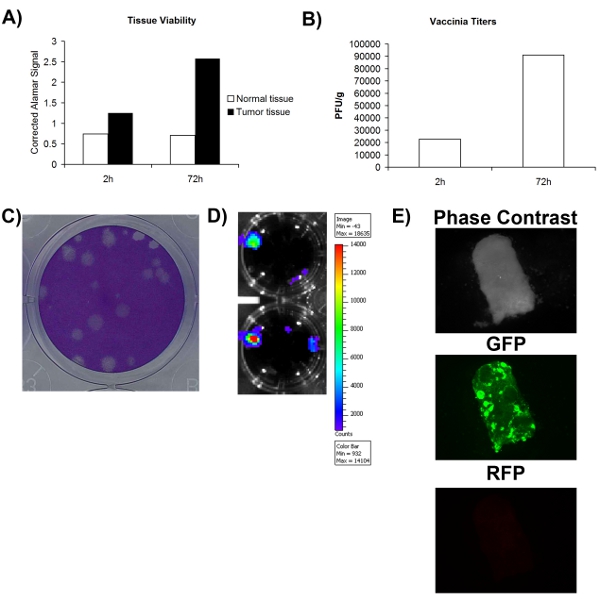
Figura 2. Viabilidade e infectability de amostras de tecido do paciente. A) a viabilidade do tecido medida pelo alamar sinal azul em 2 horas e 72 horas após a coleta. Eixo Y representa o espaço em branco corrigido alamar sinal azul. B) título de vaccinia viruscoletados por grama de amostras de tecido 2 e 72 horas pós-infecção C). Exemplo de placas vírus vaccinia nas células U2OS seguintes coomassie coloração. D) do sinal de luminescência obtidos a partir de tecido VV-luciferase pacientes infectados fotografada usando IVIS. E) imagens de microscopia de fluorescência de amostra de tecido do paciente infectado com VV-GFP.
Discussão
Um dos passos críticos neste protocolo é a obtenção de amostra de tecido fresco. Se a amostra é colocada em cultura de células após uma longa espera na sala de operação em um meio inadequado (por exemplo PBS), isso pode comprometer a viabilidade do tecido e evitar infectability. De nota, o tecido normal é inerentemente mais propensa a estes efeitos que os tecidos do tumor. Outro ponto crítico é quantos núcleos são usados para amostra do tecido e da coerência de seu tamanho. Inconsistências no tamanho levará a variabilidade entre as amostras do paciente já que fatores como hipóxia tecidual e superfície infectectable irá flutuar, dependendo do tamanho dos núcleos e bairros centrais. Embora isso possa ser parcialmente resolvido usando cortadores de tecido, uma vantagem do método apresentado aqui é que é relativamente fácil, menos propenso à contaminação, e amplamente aplicável a uma variedade de tipos de tecidos, incluindo tecidos moles ou viscoso que não são facilmente passíveis corte para o tecido. Nomeadamente, o número de núcleos pode ser aumentada a fim de obter uma melhor representação dos tecidos. Além disso, os núcleos podem ser cortados em pedaços mais (ex. 5-8) para acomodar outros ensaios potencial para ser feito em paralelo, tais como DNA, RNA, ou extração de proteínas. No entanto, o número de peças em que os núcleos podem ser cortadas em tamanhos reprodutíveis vai depender do tamanho real dos núcleos, que podem ser modificados usando diferentes corers porte. Opcionalmente, uma forma de ajudar a obter pedaços de tecido reproducibly tamanho é igualar o comprimento dos núcleos usando uma régua antes subdividindo-os em pedaços menores. O protocolo pode naturalmente ser modificado para acomodar outros vírus e nós descobrimos que os tecidos podem ser viáveis e suporte a replicação para até 6 dias. O protocolo pode ainda ser estendida a outras medidas de virally-expressa transgenes incluindo cytrokines. Após a infecção, os tecidos também podem ser incluídos em parafina para posterior corte e coloração pelos métodos de imuno-histoquímica, que permite o aperfeiçoamento da histologia do tecido e como se relaciona a uma infecção viral 10-12.
Divulgações
Agradecimentos
Gostaríamos de agradecer ao Dr. Hesham Abdelbary humana para a prestação de espécimes cirúrgicos para os dados apresentados na Figura 2.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários (opcional) |
|---|---|---|---|
| DMEM alta glicose | Hyclone | SH30243.01 | |
| Soro fetal bovino | NorthBio Inc. | NBSF-701 | |
| Anfotericina solução B | Sigma Aldrich | A2942 | Use a 0,1% |
| Pennicilin Estreptomicina- | Sigma Aldrich | P4333 | Use a 1% |
| Alamar Azul | Invitrogen | DAL1025 | |
| D-Luciferina sal de potássio | Molecular Imaging Products | D-sal de potássio Luciferina 1g | Ressuspender em PBS a 10 mg / ml e filtrar em filtro de 0,22 mM |
| MEM pó | Gibco | # 41500018 | Fazer na metade do volume sugeriu fazer MEM 2X e filtrar em filtro de 0,22 mM antes do uso |
| Carboximetil celulose (CMC) | Sigma Aldrich | C9481 | Fazer uma solução de 3% em água deionizada e autoclave. Note-se que o pó pode levar algum tempo para voltar a suspender |
| Coomassie Brilliant Blue R | Sigma Aldrich | B7920 | |
| 2 milímetros biópsia com punch | Miltex | MX-33-31 | |
| Blades Prep Double Edge | Personna Medical Care | 74-0002 | |
| Microscópio de fluorescência dissecção | Leica | modelo M205 FA | |
| In vivo de imagens do sistema (IVIS) | Caliper Life Sciences | IVIS ® série 200 | |
| Tearor tecido | Produtos Biospec | modelo 985370-395 |
Referências
- Parato, K. A., Senger, D., Forsyth, P. A., Bell, J. C. Recent progress in the battle between oncolytic viruses and cancer. Nat Rev Cancer. 5, 965-976 (2005).
- Renouf, L. C., Thway, K., Sibtain, A., McNeish, I. A., Newbold, K. L., Goldsweig, H., Coffin, R., Nutting, C. M. Phase I/II study of oncolytic HSV GM-CSF in combination with radiotherapy and cisplatin in untreated stage III/IV squamous cell cancer of the head and neck. Clin Cancer Res. 16, 4005-4015 (2010).
- Lal, R., Harris, D., Postel-Vinay, S., de Bono, J. Reovirus: Rationale and clinical trial update. Curr Opin Mol Ther. 11, 532-539 (2009).
- Park, B. H., Hwang, T., Liu, T. C., Sze, D. Y., Kim, J. S., Kwon, H. C., Oh, S. Y., Han, S. Y., Yoon, J. H., Hong, S. H., Moon, A., Speth, K., Park, C., Ahn, Y. J., Daneshmand, M., Rhee, B. G., Pinedo, H. M., Bell, J. C., Kirn, D. H. Use of a targeted oncolytic poxvirus, JX-594, in patients with refractory primary or metastatic liver cancer: a phase I trial. Lancet Oncol. 9, 533-542 (2008).
- Breitbach, C. J., Reid, T., Burke, J., Bell, J. C., Kirn, D. H. Navigating the clinical development landscape for oncolytic viruses and other cancer therapeutics: no shortcuts on the road to approval. Cytokine Growth Factor Rev. 21, 85-89 (2010).
- Boeuf, F. L. e. Synergistic interaction between oncolytic viruses augments tumor killing. Mol Ther. 18, 888-895 (2010).
- Silva, N. D. e., Atkins, H., Kirn, D. H., Bell, J. C., Breitbach, C. J. Double trouble for tumours: exploiting the tumour microenvironment to enhance anticancer effect of oncolytic viruses. Cytokine Growth Factor Rev. 21, 135-141 (2010).
- Diallo, J. S. A high-throughput pharmacoviral approach identifies novel oncolytic virus sensitizers. Mol Ther. 18, 1123-1129 (2010).
- Cooke, S. L. Intra-tumour genetic heterogeneity and poor chemoradiotherapy response in cervical cancer. Br J Cancer. , (2010).
- Pennington, K., Chu, Q. D., Curiel, D. T., Li, B. D. L., Mathis, J. M. The Utility of a Tissue Slice Model System to Determine Breast Cancer Infectivity by Oncolytic Adenoviruses. J Surg Res. , 1-6 (2010).
- Hochberg, M. Tropism of herpes simplex virus type 1 to non-melanoma skin cancers. Br J Dermatol. , (2010).
- Kuip, H. v. a. n. d. e. r. Short term culture of breast cancer tissues to study the activity of the anticancer drug taxol in an intact tumor environment. BMC Cancer. 6, 86-86 (2006).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados