É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
ReAsH / Flash Rotulagem e Análise de Imagem Sensor de Proteínas em Células Tetracysteine
Neste Artigo
Resumo
O biarsenical corantes Flash e ReAsH se ligam especificamente a motivos tetracysteine em proteínas e pode seletivamente rótulo proteínas em células vivas. Recentemente, esta estratégia de rotulagem tem sido usado para desenvolver sensores de conformações de proteínas diferentes ou estados oligoméricos. Descrevemos a abordagem rotulagem e métodos para analisar quantitativamente vinculativo.
Resumo
Proteínas fluorescentes e corantes são ferramentas essenciais para o estudo da localização de proteínas, tráfico e função nas células. Enquanto que as proteínas fluorescentes, como a proteína fluorescente verde (GFP) têm sido amplamente utilizados como parceiros de fusão para proteínas para monitorar as propriedades de uma proteína de interesse 1, os desenvolvimentos recentes com etiquetas menores permitem novas funcionalidades de proteínas a ser examinada em células, tais como mudança conformacional e proteína-associação 2, 3. Um sistema de tag pequenas envolve um motivo tetracysteine (CCXXCC) geneticamente inserido em uma proteína-alvo, que se liga aos corantes biarsenical, ReAsH (vermelha fluorescente) e Flash (verde fluorescente), com alta especificidade, mesmo em células vivas 2. O TC / biarsenical sistema de corante oferece muito menos restrições estérico à proteína do hospedeiro do que proteínas fluorescentes que tem possibilitado várias novas abordagens para medir a mudança conformacional e interações proteína-proteína 4-7. Recentemente, desenvolveu uma nova aplicação de tags TC como sensores de oligomerização em células que expressam mutante, que quando sofre mutação agregados nos neurônios em Huntington doença 7. Huntingtina foi etiquetado com dois corantes fluorescentes, uma uma proteína fluorescente para rastrear a localização de proteínas, e um segundo a marca TC que obriga apenas corantes biarsenical em monômeros. Assim, mudanças na co-localização entre as proteínas e reatividade corante biarsenical habilitado conteúdo oligômero submicroscópicas ser espacialmente mapeadas dentro das células. Aqui, descrevemos como rotular TC-tagged proteínas fundida a uma proteína fluorescente (Cherry, ou GFP PCP) com flash ou ReAsH viver em células de mamíferos e como quantificar a fluorescência de duas cores (Cherry / Flash, PCP / Flash ou GFP / combinações ReAsH).
Protocolo
1. Preparação de células para a rotulagem com ReAsH / Flash
- Usando métodos de cultura de células padrão para sua linha de celulares de interesse, prepare uma cultura de células aderentes diretamente em um slide de imagens ao vivo de células pronto para transfecção.
- Transfectar seu plasmídeo gene TC-tagged contendo de interesse de acordo com seu método de transfecção de escolha.
Note que é importante o uso de controles positivos e negativos para avaliar a extensão da ligação específica para as tags TC, para avaliar bleedthrough de fluorescência entre os canais ao coletar micrografias confocal. Assim, para duas cores (por exemplo, o Flash / Cherry ou ReAsH / PCP ou ReAsH / GFP combinações), certifique-se as amostras são preparadas para cores simples (proteína fluorescente por exemplo, sozinho ou se possível uma proteína TC-tagged obrigado a Flash / ReAsH mas sem fluorescentes proteína)
- Um a dois dias após a transfecção, lave as células com 300 mL pré-aquecido (a 37 ° C) HBSS.
- Delicadamente mergulhe as células com um flash M (ou ReAsH) em 300 mL de HBSS pré-aquecida e 10 mM 1,2-ethanedithiol (EDT).
É importante acrescentar EDT primeiro antes de adicionar Flash / ReAsH e fazer o buffer pouco antes de adicioná-lo para as células. Incubar por exatamente 30 min a 37 ° C em cultura de tecidos incubadora. Em nossa experiência vezes maior de incubação aumenta significativamente a fluorescência de fundo. Novas construções também devem ser otimizados para rotulagem tempo e Flash / ReAsH concentração (0,5-2 mM).
- Aspirar cuidadosamente rotulagem solução a partir de células e em seguida, substitua com 300 mL HBSS pré-aquecido + 250 M 2,3-dimercaptopropanol (BAL) por 15 min a 37 ° C.
- Remover solução de lavagem por aspiração suave e substituir com 300 mL HBSS pré-aquecido.
Após esta lavagem, as células podem ser fixadas com paraformaldeído (15 min com solução 3,2%), embora nós descobrimos que isto aumenta não-específicos de fluorescência de corantes biarsenical. Daí que geralmente a imagem de células vivas em temperatura ambiente. (Note que a fixação das células antes da rotulagem previne a ligação corante biarsenical.)
2. Imagem das células em um microscópio confocal
- No microscópio confocal, configurar os parâmetros para geração de imagens a fluoróforos individual (ver Tabela 1) e garantir que não é desprezível bleedthrough entre os canais. Isto pode ser conseguido através da verificação fluoróforos individual (em amostras de controle) contra a aquisição de cada configuração diferente fluorescentes para fluorescência. Ajustar o comprimento de onda de emissão pode ajudar a minimizar bleedthrough (embora isso também pode reduzir o sinal / ruído).
- Também ajustar as configurações fotomultiplicador para que a fluorescência máxima na amostra não saturar o detector. (Isto pode ser detectado utilizando a definição de Q-LUT na Leica SP2 confocal). Uma vez que as melhores configurações de imagem são determinados, não alterar qualquer um deles entre as amostras.
- Outras definições que normalmente uso (embora estes possam ser otimizados) são uma taxa de varredura de 200 Hz e recolher quatro médias de linha e um diâmetro de 1 unidade pinhole Airy. O diâmetro pinhole pode ser expandido se o sinal / ruído é um problema, no entanto, isso pode resultar em alguma perda de imagem.
- Recolher as imagens confocal em formato 12-bit (ou superior), se possível. 12-bit formato de captura uma maior gama dinâmica de valores (0-4095) para cada intensidade de pixels de 8 bits (0-255). Isso é importante para assegurar o mais rico conjunto de dados é gravado, o que maximiza a qualidade da análise de dados quantitativos.
- Coletar imagens para o canal proteína fluorescente (Cherry, ou GFP PCP) e também para o canal de corante biarsenical (Flash ou ReAsH) para todas as amostras.
3. Análise dos dados
- Instale o software ImageJ em seu computador 8. http://rsbweb.nih.gov/ij/
- Certifique-se que a sua versão do ImageJ tem os seguintes plugins:
- ImageJ aberta, e se estiver usando uma versão mais antiga que v1.32c, clique nas opções seguintes para habilitar várias imagens para ser aberto ao mesmo tempo (que pode ser feito mantendo o botão de controlo enquanto clica em arquivos diferentes):
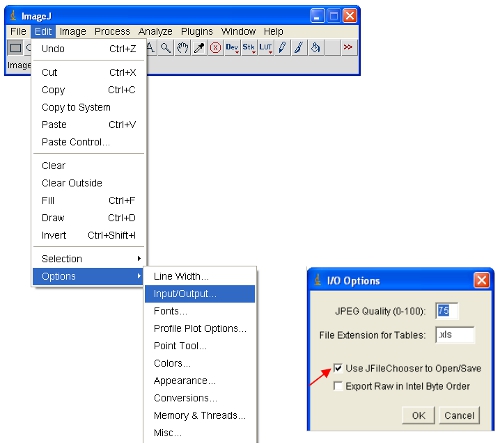
- Abra as imagens de interesse em ImageJ.
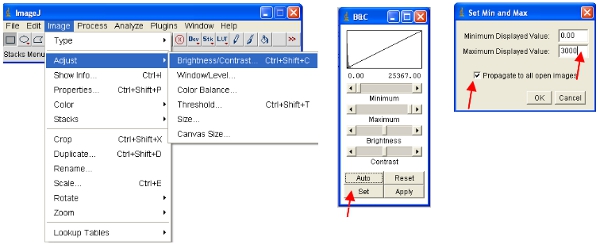
ImageJ automaticamente definir a intensidade dos pixels máximos e mínimos que são exibidos na tela para cada imagem separadamente. Dado que diferentes imagens terá dintensidades de pixel IFERENTES, isso significa que as imagens exibidas não são comparáveis como visualizados. - Para garantir que as imagens abertas são todas na mesma escala, você pode definir o fisicamente superiores e menores intensidades de pixels para ser visto (isto não vai mudar o conteúdo dos dados reais das imagens, como seria o caso de alguns outros softwares). Estes valores podem ser definidos sob o seguinte menu:
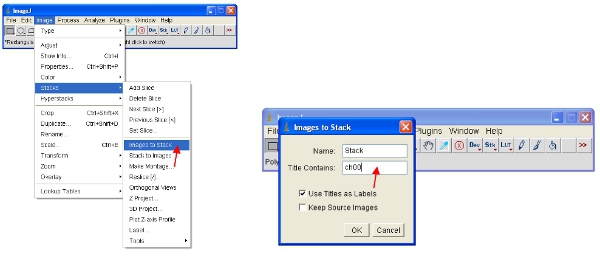
- Uma abordagem alternativa é trabalhar com pilhas, o que coloca todas as imagens juntas em um único arquivo e automaticamente escala (para ver) todas as imagens na pilha para a mesma escala. A maneira mais fácil trabalhar com os dados é converter cada canal para uma pilha. Assim, para o canal proteína fluorescente converter todos a pilha, como mostrado. Você pode facilmente selecionar um canal pelo empilhamento de todas as imagens que contenham um nome comum (por exemplo, "ch00") no título.
- Agora converter todas as imagens abertas para 8-bit para análise. Isto realmente rescale a gama visualizada em um intervalo 0-255 (que define 8 bits).
IMPORTANTE: Não poupar mais o bit 12 original (ou superior) de formato ou você vai perder conteúdo da informação. Note que alguns pacotes de software só pode exibir imagens de 8 bits de modo que este formato é útil para fazer figuras etc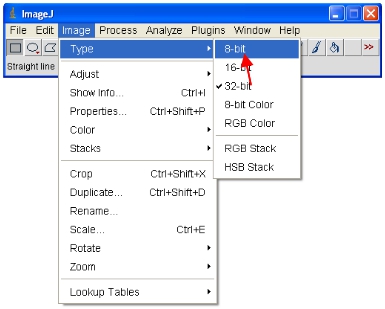
- Salvar uma cópia em uma pasta nova chamada "8-bit convertido" usando o "Salvar como ..." opção.
- Um método para examinar a extensão da ligação corante biarsenical em uma imagem inteira é realizar um plano de correlação de pixel intensidade. Este valor parcelas cada pixel em um canal em relação ao valor do pixel correspondente em um segundo canal. Portanto, uma posição de pixel em alta PCP fluorescência também será elevada na fluorescência ReAsH se há elevada taxa de ligação.
- Para analisar o pixel co-correlação, verifique se o ReAsH 8-bit e Cerulean / GFP imagens são abertas no ImageJ.
- Abra o "Image Correlator" plugin como indicado abaixo. Selecione "Image1", como a pilha ReAsH ou Flash e "Image2", como a pilha de proteína fluorescente.
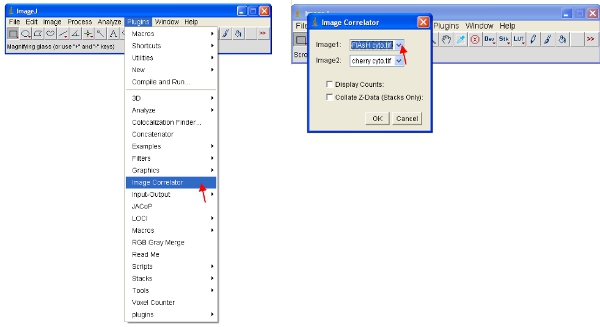
- A pilha resultante não pode exibir qualquer informação detalhada - isto é normal. Salvar a pilha em uma nova pasta chamada "Scatterplots" e dar-lhe o mesmo nome de arquivo como o exemplo refere-se a (por exemplo, "plot correlação Flash-cereja")
- Para visualizar os dados significativa que você pode fazer uma de duas opções. Primeiro transformar os dados de modo que é em formato de log. Então visualmente redimensionar os dados da seguinte forma:
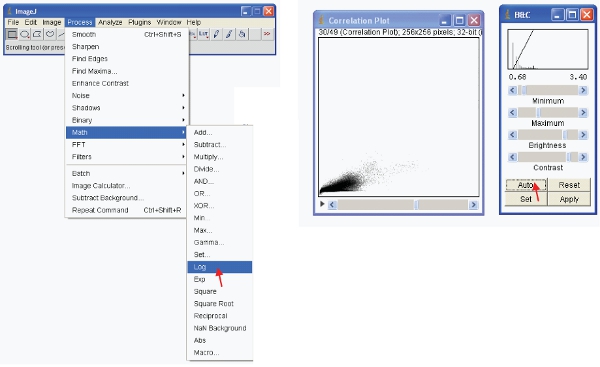
- Alternativamente, você pode redimensionar os dados visualmente para mostrar apenas valores baixos (por exemplo, 1-255) e exibir os dados usando uma LUT especial. Uma LUT (Look Up Table) representa uma tabela de cores que são atribuídos a cada valor de pixel em uma imagem . Isto pode ser usado para definir um esquema de pseudo para uma imagem e é útil para a definição de certas características em uma imagem. Para criar um clique LUT personalizado no "editor LUT" e fazer um novo, como a mostrada (isso pode ser guardada e utilizada mais tarde).
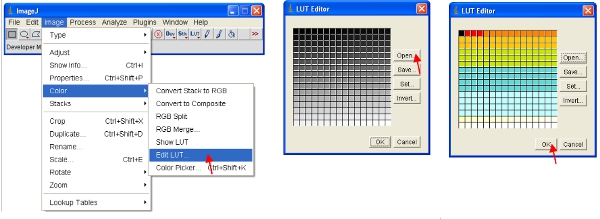
- Definir o intervalo de brilho / contraste 0-255 (como descrito na etapa 13 acima). Para "travar" a imagem como a mostrada na tela, a imagem pode ser convertida em formato RGB o que economiza um valor de 8 bits para cada uma das cores vermelha, verde e azul de cada pixel.
Para copiar e colar imagens para outros programas aberto pela primeira vez as imagens de 8 bits ou 16 bits. Como descrito na etapa 14 acima, atribuir um esquema de cores LUT para a imagem. Para PCP, atribuir o "Ciano" LUT, conforme descrito abaixo ...
- Selecione a imagem e copiá-lo para a área de transferência, selecione ...
4. Resultados representativos:
O sucesso das células rotulagem com corantes biarsenical é dependente de alguns parâmetros-chave. Primeiro, o momento da marcação com corantes é crucial. Descobrimos que longos períodos de rotulagem (mais de 30 min) resulta em um alto nível de não-específica coloração de fundo. Fig. 1 mostra um resultado típico de uma forma selvagem-tipo de fragmento huntingtina (25Q) fundida ao Cerulean PCP derivados contendo um tag TC, conforme descrito anteriormente 7. Esta amostra foi manchada por 30 min com ReAsH e não há fundo mínimo na amostra sem a tag TC. Nós descobrimos que a fixação de células com fundo aumenta paraformaldeído enquanto fixação com metanol revoga a fluorescência da tag proteína fluorescente. Por isso, sempre que possível nós a imagem de células vivas. É importante notar também que a fixação préviaà rotulagem com corantes biarsenical impede sua ligação, provavelmente devido a modificações do motivo TC.
Outro fator crítico para resultados consistentes é a densidade de células. Nós descobrimos que é fundamental para as células de imagem que são distribuídas livremente e também que clumping extensa pode levar a manchas irregulares dos corantes biarsenical em diferentes células.
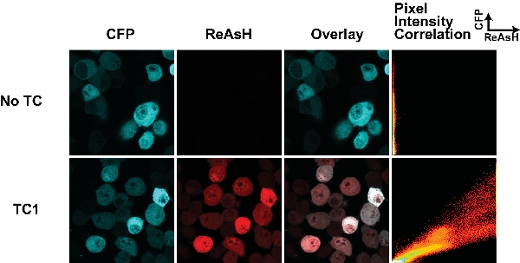
Figura 1. Etiquetas Tetracysteine e coloração ReAsH em células vivas transfectadas com huntingtina (exon1-25Q)-Cerulean fusões. A tag TC está localizado na junção da fusão huntingtina-Cerulean (como descrito na 7). O enredo de correlação de pixel intensidade permite uma avaliação para as diferenças de ReAsH vinculativa em toda a célula e pode ser usado para mapear mudanças na ReAsH vinculativo devido à mudança conformacional ou interações ligante.
Access restricted. Please log in or start a trial to view this content.
Discussão
A abordagem para localização de proteínas rótulo com uma proteína fluorescente e propriedades conformacionais com um corante segundo oferece um grande potencial para o mapeamento de onde conformações diferentes de proteínas acumulam nas células e eventos que alteram a dinâmica da conformação protéica. ReAsH / Flash foi usado primeiramente como um sensor na célula para o dobramento de proteínas dos mamíferos celular proteína ácido retinóico-binding I 4. Neste exemplo, o Flash vinculado a um ...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Este trabalho foi financiado por doações de DMH e TDM (subvenções NHMRC projeto). DMH é um companheiro Grimwade, financiado pelo Fundo Miegunyah.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número Catálogo | Comentários |
|---|---|---|---|
| 8-μ bem-slides | Ibidi | 80826 | Encontramos estas câmara de slides a ser particularmente útil para a cultura de células para geração de imagens. |
| TC-FLASH II na célula Detecção Tag Tetracysteine Kit * * * fluorescência verde para a imagem latente em células vivas | Invitrogen | T34561 (Flash) ou T34562 (ReAsH) | |
| Solução de Hanks salina balanceada | Invitrogen | 14175-103 | |
| 2,3-dimercapto-1-propanol | Sigma-Aldrich | D1129-5mL | |
| 1,2-Ethanedithiol | Sigma-Aldrich | 02390-25ML |
Referências
- Tsien, R. Y. The green fluorescent protein. Ann. Rev. Biochem. 67, 509-544 (1998).
- Griffin, B. A., Adams, S. R., Tsien, R. Y. Specific covalent labeling of recombinant protein molecules inside live cells. Science. 281, 269-2672 (1998).
- Uttamapinant, C. A fluorophore ligase for site-specific protein labeling inside living cells. Proc. Natl. Acad. Sci. USA. 107, 10914-10919 (2010).
- Ignatova, Z., Gierasch, L. M. Monitoring protein stability and aggregation in vivo by real-time fluorescent labeling. Proc. Natl. Acad. Sci. USA. 101, 523-528 (2004).
- Coleman, B. M. Conformational detection of prion protein with biarsenical labeling and FlAsH fluorescence. Biochem. Biophys. Res. Commun. 380, 564-568 (2009).
- Luedtke, N. W., Dexter, R. J., Fried, D. B., Schepartz, A. Surveying polypeptide and protein domain conformation and association with FlASH and ReAsH. Nat. Chem. Biol. 3, 779-784 (2007).
- Ramdzan, Y. M. Conformation sensors that distinguish monomeric proteins from oligomers in live cells. Chem. Biol. 17, 371-379 (2010).
- Abramoff, M. agelhaes, PJ, S. J. R. am Image processing with ImageJ. Biophotonics International. 11, 36-42 (2004).
- Hearps, A. The biarsenical dye Lumio exhibits a reduced ability to specifically detect tetracysteine-containing proteins within live cells. J. Fluor. 17, 593-597 (2007).
- Adams, S. R. New biarsenical ligands and tetracysteine motifs for protein labeling in vitro and in vivo: Synthesis and biological applications. J. Am. Chem. Soc. 124, 6063-6076 (2002).
- Shaner, N. C., Steinbach, P. A., Tsien, R. Y. A guide to choosing fluorescent proteins. Nat. Meth. 2, 905-909 (2005).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados