É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Um In Vitro Sistema para Estudo de dormência Tumor ea Mude para o crescimento metastático
Neste Artigo
Resumo
A modificação em 3-D in vitro sistema é apresentado em que características de crescimento de várias linhagens de células tumorais na membrana basal reconstituída se correlacionam com o comportamento dormentes ou proliferativa das células tumorais em um local metastático secundário In vivo.
Resumo
Recorrência de câncer de mama geralmente segue um longo período de latência em que não há sinais de câncer e metástases não pode tornar-se clinicamente aparente até muitos anos após a remoção do tumor primário e terapia adjuvante. Uma provável explicação desse fenômeno é que as células tumorais têm semeado sítios metastáticos, são resistentes às terapias convencionais, e permanecem dormentes por longos períodos de tempo 1-4.
A existência de células cancerosas dormentes em sites secundários tem sido descrita anteriormente como células quiescentes solitária que nem proliferam nem apoptose 5-7. Além disso, essas células solitária foi mostrado para disseminar a partir do tumor primário em um estágio inicial de 10/08 a progressão da doença e permanecer preso em crescimento dos pacientes medula óssea, sangue e linfonodos 1,4,11. Portanto, a compreensão dos mecanismos que regulam a dormência ou a mudança para um estado proliferativo é fundamental para descobrir novos alvos e intervenções para prevenir a recorrência da doença. No entanto, desvendar os mecanismos que regulam a passagem de dormência tumor metastático para o crescimento tem sido dificultada pela falta de sistemas modelo disponível.
in vivo e sistemas modelo ex vivo para estudar a progressão metastático das células tumorais têm sido descritos anteriormente 1,12-14. No entanto, estes sistemas modelo não tenha fornecido em tempo real e em uma alta taxa de idéias em forma mecanicista o que desencadeia o aparecimento de células tumorais dormentes solitária a proliferar a doença metastática. Recentemente, desenvolvemos um sistema in vitro 3D para modelar as características de crescimento em vivo de células que apresentam ambos os dormentes (D2.OR, MCF7, K7M2-AS.46) ou proliferativa (D2A1, MDA-MB-231, K7M2) comportamento metastático in vivo. Nós demonstramos que as células tumorais que apresentam dormência in vivo em um local metastático permanecem quiescentes quando cultivadas em um 3-dimensão extrato de membrana (3D) cave (BME), enquanto que as células altamente metastáticas in vivo prontamente proliferar em cultura após 3D variável, mas relativamente curta períodos de quiescência. Importante, utilizando o 3D in vitro sistema modelo demonstramos pela primeira vez que a composição ECM desempenha um papel importante na regulação se dormente células tumorais irá mudar para um estado proliferativo e confirmaram isso em estudos in vivo 15-17. Assim, o sistema modelo descrito no presente relatório fornece um método in vitro para a dormência tumor modelo e estudar a transição para o crescimento proliferativa induzida pelo microambiente.
Protocolo
1. Manutenção de cultura de células de dormentes e metastático linhagens de células tumorais
- Crescer dormente (D2OR / MCF7/K7M2-AS.46) e metastático de células tumorais (D2A1 / MDA-MB-231 / K7M2) em 10 centímetros placas de cultura contendo meio modificado Dulbecco Águia (DMEM), glicose alta e 10% de soro fetal bovino ( FBS) e antibióticos. Quando as células atingem confluência de 70-80%, vá para os ensaios seguintes.
2. Ensaio de proliferação celular de células tumorais dormentes (quiescente) e metastático (proliferação) cultivadas em um sistema 3D-BME
A cultura de células dormentes / metastático no sistema 3D
- Descongelar crescimento Cultrex fator reduzida Extract membrana basal (BME), em 4 ° C geladeira uma noite antes de realizar o ensaio. Observe o BME deve ser tratado no gelo em todos os momentos.
- No dia seguinte, coloque uma placa de 96 poços em uma bandeja de gelo dentro de uma capa laminar. Casaco de cada poço com 50 100μl da BME gelada utilizando um dispensador com uma seringa. Verifique se não há bolhas se formam nos poços. Coloque a placa de 96 poços revestidos com BME em uma incubadora umidificada com 5% de CO 2 a 37 ° C por 30 minutos.
- Nesse meio tempo aspirar a mídia a partir de células dormentes e ou metastático do tumor (preparado na seção 1). Enxágüe placas de cultura com 10 ml de fosfato tamponada pH, solução salina 7,4 (PBS). Aspirar o PBS e adicionar 2 ml de tripsina pré-aquecido a 37 ° C, para as placas de cultura. Incubar as placas em um CO 2 umidificado 5% a 37 ° C, por 5 min.
- Transferência de células para um tubo cônico de 15 ml contendo 5 ml de DMEM suplementado com glicose 10% SFB e antibióticos e contagem das células.
- Spin para baixo o número total de células a serem cultivadas em uma centrífuga de cultura de tecidos a uma velocidade de 1500g, em temperatura ambiente por 5 min. Em nossos ensaios nos preparamos 2X10 3 células / poço para cada linha de célula ou ponto de tempo para ser examinada. No entanto, isto pode variar dependendo de linhas celulares utilizadas.
- Aspirar cuidadosamente o sobrenadante. Note, na maioria dos casos, o pellet não é visível. Portanto, deixar para trás alguns meios de comunicação. Toque no fundo do tubo de 15ml cônica com os dedos para garantir que uma suspensão de células simples é obtido. Re-suspender o pellet com DMEM baixa glicose com antibióticos complementado com FCS a 2% + 2% BME (teste de mídia). 100 l da mídia ensaio deve ser adicionado para cada 2x10 3 células. Triturar as células muitas vezes com uma pipeta de 5 ml para garantir que uma suspensão única célula é mantida.
- 100μl um prato da mistura de células por poço em cima da placa de 96 BME bem revestido. Para a avaliação de fundo (na seção 2.8) Placa em 100μl por poço além de apenas a mídia ensaio em cima da placa de 96 poços BME revestido. Incubar a 96 placas de cultura bem em um umidificado 5% CO 2 incubadora a 37 ° C. As células devem ser re-alimentados a cada 4 dias com a mídia ensaio.
Ensaio de proliferação:
- Ensaio de proliferação das células: adicione aos poços no momento desejado pontos 20 l da Célula 96 aquosas testes sorológicos Um kit solução da célula de ensaio Proliferação. Incubar em 5% umidificado incubadora de CO 2 a 37 ° C por 2h. Usando um leitor de placas Elisa registro da absorbância em 490nm. Para a avaliação de fundo e subtração, adicionar 20μl da Célula 96 aquosas testes sorológicos Um kit de ensaio Proliferação Celular Solution para poços revestidos com pré BME e apenas coberta com a mídia ensaio. Usando um leitor de placas Elisa registro a absorvância a 490 nm.
3. Coloração de imunofluorescência para as moléculas de sinalização celular no dormente (quiescente) células tumorais e / ou metastático (proliferação) de células tumorais
A cultura de células dormentes / metastático no sistema 3D para a coloração immunfluorescence
* O protocolo a seguir é uma modificação de um protocolo de cultura 3D publicado pela Debnath J et al 18.
- Prepare BME como descrito na seção 2.1. No dia seguinte: colocar uma câmara de 8-sistema de lâmina de vidro em uma bandeja de gelo dentro de uma capa laminar. Casaco de cada poço com 50uL de gelada BME usando um Pipetman 200μl. Certifique-se de BME é distribuído uniformemente e sem bolhas se formam nos poços. Coloque o 8 lâmina de vidro revestida com câmara de BME em CO 2 umidificado 5% a 37 ° C por 20 min.
- Colheita de células dormentes e ou metastáticos da secção 1 e se preparar para a cultura como descrito na seção 2,3-2,4. Recolher o número total de células a serem cultivadas em um tubo de 15 ml. Nós preparamos 5 x10 3 células / poço para cada linha celular e tempo para ser examinada. Girar as células em uma centrífuga de cultura de tecidos a uma velocidade de 1500g, em temperatura ambiente por 5 min. Aspirar o sobrenadante com cuidado. Note que o pellet não é visível, portanto deixe alguns meios de comunicação por trás. Toque no fundo do tubo de 15ml cônica com os dedos para garantir que uma suspensão única célula é obtido.Re-suspender o pellet com a mídia ensaio. 400μl dos meios de comunicação de ensaio deve ser adicionado para cada 5x10 3 células. Triturar as células muitas vezes com uma pipeta de 5 ml. Este passo é muito importante para garantir que a suspensão única célula é mantida.
- 400μl placa da mistura de células por poço em cima de cada uma das oito câmaras revestido com BME. Incubar a cultura oito câmaras sistema lâmina de vidro em um umidificado 5% CO 2 incubadora a 37 ° C. As células devem ser re-alimentados a cada 4 dias com a mídia ensaio.
Imunofluorescência:
- Nos pontos de tempo desejado, aspirar a camada superior da mídia e adicionar 200μl do fixador contendo paraformaldeído 4% (PFA), sacarose 5% e 0,1% Triton X-100 e incubar à temperatura ambiente por 5 minutos. Aspirar o fixador e adicionar 200μl de PFA 4% contendo 5% de sacarose e incubar em temperatura ambiente por 25 minutos.
- Aspirar o fixador; adicionar mL 400 de tampão fosfato (PBS) a cada poço. Incubar por 10 minutos em temperatura ambiente. Aspirar o PBS e adicionar 400 μ PBS contendo 0,05% Tween 20 por 10 minutos em temperatura ambiente.
- Impedir as células fixado em temperatura ambiente com 200μl de ambos 10% de soro de burro ou com BSA 3% para 1 hora (solução de bloqueio a ser utilizado deve ser determinado empiricamente para cada anticorpo primário).
- Aspirar a solução de bloqueio e adicionar 200μl do anticorpo primário (diluição deve ser determinado empiricamente para cada anticorpo primário a ser utilizado). Diluir o anticorpo primário no soro burro de 10% se 10% de burro soro foi utilizado para bloquear ou diluir o anticorpo primário em BSA 3%, se 3% BSA solução de bloqueio foi usado. Incube com o anticorpo primário durante a noite a 4 ° C.
- Aspirar o anticorpo, lavar os poços com 400μl de PBS por 15 minutos e repita duas vezes. Aspirar o PBS e adicionar 200μl de burro anti-respectivos-IgG conjugada a rodamina vermelho (diluição deve ser determinada empiricamente), cubra o slide câmara de 8 com papel alumínio e incubar por 1 hora à temperatura ambiente.
- Lavar os poços com 400μl de PBS (3x15 minutos cada lavagem). Aspirar PBS. Montado com VECTASHIELD meio de montagem com DAPI. Slides secar por 40 minutos em temperatura ambiente no escuro. Slides pode ser mantida por uma semana a 4 ° C. Armazenar os slides no escuro. Slides de imagem por microscopia confocal.
4. Resultados representativos:
Um exemplo de uma análise de proliferação do D2.0R dormentes e D2A1 metastático de células tumorais na cultura 3D é mostrado na Figura 1A. Células D2.0R estão dormentes (quiescente) durante o período experimental cultura inteira 14 dias enquanto o altamente metastáticas D2A1 células permanecem latentes apenas para 4-6 dias após os quais começam a proliferar. Durante a fase inicial dormente, muitas células permanecem solitários na cultura 3-D (Figura 1B; dia 4), enquanto que outras células não-proliferação de forma multi-celular esferóides. A transição de D2A1 células de um dormente para o estado proliferativo em 3 D-cultura (Figura 1B, dia 12) está associada a mudanças dramáticas na morfologia celular. Assim, este ensaio pode ser usado para testar o fator / s pode desencadear células dormentes D2.0R a emergir de seu estado dormente e que fator / s pode impedir D2A1 células a transição de seu estado dormente. Figura 2 é um exemplo de um agente prevenção D2A1 células a transição de um estado dormente para proliferativa. Como ilustrado na Figura 2, os tratamentos de D2A1 células com um inibidor específico da miosina quinase da cadeia leve (ML-7) manteve D2A1 células em um estado dormente.
Sinalização celular nas células dormentes e proliferação do tumor cultivadas em sistema 3D pode ser estudada por imunofluorescência para as moléculas de sinalização celular. Como ilustrado na Figura 3 um aumento significativo na fosforilação da miosina de cadeia leve no D2A1 células (coloração vermelha), seguido de reorganização dos filamentos de actina-f formando fibras de actina stress (coloração verde) ocorre durante a transição de dormência (1-4 dias) para proliferação (dia 7). No entanto, bloqueando a luz miosina atividade quinase da cadeia em D2A1 células shRNA ou medicamento específico (ML-7) mantém D2A1 células em um estado dormente e resulta em inibição da fosforilação da cadeia leve da miosina e actina-f organização fibra de estresse (Figura 4).
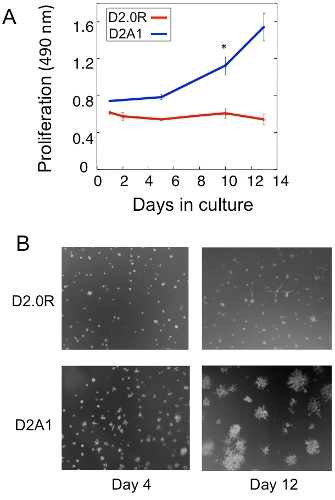
Figura 1. Modelo in vitro para estudar a dormência cela solitária tumor ea chave para o crescimento metastático. A proliferação) de D2.0R dormentes e D2A1 metastático em 3-D Cultrex BME, n = 8 (média ± SE). Resultados representativos de três experimentos (* p ≤ 0,05). B) As imagens de microscopia de luz e de D2.0R D2A1 células cultivadas em 3-D Cultrex x20 ampliação BME.Figura modificada de Barkan et al 17.
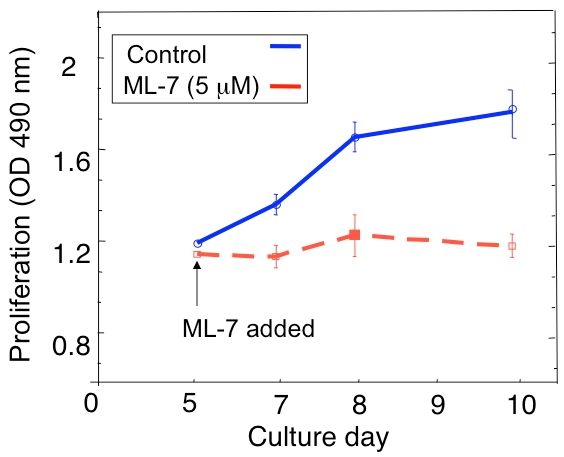
Figura 2. Evitar que o interruptor de D2A1 células de dormência (quiescência) para a proliferação do sistema de cultura 3D pela inibição da miosina quinase da cadeia leve (MLCK). Curso de tempo de D2A1 proliferação celular cultivadas em 3-D Cultrex BME, n = 8 (média ± SE). Células foram tratadas (controle) ou tratados com um inibidor específico da MLCK (ML-7, 5 mM) por 48 hr início no dia 5 de cultura. Figura modificada de Barkan et al 17.
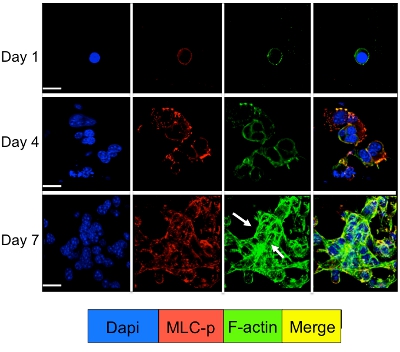
Figura 3. Fosforilação da miosina de cadeia leve seguido por f-actina reorganização durante a mudança de D2A1 células de dormência para o crescimento proliferativa. D2A1 células foram cultivadas em 3-D Cultrex BME em 8 de lâmina de vidro de câmara. As células foram fixadas e coradas com DAPI (azul) para a localização nuclear, phalloidin (verde) para f-actina e com um anticorpo contra a forma fosforilada da cadeia leve de miosina (MLC-p) (vermelho), como indicado em várias alturas. Fusão de f-actina e MLC-p coloração (amarelo). Expressão de MLC-p foi aumentado durante a transição de D2A1 células de dormência (dias1-4) para o crescimento proliferativa (dia 7) seguido por actina formação das fibras de estresse (setas). Microscopia confocal, ampliação X63. Branco bar é igual a 20 microns. Figura modificada de Barkan et al 17.
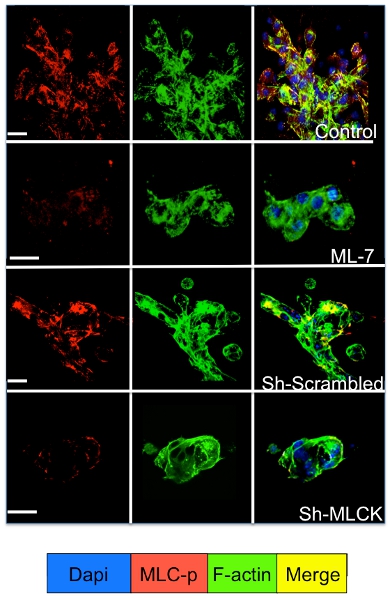
Figura 4. . Inibição da miosina quinase da cadeia leve (MLCK) mediada f-actina formação das fibras de estresse em células D2A1 D2A1 As células foram tratadas (controle) ou tratados com inibidor de MLCK (ML-7, 5 mM), por 48 hr início no dia da cultura 5, ou tratados com embaralhada ou shRNA MLCK e corados para a forma fosforilada da cadeia leve de miosina (MLC-p) (vermelho), f-actina (verde), eo núcleo (azul). Fusão de f-actina e MLC-p coloração (amarelo). Microscopia confocal, ampliação X63. Branco bar é igual a 20 microns.
Discussão
Os mecanismos subjacentes que mantêm as células tumorais disseminadas em um estado dormente ou resultar na sua transição para o crescimento metastático permanecem largamente desconhecidos. Esse fenômeno tem sido extremamente difícil de estudar em pacientes humanos 4,12 e poucos modelos pré-clínicos têm sido desenvolvidos para resolver este problema. No entanto, alguns sistemas in vivo e ex-vivo modelo de dormência tumor têm sido caracterizadas (revisto em 1,12). No ent...
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Esta pesquisa foi suportada em parte pelo Programa de Pesquisa Intramural do National Cancer Institute.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários |
|---|---|---|---|
| DMEM alta glicose | Invitrogen | 11965-118 | |
| DMEM baixa glicose | Invitrogen | 11885-092 | |
| De soro fetal bovino (FBS) | Invitrogen | 10091-148 | |
| Do fator de crescimento reduzido em 3-D Cultrex Extract Membrana Basal | Trevigen Inc. | Concentração de proteína entre 14-15mg/ml | |
| D2.0R e D2A1 linhas celulares | 5,19 | ||
| K7M2 e K7M2AS1.46 células | 20 | ||
| MCF-7 e MDA-MB-231 células de câncer de mama | ATCC | ||
| Um sistema de câmara de 8 lâmina de vidro | (Lab-TEK, Thermo científico) | 177402 | |
| Os testes sorológicos 96 células aquoso uma solução celular kit ensaio de proliferação | Promega | G3580 | |
| VECTASHIELD meio de montagem com DAPI | Vector Laboratories Inc. | H-1200 | |
| Normais burro soro | ImmunoResearch Jackson | 017-000-121 | |
| Leitor de placas ELISA | Bio-Tec | 490nm registro | |
| Microscópio confocal | Zeiss-LSM-510 | Ampliação X63 |
Referências
- Aguirre-Ghiso, J. A. Models, mechanisms and clinical evidence for cancer dormancy. Nat Rev Cancer. 7, 834-846 (2007).
- Pantel, K., Woelfle, U. Micrometastasis in breast cancer and other solid tumors. J Biol Regul Homeost Agents. 18, 120-125 (2004).
- Naumov, G. N. Ineffectiveness of doxorubicin treatment on solitary dormant mammary carcinoma cells or late-developing metastases. Breast Cancer Res Treat. 82, 199-206 (2003).
- Klein, C. A. Framework models of tumor dormancy from patient-derived observations. Curr Opin Genet Dev. , (2010).
- Naumov, G. N. Persistence of solitary mammary carcinoma cells in a secondary site: a possible contributor to dormancy. Cancer Res. 62, 2162-2168 (2002).
- Townson, J. L., Chambers, A. F. Dormancy of solitary metastatic cells. Cell Cycle. 5, 1744-1750 (2006).
- Chambers, A. F., Groom, A. C., MacDonald, I. C. Dissemination and growth of cancer cells in metastatic sites. Nat Rev Cancer. 2, 563-572 (2002).
- Pantel, K. Differential expression of proliferation-associated molecules in individual micrometastatic carcinoma cells. J Natl Cancer Inst. 85, 1419-1424 (1993).
- Demicheli, R. Tumour dormancy: findings and hypotheses from clinical research on breast cancer. Semin Cancer Biol. 11, 297-306 (2001).
- Braun, S. A pooled analysis of bone marrow micrometastasis in breast cancer. N Engl J Med. 353, 793-802 (2005).
- Pantel, K., Alix-Panabieres, C., Riethdorf, S. Cancer micrometastases. Nat Rev Clin Oncol. 6, 339-351 (2009).
- Goss, P. E., Chambers, A. F. Does tumour dormancy offer a therapeutic target. Nat Rev Cancer. 10, 871-877 (2010).
- Mendoza, A. Modeling metastasis biology and therapy in real time in the mouse lung. J Clin Invest. 120, 2979-2988 (2010).
- Naumov, G. N. A model of human tumor dormancy: an angiogenic switch from the nonangiogenic phenotype. J Natl Cancer Inst. 98, 316-325 (2006).
- Barkan, D. Metastatic growth from dormant cells induced by a col-I-enriched fibrotic environment. Cancer Res. 70, 5706-5716 (2010).
- Barkan, D., Green, J. E., Chambers, A. F. Extracellular matrix: A gatekeeper in the transition from dormancy to metastatic growth. Eur J Cancer. , (2010).
- Barkan, D. Inhibition of metastatic outgrowth from single dormant tumor cells by targeting the cytoskeleton. Cancer Res. 68, 6241-6250 (2008).
- Debnath, J., Muthuswamy, S. K., Brugge, J. S. Morphogenesis and oncogenesis of MCF-10A mammary epithelial acini grown in three-dimensional basement membrane cultures. Methods. 30, 256-268 (2003).
- Morris, V. L. Mammary carcinoma cell lines of high and low metastatic potential differ not in extravasation but in subsequent migration and growth. Clin Exp Metastasis. 12, 357-367 (1994).
- Khanna, C. The membrane-cytoskeleton linker ezrin is necessary for osteosarcoma metastasis. Nat Med. 10, 182-186 (2004).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados