Method Article
Análise quantitativa de Reposição da vesícula sináptica Piscina em Cultured neurônios granulares do cerebelo usando Dyes FM
Neste Artigo
Resumo
A técnica de imagem ao vivo de fluorescência para quantificar o reabastecimento e mobilização de vesículas sinápticas específicas (SV) piscinas de terminais nervosos central é descrito. Duas rodadas de SV reciclagem são monitorados nos terminais nervosos mesmo fornecendo um controle interno.
Resumo
Após a liberação do neurotransmissor nos terminais nervosos central, são rapidamente recuperados SVs por endocitose. SVs recuperados são então recarregados com neurotransmissor e voltar a piscina de reciclagem, definido como SVs que estão disponíveis para 1,2 exocitose. A piscina de reciclagem geralmente podem ser subdivididos em dois grupos distintos - a piscina prontamente liberável (RRP) e da piscina de reserva (RP). Como seus nomes sugerem, o RRP consiste em SVs que estão imediatamente disponíveis para a fusão, enquanto RP SVs são liberados apenas durante 1,2 estimulação intensa. É importante ter um teste confiável que relata a reposição diferencial dessas piscinas SV, a fim de compreender 1) como SVs tráfego após diferentes modos de endocitose (como clatrina-dependente e endocitose dependente de atividade endocitose granel) e 2) os mecanismos de controlar a mobilização de ambos os RRP e RP em resposta a estímulos diferentes.
Corantes FM são rotineiramente empregamed quantitativamente relatório volume de negócios SV em terminais de nervo central 3-8. Eles têm uma cauda de hidrocarbonetos hidrofóbicas que permite particionamento reversível na bicamada lipídica, e um grupo cabeça hidrofílico que bloqueia a passagem através das membranas. Os corantes têm pouco de fluorescência em solução aquosa, mas o seu rendimento quântico aumenta dramaticamente quando particionado na membrana 9. Assim corantes FM são ideais sondas fluorescentes para acompanhar ativamente a reciclagem SVs. O protocolo padrão para uso de corante FM é a seguinte. Primeiro, eles são aplicados aos neurônios e são captados durante a endocitose (Figura 1). Depois de não-internalizado corante é lavado da membrana plasmática, redistribuir SVs reciclados dentro do pool de reciclagem. Estes são, então, esgotadas SVs usando estímulos descarga (Figura 1). Desde FM rotulagem tintura de SVs é quantal 10, a queda de fluorescência resultante é proporcional à quantidade de vesículas libertadas. Assim, a reciclagem e fusão de SVs gerada a partir da previous rodada de endocitose podem ser confiavelmente quantificados.
Aqui, apresentamos um protocolo que foi modificado para obter dois elementos adicionais de informação. Em primeiro lugar, os estímulos seqüenciais são usados para descarga diferencialmente descarregar o RRP eo RP, para permitir a quantificação da reposição de piscinas específicas SV. Em segundo lugar, cada terminal nervoso sofre o protocolo duas vezes. Assim, a resposta do terminal nervoso mesmo em S1 pode ser comparada com a presença de uma substância de ensaio na fase S2 (Figura 2), proporcionando um controle interno. Isso é importante, dado que a extensão de SV reciclagem nos terminais nervosos diferentes é altamente variável 11.
Qualquer adepto culturas primárias neuronais podem ser usados para este protocolo, porém a densidade de plaqueamento, soluções e condições de estimulação são otimizados para neurônios granulares do cerebelo (CGNs) 12,13.
Protocolo
1. Preparação Neuron cerebelar Granule
- Autoclave aproximadamente 100 mm de diâmetro 25 lamínulas (Tabela 1).
- Lamínulas lugar em um tubo de 50 ml estéril, contendo solução de poli-D-lisina estéril (Tabela 2). Coloque em uma plataforma giratória para 2 h para revestir as lamelas.
- Lamínulas seca revestida com papel de filtro estéril em uma capela de fluxo laminar (Tabela 1).
- Lamínulas estéreis lugar em 6 pratos e Lamelas bem quente em uma incubadora de CO 2 (Tabela 1). Pode ser armazenado por 1 mês a 4 ° C para antes do uso.
- Euthanize a 7 dias de idade Sprague Dawley rat filhote de cachorro de acordo com as orientações locais de comitê de ética. Nós sacrificados filhotes usando deslocamento cervical.
- Dissecar o cerebelo e colocá-lo numa placa de Petri estéreis, contendo uma solução de sais de fosfato tamponada (solução B, Tabela 3).
- Repita os passos 1.5 e 1.6 para 4-6 filhotes de ratos.
- Cerebelos são então colocados no palco estéril de um tecido McIlwain Chopper (Tabela 1). Tecido é cortado em 375 intervalos mM antes de girar o estágio de 90 ° e repetindo o processo.
- O cerebelo picada são transferidos para uma solução de tripsina (solução de T, a Tabela 4), que tinha sido previamente aquecido a 37 ° C.
- Incubar cerebelos a 37 ° C por 20 min com agitação suave a cada 5 min, aproximadamente.
- Durante a digestão tríptica, chama polonês três pipetas de vidro estéreis (Tabela 1) utilizando uma chama de Bunsen. Use a chama para criar um furo fino, um furo médio e um furo de largura na boca respectivos das pipetas.
- Após 20 min de incubação em solução T, adicione 20 ml de uma solução de inibidor de tripsina / DNase (solução W, Tabela 5) para a suspensão do cerebelo e células de pelotas em 1000 g por 1 min em uma centrífuga de bancada (Tabela 1).
- Decantar o sobrenadante e ressuspender o pellet celular em 1,5 ml de um concentrado de tripsina / DNase inibidor (solução C, Tabela 6), utilizando a mais ampla pipeta furo.
- Triturar as células usando a pipeta primeiro furo de largura, então o meio de diâmetro e, finalmente, o furo estreito até a suspensão de células é homogêneo. Este é um passo fundamental, a suspensão deve ser homogênea nesta fase.
- Suspensão a camada de células na parte superior de 10 ml de uma pré-aquecido (37 ° C) albumina sérica bovina complementada Earles solução de sais Balanceada (Tabela 7) em um tubo estéril ml 15.
- Centrifugar a suspensão por 5 min a 1.500 g e ressuspender o pellet celular em 2 mls de pré-aquecida (37 ° C) meio de cultura (Tabela 8).
- Estimar o número de células usando uma hemocitómetro (Tabela 1) e diluir a suspensão de célula para uma densidade final de 3,3 x 10 6 células por ml.
- Células são banhados pela adição de 75 mL da suspensão de células para o centro de poli-D-lisina revestido lamínulas (densidade final 2,5 x 10 5).
- As placas de cultura contendo as lamelas são colocados na incubadora de CO 2 por 60 minutos para permitir que as células a umadhere.
- Adicionar 1,5 ml de meio de cultura em cada poço tomando cuidado para não perturbar as células banhado e retornar a placas de cultura para o CO 2 incubadora.
- No dia seguinte, substituir o meio de cultura com meio de cultura fresco suplementado com o inibidor mitótico arabinoside citosina (Tabela 8). Prisões Esta proliferação de células gliais em cultura.
2. Instalação Experimental
- Configuração experimental básica deve consistir no seguinte (ver tabelas 1 e 9 de equipamentos e software específicos utilizados):
- Microscópio invertido epi-fluorescência
- Câmera CCD refrigerado
- Fonte de luz fluorescente (monocromador ou roda de filtros)
- Aparelho de perfusão gravidade
- Imagem de câmara com eletrodos de platina paralelo
- Estimulador elétrico
- Computador
- Software de aquisição de imagem
- Experimentos devem ser realizados no escuro ou sob luz vermelha conditions com iluminação fluorescente mínimo da amostra para evitar a tintura FM branqueamento.
- Experimentos são realizados à temperatura ambiente. Se a temperatura fisiológica é necessário, um sistema de perfusão com temperatura controlada pode ser usado.
3. Preparação da Amostra
- Culturas deve ser utilizado após 8-12 dias in vitro.
- Transferência de uma lamínula única solução salina (Tabela 10) por 10 min em temperatura ambiente para permitir a estabilização no novo meio.
- Retirar as lamelas, seque sua parte inferior ea área circundante as células associadas com um pequeno pedaço de papel toalha ou papel absorvente.
- Utilizando graxa de silicone (Tabela 2), cola a lamela na parte inferior da câmara de imagem. As células devem ser entre os dois fios paralelos. Graxa de silicone suficiente deve ser usado para fechar completamente a câmara, mas sem qualquer graxa entrar no centro da câmara de banho.
- Suavemente preencher a câmara de banho com ~ 260 mL sasolução de linha e preencha o tubo de entrada com a mesma solução.
- Cola uma lamela limpo com graxa de silicone para o topo da câmara para selá-lo. A tubulação de entrada e saída pode ser usado para remover as bolhas de ar aprisionado na câmara. É importante que o circuito elétrico não é interrompido por bolhas de ar.
- Imobilizar a câmara de imagem em uma plataforma de aço inoxidável e verificar se há vazamentos suavemente perfusão de solução salina através do tubo de entrada.
- Montar a câmara montada no palco de um microscópio invertido, e conectar a câmara a um sistema de perfusão gravidade, após ter preparado a entrada com solução salina.
- Anexar fios de ligação da câmara ao estimulador elétrico.
- Adicionar uma gota de óleo de imersão para o objectivo, se uma lente de óleo é usado. Foco sobre as células no meio da câmara com uma iluminação de campo claro.
4. Fase S1
- Neurônios perfundir com 1,5 mlFM de corante (Tabela 2) diluída em solução salina.
- Estimulam os neurônios para evocar a absorção de corante utilizando o estimulador ligado.
- Após a estimulação, os neurônios perfundir com solução salina fresca por 2 min para lavar o excesso de corante FM (vazão 7 ml / min). Contaminação da glia no sistema de cultura CGN é inferior a 5% 14, portanto, enquadrar este tempo é suficiente para remover a tintura .
- Deixe descansar por neurônios a 8 min.
- Durante este intervalo, localize redes axonal onde individuais FM terminais dye-carregado do nervo são visíveis usando comprimentos de onda de fluoresceína (excitação, 480 nm; emissão,> 550 nm). Evite áreas com aglomerados de células. Mantenha a iluminação a um mínimo nesta etapa, já que a excitação intensa pode resultar em fototoxicidade corante. Sinais evidentes disso são blebbing de axônios e uma falta de corante descarga (devido à fixação de corantes).
- Re foco imagem imediatamente antes da aquisição da imagem desde um ligeiro desvio pode ter ocorrido durante o período de descanso.
- Comece lapso de tempo de aquisição de imagem, à taxa de 1 quadro a cada 4 s.
- Depois de adquirir 5-10 imagens de referência, evocar exocitose do PRR, oferecendo um estímulo Hz 30 para 2 s (60 potenciais de ação) 8 Commence estimulação manualmente imediatamente após a captura frame..
- Depois de adquirir mais 10 imagens, evocam exocitose SV da RP com três estímulos de 40 Hz por 10 s (400 potenciais de ação), a cada 30 s para além 8.
- Adquirir um outro 5-10 imagens e, em seguida, a aquisição de imagens de pausa.
5. Fase de recuperação (ver Figura 2)
- Permitem que os neurônios para recuperar, pelo menos, 20 min.
- Opcional - Se o efeito de uma droga sobre endocitose deve ser testada, os neurônios perfundir com solução de drogas durante este período (Figura 2b) 3,8.
6. Fase S2
- Repita protocolo fase S1 (seção 4) para um experimento de controle usando o mesmo campo de visão comoem S1.
- Opcional - Se o efeito de uma droga sobre endocitose é para ser testado, perfundir neurônios com a solução de drogas suplementado com FM corante (Figura 2b) 3,8.
- Opcional - Alternativamente, se os efeitos da droga sobre exocitose são de interesse, os neurônios perfundir com a solução de drogas antes e durante o RRP e estímulos RP descarga (Figura 2c) 3.
7. Análise de Dados
- Use ImageJ e Microsoft Excel ou software semelhante para análise de dados.
- Para a análise, uma seqüência de imagens em formato de pilha é necessária. Alguns software de imagem pode exportar seqüências como únicas imagens. Se este for o caso, converter as imagens para uma pilha usando um ImageJ built-in função Imagem> Pilhas> Imagens de pilha.
- Ajustar o brilho eo contraste da pilha para maximizar a gama dinâmica. Image> Adjust> Brightness / Contrast (Figura 3a).
- Se deriva horizontal significativa ocorreu durante tele experimento, executar StackReg ( http://bigwww.epfl.ch/thevenaz/stackreg/ ) e TurboReg ( http://bigwww.epfl.ch/thevenaz/turboreg/ ) plugins em ImageJ para alinhar pilha de imagens (Figura 3b) .
- Run-Time Series Analyzer plugin ( http://rsbweb.nih.gov/ij/plugins/time-series.html ) (Figura 3c).
- Definir regiões de interesse (ROIs) ao longo de pelo menos 90 terminais nervosos. Estes devem ser idênticos (ROIs circular com diâmetro 1,5 mm) É útil para alternar entre as imagens antes e depois da descarga de corante para revelar terminais nervosos ativa (alternativamente um estímulo pré-imagem pode ser subtraído de uma imagem pós-estimulação). Um ideal ROI é um tamanho que é muito maior do que um terminal nervoso típico (Figura 3c).
- Obter a intensidade total / integrada de fluorescência de cada ROI sobre time e exportar para o Microsoft Excel (Figura 3d e 4a).
- Normalize traços ROI para o mesmo valor arbitrário, alinhando traços no plano do eixo Y para o estímulo primeiro desembarque em fases tanto S1 e S2 (Figura 4b-c). Este é o controle para pequenas variações na intensidade da fluorescência de fundo.
- Medir a queda absoluta na fluorescência evocados por cada estímulo descarga em arbitrária unidades de fluorescência para S1 e S2 da seguinte forma (Figura 4d):
- RRP = Mudança de fluorescência (ΔF) desencadeada por 30 Hz 2 s
- RP = Soma de ΔF desencadeada por 3 x 40 Hz 10 s
- Piscina de reciclagem total = RRP + RP
- Para cada parâmetro relevante em 7,9, calcular o valor médio de todos os terminais nervosos de uma experiência única.
- Para a análise estatística, os valores médios obtidos a partir de vários experimentos independentes podem ser calculadas. O número de lamelas em vez de o número de terminais nervosos deve ser usado como o statistical n.
8. Resultados representativos:
Um experimento de controle, onde foi submetido a duas rodadas CGNs de passos idêntica carga e descarga é representado na Figura 5. Ao começar uma série de experimentos, é essencial que um experimento de controle como este é realizado a cada dia para confirmar que S1 e S2 são comparáveis antes de variadas condições experimentais durante a S2.
Neste exemplo, CGNs foram carregados com 10 mM FM1-43 usando um 80 Hz 10 a estimulação s (Figura 5a). Figura 5b mostra terminais FM1-43-carregados nervo representada por puncta fluorescente. ROIs foram definidos mais de 90 terminais nervosos como mostrado na Figura 5c. O mesmo conjunto de ROIs foi utilizado tanto para S1 e S2. Durante ambas as descarrega, o PRR foi descarregado com um Hz 30 (2 s) estímulo seguido por RP descarga com 3 40Hz seqüencial (10 s) estímulos (Figura 5a). A queda de fluorescência durante cada estímulo podem ser claramente observados e quantificados (Figura 5d-e). Quando examinado, a fluorescência gotas correspondente ao PRR, RP e piscina de reciclagem total foram comparáveis em ambos os S1 e S2. Além disso, 20% dos SVs reciclados residia no RRP enquanto 80% residiam na RP em ambos os S1 e S2.
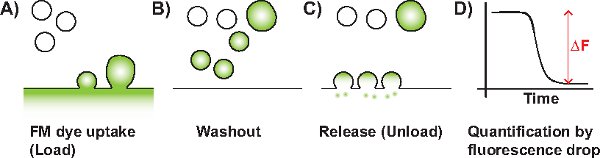
Figura 1 Diagrama esquemático de um experimento típico FM. A) endocitose SV é acionado na presença de corante FM (representada em verde). O corante é absorvido pela membrana invaginante (SVS única ou a granel endossomos). B) corante não-internalizado na membrana plasmática é lavado por perfusão. C) Após a aplicação de um estímulo descarga, rotulados SVs que se tornaram disponíveis para fusível de liberação com a membrana plasmática, resultando em uma perda de fluorescência. D) A mudança de fluorescência (ΔF), que é proporcional à quantidade de lançado SVs rotulados podem ser quantificados.
_upload/3143/3143fig2.jpg "/>
Figura 2 Diagramas esquemáticos de possíveis protocolos experimentais. A) Fluxograma de um experimento de controle onde as células sofrem duas rodadas de FM corante carga e descarga (S1 e S2). As células podem ser carregados usando uma variedade de estímulos diferentes. Passos descarga são idênticos em que a RRP é descarregado com 30 Hz por 2 s seguido por RP descarregar usando 3 vezes 40 Hz para 10 s. RRP e estímulos piscina reserva descarga foram separados por 40 segundos, todos os outros estímulos por 30 seg. Células são deixados para se recuperar de 20 min entre S1 e S2. Fluxogramas de possíveis modificações para testar o efeito de uma substância ou B) ou C endocitose exocitose) também são mostrados. Teste de drogas correspondentes podem ser perfundidos na câmara durante períodos indicados.
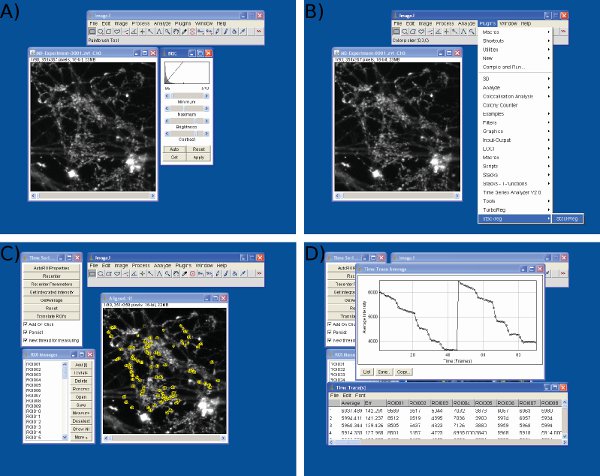
Figura 3 Imagens de análise de dados em J imagem. Imagens são mostradasUm de brilho) e ajuste de contraste, B) de alinhamento de quadro, C) a seleção ROIs, e D) de intensidade de extração valores usando Image J.
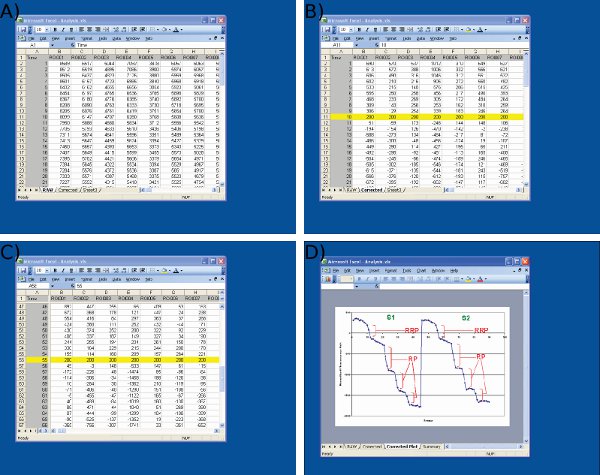
Figura 4 Imagens da análise de dados em Microsoft Excel. Imagens são mostradas para A) a importação de dados brutos de imagem J (1 coluna st = número de quadro, colunas restantes = dados de terminais nervosos individual) B) de ajuste de valores de referência S1 (quadro 10) para um valor arbitrário (200) no início do primeiro estímulo, C ajuste) dos valores basais S2 no quadro 55, usando um protocolo idêntico ao S1, e D de medição) de gotas de fluorescência usando Microsoft Excel. Note-se que o traço mostrado na média D é usado para definir os pontos de tempo antes e depois de cada queda. O tamanho das gotas de fluorescência para cada ROI deve ser determinada a partir de valores na planilha mostrada na C.

Figura 5. Representante experimento de controle. A) Fluxograma de um experimento de controle, onde CGNs foram carregados com 10μM FM1-43 usando 80 Hz (10 s) estimulação. As fases de S1 e S2 são idênticos. RRP e estímulos piscina reserva descarga foram separados por 40 segundos, todos os outros estímulos por 30 seg. B) Uma imagem que mostra terminais nervosos carregados com FM1-43. C) A mesma imagem B mostra 90 ROIs numeradas selecionadas para análise. D) Imagens de uma área representada por uma caixa vermelha no B em pontos de tempo selecionado. = Basal antes da estimulação; 30 Hz = depois de 30 Hz 2 s estimulação; 40 Hz 1,2,3 = após cada estímulo 40 Hz 10 s. Estas imagens são apresentadas em pseudo para ilustrar mudanças na fluorescência (bar espectro exibido à direita). E) Média ± SEM traço obtido a partir de 90 terminais nervosos retratado em C. estímulos individuais são representados por barras horizontais. Barra de escala = 10 mM.
Discussão
FM corantes são usados extensivamente para investigar a função do nervo terminal em muitas preparações neuronal. Eles têm sido utilizados principalmente para acompanhar o grau de qualquer endocitose SV, SV volume de negócios ou a cinética da exocitose 6. O protocolo descrito estende esses estudos para examinar o diferencial de descarga de piscinas específicas SV. Esta fornece informações adicionais sobre a reposição de piscinas SV e também a sua extensão de mobilização.
Corantes FM pode ser usado para rotular várias rodadas de reciclagem de SV dentro dos terminais nervosos mesmo. Temos explorado esta propriedade e projetado protocolos em que SV volume de negócios em cada terminal pode ser monitorado duas vezes na mesma terminais nervosos. Isso proporciona um controle preciso interna, que é essencial devido à natureza heterogénea de reciclagem SV em terminais nervosos paralelo 11. Através do uso da fase de S1 como um controle interno, a recarga do PRR, RP eo totalSV piscina na presença de drogas pode ser confiável e directamente comparados.
Além de fornecer informações do tamanho absoluto da reciclagem, piscinas RRP e RP em condições de estimulação diferente, este protocolo também pode fornecer dados para o seguinte - 1) O particionamento de SVs entre o PRR e RP em função da piscina de reciclagem para S1 e S2, 2) o tamanho relativo das piscinas S2 (RRP e RP) em função da piscina reciclagem total S1 e 3) o tamanho relativo de qualquer piscina SV definido no S2 em função da mesma piscina em S1. Este protocolo particular, não fornecerá informações sobre cinética de descarga no entanto, desde o tempo de aquisição é muito lento (para medições cinética tempos de aquisição deve ser o mais rápido possível e descarga automaticamente sincronizados para capturar imagem).
Os nossos 30 Hz estímulos 2 s evoca uma extensão idêntica de RRP descarga à sacarose hipertônica 8. Como o tamanho do PRRé definida por sacarose hipertônica descarga 15, podemos afirmar que este protocolo descarrega todos os SVs RRP, de acordo com estudos em neurônios do hipocampo 16. O pool de reserva é quase completamente esgotada por três trens de 400 estímulos (40 Hz 10 s cada) já que este estímulo descarrega uma quantidade idêntica de tintura para um paradigma (2 estímulos com 50 mM KCl), que esgota os 95% de todos os SVs dye-rotulados 8,17. Quantificação exata do tamanho de ambos os RRP e piscina reserva é também dependente de aquisição de informação dentro da faixa linear dinâmica da câmera CCD.
Este protocolo simples também pode ser modificado ainda. A força de estímulos de carga também pode ser variado para determinar como a atividade neuronal e modos diferentes afetam endocitose SV reabastecimento da piscina. Além disso, maior do que dois ciclos de carga e descarga também pode ser realizada, se necessário. Este protocolo também pode ser usado em células transfectadas tanto com superexpressão ouvetores shRNA. Devido à eficiência de transfecção baixos de culturas primárias de neurônios, proteínas expressas devem ser marcadas com proteínas fluorescentes. É essencial que essas marcas fluorescentes não interferir com o sinal FM corante (use ciano ou proteínas vermelho, por exemplo). Neste exemplo, terminais nervosos das células transfectadas e não transfectadas no mesmo campo de visão também pode ser comparada como um controle adicional de 8. Em tais experimentos uma comparação da extensão de carga, entre cargas de S1 e S2 é de pouco valor, uma vez que a perturbação está presente durante as duas cargas. Particionamento de corante entre piscinas SV ainda pode ser visualizado no entanto 8.
Repórteres genética chamada pHluorins também pode ser empregado para monitorar SV exocitose e endocitose na cultura neuronal primária. Estas sondas usar um pH-sensível proteína verde fluorescente ao ambiente pH de domínios luminal de proteínas tag SV, como VAMP, sinaptofisina e VGLUT1 18 . Quando usado em conjunto com inibidores da ATPase vesicular, pHluorins pode relatar tanto a cinética ea extensão da SV mobilização piscina 19. A abordagem FM-dye com base descrita aqui tem algumas vantagens sobre a técnica pHluorin, Em primeiro lugar, corantes FM fornecer informações sobre quais SV modo endocitose reabastece o RRP e piscinas reserva 8. Em segundo lugar piscinas específicas SV pode ser rotulado com corantes FM que possuem diferentes propriedades espectrais 20 e, finalmente, não há nenhuma exigência para a transfecção. Corantes FM não pode fornecer informações sobre o tráfego entre o SV de descanso e reciclagem piscinas SV porém (em contraste com pHluorins 19), uma vez que, por definição, SVs têm de ser carregados com tinta durante a endocitose a ser visível. Assim, tanto corantes FM e pHluorins têm pontos fortes e fracos e são mais poderosos quando utilizados em experimentos independentes para lidar com a mesma pergunta.
Imagens de alta qualidade são essenciais para a análise válida e reproducible resultados. Enquanto o deslizamento horizontal pode ser facilmente corrigido, experimentos onde há um desvio no eixo Z não podem ser recuperados. Por esta razão, é importante re-focar imagens antes de iniciar a descarrega S1 e S2. Nos casos em que uma deterioração significativa fluorescentes ocorreu, correções decadência pode ser aplicado (geralmente subtraindo um traço previamente gravados a partir de células FM-carregados na ausência de estimulação). No entanto, sugere-se que a correção de atenuação é realizada somente para a representação gráfica e não deve ser usado para qualquer análise quantitativa.
Divulgações
Não temos nada a revelar.
Agradecimentos
Este trabalho foi financiado por uma concessão do Wellcome Trust (Ref: 084277).
Materiais
| Name | Company | Catalog Number | Comments |
| Nome | Companhia | Catálogo não. | |
|---|---|---|---|
| AxioCam MRM Rev. 3 Câmera Digital | Carl Zeiss | 4265099901000 | |
| Axio Microscópio Observer.A1 | Carl Zeiss | 4310040000000 | |
| Placas de cultura de células (6 poços) | Greiner bio-one | 657160 | |
| Centrifugação (Universal 32R) | Hettich Zentrifugen | 1610 | |
| Incubadora de CO 2 | Heraeus Instruments | 51014042 | |
| Falcon tubos (15/50 ml) | Greiner bio-one | 188271/210261 | |
| Fluar 20X / 0,75 ∞ / 0,17 Objetivo | Carl Zeiss | 4401459901000 | |
| Lamínulas de vidro (Ø25mm) | A VWR International | 631-1584 | |
| Pasteur de vidro pipetas (230 nm) | Greiner bio-one | 612-1799 | |
| Hemocitómetro | VWR | 15170-170 | |
| Imagens da câmara | Warner | RC-21 BRFS | |
| Capela de fluxo laminar | Biohit | VLF BHS 1200 | |
| McIlwain Tissue Chopper | Mickle Laboratory Engineering Co. Ltd. | MTC / 2 | |
| Lâmpada de mercúrio | Carl Zeiss | HBO 103 | |
| MultiStim Sistema Elétrico Estimulador (100mV, largura pluse 1ms) | Digitimer Ltd. | D330 | |
| Bomba de perfusão | Watson-Marlow | 313S | |
| Pipetas sorológicas (5/10/25 ml) | Greiner bio-one | 606180/607180/760180 | |
| Obturador controlador | Carl Zeiss | MAC5000 | |
| Seringa (20 ml) | BD Plastipak | ST01-B002 | |
| Filtros de seringa (Minisart - 0,20 mm) | Sartorius Stedim | 16532 | |
| VC-6 Six controlador de válvula Canal | Warner | 64-0135 | |
| YFP filter set (Set 46) | Carl Zeiss | 1196-681 |
Tabela 1. Equipamentos específicos e aparelhos utilizados
| Nome | Companhia | Catálogo não. | Concentração |
|---|---|---|---|
| FM1-43 | Cambridge BioScience | BT70021 | 10 mM |
| FM2-10 | Cambridge BioScience | BT70044 | 100 mM |
| Poli-D-lisina | Sigma | P7886 | 15 mcg / ml |
| Graxa de silicone | Sigma | 85403 | - |
Tabela 2. Reagentes específicos utilizados
| Nome | Companhia | Catálogo não. | Concentração |
|---|---|---|---|
| Albumina de soro bovino (BSA) | Sigma | A4503 | 0,3% |
| D-Glicose | Sigma | G5767 | 0,25% |
| MgSO 4 · 7H 2 O | Sigma | M2773 | 1,5 mM |
| D-PBS | Gibco | 21300 | 960 mg/100 ml |
-Make 100ml frescas para cada preparação
Estéril antes do uso do filtro
Tabela 3. Solução B para a preparação CGN
| Nome | Companhia | Catálogo não. | Concentração |
|---|---|---|---|
| Solução B | - | - | 19 ml |
| Tripsina (5 estoque mg / ml, -20 ° C) | Sigma | T9201 | 1 ml |
Tabela 4. T solução para a preparação CGN
| Nome | Companhia | Catálogo não. | Concentração |
|---|---|---|---|
| Solução C | - | - | 3,2 ml |
| Solução B | - | - | 16,8 ml |
Tabela 5. Solução W para CGN preparação
| Nome | Companhia | Catálogo não. | Concentração |
|---|---|---|---|
| Desoxirribonuclease (DNase, 500 U por 0,5 ml de ações, -20 ° C) | Sigma | D5025 | 0,5 ml |
| MgSO 4 · 7H 2 O | Sigma | M2773 | 1,5 mM |
| Solução B | - | - | 10 ml |
| Inibidor de tripsina de soja (SBTI, 0,5 mg por 0,5 ml de ações, -20 ° C) | Sigma | T9003 | 0,5 ml |
Tabela 6. Solução C para CGN preparação
| Nome | Companhia | Catálogo não. | Concentração |
|---|---|---|---|
| Albumina de soro bovino (BSA) | Sigma | A4503 | 4% |
| Solução salina balanceada de Earle (EBSS) | Gibco | 24010 | 10 ml |
| MgSO 4 · 7H 2 O | Sigma | M2773 | 3 mM |
Tabela 7. EBSS solução para a preparação CGN
| Nome | Companhia | Catálogo não. | Concentração |
|---|---|---|---|
| Citosina β-D-arabinofuranoside (Ara-C) * | Sigma | C1768 | 10 mM |
| Fetal bovino Serum | Gibco | 10106 | 10% |
| D-Glicose | Sigma | G5767 | 30 mM |
| L-Glutamina | Sigma | G3126 | 2 mM |
| KCl | Sigma | P5405 | 25 mM |
| Meio essencial mínimo (MEM) | Gibco | 21090 | 500 ml |
| Penicilina (P) / estreptomicina (S) | Gibco | 15140 | 100 U / ml (P), 100 mg / ml (S) |
* Ara-C deve ser adicionado ao meio a partir de 1 DIV
Tabela 8. Meios de Cultura para a preparação CGN
| Nome | Versão | Companhia |
|---|---|---|
| AxioVision Rel. | 4,8 | Carl Zeiss |
| ImageJ | 1.42q | National Institutes of Health |
| Microsoft Excel | 2003 | Microsoft |
Tabela 9. Software de computador específicos utilizados
| Nome | Companhia | Catálogo não. | Concentração |
|---|---|---|---|
| CaCl 2 · 2H 2 O | Sigma | C7902 | 1,3 mM |
| Glicose | Sigma | G5767 | 5 mM |
| KCl | Sigma | P5405 | 3,5 mM |
| KH 2 PO 4 | Sigma | P9791 | 0,4 mM |
| MgCl 2 · 6H 2 O | Sigma | M0250 | 1,2 mM |
| NaCl | Fluka | 71378 | 170 mM |
| NaHCO 3 | Fluka | 71627 | 5 mM |
| Na 2 SO 4 | Suprimentos BDH Laboratory | 10264 | 1,2 mM |
| TES | Sigma | T1375 | 20 mM |
Tabela 10. Solução salina (pH 7,4)
Referências
- Rizzoli, S. O., Betz, W. J. Synaptic vesicle pools. Nat. Rev. Neurosci. 6, 57-69 (2005).
- Sudhof, T. C. The synaptic vesicle cycle revisited. Neuron. 28, 317-320 (2000).
- Evans, G. J., Cousin, M. A. Activity-dependent control of slow synaptic vesicle endocytosis by cyclin-dependent kinase 5. J. Neurosci. 27, 401-411 (2007).
- Clayton, E. L., Cousin, M. A. Differential labelling of bulk endocytosis in nerve terminals by FM dyes. Neurochem. Int. 53, 51-55 (2008).
- Clayton, E. L., Evans, G. J., Cousin, M. A. Bulk synaptic vesicle endocytosis is rapidly triggered during strong stimulation. J. Neurosci. 28, 6627-6632 (2008).
- Cousin, M. A. Use of FM1-43 and other derivatives to investigate neuronal function. Curr. Protoc. Neurosci. Chapter 2, Unit 2-Unit 2 (2008).
- Clayton, E. L. The phospho-dependent dynamin-syndapin interaction triggers activity-dependent bulk endocytosis of synaptic vesicles. J. Neurosci. 29, 7706-7717 (2009).
- Cheung, G., Jupp, O. J., Cousin, M. A. Activity-dependent bulk endocytosis and clathrin-dependent endocytosis replenish specific synaptic vesicle pools in central nerve terminals. J. Neurosci. 30, 8151-8161 (2010).
- Betz, W. J., Mao, F., Smith, C. B. Imaging exocytosis and endocytosis. Curr. Opin. Neurobiol. 6, 365-371 (1996).
- Ryan, T. A., Reuter, H., Smith, S. J. Optical detection of a quantal presynaptic membrane turnover. Nature. 388, 478-482 (1997).
- Murthy, V. N., Sejnowski, T. J., Stevens, C. F. Heterogeneous release properties of visualized individual hippocampal synapses. Neuron. 18, 599-612 (1997).
- Tan, T. C. Cdk5 is essential for synaptic vesicle endocytosis. Nat. Cell. Biol. 5, 701-710 (2003).
- Anggono, V., Cousin, M. A., Robinson, P. J. Styryl dye-based synaptic vesicle recycling assay in cultured cerebellar granule neurons. Methods. Mol. Biol. 457, 333-345 (2008).
- Gallo, V. Selective release of glutamate from cerebellar granule cells differentiating in culture. Proc. Natl. Acad. Sci. U.S.A. 79, 7919-7923 (1982).
- Stevens, C. F. Neurotransmitter release at central synapses. Neuron. 40, 381-388 (2003).
- Mozhayeva, M. G. Development of vesicle pools during maturation of hippocampal synapses. J. Neurosci. 22, 654-665 (2002).
- Cousin, M. A., Evans, G. J. O. Activation of silent and weak synapses by cAMP-dependent protein kinase in cultured cerebellar granule neurons. J. Physiol. 589, 1943-1955 (2011).
- Kim, S. H., Ryan, T. A. Synaptic vesicle recycling at CNS synapses without AP-2. J. Neurosci. 29, 3865-3874 (2009).
- Kim, S. H., Ryan, T. A. Cdk5 serves as a major control point in neurotransmitter release. Neuron. 67, 797-809 (2010).
- Groemer, T. W., Klingauf, J. Synaptic vesicles recycling spontaneously and during activity belong to the same pool. Nat. Neurosci. 10, 145-147 (2007).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados