Method Article
Imagens de células vivas de Bacillus subtilis E Streptococcus pneumoniae Usando Microscopia lapso de tempo Automated
Neste Artigo
Resumo
Este protocolo fornece um procedimento passo-a-passo para monitorar o comportamento de células individuais de diferentes bactérias no tempo usando automatizado de microscopia de fluorescência de lapso de tempo. Além disso, fornecem diretrizes como analisar as imagens de microscopia.
Resumo
Durante os últimos anos os cientistas se tornaram cada vez mais conscientes de que os dados médios obtidos a partir de experimentos população microbiana baseada não são representativos do comportamento status, ou fenótipo de células individuais. Devido a essa nova visão o número de estudos única célula aumenta de forma contínua (para revisões recentes ver 1,2,3). No entanto, muitas das técnicas aplicadas única célula não permitem acompanhar o desenvolvimento eo comportamento de uma única célula específica no tempo (por exemplo, citometria de fluxo ou microscopia padrão).
Aqui, fornecemos uma descrição detalhada de um método de microscopia utilizada em vários estudos recentes 4, 5, 6, 7, que permite seguir e de gravação (fluorescência) individual células bacterianas de Bacillus subtilis e Streptococcus pneumoniae através do crescimento e divisão por muitas gerações. Os filmes resultantes podem ser usados para construir árvores filogenéticas linhagem traçando volta a história de uma única célula dentro de uma população que se originou de um ancestral comum. Este lapso de tempo método de microscopia de fluorescência não pode ser usado apenas para investigar a divisão, crescimento e diferenciação de células individuais, mas também para analisar o efeito da história da célula e ascendência sobre o comportamento celular específica. Além disso, lapso de tempo de microscopia é ideal para examinar a dinâmica de expressão gênica e localização de proteínas durante o ciclo celular bacteriana. O método explica como preparar as células bacterianas e construir a lâmina de microscópio para permitir que o crescimento de células individuais em uma microcolony. Em resumo, as células individuais são vistos em uma superfície semi-sólida composta por meio de crescimento suplementado com agarose em que crescem e se dividem em um microscópio de fluorescência dentro de uma câmara de temperatura controlada ambiental. As imagens são capturadas em intervalos específicos e são posteriormente analisados usando o software de código aberto ImageJ.
Protocolo
1. Preparação de B. culturas subtilis
- Inocular as células de -80 ° C stocks em 10 de lapso de tempo médio de microscopia ml (TLM) (62 mM K 2 HPO 4, 44mm KH 2 PO 4, 15 mM (NH 4) 2 SO 4, citrato de sódio 6,5 mM, 0,8 mM MgSO 4, ácidos 0,02% casamino, 27,8 mM de glicose, 0,1 mM L-triptofano, o pH foi ajustado para 7 com uma solução de KOH) suplementadas com antibióticos, se necessário.
- Cultivar as células durante a noite em um frasco de vibração (30 ° C, 225 rpm).
- Na manhã seguinte, diluir a 1:10 em células pré-aquecido meio quimicamente definido (CDM) (62 mM K 2 HPO 4, 44mm KH 2 PO 4, 15 mM (NH 4) 2 SO 4, 6,5 mM de citrato de sódio, 0,8 mM MgSO 4, 2,2 mM de glicose, 2,1 de ácido L-glutâmico mM, 6 mM L-triptofano, 7,5 mM MnCl 2, 0,15 mix de metal x (50x preparar ações mix MT (ref 8) que contém: 0,2 M MgCl 2, 70 mM CaCl 2, 5 mM MnCI 2, 0,1 mM ZnCl 2, 0,2 mM cloridrato de tiamina, 2 mM HCl, 0,5 mM FeCl 3 (add última)) sem antibióticos.
- Crescer o B. subtilis células para meados de fase exponencial (30 ° C, 225 rpm). Normalmente, isso leva aproximadamente quatro horas. Importante, preparar o slide agarose uma hora antes de as células chegar ao centro da fase exponencial (ver secção 2).
- Medir a absorbância da cultura em 600nm (A 600) e diluir as células a um valor aproximado de 0,035 600 A utilização do MDL. Este OD garante que uma única célula com espaçamento apropriado são manchados na lâmina de microscópio para microscopia de lapso de tempo.
2. Preparação da amostra do microscópio (ver também Figura 2)
Uma hora antes de chegar a meados de células de crescimento exponencial, prepare a lâmina de microscópio como segue:
- Limpe duas lâminas de vidro para microscópio (por exemplo, Knittel vidro, 7,6 x 2,6 centímetros), com 70% de etanol e água.
- Tome um quadro gene (ABgene; 1,7 x 2,8 cm) e remova cuidadosamente uma das folhas de plástico a partir do quadro gene, sem causar a desmontagem da cobertura plástica no outro lado do quadro gene.
- Anexar o quadro de gene no meio de uma das lâminas de vidro pelo contato facilitando primeiro em apenas um lado, seguido pelo apego guiada do quadro gene restante com uma unha. Evitar bolhas de ar enquanto anexando o quadro gene para a lâmina de vidro.
- Use um microondas para dissolver 150 mg (1,5%) de alta resolução ponto de fusão baixo agarose (Sigma) em 10 ml de MDL. A agarose precisa ser completamente dissolvido para obter habilitações mínimas exigidas para os experimentos de microscopia de lapso de tempo. Se necessário, complementar a agarose-CDM com indutor ou outros compostos neste momento
- Transferência de 500 mL do aquecimento agarose-MDL no meio do quadro gene. Certifique-se de toda a área, incluindo (as fronteiras) é totalmente coberta.
Os passos seguintes (2,6-2,10) têm que ser realizadas rapidamente para evitar o ressecamento excessivo da agarose-CDM. - Coloque a lâmina de vidro segundo no quadro gene agarose-CDM preenchido. Tente evitar bolhas de ar. Coloque os slides imprensada em uma posição horizontal por 45 min a 4 ° C na geladeira para permitir a agarose-CDM para solidificar o suficiente.
- Cuidadosamente deslizar a lâmina de vidro superior. Use uma lâmina de barbear para cortar tiras de agar de ~ 5 mm de largura dentro da estrutura do gene, no qual as células serão cultivadas. Um máximo de três tiras podem ser usadas por slide, separados por espaço ~ 4 mm para cada lado. Estes espaços irão fornecer ar que é essencial para B. crescimento subtilis. Se quatro cepas diferentes precisam ser seguidas no tempo, duas tiras podem ser feitas e ser cortado pela metade a resultar em quatro pequenas praças. Remova qualquer meio residual sólido.
- Remova cuidadosamente a tampa segunda e última plástico a partir do quadro gene para expor o lado adesivo do quadro gene
- Células de carga única (a partir do passo 1.5) sobre o meio sólido sem tocá-lo com a ponta da pipeta. Use 2,5 mL de uma faixa inteira, ou 1 ml de uma pequena praça. Sempre começam em cima da almofada de agarose e deixe o líquido para dispersar igualmente em sua área de crescimento atribuído, transformando o slide para cima e para baixo. O slide está pronto, assim que as bordas do líquido se torne ondulado e movimento do líquido não é mais visível quando rodar o slide.
- Coloque uma lamínula limpa microscópio slide (24 x 50 mm) no quadro gene de um lado para o outro (evitar bolhas de ar). Assegurar apego completo, aplicando pressão sobre a lamínula ao longo do quadro gene com a unha. Se a lamínula é colocada sobre as células, sem permitir que sequem o suficiente, as células tendem a crescer em cima uns dos outros durante o experimento. Também tome cuidado para não esperar muito tempo antes de aplicar a lamínula, desde o agarose será, então, muito seco.
- Pré-aquecer o deslize por 1 hora a 30 ° C. Se o slide would directamente ser colocado na câmara de pré-aquecido ambiental (veja o passo 3.1) do microscópio, as flutuações de temperatura pode causar problemas de focagem automática nas primeiras horas do experimento.
3. Lapso de tempo de microscopia de fluorescência (ver também Figura 3 e Movie 1)
- Pré-aquecer a câmara ambiental sobre tempo (em nossas mãos, pelo menos, 2h antes do início do experimento), a fim de evitar problemas de foco automático após o início do experimento. O tempo necessário depende da câmara ambiental utilizados, bem como o sistema de aquecimento e do microscópio.
- Selecione o objetivo apropriado, filtros e espelho dicróico de acordo com o seu set-up experimental. Para experimentos de longo certifique-se que um UV-filtro é colocado entre a fonte luminosa ea amostra. Também, se possível, bloquear parte da luz de excitação usando filtros de densidade neutra para minimizar a exposição.
Os seguintes equipamentos (fornecidos pelo DeltaVision, UK) foi utilizado para os experimentos de microscopia de lapso de tempo publicada em de Jong et al 2010 5:. IX71 microscópio (Olympus), CoolSNAP HQ2 câmera (Princeton Instruments), 300W Fonte de Luz Xenon, 60x brilhante objetivo de campo (1,25 NA), GFP filterset (Chroma, excitação em nm 470/40, 525/50 emissão nm), mCherry filterset (Chroma, excitação em nm 572/35, 632/60 emissão nm). Focagem automática foi realizada utilizando a luz diascopic e usando o presente de rotina no software autofocus Deltavision de Softworx. Note-se que agora há uma série de sistemas de foco automático outros que também são adequados, como o Focus Zeiss Definite, a Nikon Sistema de Foco Perfeito eo Leica Controle de Foco Adaptive.
- Programa de sua experiência de acordo com seu set-up experimental. É sábio para determinar a quantidade de luz necessária para construções específicas, assim como as definições de focagem automática para outros lapso de tempo microscópios ou bactérias antes da experiência real. Menor tempo de exposição e menor quantidade de luz de excitação irá minimizar branqueamento e fototoxicidade. Use luz diascopic para a rotina de focagem automática.
As seguintes definições foram utilizadas para os experimentos de microscopia de lapso de tempo publicada em de Jong et al 2010 5:. Instantâneos para filmes foram tomadas em intervalos de 8 ou 12 minutos, utilizando 10% APLLC White LED de luz e 0,05 s de exposição para imagens de campo claro, 10% de luz Xenon e 0,5 s de exposição para GFP, detecção e 32% de luz Xenon e 0,8 s de exposição para mCherry detecção, respectivamente. Dados brutos foram armazenados usando softWoRx 3.6.0 (Applied presicion). O foco automático foi programado para 0,06 mm e passos uma gama total de 1,2 mM.
- Coloque o slide preparados (seção 2) na câmara de pré-aquecido ambiental do microscópio e monitorar o crescimento de células individuais em uma monocamada microcolony a 30 ° C.
Dicas específicas:
- Selecione as células individuais que estão localizados no meio do bloco de ágar. As bordas do bloco de agar secam mais facilmente. Armazenar o X, Y, Z posição usando software do microscópio.
- Grandes movimentos da fase do X, Y e Z pode perturbar a agarose e, conseqüentemente, dificultar a identificação de células pela rotina de focagem automática. Em geral, para minimizar X, Y, Z movimento, nós não marcar mais de 10 posições por experimento, mesmo se um slide contém várias cepas.
- Depois de ter seleccionado a primeira célula, apenas ajustar o Z-foco com o software. A partir deste ponto, não alteram o foco manualmente no corpo do microscópio usando o "botão Z", a menos que este é codificado digitalmente. Garantir que, após cada rotina autofocus o novo X, Y, Z posição é armazenada pelo software.
- Verifique se as definições de focagem automática são apropriados para o experimento, antes de começar a correr. O uso de microscopia de contraste de fase pode melhorar a rotina de autofocus comparação com o uso de microscopia de campo claro ou DIC, devido ao contraste reforçada. No entanto, o anel de fase em contraste de fase objetivos torna-os menos sensíveis (aproximadamente 10%) na coleta de luz de fluorescência. Assim, por fracos amostras fluorescentes, um objetivo sem anel de fase é mais adequado.
- Verificar se as células selecionadas ainda estão em foco a cada meia hora, até que o experimento é executado de forma estável. Quando as células neste momento estão fora de foco, ajuste manualmente. Devido às variações de temperatura, bem como amostras secas mal, isso pode ser necessário durante as primeiras horas. Além disso, devido ao melhor contraste, o foco automático funciona melhor quando as células são mais no campo de visão.
- Após a experiência terminou, separar os diferentes canais do filme e segura-los como arquivos separados (ou seja, contraste de fase, GFP, mCherry) se necessário (pacotes aquisição certos vai colocar todos os canais em um único arquivo empilhados). Para publicação, as imagens podem ser reforçada por deconvolução em 2D, o que é especialmente noseful para estudos de localização de proteínas. Deconvolve as imagens usando o software do microscópio ou com um pacote de comerciais, como Huygens ( www.svi.nl ).
- Analisar os dados usando ImageJ ( http://rsbweb.nih.gov/ij/ ) (use o cru, arquivos de imagem não processados para isso) e Microsoft Excel ou Plot Sigma. Stacks, por exemplo, pode ser salva como um arquivo ". Avi" arquivo de filme no ImageJ. A descrição detalhada de como fluorescência de células individuais podem ser medidos em tempo é dada abaixo.
4. Análise de dados de dinâmica de atividade do promotor usando ImageJ
Tomamos nota de que outros pacotes de software são bons disponíveis, que são especializados em análise de imagens de microscopia de lapso de tempo, tais como software BHV 9, 4, Schnitzcell 10, PSICIC 11, e Microbe-Tracker 12, mas aqui vamos nos concentrar sobre o pacote ImageJ livremente disponíveis.
- Download ImageJ ( http://rsbweb.nih.gov/ij/ ) e (se necessário) o plugin correto para abrir o seu arquivo (empilhadas). Por exemplo, filmes gravados usando um microscópio deltavision só pode ser aberto em ImageJ com o plugin opener deltavision. Copie o DV-plugin na pasta plugin do ImageJ e iniciar o programa. Alterar a capacidade de memória em editar / / opção de memória e tópicos para 1250. Isto permite trabalhar com arquivos maiores, tais como os obtidos a partir de lapso de tempo filmes.
- Para avaliar o histórico de células de uma única célula, abra o filme contraste original fase de um microcolony e vá até o último quadro de interesse no filme. Selecione a opção "linhas segmentadas" botão de seleção no menu.
- Desenhar uma linha no fundo e pressione "CTRL" + "T". Isto abrirá as regiões do gerente de interesse (ROI). (O valor correspondente a fluorescência de fundo pode ser usado manualmente para subtrair o fundo -.. Veja abaixo Alternativamente, use o fundo atual rotina de subtração dentro ImageJ) Também desenhar uma linha na célula de interesse e adicionar o ROI com o gerente ROI. Uma vez que estamos investigando promotor GFP-fusões neste estudo de caso eo GFP é difundido por todo o citoplasma, a célula inteira deve ter valores semelhantes de fluorescência para cada pixel único em toda a extensão da célula. Rolar um quadro de volta no tempo e selecione um ROI novo na mesma célula de interesse. Salvar este terceiro ROI e continuar com o procedimento até que o ROI correspondente no primeiro frame do filme foi salvo.
Estar ciente de que a fluorescência de células-filhas podem variar muito após a divisão celular. Ou usar um corante de membrana que pode ser aplicado em conjunto com proteínas de fluorescência produzida pelas células (tais como a combinação do vermelho membrana corante FM 5-95 ® (Invitrogen) e GFP) para visualizar a formação de septo. Neste caso, o canal correspondente de fluorescência e não o filme de contraste de fase deve ser usado para acompanhar células no tempo. Alternativamente, pode-se ficar no lado seguro, selecionando ROI em apenas metade de uma célula. - Dentro do gerenciador de ROI, clique em "save". Se o final do arquivo é "roi". E depois um roi é selecionado na lista, e somente este será salvo. Se o final do arquivo é "zip"., Então todo o conjunto será salvo (obrigatório).
- Fechar o filme de contraste de fase e abrir o filme original de fluorescência (GFP, por exemplo). Clique em "mostrar todos" e "medir" no gerenciador de ROI. Uma nova janela será aberta (Resultados). Copiar os resultados em uma folha de Excel e subtrair a fluorescência média para cada célula da fluorescência de fundo do meio. A fluorescência líquidos resultantes podem ser plotados contra o tempo para revelar a atividade do promotor da célula de interesse no tempo.
- Alternativamente, a fluorescência de todas as células de um microcolony podem ser analisados em um determinado ponto do tempo. A fim de fazer isso selecionar e salvar ROI para o fundo e cada célula em um quadro, como descrito acima, copie os valores de fluorescência para o Excel e produzem histogramas usando a função "histograma" na "ferramenta" menu.
- Para obter imagens de quadros individuais para publicação, selecione o quadro de interesse, selecione "image" - "duplicado de imagem" e mudar o tipo de imagem para "RGB" ou "8 bits", selecionando "imagem" - "tipo" - "cor RGB" ou "8 bits". Guardar a moldura duplicada como ". Tiff". As imagens RGB/8-bit podem ser abertos por programas de desenho convencional, como CorelDraw ou Adobe Illustrator. Se necessário, as imagens podem ser adaptados usando "imagem" - "ajuste" - "brilho / contraste" ou "imagem" - "ajuste" - "janela / nível" no ImageJ.
5. Produção de filmes para a publicação com ImageJ
- Abra o contraste de fase original e do filme de fluorescência correspondente (s) no ImageJ como descrito acima. Selecione o botão seleções retangulares (1 ª à esquerda) e desenhe um retângulo de ROI no primeiro quadro de tal maneira, que o microcolony desenvolvimento é delimitada pela throu ROIar por toda a filme inteiro. Selecione "imagem" - "cultura" e esta versão segura menor do filme com um novo nome. Selecione o ROI mesmo através do gerente de ROI no filme de fluorescência e proceda como antes.
- Para combinar os filmes tanto na horizontal ou na vertical, selecione "plugin" - "combinador de pilha". Se desejar, um batedor de tempo podem ser adicionados através de "plug-in" - "stamper tempo". Salvar a pilha uma vez como combinado ". Dv" ou ". Tiff" e uma vez como ". Avi" ou filme quicktime.
Adaptações protocolo alternativo para Streptococcus pneumoniae (Figura 4 e Movie 2):
6. Preparação de S. culturas pneumoniae
- Crescer S. células pneumoniae (cepa D39 13 encapsulados, ou da tensão unencapsulated R6 14 como culturas de pé em C + Y média 15 a 37 ° C até que um OD em A 600nm de cerca de 0,4 é atingido. Centrifugar as células por 2 min a 14.000 rpm e ressuspender o pellet celular em um volume de produtos frescos C + Y contendo glicerol médio de 14,5% (v / v), que resultaria em um 600nm A de exatamente 0,4. alíquotas das células e armazená-los a -80 ° C para uso futuro.
- Por lapso de tempo microscopia, tomar uma alíquota de S. anteriormente cultivadas células pneumoniae. Inocular 4 ml de doce C + Y médio 1:100 com células a partir da alíquota de -80 C °. Cultivar as células até meados de fase exponencial para um OD de A 600nm de 0,1 - 0,2. Normalmente, isso leva cerca de duas horas quando são usadas células de -80 ° C alíquotas.
7. Preparação da amostra do microscópio
- Prepare uma lâmina de microscópio como descrito acima para B. subtilis mas certifique-se que a agarose contém complexos C + Y médio. Desde S. pneumoniae é uma microaerophile, os bolsões de ar entre as tiras agarose deve ser menor do que para B. subtilis (~ espaço de 1 mm em ambos os lados).
- Medir a absorbância da cultura em 600 nm (A 600), diluir o crescimento exponencial células S. pneumoniae de um A 600 aproximada de 0,05 usando C + Y médio e use esta diluição para carregar o slide agarose.
8. Lapso de tempo de microscopia de contraste de fase
Ajustar as configurações de microscópio para S. pneumoniae: o uso de microscopia de contraste de fase desde S. pneumoniae é difícil identificar usando microscopia de campo brilhante. Continue o protocolo como descrito para B. subtilis (siga os passos de 2,9-3,7). S. pneumoniae células podem ser cultivadas em cada 30 ° C ou 37 ° C (que crescem mais rápido a 37 ° C).
9. Resultados representativos:
O experimento de fluorescência de lapso de tempo foi realizada com sucesso, se as bactérias cresceu em uma monocamada microcolony, que é completamente localizada dentro do campo de visão no final do experimento (ver Figura 5A-C). Se as células cresceram em cima uns dos outros, é não só impossível rastrear sua história com precisão, mas também os níveis de fluorescência de células sobrepostas não pode ser medido corretamente. Células tendem a crescer em cima uns dos outros, se as células manchadas não foram suficientemente seca (passo 2.9) ou se a composição do meio precisa ser ajustado para obter um crescimento mais lento. Se um microcolony cresceu fora de vista, então a distribuição de sinais de fluorescência dentro de uma colônia não pode ser determinado. Causas para "movimento microcolony" pode ser de secagem insuficiente de células manchadas (passo 2.9), ou se o software não foi programado para acompanhar o microcolony durante o desenvolvimento. Além disso, é importante que os patches locais de fluorescência aumentada não são detectáveis no meio, pois isso obscurece os sinais de fluorescência provenientes das células (ver Figura 5D-F). Problemas de fundo relacionados podem surgir a partir de compostos de mídia, airbubbles ou aglomerações não dissolvido agarose. Para visualizar isso, nós mostramos na figura. Sinais de fundo 5F deste slide específico, quando a imagem foi tirada utilizando excitação / emissão de filtros para o vermelho corantes fluorescentes. Como visto, brilhante spots autofluorescent estão presentes o que poderia dificultar a imagem. Para evitar tais pontos, verifique se a agarose é completamente dissolvido e não há airbubbles quando colocar a lamínula sobre a lâmina de microscópio.
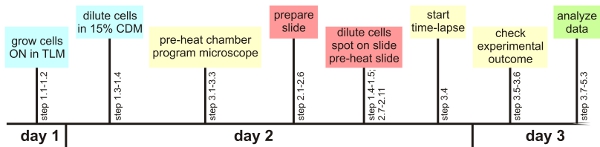
Figura 1: Visão geral Experimental

Figura 2: Preparação da amostra do microscópio
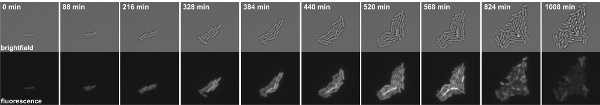
Figura 3: Time-lapse de microscopia de fluorescência de B. subtilis células abrigar uma fusão kinB P-GFP. Instantâneos são tomadas a partir Movie 1. Painéis superior: campo claro, painéis de fundo: canal de GFP.
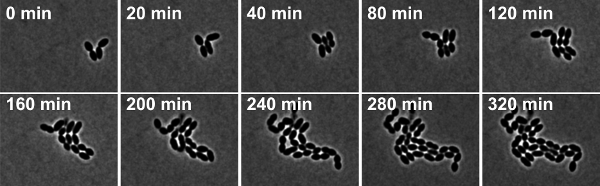
Figoure 4: Tempo de lapso de microscopia de contraste de fase da S. pneumoniae cepa selvagem R6. Instantâneos são tomadas a partir do filme 2.
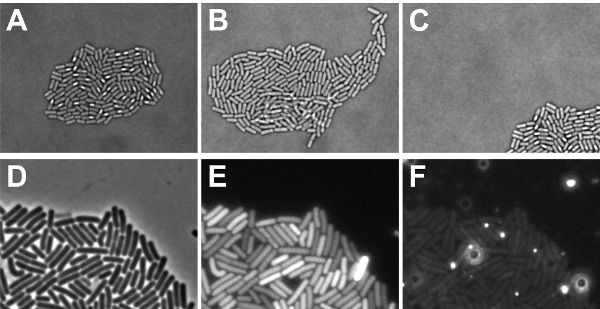
Figura 5: Ilustração dos possíveis resultados (time-lapse) microscopia. AC mostra fatores que precisam ser considerados para os dados obtidos com diascopic configurações de luz. (A) Micrografia Brightfield de uma monocamada microcolony (resultado positivo) de esporulação B. células subtilis (B) de uma imagem Brightfield B. subtilis microcolony em que algumas células cresceram em cima uns dos outros (resultado negativo) (C) a imagem de um Brightfield B. esporulação subtilis microcolony que cresceu fora do campo de foco (resultado negativo). Fatores mostram DF que precisam ser considerados para os dados obtidos com episcopic configurações de luz (D) imagem de contraste de fase de B. subtilis células em fase exponencial descrito para visualizar onde os sinais de fluorescência em E e F se originam a partir de sinais (E) GFP das células mostrado na D. Note-se que os sinais de fundo são semelhantes em cada pixel (resultado positivo). Observe também que o tempo de exposição pode ser muito muito desde uma célula mostra um sinal saturado (resultado negativo) (F) Os sinais obtidos através do canal vermelho das células demonstrado na Nota D. que o fundo contém áreas com maior vermelho níveis de fluorescência (negativo resultado).
Filme 1. Microscopia de lapso de tempo de fluorescência de B. subtilis células abrigar uma fusão kinB P-GFP. Instantâneos foram tomadas em intervalos de 8 min. Esquerda: campo claro, Direita: GFP canal. Clique aqui para assistir o filme.
Filme 2. Lapso de tempo de microscopia de contraste de fase da S. pneumoniae cepa selvagem R6. Instantâneos foram tirados em intervalos de 10 min. Clique aqui para assistir o filme.
Discussão
Em contraste com muitas outras técnicas única célula, o lapso de tempo método de microscopia de fluorescência descrita aqui pode ser usado para acompanhar a história de uma célula específica em relação aos seus ancestrais, seu comportamento, e eventos divisão. Em combinação com os promotores alvo fluorescente etiquetado ou proteínas, a ativação via específica de desenvolvimento podem ser acompanhadas em tempo e localização de proteínas assim como a dinâmica de proteínas podem ser monitorados durante o desenvolvimento de bactérias.
Como indicado acima, os estudos concentrando-se em diferentes espécies bacterianas pode ser realizada através da adaptação das condições de crescimento de acordo com os requisitos para uma bactéria específica. As únicas limitações que encontramos estão relacionados com as condições de crescimento e tamanho da amostra. Devido a um ambiente fechado, condições médias não podem ser alterados durante o experimento. Além disso, um máximo de quatro cepas por experimento pode ser monitorado de forma eficiente.
Considerando-se a poucos passos de crítica, o método de análise única célula descrito aqui pode ser facilmente aplicado utilizando qualquer microscópio automatizado. A seguir, uma visão geral dessas etapas críticas será dado. Informações detalhadas podem ser encontradas no texto principal preparação geral:. É aconselhável verificar as definições de focagem automática necessários para uma bactéria específica antes do experimento. Da mesma forma, aproximar as configurações ideais para a visualização de fluorescência deve ser determinado de antemão, se possível. Além disso, seguindo uma linha do tempo preparado ajuda a ter todo o material pronto para ser usado em tempo (pré-aquecimento da câmara de microscópio, as configurações de programação microscópio, preparando o slide uma hora antes que as células estão em fase de crescimento desejado, ver Figura 1) . Crescimento do B. subtilis no TLM e MDL: TLM e MDL são quimicamente definido media inanição em que B. subtilis só cresce lentamente. O período de tempo no qual as células são cultivadas em meios de comunicação pode ter que ser prolongado, dependendo da cepa específica. O lento crescimento impede que as células de empilhar uns sobre os outros Preparação da amostra do microscópio:. Bolhas de ar entre a estrutura genética, a lâmina de vidro ea lamínula tem que ser prevenida para evitar a secagem extensiva do meio agarose-based. O mesmo vale para a interface de deslizamento médio / tampa. É crucial para permitir que as células seco o suficiente, para evitar a natação e / ou crescimento de múltiplas camadas lapso de tempo de microscopia de fluorescência:. Pré-aquecimento do slide, bem como a câmara ambiental é crucial para evitar problemas de focagem automática principais. Células devem ser selecionados no meio de um bloco de ágar, uma vez que estes têm a maior chance de ficar no campo e foco durante o experimento (desde que a amostra foi seca bem o suficiente). Um máximo de 10 locais por experiências ainda funciona corretamente. Depois de ter seleccionado a primeira célula de interesse apenas usar o software para ajustar o foco (ver texto para detalhes). Verificar se as células ainda estão em foco durante as primeiras horas do experimento, em intervalos de 30 min Análise:. É importante verificar antes de procedimentos de análise estendida se o fundo do meio tem valores semelhantes nos canais de fluorescência. Pequenas partículas de poeira, componentes médio, as lentes sujas ou minúsculos pedaços de agarose podem contribuir para o aumento de fluorescência localmente, tornando o filme difícil ou impossível analisar Resolução de problemas:. Se as células crescem em cima uns dos outros, isso pode tanto indicar que a lamela foi anexado muito cedo ou que o meio não é adequado para o crescimento de monocamadas microcolony. Se as células de interesse continuamente morrem prematuramente, enquanto que outras células no slide dividir felizmente, você pode querer verificar se você colocar o filtro UV na posição. Ele também pode ajudar a diminuir o tempo de exposição ou intensidade de luz durante as experiências de comprimento.
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Trabalho no grupo de JWV é apoiado por uma Marie-Curie UE Reintegração Fellowship, um Grant Sysmo2 (NWO-ALW/ERASysBio), a Horizon subvenção (ZonMW) e por uma bolsa VENI (NWO-ALW). O grupo de OPK é apoiado por várias bolsas STW (NWO), um SYSMO1 (IGdeJ) e SYSMO2 subvenção, as ESF EUROCORES SynBio subvenção (SynMod) e pelo Centro de Genômica Kluyver de Fermentação Industrial eo Instituto Superior de Alimentação e Nutrição.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários (opcional) |
|---|---|---|---|
| Gene Quadro | ABgene | AB-0578 | 1,7 x 2,8 centímetros |
| de alta resolução baixa temperatura de fusão agarose | Sigma | A4718 | |
| lamínula grande | vários | 24 x 50 mm | |
| se desejar, membrana tintura, por exemplo, FM 5-95 | Invitrogen | T23360 | corantes membrana outras também estão disponíveis: http://probes.invitrogen.com/media/pis/mp34653.pdf |
| Lapso de tempo microscópio com câmara ambiental | vários | ver detalhes para o nosso dispositivo nas secções correspondentes |
Referências
- Veening, J. W., Smits, W. K., Kuipers, O. P. Bistability, epigenetics, and bet-hedging in bacteria. Annu. Rev Microbiol. 62, 193-193 (2008).
- Dubnau, D., Losick, R. Bistability in bacteria. Mol Microbiol. 61, 564-564 (2006).
- Locke, J. C., Elowitz, M. B. Using movies to analyse gene circuit dynamics in single cells. Nat. Rev. Microbiol. 7 (5), 383-383 (2009).
- Veening, J. W. Bet-hedging and epigenetic inheritance in bacterial cell development. Proc. Natl. Acad. Sci. U. S. A. 105 (11), 4393-4393 (2008).
- de Jong, I. G., Veening, J. W., Kuipers, O. P. Heterochronic phosphorelay gene expression as a source of heterogeneity in Bacillus subtilis spore formation. J. Bacteriol. 192 (8), 2053-2053 (2010).
- Veening, J. W., Murray, H., Errington, J. A mechanism for cell cycle regulation of sporulation initiation in Bacillus subtilis. Genes Dev. 23 (16), 1959-1959 (2009).
- Eberhardt, A. Cellular localization of choline-utilization proteins in Streptococcus pneumoniae using novel fluorescent reporter systems. Mol Microbiol. 74 (2), 395-395 (2009).
- Vasantha, N., Freese, E. Enzyme changes during Bacillus subtilis sporulation caused by deprivation of guanine nucleotides. J Bacteriol. 144 (3), 1119-1119 (1980).
- Stewart, E. J. Aging and death in an organism that reproduces by morphologically symmetric division. PLoS. Biol. 3, 45-45 (2005).
- Rosenfeld, N. Gene regulation at the single-cell level. Science. 307 (5717), 1962-1962 (2005).
- Guberman, J. M. PSICIC: noise and asymmetry in bacterial division revealed by computational image analysis at sub-pixel resolution. PLoS. Comput. Biol. 4 (11), 1000233-1000233 (2008).
- Montero, L. l. o. p. i. s. . P. Spatial organization of the flow of genetic information in bacteria. Nature. 466, 77-77 (2010).
- Avery, O. T., Macleod, C. M., McCarty, M. Studies on the chemical nature of the substance inducing transformation of pneumococcal types: Induction of transformation by a desoxyribonucleic acid fraction isolated from pneumococcus type III. J Exp. Med. 79, 137-137 (1944).
- Hoskins, . Genome of the bacterium Streptococcus pneumoniae strain R6. J Bacteriol. 183, 5709-5709 (2001).
- Martin, B. The recA gene of Streptococcus pneumoniae is part of a competence-induced operon and controls lysogenic induction. Mol Microbiol. 15, 367-367 (1995).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados