Method Article
Estudo do citoesqueleto de actina em Live Células Endoteliais Expressando GFP-Actina
Neste Artigo
Resumo
Imagens microscópicas de vida das células endoteliais expressando GFP-actina permite a caracterização de mudanças dinâmicas em estruturas do citoesqueleto. Ao contrário das técnicas que utilizam amostras fixadas, este método fornece uma avaliação detalhada das mudanças temporais no citoesqueleto de actina nas mesmas celas antes, durante e depois de vários estímulos físicos, farmacológicos, ou inflamatórias.
Resumo
O endotélio microvascular desempenha um papel importante como uma barreira seletiva permeável a fluidos e solutos. As junções adesivas entre as células endoteliais regulam a permeabilidade do endotélio, e muitos estudos têm indicado a importante contribuição do citoesqueleto de actina para determinar a integridade juncional 1-5. Um cinto de actina cortical é pensado para ser importante para a manutenção das junções estável 1, 2, 4, 5. Em contraste, as fibras de estresse actina são pensados para gerar tensão centrípeta no interior das células endoteliais que enfraquece junções 2-5. Grande parte desta teoria foi baseada em estudos em que as células endoteliais são tratados com mediadores inflamatórios conhecidos por aumentar a permeabilidade endotelial e fixação das células e rotulagem F-actina para observação microscópica. No entanto, estes estudos fornecem uma compreensão muito limitada do papel do citoesqueleto de actina porque as imagens de células fixos proporcionam snapshots apenas emtempo com nenhuma informação sobre a dinâmica das estruturas de actina 5.
Live-célula de imagem permite a incorporação da natureza dinâmica do citoesqueleto de actina nos estudos dos mecanismos de determinação integridade da barreira endotelial. Uma grande vantagem deste método é que o impacto de vários estímulos inflamatórios em estruturas de actina em células endoteliais pode ser avaliada no mesmo conjunto de células vivas, antes e após o tratamento, a remoção viés potencial que podem ocorrer quando se observa os espécimes fixos. Células endoteliais da veia umbilical humana (HUVEC) são transfectadas com GFP-β-actina plasmídeo e cresceu para confluência em lamínulas. Lapso de tempo imagens de GFP-actina em HUVEC confluentes são capturados antes e após a adição de mediadores inflamatórios que provocam mudanças dependentes do tempo na integridade da barreira endotelial. Estes estudos permitem a observação visual da seqüência fluida de mudanças no citoesqueleto de actina, que contribuem para endotéliol rompimento da barreira e restauração.
Nossos resultados mostram consistentemente local, rico em actina lamellipodia formação e volume de negócios nas células endoteliais. A formação e movimento das fibras de actina estresse também pode ser observado. Uma análise da frequência de formação e volume de negócios do lamellipodia local, antes e após o tratamento com estímulos inflamatórios podem ser documentadas por meio de análises quimógrafo. Estes estudos fornecem informações importantes sobre a natureza dinâmica do citoesqueleto de actina em células endoteliais, que pode ser usado para descobrir previamente não identificados mecanismos moleculares importantes para a manutenção da integridade da barreira endotelial.
Protocolo
1. Transfecção de HUVEC com GFP-actina
- Vários métodos podem ser usados para transfecção HUVEC. Nosso laboratório utiliza o sistema Nucleofector (Lonza, Basel Suíça) descritos abaixo. Em geral, o trabalho rapidamente para melhorar a viabilidade celular e eficiência de transfecção. Cada transfecção requer 5 x 10 5 HUVEC que serão semeados em duas lamínulas de vidro (Corning No. 1, 22 x 50 mm). O Nucleofector combina reagentes químicos para eletroporação e transfecção de DNA plasmídeo e, normalmente, atinge uma eficiência de expressão> 50%. Reagentes de transfecção químicos são um método alternativo. Um grupo conseguiu transfectadas de bovinos células endoteliais com GFP-actina utilizando o reagente GenePORTER 6. O protocolo Nucleofector que usamos é descrito abaixo.
- Esterilizado lamínulas cultureware ou ordinário pode ser usado, dependendo do tipo de câmara. Para lamínulas de vidro, esterilizar em uma capa de segurança biológica, colocando a-los em uma placa de 10 centímetros culturacontendo aproximadamente 5 ml de etanol 70% por 2 min. Pegá-los com uma pinça estéril e ar seco, inclinando-os contra a lateral de uma placa de cultura separada.
- Depois de seco, coloque cada lamela em sua própria placa de cultura de 10 cm. Pipetar uma gota de 300 mL de solução de gelatina quente (1,5% em 0,9% NaCl) no centro da lamela e deixe-a descansar por 5 min. E depois aspirar. Mantendo este revestimento matriz no centro, sem tocar as bordas, irá garantir que as células serão distribuídos densamente e irá atingir confluência rapidamente.
- Prepare um tubo de microcentrífuga 1,5 mL por transfecção com 500 mL de EGM2MV media (Lonza) e reserve em um 37 ° C, 5% incubadora de CO 2.
- Separar HUVEC com 0,25% de tripsina-EDTA e recolher em um tubo cônico de 15 mL. Contagem das células. 5 x 10 5 células são necessárias para cada transfecção. Ajustar o volume de suspensão celular para obter uma pelota que irá conter 5 x 10 5 células multiplicado pelo número de transfeCÇÕES a ser realizado.
- Centrifugar a suspensão de células em centrífuga clínica a 5000 rpm por 3 minutos em temperatura ambiente. Aspirar o sobrenadante por tubo a inclinação para remover a mídia, tanto quanto possível.
- Ressuspender o sedimento com solução Nucleofector básicos tanto do HUVEC ou primária da célula endotelial Nucleofector Kit (Lonza). Use de 100 L por 5 x 10 5 células. Devido à toxicidade desta solução, é importante trabalhar rapidamente, enquanto as células estão suspensas nesta solução.
- Adicione o vector GFP-β-actina plasmídeo (0,2-2 mg por 100 mL de suspensão Nucleofector) para a amostra de transfecção. 0,2-2 mg de GFP-actina plasmídio por 5 x 10 5 células por transfecção.
- Transferir 100 mL da suspensão celular a um Cuvette Nucleofector. Cobertura e toque na cuvete algumas vezes para garantir a suspensão celular é todo o caminho até o fundo.
- Coloque a cuvete no slot de Nucleofector cuvete dispositivo e executar o II dprograma de eletroporação esired. Usamos o programa A-034 para HUVEC.
- Retornar a cuvete para a capa de segurança biológica. Trazer um dos tubos de microcentrífuga dos 37 ° C incubadora que contém 500 mL de EGM2MV para a capa. Usando uma das pipetas de transferência fornecido no kit Nucleofector, delicadamente adicione o morna 500 mL de mídia para a suspensão de células na cuvete. Transferência da totalidade dos conteúdos das costas cuvete para o tubo de microcentrífuga e colocar na incubadora por 15 min. para permitir que as células a se recuperar.
- Repita os passos 9-11, conforme necessário, se mais células são transfectadas.
- Um tubo de microcentrífuga contendo 600 mL de suspensão HUVEC transfectadas podem ser semeados em duas lamelas. Sob o capô e com uma micropipeta 1000 mL, gentilmente pipeta para cima e para baixo uma vez para misturar a suspensão, e depois colocar 300 mL da suspensão diretamente em uma lamela de gelatina revestidos. Não deixe que a suspensão tocar na borda da lamínula. Lugar no 37 ° CO C / 5% 2 incubadora de 1-4 h para permitir a fixação das células.
- Após 1-4 h, inspecionar as células transfectadas para confirmar que têm ligado à lamela. Em seguida, adicione 10 mL de EGM2MV mídia, e retornar para a placa aos 37 ° C / 5% CO 2 incubadora. GFP-actina expressão geralmente pode ser observada dentro de 4-8 horas. Experimentos são normalmente realizadas dentro de 24-48 h.
2. Criação da câmara de imagens ao vivo de células e aquecedor de estágio
- Para a maioria dos nossos estudos, temos usado um Warner Instruments aberta diamante banho (RC22) colocado em um PH-1 aquecedor de palco, alimentado por um sistema de fluxo de gravidade. No entanto, várias opções estão disponíveis para as fases de células vivas de imagem, incluindo as câmaras, que podem acomodar pratos de vidro de fundo de cultura, câmaras aberto versus fechado, e várias combinações microincubator / objetivo aquecedor e sistemas de grande porte incubadora. Em última análise, a seleção câmara vai depender de fatores incluindo a necessidade de acessar o banho para adicionar um agente de teste ou droga, whehá o meio vai ser estático ou sob fluxo, bem como a duração do experimento. Além disso, por vezes, factores como a instabilidade da temperatura pode causar desvio de foco, e podem ser minimizados por sistemas de controle que pode manter banho estável e temperaturas objetivo.
- Alíquota média suficiente para o experimento. Nós alíquota de 50 ml de solução salina fisiológica de albumina (APSS; Tabela 1) para cada hora o experimento vai durar.
- Um sistema de bomba ou de fluxo por gravidade pode ser usado para entregar médio para a câmara. Para o nosso sistema, nós adicionamos APSS a um sistema de fluxo por gravidade simples, construído a partir de uma linha de fluxo intravenosa, conectado a um aquecedor de inline (Warner Instruments modelo SH-27A). Nós aplicamos o fluxo em aproximadamente 40 mL / h.
- Se uma câmara de banho aberta como a nossa vai ser usado, aplique graxa de vácuo para a borda externa na parte de baixo do banho de diamantes e com um aplicador com ponta de algodão. Em seguida, temos uma lamela celular coberto da incubadora, e levante cuidadosamente a lamínula com a pinça. Gently toque na parte traseira para um kimwipe para absorver o excesso médio, mantendo o lado de células cobertas molhadas. Com as células de face para cima, coloque o banho de diamante sobre a lamela para formar uma câmara.
- Colocar rapidamente a câmara para o aquecedor de estágio e aperte os grampos sobre a câmara. Uma grande preocupação nesta fase é a possibilidade de que as células vão secar. Por isso, é importante trabalhar de forma rápida e quando feito, imediatamente pipeta ~ 1 ml de meio na câmara para evitar que as células de secar.
- Nossa câmara permite o fluxo constante do meio sobre as células. Pouco antes de ligar no fluxo, é importante anexar uma mangueira de vácuo ao seu titular na câmara para permitir a saída do meio de cultura em excesso (APSS). O aquecedor embutidos e aquecedor de banho também deve ser transformado em um ponto este (a 37 ° C). Nosso sistema também tem uma sonda térmica para monitorar a temperatura, que deve ser colocado na borda da banheira.
- Limpe cuidadosamente a parte inferior da coverslip com um kimwipe embebido com EtOH 70% para remover mídia restante EGM2MV e acúmulo de sal. Limpe uma segunda vez com um kimwipe seco ou papel de lente.
- Depois de a câmara foi criado, o fluxo está ligado, ea temperatura é constante a 37 ° C, permitem às células pelo menos 30 minutos para ajustar e estabilizar antes de iniciar o experimento.
- Enquanto espera, ligue todos os componentes do microscópio imagens ao vivo de células (lâmpadas, controlador de roda de filtros, câmera, computador).
3. Aquisição de dados com live-célula microscópio de imagem
- Vários sistemas de microscopia de células vivas estão disponíveis. Nosso sistema é uma Nikon Eclipse TE-2000U com os seguintes componentes:
- Sutter Lambda Instruments LS 300 W lâmpada xenon
- Sutter Lambda Instruments roda excitação 03/10 com filtro e filtro SmartShutter S492 (D350 e S572 filtros excitador também estão disponíveis para aplicações de UV e RFP)
- Dichroic emissor 2002bs (Nikon 61002M)
- CI Plano Fluor Objetivo DLL 10X, NA 0,30 (Nikon MRH10100)
- Plano de Fluor ELWD objetiva de 40x DM, NA 0,60 (Nikon MRH08420)
- Plano de Apo VC Objetivo Oil 100X, NA 1.40 (Nikon MRD01901)
- Fotométricos CoolSNAP HQ2 câmera, 1392 x matriz de imagem de 1040, 6,45 x 6,45 M pixels
(Roper Scientific) - Temos também dois pacotes de software que podem ser usados para aquisição de imagem. Elementos-AR Nikon 3.0, e Metamorph 6.1.
- Depois de ver as células e encontrar uma área adequada para o estudo, bloquear o botão de foco grosso e verifique as configurações de software de aquisição de modo que:
- A roda de filtro está definido para o filtro S492 (identificado como "FITC" em nossa configuração)
- Na aquisição de software, o objetivo é definido para corresponder a ampliação desejada (nosso microscópio não é motorizada, mas isso define a relação M / pixel). Também certifique-se que a lente Optivar no microscópio está definido para a ampliação 1.0X. Definir o optivar a 1.5X pode aumentar a ampliação, no entanto, à custa de perder a intensidade do sinal.
A ampliação para ser usado depende objetivos do estudo. Para o melhor detalhe, um objetivo 100X com uma alta abertura numérica irá fornecer a melhor resolução espacial e transmissão de sinal. Nosso microscópio também é equipado com um objetivo de longa distância de trabalho 40X destinado a uma aplicação diferente que exige a distância extra. No entanto, este objectivo pode ser útil quando queremos observar várias células ao mesmo tempo, e funciona bem para a visualização de estruturas organela porte, porém a um custo de perder resolução espacial e intensidade de sinal. Para qualquer estudo em que a intensidade do sinal é um ponto final, ou para mais técnicas de imagem avançadas, como a fluorescência speckle microscopia, um objetivo 100X é recomendado. - O tempo de exposição da câmera é definida entre 0,5-2 s. Este depende da intensidade GFP-actina nas células. Geralmente usamos o tempo de exposição mais baixo possível para evitar bleaching do GFP-actina e potencial de toxicidade para as células.
- Para alcançar a melhor resolução, o Binning deve ser fixado em 1 x 1 e ganho a 1. Em alguns casos, temos um conjunto binning a 2 x 2 para reduzir o tempo de exposição, no entanto, este reduz a precisão das medições que podemos fazer em objetos movendo-se no estudo de lapso de tempo.
- Configurar as definições de lapso de tempo:
- Escolha a pasta para salvar as imagens capturadas e digite um nome.
- Definir o número de imagens e os tempos de duração do intervalo para o experimento. Normalmente usamos um intervalo min 15 s para 1 entre imagens e até 2 h para a duração.
- Certifique-se que o obturador ativo está previsto para ser fechado entre as aquisições.
- Antes de iniciar lapso de tempo de aquisição de imagem, desligue as luzes da sala e capturar uma imagem única para verificar as configurações.
- Também capturar uma imagem de campo claro. Certifique-se o condensador está definido para a fase adequada ou filtro DIC. Ligara lâmpada halógena e recolher a imagem. Desligar a lâmpada de halogéneo.
- Voltar a "FITC" definições para a imagem de lapso de tempo e capturar uma imagem de teste.
- Capturar a série de lapso de tempo.
Durante o experimento, é importante para monitorar as imagens como são adquiridos. Em alguns casos, pequenas mudanças de temperatura dentro da câmara pode causar desvio de foco. Isto pode ser evitado através da otimização do fluxo de entrada e linhas de vácuo para que o fluxo é constante ao longo das células. Também, minimizando o tráfego na sala de microscópio, e redirecionando rascunhos de saídas de ar de teto longe do microscópio pode ser útil. Uma alternativa que tem funcionado bem em nossa experiência é a utilização de 37 ° C / 5% CO 2 câmaras de incubadora que incluir todo o palco e objetivo. Estes oferecem a vantagem de células monitoramento durante a noite ou mais, mas o acesso às células é limitada.
Se necessário, interromper a aquisição de lapso de tempo e recentrar a imagem. Executar a reorientar o mais rapidamente possível evitar a alteração do intervalo de tempo entre as imagens. - Um protocolo típico será composto de 20-30 minutos de imagens de linha de base antes de adicionar um agente de teste seguido por 0,5 a 4 horas de aquisição de imagens adicionais. A duração do experimento pode ser limitada pela fotodegradação da GFP ao longo do tempo, que é por isso que é importante escolher o menor tempo de exposição possível. Também pode ser desejável para alterar o intervalo entre as imagens de lapso de tempo de 30-60 s se um estudo mais longo é desejada.
4. A análise dos dados
- Vários pacotes de software pode ser usado para analisar os conjuntos de imagens, tais como Elementos NIS, Metamorph, Slidebook, etc Nós normalmente executam a nossa análise de imagem usando NIH ImageJ permitindo a análise em qualquer computador em nosso laboratório ou em casa. As versões que usamos são:
MBF ImageJ ( http://www.macbiophotonics.ca/imagej/ )
FIJI (i "target =" _blank "> http://pacific.mpi-cbg.de/wiki/index.php/Fiji). - ImageJ pode ser usado para analisar muitos processos dinâmicos, incluindo:
- Freqüência de saliências lamellipodia
- Distância, tempo e velocidade de saliências
- Actina movimento de fibra ao longo do tempo
- No ImageJ, quando o conjunto imagem abre o número fatia / fatias total será exibida no canto superior esquerdo da janela, junto com o nome do arquivo, o número de pixels, tipo de arquivo, e tamanho. A barra de rolagem na parte inferior Z corresponde ao tempo. Além disso, passar o ponteiro do mouse sobre a imagem irá mostrar o x, y, z e localização de pixel na parte inferior da barra de ferramentas ImageJ.
- Protrusão Lamellipodia pode ser estudada através da determinação do número de novas saliências ao longo do tempo. Isto pode ser feito para o perímetro célula inteira ou de uma região selecionada. Este tipo de análise também pode ser realizado em nonconfluent, células untransfected com contraste de fase ou microscopia DIC. No entanto, usando células expressando GFP-actina permite a análise de monocamadas confluentes, particularmente quando as células que contêm e sem GFP-actina são adjacentes uns aos outros.
- Lamellipodia distância protrusão, persistência (tempo), ea velocidade pode ser avaliada por quimógrafo análise (linha de varredura). Desenhar uma linha perpendicular à borda de uma célula (isto é mais fácil se não há célula adjacente, ou a célula adjacente não expressa GFP-actina). No ImageJ, pressionando "/" irá gerar uma quimógrafo, com o eixo x representando distance eo tempo eixo y representando (15 sa 1 min por pixel de acordo com as diretrizes intervalo de tempo acima). Linhas podem ser desenhadas ao longo de um lamellipodia salientes e as dimensões caixa medida (pressionando M no ImageJ). A distância, tempo e velocidade pode ser calculada.
- O movimento de fibras de stress também pode ser medido pela análise quimógrafo de forma semelhante.
5. Resultados representativos:
Com o nosso protocolo de transfecção, que normalmente ver a expressão de GFP-actina em pelo menos 50% do HUVEC transfectadas, e muitas vezes pode encontrar áreas na lamela onde> 90% do HUVEC na região expressar GFP-actina. Um exemplo de um experimento de células vivas de imagem com HUVEC confluentes expressando GFP-actina é mostrado no filme 1. Para esta experiência particular, uma imagem foi adquirida uma vez por minuto. Como pode ser visto no filme, GFP-actina na HUVEC pode ser observado em todo o citoplasma, bem como na estrutura filamentosamentos e em locais lamellipodia salientes ao longo da borda da célula. Também evidente no filme é que GFP-actina expressão não é uniforme entre as células. Células escolhidas para estudo normalmente têm o suficiente GFP actina-presente para visualizar várias estruturas filamentosas contendo actina. Células que expressam níveis muito altos de GFP-actina pode ser problemático para o estudo porque nessas células é normalmente difícil distinguir actina F-estruturas da grande quantidade de G-actina presentes.
Filme 2 mostra um exemplo do comportamento de HUVEC confluentes expressando GFP-actina. Como o HUVEC subconflent, ativa e formação lamellipodia volume de negócios ao longo do perímetro das células era aparente. No entanto, estes muitas vezes lamellipodia deu origem à membrana babados, indicando protrusão menos eficientes 7. Este é provavelmente devido à presença de células adjacentes bloqueando o substrato nas proximidades. Fibras de actina cortical e fibras de estresse também são visíveis em Filmes 1 e 2. Embora as células que otro foram observados mantiveram-se estacionárias, as fibras de estresse são semelhantes às fibras arco transversal em células migram, formando perto da borda da célula e se movendo lateralmente em direção ao centro da célula onde se desmontar 8, 9. Uma característica adicional dinâmica observada nestas células foi a formação de estruturas do anel de actina que se expandiu de forma concêntrica, anteriormente chamado de actina nuvens 10.
Um exemplo de como a distância, persistência, velocidade e de saliências células são quantificadas a partir desses imagem lapso de tempo sets usando análise quimógrafo é mostrado na Figura 1. Na Figura 1A, uma linha único pixel é desenhado aproximadamente perpendicular à borda da célula para geração de um quimógrafo (Figura 1B). Neste quimógrafo, a região definida por uma linha é colocado na vertical e as imagens de todo o lapso de tempo são empilhadas na horizontal. Olhando da esquerda para a direita na quimógrafo, saliências são representados como os movimentos de subida na borda da célula. Na Figura 1C, uma linha foi superimposed na borda de uma dessas saliências, e os dados de pixel associado a essa linha foram coletados e são mostrados na janela de resultados na parte inferior do painel. Esta análise permite a quantificação da dinâmica protrusão, e também pode ser usado para estimar a freqüência de protrusão (número de saliências / hora) na região da célula.
Um exemplo da análise do movimento de fibra estresse é mostrado na Figura 2. Fibras mais estresse observou-se formado próximo à periferia da célula e se mudou para o centro da célula, onde eles finalmente desmontado. Isso também pode ser quantificados pela análise quimógrafo. Uma linha é traçada perpendicularmente à borda das células e as fibras de estresse (Figura 2A) e um quimógrafo é gerado (Figura 2B). As fibras de estresse aparecem como linhas contínuas na área citoplasmática na quimógrafo, muitas vezes se movendo para baixo e à direita (em direção ao centro da célula). Às vezes, as fibras são difíceis de ver no quimógrafo original, e nestes casos,usar a máscara unsharp filtro para dar nitidez da imagem (Figura 2C). Linhas são desenhadas no fibras de stress e os dados de pixel são coletados usando a função medida (Figura 2D). Uma forma alternativa para coletar esses dados é traçar uma linha do início ao fim da fibra de estresse identificados para obter a declividade média para a duração que a fibra foi observada (Figura 2E). Esta análise permite a quantificação do movimento de estresse de fibra lateral e também pode ser usada para quantificar o número de fibras de stress observados nesta região da célula.
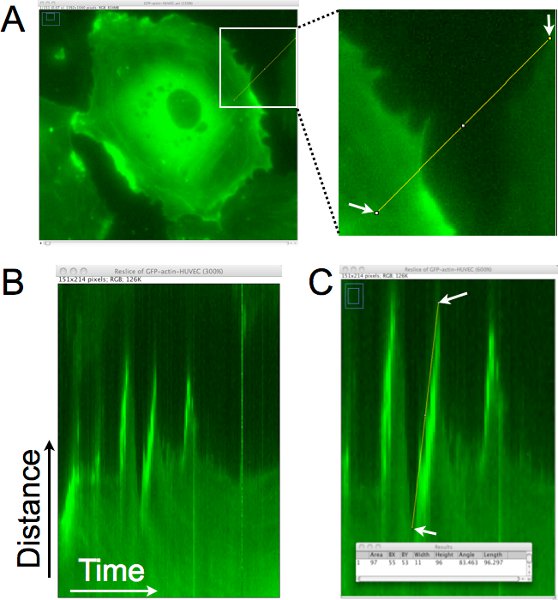
Figura 1. Quimógrafo análise da borda celular para determinar a distância protrusão, persistência e velocidade de lamellipodia local. A. Uma linha único pixel é desenhado aproximadamente perpendicular à borda da célula. Esta região é extraído de cada imagem do lapso de tempo definido para gerar uma montagem da região ao longo do tempo. B. Em diae resultando quimógrafo, o eixo x representa o tempo, movendo-se da esquerda para a direita, eo eixo y mostra a distância. Movimento da borda das células ao longo do tempo pode ser avaliada neste quimógrafo e lamellipodia são identificadas regiões onde o limite da célula, movendo-se para a direita, vai para cima. C. Uma linha é desenhada na borda célula onde uma protrusão de uma lamellipodium foi identificado. As dimensões do retângulo delimitador para a linha desenhada são então adquiridos (mostrado na janela sobreposta). A largura é usado para calcular o tempo de protrusão ou persistência. A altura é usado para calcular a distância protrusão. A velocidade de protrusão é calculado dividindo a altura pela largura. Neste exemplo, a distância foi de 96 pixels para cima x 0,16125 M / pixel = 15,5 mM, eo tempo foi de 11 pixels x 1 min. / pixel = 11 min. A velocidade foi calculada como 15,5 min μm/11. = 1,4 mM / min.

FIGURA análise quimógrafo 2. do movimento de fibras de stress de actina. A. Uma linha único pixel é perpendicular à borda da célula para gerar um quimógrafo. B. Como mostrado na figura. 1, no quimógrafo resultante, o eixo x representa o tempo ea distância do eixo-y. Fibras de estresse são observadas como linhas contínuas na célula, muitas vezes indo para baixo e para a direita (setas) C. Para visualizar melhor as fibras stress, o filtro da máscara unsharp pode ser usado. Neste exemplo, um raio de 3 pixels e peso da máscara de 0,60 foi usado. D. Linhas único pixel são então desenhada sobre a fibra de stress identificados, e os dados coletados. Neste painel de três linhas foram desenhadas e depois "delete" foi pressionado para fazer uma anotação permanente (linha branca) de suas posições após cada medição. E. Alternativamente, se a distância média, tempo e velocidade da fibra de estresse é desejada, uma linha pode ser traçada desde o início e pontos de acabamento (linha amarela), e os dados parar que podem ser adquiridos (em destaque na janela de resultados). Para este exemplo, as medições foram feitas em fibra este stress para 37 frames x min 1 frame /. = 37 min. A distância percorrida ao longo deste período de tempo foi de 75 frames x 0,16125 M / pixel = 12,1 mM. A velocidade resultante lateral da fibra de estresse foi de 12,1 μm/37min = 0,33 mM / min. Um valor positivo para a velocidade é atribuído para as fibras que se deslocam em direção ao centro da célula, e negativo para as fibras que se deslocam para a periferia.
Imagens do filme 1. Time-lapse de HUVEC viver expressando GFP-actina. O intervalo entre as imagens é de 1 min. Locais lamellipodia se projetava em todo o perímetro das células. Além disso, as fibras de estresse transversal do arco movido lateralmente em direção ao centro das células. Quando a trombina (1 U / ml) foi adicionado ao banho, as células contratada ligeiramente e as saliências exteriores de lamellipodia parou por cerca de 10 min. Depois que as células contratada, lamellipodia formação e volume de negócios currículo d. Clique aqui para assistir o filme.
Filme 2. HUVEC Confluent expressando GFP-actina, antes e após o tratamento com trombina. Tempo decorrido é mostrado no canto inferior direito como minutos: segundos. O intervalo entre as imagens é de 30 s. Trombina (1 U / ml) foi adicionado após a 45 min. período basal. Eventos anotados incluem a formação lamellipodia locais e volume de negócios (setas perto bordas de célula, 00:59 - 37:29), actina nuvens (setas, 1:59-21:29), e uma lacuna em uma junção tricellular que aumenta após a trombina é adicionada (seta, 62:30 - 70:00). Fibras de stress transversal arco também são visíveis em várias das células. As células exibido formação de ativos e volume de negócios de lamellipodia locais ao longo de seus perímetros, com muitos dando origem a membrana babados. Trombina provocou uma pausa em lamellipodia formação e volume de negócios, ea breve aparição de alguns pequenos espaços entre as células.https://www.jove.com/files/ftp_upload/3187/Movie2-confluentHUVEC.avi "> Clique aqui para assistir o filme.
Discussão
A imagem de GFP-actina em células endoteliais ao vivo permite uma análise detalhada da dinâmica do citoesqueleto de actina em resposta a estímulos inflamatórios. Este método também pode ser útil para construir em cima descobertas anteriores que mostram remodelação do citoesqueleto em resposta às forças físicas, como tensão de cisalhamento 11. Além disso, este método permite uma avaliação detalhada da contribuição da dinâmica do citoesqueleto de actina para diversas atividades das células endoteliais, incluindo a migração, mitose, formação de junções intercelulares e maturação juncional, e manutenção da função de barreira.
Nos dados apresentados, o comportamento do citoesqueleto de actina endotelial pode ser observado antes e após o tratamento com trombina. Lamellipodia locais, todos ao longo das bordas das células endoteliais foram observados formando e regredindo ao longo do tempo em monocamadas de células tanto nonconfluent e confluente. Tratamento com trombina brevemente interrompido forma lamellipodiação e volume de negócios. Trombina também causou as células a contrair-se ligeiramente, de acordo com relatos anteriores de que a trombina causas actina formação das fibras de estresse e desenvolvimento crescente tensão centrípeta nas células endoteliais 12-14. No entanto, a partir de estudos de células vivas de imagens como esta, a origem das fibras de estresse pode agora ser determinada. Em HUVEC, a maioria das fibras de estresse originam na periferia celular e assemelham-se fibras de arco transversal na migração de células 8, 9. Outro ponto forte deste método sobre o uso de células fixas é que o número de fibras de stress podem ser quantificados em células individuais antes e após o tratamento de trombina, eliminando o viés de seleção entre os grupos experimentais.
Com este protocolo nós avaliamos movimento dinâmico da borda de células e fibras de stress de actina. Para entender a dinâmica de monômero de actina em células endoteliais, as técnicas mais avançadas, como a recuperação de fluorescência após a fotodegradação (FRAP) ou fluorescência speckle microscópia (FSM) pode ser aplicado 15, 16. Além disso, como células endoteliais microvasculares pode representar um modelo melhor da função de barreira microvascular, otimização de protocolos de transfecção de efetivamente expressar GFP-actina em células endoteliais microvasculares representa uma direção futura lógica.
Em resumo, a imagem latente de viver células endoteliais expressando GFP-actina representa uma ferramenta poderosa para determinar como o citoesqueleto de actina da célula endotelial responde a vários tipos de estímulos. Estudos utilizando fortemente confluentes monocamadas endotelial irá ajudar a determinar as funções de estruturas dinâmicas, tais como actina-ricos lamellipodia e fibras arco transversal estresse em função de barreira endotelial. Além disso, imagens de células vivas de células endoteliais expressando GFP-actina ou proteínas de fusão outras que permitem a visualização de outras estruturas subcelulares irá fornecer informações detalhadas espaço-temporal necessária para entender a sinalização e os mecanismos estruturais que determine integridade da barreira.
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
O plasmídeo GFP-β-actina foi generosamente fornecidos pelo Dr. Wayne Orr, LSUHSC-S Departamento de Patologia, e foi amplificado no laboratório do Dr. Becky Worthylake, LSUHSC-NO Departamento de Farmacologia. Este trabalho foi financiado por concessões do National Institutes of Health (P20 RR-018766) e da American Heart Association (05835386N).
Materiais
| Name | Company | Catalog Number | Comments |
| 1. Ringer stock 5x | |||
| Químico | Companhia | Número de catálogo | Quantidade |
| Cloreto de sódio | EMD | SX0420-3 | 35 g |
| Cloreto de Potássio | JT Baker | 3040 | 1,75 g |
| Cloreto de cálcio | Sigma | C-3881 | 1,47 g |
| Sulfato de magnésio | Sigma | M-9397 | 1,44 g |
| Água filtrada estéril | N / A | N / A | Trazer para 1 L |
| Filtro estéril em frascos autoclavados e lojas a 4 ° C | |||
| 2. Tampão MOPS | |||
| Químico | Companhia | Número de catálogo | Quantidade |
| MOPS | Sigma | M3183 | 125,6 g |
| Água filtrada estéril | N / A | N / A | Trazer para 1 L |
| Filtro estéril em frascos autoclavados e lojas a 4 ° C | |||
| 3. Solução Sal albumina Physiological (APSS) | |||
| Químico | Companhia | Número de catálogo | Quantidade |
| Ringer estoque (5x) | N / A | N / A | 200 mL |
| Tampão Mops | N / A | N / A | 5 mL |
| Fosfato de sódio | Sigma | S-9638 | 0,168 g |
| Piruvato de sódio | Sigma | P5280 | 0,22 g |
| EDTA sal de sódio | Sigma | ED2SS | 0,0074 g |
| Glicose | Sigma | G7528 | 0,901 g |
| Albumina Bovina | USB | 10856 | 10 g |
| Água filtrada estéril | N / A | N / A | Trazer para 1 L |
| Ajustar o pH para 7,4 a 37 ° C, seguida de filtração estéril em frascos autoclavados e armazenar a 4 ° C. | |||
| 4. Saline 0,9% | |||
| Químico | Companhia | Número de catálogo | Quantidade |
| Cloreto de sódio | EMD | SX0420-3 | 9 g |
| Água filtrada estéril | N / A | N / A | Trazer para 1 L |
| Filtro estéril em frascos autoclavados e lojas a 4 ° C | |||
| 5. 1,5% Solução Gelatina | |||
| Gelatina de pele suína | Sigma | G2500 | 15 g |
| Saline 0,9% | N / A | N / A | Trazer para 1 L |
| Aquecer a solução a 37 ° C para dissolver a gelatina suficientemente. Enquanto ainda quente filtro, estéril em frascos autoclavados e armazenar a 4 ° C | |||
Referências
- Spindler, V., Schlegel, N., Waschke, J. Role of GTPases in control of microvascular permeability. Cardiovasc. Res. 87, 243-253 (2010).
- Wojciak-Stothard, B., Ridley, A. J. Rho GTPases and the regulation of endothelial permeability. Vascul. Pharmacol. 39, 187-199 (2002).
- Yuan, S. Y. Signal transduction pathways in enhanced microvascular permeability. Microcirculation. 7, 395-403 (2000).
- Birukov, K. G. Small GTPases in mechanosensitive regulation of endothelial barrier. Microvasc. Res. 77, 46-52 (2009).
- Duran, W. N., Sanchez, F. A., Breslin, J. W. Microcirculatory Exchange Function. Handbook of Physiology: Microcirculation. Tuma, R. F., Duran, W. N., Ley, K. , 2nd Edition, Elsevier. San Diego. 81-124 (2008).
- Hu, Y. L., Chien, S. Dynamic motion of paxillin on actin filaments in living endothelial cells. Biochem. Biophys. Res. Commun. 357, 871-876 (2007).
- Borm, B., Requardt, R. P., Herzog, V., Kirfel, G. Membrane ruffles in cell migration: indicators of inefficient lamellipodia adhesion and compartments of actin filament reorganization. Exp. Cell. Res. 302, 83-95 (2005).
- Hotulainen, P., Lappalainen, P. Stress fibers are generated by two distinct actin assembly mechanisms in motile cells. J. Cell. Biol. 173, 383-394 (2006).
- Pellegrin, S., Mellor, H. Actin stress fibres. J. Cell. Sci. 120, 3491-3499 (2007).
- Ballestrem, C., Wehrle-Haller, B., Imhof, B. A. Actin dynamics in living mammalian cells. J. Cell. Sci. 111, 1649-1658 (1998).
- Helmke, B. P., Rosen, A. B., Davies, P. F. Mapping mechanical strain of an endogenous cytoskeletal network in living endothelial cells. Biophys. J. 84, 2691-2699 (2003).
- Birukova, A. A., Smurova, K., Birukov, K. G., Kaibuchi, K., Garcia, J. G., Verin, A. D. Role of Rho GTPases in thrombin-induced lung vascular endothelial cells barrier dysfunction. Microvasc. Res. 67, 64-77 (2004).
- van Nieuw Amerongen, G. P., van Delft, S., Vermeer, M. A., Collard, J. G., van Hinsbergh, V. W. Activation of RhoA by thrombin in endothelial hyperpermeability: role of Rho kinase and protein tyrosine kinases. Circ. Res. 87, 335-340 (2000).
- Moy, A. B., Blackwell, K., Kamath, A. Differential effects of histamine and thrombin on endothelial barrier function through actin-myosin tension. Am J Physiol Heart Circ Physiol. 282, H21-H29 (2002).
- Wittman, T., Littlefield, R., Waterman-Storer, C. Fluorescent speckle microscopy of cytoskeletal dynamics in living cells. Live Cell Imaging: A Laboratory Manual. Goldman, R. D., Spector, D. L. , Cold Spring Harbor Laboratory Press. 184-204 (2005).
- Rabut, G., Ellenberg, J. Photobleaching techniques to study mobility and molecular dynamics of proteins in live cells: FRAP, iFRAP, and FLIP. Live Cell Imaging: A Laboratory Manual. Goldman, R. D., Spector, D. L. , Cold Spring Harbor Laboratory Press. 101-126 (2005).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados