É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Análise de Tronco de Migração da crista neural celular usando uma modificação Zigmond Ensaio Câmara
Neste Artigo
Resumo
Uma abordagem para analisar a migração de células explantadas (células tronco da crista neural) é descrita. Este método é barato, suave, e é capaz de distinguir a quimiotaxia tanto de quimiocinese e outras influências sobre a polaridade migratórias tais como aqueles derivados de interacções célula-célula dentro da cultura de células primária tronco da crista neural.
Resumo
Células da crista neural (CBCs) são uma população transitória de células presentes no desenvolvimento de vertebrados que emigram do tubo neural dorsal (NT) depois de passar por um 1,2 transição epitelial-mesenquimal. Após EMT, NCCs migrar grandes distâncias ao longo de caminhos estereotipados até que eles atinjam seus alvos. NCCs diferenciar em uma vasta gama de tipos de células incluindo neurónios, glia, melanócitos e células cromafins 1-3. A capacidade do NCC para chegar e reconhecer os seus locais de destino adequados é fundamental para a formação adequada de todas as estruturas que contêm NCC-tronco derivadas de componentes 3. Elucidar os mecanismos de orientação para o tronco NCC migração tem sido, portanto, uma questão de grande importância. Numerosas moléculas têm sido demonstrados para orientar a migração NCC 4. Por exemplo, os CBCs tronco são conhecidos por ser repelida por pistas de orientação negativas, tais como Semaforina, Efrina, e ligandos de fenda 5-8. No entanto, nãoaté recentemente tem quimioatractivos de NCCs tronco foram identificados 9.
Convencional em abordagens in vitro para estudar o comportamento quimiotática de células aderentes trabalhar melhor com imortalizados, homogénea células distribuídas, mas são mais difíceis de aplicar a certas culturas primárias de células-tronco que, inicialmente, não possuem uma distribuição homogênea e rapidamente diferenciar (como NCC). Uma abordagem para homogeneizar a distribuição dos CBCs tronco para quimiotaxia estudos é isolar NCCs tronco a partir de culturas de explantes primários NT, em seguida, levantar e replate-los a ser quase 100% confluentes. No entanto, esta abordagem de revestimento requer quantidades substanciais de tempo e esforço para explantar células suficientes, é duro, e distribui NCCs tronco de um modo diferente daquele que foi encontrado em condições in vivo.
Aqui, apresentamos uma abordagem in vitro que é capaz de avaliar quimiotaxia e outras respostas migratórios de tronco sem NCC requiringa distribuição celular homogênea. Esta técnica utiliza lapso de tempo de imagem de principal, imperturbável NCCs tronco dentro de uma câmara de Zigmond modificado (uma câmara Zigmond padrão é descrito em outra parte 10). Ao expor NCCs tronco na periferia da cultura a um gradiente chemotactant que é perpendicular à sua direccionalidade previu natural, alterações na polaridade migratório induzidas pelo gradiente chemotactant aplicada pode ser detectado. Esta técnica é pouco dispendioso, requer a cultura de apenas dois explantes por tratamento NT replicate, evita levantamento célula dura (tal como tripsinização), deixa NCCs tronco de uma distribuição mais semelhante a condições in vivo, reduz a quantidade de tempo entre o explante e experimentação (o que provavelmente reduz o risco de diferenciação), e permite a avaliação de lapso de tempo de numerosas características migratórias.
Protocolo
1. Dia 1: O isolamento de tubos de tronco neurais para a cultura durante a noite em lamelas
- Incubar os ovos de pintainho para 56 h a 38 ° C. Retirar os ovos de incubação, levemente pulverizá-los com etanol a 70%, e, em seguida, permitir que sequem. Quebre os ovos abertos em uma bandeja de vidro UV-esterilizado.
- Extraia cada embrião a partir da sua gema e colocá-lo no pinto de Ringer. Faça isso primeiro corte em torno de suas ilhas de sangue com tesoura curva, em seguida, com uma pinça sem corte, escolher o embrião por sua membrana extraembryonic e colocá-lo em uma placa de Petri estéril plástico contendo solução de Ringer garota.
- Isolar o tronco de cada embrião por aparando o excesso de membranas extra-embrionário, bem como cranianos, vagal, e sacral níveis axiais, utilizando uma agulha de tungsténio (Fig. 1). Primeiro, selecione cerca de 9 embriões que estão entre os estágios HH15-17 11. Para fases HH15 e para cima, os eixos do prosencéfalo e rombencéfalo formar um ângulo agudo e, por conseguinte, a cabeça parece inclinar caudalmente. Emestágio HH17, o broto da cauda está presente e inclina ventralmente mas ainda não conter somitos. Com uma agulha de tungstênio, corte Membranas Extra-Embrionárias para cerca de 2 mm a partir do embrião e cortar todos os tecidos embrionários anteriores a somito 10. Também remover todos os tecidos embrionários a partir de caudais em torno do quinto somito mais recentemente formado.
- Colocar os troncos isolados embrionárias em Dispase (0,24 U / ml de DMEM) e incubar durante 1 h 15 min a 37 ° C e 5% CO 2. Uma vez que os troncos de começar a incubação, começar a preparar 6 lamelas (CS) para explantes NT (passos 1,5-1,8).
- Enxaguar 6 CS em etanol a 70% (diluído em água, estéril ultrapura), e, em seguida, permitir que sequem. Usando um marcador de laboratório, desenhar um círculo no centro de cada CS que é de cerca de 1 cm de diâmetro (este círculo, mais tarde, ajudá-lo a identificar onde um casaco de fibronectina foi aplicada). Na mesma face de cada CS, escrever a palavra "ser" (ou alguma outra palavra assimétrico ou forma) fora do círculo desenhado (isso vai ajudá-yOU identificar se o lado marcado do CS está voltada para cima ou para baixo).
- Colocar cada CS em um 40 x 10 mm separado prato esterilizado com a superfície marcada voltada para baixo e permitir que o prato de sentar aberto por baixo de uma lâmpada de UV germicida, durante 10 min.
- Aplicar 60 ul a fibronectina (FN, 10 ug / ml de DMEM) para a superfície não marcada do CS assegurando ao mesmo tempo toda a área dentro do círculo de 1 cm é revestido. Colocar as placas a incubar a 37 ° C durante 30 min e, em seguida, cuidadosamente aspirado a partir de cada fibronectina CS.
- Adicionar 250 ul de "cultura" medium [DMEM com L-glutamina (2 mM), penicilina (100U/ml), estreptomicina (100 mcg / ml), e 8% de soro fetal bovino (FBS)] à área de FN revestido o CS. Colocar as cápsulas contendo cada CS a 37 ° C e 5% CO 2, até que os NTs têm sido isolados.
- Transferir todos os troncos de embriões incubados a um centímetro de vidro de 5 placa de Petri contendo meio L15 e começar dissecando cada NT utilizando uma pinça fina e uma agulha de tungsténio (Fig. 1). Carefully cortar ao longo da fronteira do NT e somitos com uma agulha de tungstênio afiada ao ser cauteloso para não danificar o NT. Muitas vezes, é mais fácil começar isolando cada NT a partir do final caudal-a maior parte do tronco.
- Selecione 6 dos NTs retas longas e para a cultura durante a noite (NTs entre cerca de 8 e 15 somitos prazo é recomendado). Utilizando uma ponta de micropipeta preparado com meio de cultura, transferir cada um dos 6 NTs ao seu próprio CS previamente preparado (a partir de 1,5 por meio de etapas de 1,8). Certifique-se de que o NT não permanece flutuando na superfície. Se o NT é flutuante, gotejamento meio para ele até que ele afunda usando uma micropipeta.
- Colocar cada prato a 37 ° C e 5% CO 2 durante a noite. Ter cuidado para assegurar que cada NT está dentro da área de FN revestido da sua respectiva CS imediatamente antes de se colocar o prato na incubadora (usando o círculo desenhado no passo 1.5 como uma referência). A micropipeta pode ser usado para ajustar melhor a posição de cada NT, se necessário.
- Lugar nopelo menos 2 ml de meio de cultura (sem soro) para um tubo de centrífuga estéril de 15 ml e incubar durante a noite a 37 ° C e 5% CO 2. Deixe a tampa ligeiramente desenroscada para permitir que o pH do meio de ajustar a noite. Pré-incubar o meio é importante para ajudar a prevenir a formação de bolhas na sua câmara, o que pode perturbar o estabelecimento de um gradiente molecular. Tal meio de "pré-incubadas" deve ser utilizado em todas as etapas futuras. Quando não está a ser utilizada, esta deve ser meio de incubação a 37 ° C.
2. Dia 2: Carregamento da câmara modificado Zigmond e lapso de tempo de análise da migração celular
- Dos 6 NTs cultivadas, selecione as três culturas mais adequadas para análise. Em geral, as culturas de NCC que têm pelo menos uma aresta longa, linear deve ser seleccionado (Fig. 2A). Os 3 melhores culturas irão ser usados para carregar e filme 3 câmaras modificados Zigmond ao longo do dia, cada uma com um tratamento diferente. Fora das três culturas, escolher um para loading câmara o primeiro e retornar os outros para a incubadora para uso posterior.
- Usando um cotonete, aplique uma camada fina e uniforme de vaselina ao redor dos reservatórios e pontes de uma modificação Zigmond câmara.
- Com uma agulha de tungsténio, retire o NT do CS, enquanto deixa os CBCs circundantes que aderem à superfície do CS. Marcar o recipiente com uma caneta para lembrar a orientação da reta borda da cultura NCC.
- Coloque algumas gotas de meio de pré-incubado na ponte. Pegar o CS com uma pinça fina, dab a borda do CS contra um Kimwipe para remover a maior parte do meio de cultura anterior, então colocar imediatamente o CS na câmara Zigmond modificado de modo que a vara de a cultura a ser filmado está centrada sobre o comprimento da ponte e aproximadamente perpendicular à borda ponte reservatório (Fig. 2A, B).
- Utilizando um microscópio invertido, mova a borda NCC directamente para estar no lado da ponte mais próxima threservatório e que irá conter o chemotactant suspeita (Fig. 2B; para controles isto irá corresponder a qualquer reservatório é carregado segundo). Além disso, mais finamente alinhar a vara da cultura a ser perpendicular à borda ponte reservatório.
- Cuidadosamente, mas firmemente apertar o CS em vaselina líquida presente na câmara Zigmond, certificando-se que seja completamente selada para a câmara e, em seguida colocar vaselina adicional ao longo da extremidade do CS para assegurar, além disso, será estanque ao ar. Fino-ajustar o ângulo da borda NCC novamente para corrigir qualquer movimento durante o processo de selagem.
- Carregar o reservatório que não irá conter o suspeito chemotactant primeira (Fig. 2B). Fazê-lo através do carregamento de uma seringa de 1 ml (25 G x 1,5 pol agulha), com cerca de 300 ul de meio pré-incubado e injectar o meio para dentro do reservatório até completa (tendo cuidado para não gerar quaisquer bolhas no reservatório). Ligue o reservatório em ambos os lados com um sufficient quantidade de vaselina antes de carregar o próximo reservatório.
- Repita o passo 2.7, só que desta vez com o meio-incubadas contendo o chemotactant candidato. É crítico ao gerar um gradiente molecular através da cultura para sempre carregar o reservatório que contém a molécula a ser testado após o carregamento do reservatório sem a molécula testada.
- Coloque a câmara Zigmond carregada a 37 ° C a incubar durante 1 h antes da filmagem. Imagem a reta borda da cultura NCC durante 3 horas a 90 s intervalos de tempo de incubação a cerca de 37 ° C (Fig. 2A, B). Antes de criar qualquer filme, certifique-se de alinhar a câmera para que a borda das imagens a serem obtidos estão alinhados com e tocar a borda da ponte que faz fronteira com o último reservatório carregado (Fig. 2B, painel superior, caixa tracejada representa ideal posição para geração de imagens). Isto irá facilitar a análise de software mais tarde, padronizando a direção do gradiente molecular aplicada e thdistância a partir do reservatório e filmado em cada filme produzido.
- Para os controlos, repetir as etapas de 2,2-2,9 para cada uma das duas outras culturas NCC seleccionados (no passo 2.1), mas cada encher o reservatório com um meio apropriado. Para um tipo de controlo preencha os dois reservatórios previamente incubado com meio não contendo a molécula a ser testada. Para um tratamento de controle de segunda, primeiro a ponte com algumas gotas de meio-incubadas contendo o chemotactant suspeita antes da montagem do CS. Em seguida, carrega ambos os reservatórios com o mesmo meio contendo o chemotactant suspeita.
- Use ImageJ (NIH) Tracking Manual (rsb.info.nih.gov / ij / plugins / faixa / track.html) e Quimiotaxia e Migration Tool v1.01 (www.ibidi.de / aplicativos / ap_chemo.html) plugins para rastrear a migração dos CBCs periféricos ao longo da fronteira reta da cultura just fotografada e analisar vários parâmetros das trajectórias migratórias obtidos (Fig. 2B-C).
3. Resultados representativos:
Uma amostra de trajectórias de células a partir de um filme em que NCCs tronco muitos foram responsivo a um quimioatraente candidato utilizando a técnica acima é mostrado (Fig. 2D). A maioria das células no presente exemplo de uma resposta positiva exibido um movimento líquido se o gradiente chemoattractant (como mostrado a vermelho). Dados da trajectória pode ser utilizado para analisar outras propriedades de migração celular, bem.
A fim de avaliar visualmente um gradiente aplicado numa câmara Zigmond modificado, um Alexa Fluor 488 conjugado IgM (MW ~ 900 kDa) foi carregado para o segundo reservatório de uma câmara Zigmond modificado (a cerca de 40 ug / ml de H 2 O). Um gradiente foi estabelecida por 1 h e ainda um pouco presente após 26 horas, mas fortemente diminuída em 50 h (Fig. 3). Se a molécula a ser testada é menor, em seguida, aplicada ao gradiente wivai degradar mais rapidamente do que o que é mostrado.

Figura 1. Explantes de tronco de nível de NTs para cultura durante a noite em fibronectina revestidos lamínulas. Porque delaminate tronco NCCs do NT dorsal localizado adjacente ao somitos 8-28, este segmento do NT é isolado por microdissecção e cultivadas durante a noite em um CS fibronectina revestido para permitir a emigração de NCCs do explante NT. NTs isoladas que estão entre 8-15 somitos longa e relativamente simples são os mais adequados para o cultivo durante a noite, já que tendem a produzir culturas NCC com mais fronteiras retas. Regiões do tubo neural, que dão origem a outros níveis axiais da crista neural são mostrados em uma fonte menor. s, somito.

Figura 2. Método para a avaliação da migração dos CBCs tronco explantadosutilizando uma versão modificada câmara Zigmond. (A) culturas tronco alongados NCC são preparadas por cultura durante a noite de NTs e culturas resultantes NCC com pelo menos uma fronteira longa e reta são selecionadas para experimentação. A maior fronteira reto de uma cultura seleccionada é então posicionado perpendicularmente à borda da ponte-reservatório, e, portanto, paralela ao vector do gradiente aplicado futuro. (B) Depois do ajuste preciso da posição do NCC cultura na câmara de vedação e Zigmond a lamela para a câmara, a câmara é carregada. Ao testar a quimiotaxia, o reservatório que não irá conter o chemotactant suspeita (-) é carregado em primeiro lugar e selado. Em seguida, o outro reservatório é carregado com o chemotactant suspeita (+) e selada. NCCs periféricos ao longo da fronteira previamente selecionados podem ser analisados e monitorados usando o plugin manual de Rastreamento para ImageJ (painel inferior). (C) Numerosas características migratórias em respostapara o gradiente aplicado pode ser avaliado com base nos dados de controle. Por exemplo, um índice de quimiotaxia pode ser calculado dividindo o deslocamento de uma célula ao longo do eixo x pela distância total que migrou. (D) Um exemplo de uma resposta atraente é mostrada por um gráfico de trajectória de células inicialmente gerado pela quimiotaxia e migração plugin de ferramenta para ImageJ. O ponto de partida de cada percurso está definido para a origem (0,0). Observe quantos mais células migram para o centro de massa source.The quimioatraente de todas as células na sua posição final (cruz azul, todas as células igualmente ponderados) é também mais perto da fonte quimioatraente. NCCs, células da crista neural, faixas vermelhas, as células que migraram para o reservatório carregado com uma suspeita chemoattractant; faixas pretas, as células que migraram para longe; (+), a concentração mais elevada; chemotactant (-), a concentração mais baixa chemotactant.

perfis g> Figura 3. Intensidade através da ponte de uma câmara Zigmond modificada em diferentes tempos após a adição de um conjugado de Alexa Fluor 488. IgM A câmara foi carregado de um modo semelhante ao descrito no protocolo, com as excepções de que a água previamente incubado principais (em vez de meio de pré-incubado) foi utilizado para diluir o anticorpo a 40 mg / ml, e as bolsas de ar pequenas estavam presentes nas extremidades da ponte (longe do segmento onde os perfis de intensidade acima foram tiradas). Inicialmente, nenhum gradiente estava presente na maior parte da ponte. Por um gradiente ha foi estabelecida e continuou presente até 26 h. Por 50 h, a presença do gradiente era inconsistente em diferentes áreas da ponte, e, quando presente, o grau de inclinação do gradiente foi grandemente diminuída. Todos os perfis foram gerados a partir de uma fatia idêntico através da ponte (a partir de uma fronteira ponte reservatório para o outro), utilizando o software AxioVision 4.6. Note que, mesmo enquanto o arbolsos estavam presentes, o gradiente não foi interrompida. , Intensidade elevada de altura; baixa, baixa intensidade; eixo x a distância, através de toda a largura da ponte (2 mm), (+), o reservatório carregado com a Alexa Fluor 488 conjugado IgM, (-), o reservatório não carregado com o conjugado.
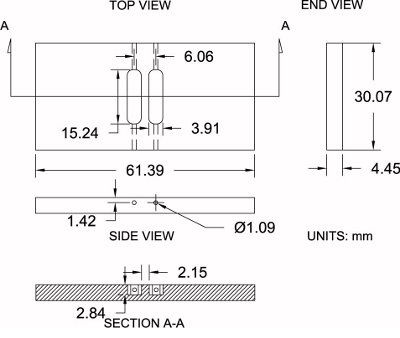
Figura 4. Modificados especificações da câmara. Zigmond mostrado é um diagrama da câmara de Zigmond modificado usado aqui, juntamente com as suas especificações dimensionais (± 0,2 mm). As medições podem ser moderadamente ajustados de forma a coincidir com as preferências individuais.
Suplementar Protocolo: Fabricação de um Zigmond Modificado Câmara
Por favor consulte a figura 4, tal como uma referência para o protocolo abaixo:
- Comprar uma folha de 3/16 "de acrílico grosso polido (4,45 mm de espessura real).
- Usando uma serra de mesa, cortar espaços em branco da câmara de grandes dimensões para adimensões aproximadas de 33,25 milímetros x 64,57 milímetros. Isso permite que 3,175 mm material extra para usinagem.
- Defina a câmara em branco em um torno. Com uma máquina de moagem e um de 6,35 mm (1/4 ") bit fresa de topo, o acabamento dos lados da câmara, para as suas dimensões exactas: 30,07 milímetros x 61,39.
- Posicione a câmara em branco na máquina de fresagem e localizar o centro do branco ao longo de ambos os eixos X e Y com um localizador de extremidade, então zero a posição do centro.
- Adquirir a altura da câmara (eixo z), tocando o bit de fresa de topo com a superfície de topo e de zero a altura.
- Usando um milímetro 3,91 (0,154 ") bit fresa, compensar a 3,03 milímetros de bits ao longo do eixo x (sentido positivo) para o primeiro reservatório. Comece a maquinagem no interior da câmara, até uma profundidade de 2,84 mm, enquanto se move ao longo do eixo y (sentido positivo) a 7,62 mm (0,300 ") e, em seguida, percorrem a 7,62 mm (0,300") na direcção (negativa), em frente a um reservatório completo comprimento de 15,24 mm (0,600 "). Compensaro bit a 3,03 mm (0,119 ") ao longo do eixo x (sentido negativo) e repetir o processo para o segundo reservatório.
- Posicionar a câmara na sua extremidade e um furo com um milímetro 1,09 (0,043 polegadas) da broca na extremidade de cada reservatório (4 total) que liga a extremidade do reservatório para o lado da câmara de carga média durante a experimentação.
- Mergulhe a câmara bem em água morna e sabão para ajudar a remover quaisquer contaminantes químicos.
- Embeber e enxaguar a câmara poço de água duplamente destilada para remover qualquer sabão. As câmaras estão agora prontos a usar, tal como descrito acima.
Discussão
Realização de pesquisas sobre a quimiotaxia NCCs tronco provou um desafio para uma série de razões. NCCs tronco constituem uma população heterogénea de células estaminais que se diferenciam de cultura de longo prazo, por isso, NCCs tronco deve ser obtido a partir de explante primário do tronco NT-nível. Os métodos convencionais para estudar a resposta quimiotáctica de forma homogénea as populações de células in vitro são distribuídos difícil de testar em NCCs tronco desde que eles exigem que ...
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Damos graças especiais para Lino Kim, Steve Guzman e Satyarthi Ujit de assistência técnica durante o desenvolvimento deste método. Myron Hawthorne, Richard Spengel, e Roberto Rojas usinado as câmaras usadas aqui e desde muito necessária assistência técnica. Notavelmente, Roberto Rojas produzido Figura 4. Estamos também gratos conselhos inestimáveis Scott Fraser antes do desenvolvimento do ensaio de quimiotaxia acima. Este trabalho foi parcialmente financiado por um SCORE-5S06GM048680-13 NIH-MBRS para Medb e por um prêmio do, Northridge CSU de Pós-Graduação Programa de Apoio à Tese de CW.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários (opcional) |
| DMEM | Omega Científico | DM-22 | |
| Solução penicilina estreptomicina | Omega Científico | PS-20 | Concentração da 100X |
| L-Glutamina | Omega Científico | GS-60 | Concentração da 100X |
| Soro Fetal Bovino | Omega Científico | FB-11 | Lote # 105247 (ou outro que é comparável) |
| Modificado Zigmond câmara | Home made | N / A | Volume do reservatório: ~ ea 160 ul, para especificações adicionais, ver fig. 4 e o protocolo de fabricação suplementar |
| Placa de cultura de células | Denville | T6040 | 40 x 10 mm |
| Fibronectina | BD | 354008 | Banco 10X preparado por diluição de 1 mg em 1 ml de FN H 2 O e 9 ml de DMEM |
| Lamelas | Pescador | 12-548 B- | Previamente limpas, 22 x 22 mm |
| L15 médio | Thermo Scientific | SH30525.02 | |
| Vaselina | Conforta | 011110794642 | 100% |
| Tubo de centrífuga | Biologix | 10-9152 | 15 ml |
| Dispase | Sistemas celulares | 4Z0-850 | Concentração da 10X |
| Seringa | BD | 309602 | 1 ml |
| Agulha | BD | 305127 | 25 G x 1,5 pol |
| Alexa Fluor 488-IgM | Eunvitrogen | A21042 | Estoque é de 2 mg / ml; 7 moles de corante / mole IgM |
| Pinças de dissecação | FST | Misc. | Dumont n º 5 ou 55; reta ponta, aço inox ou titânio |
| Agulha de tungstênio | N / A | N / A | Home made; colocada num suporte pino |
| Fórceps Blunt | Tiemann | 160-18 | Utilizado para transferência de embriões para Ringer de gema de ovo |
Suplementar Protocolo: Fabricação de um Zigmond Modificado Câmara
Por favor consulte a figura 4, tal como uma referência para o protocolo abaixo:
- Comprar uma folha de 3/16 "de acrílico grosso polido (4,45 mm de espessura real).
- Usando uma serra de mesa, cortar espaços em branco da câmara de grandes dimensões com as dimensões aproximadas de 33,25 milímetros x 64,57 milímetros. Isso permite que 3,175 mm material extra para usinagem.
- Defina a câmara em branco em uma vise. Com uma máquina de moagem e um de 6,35 mm (1/4 ") bit fresa de topo, o acabamento dos lados da câmara, para as suas dimensões exactas: 30,07 milímetros x 61,39.
- Posicione a câmara em branco na máquina de fresagem e localizar o centro do branco ao longo de ambos os eixos X e Y com um localizador de extremidade, então zero a posição do centro.
- Adquirir a altura da câmara (eixo z), tocando o bit de fresa de topo com a superfície de topo e de zero a altura.
- Usando um milímetro 3,91 (0,154 ") bit fresa, compensar a 3,03 milímetros de bits ao longo do eixo x (sentido positivo) para o primeiro reservatório. Comece usinagem para dentro da câmara, até uma profundidade de 2,84 mm, enquanto se move ao longo do eixo y ( positivo sentido) a 7,62 mm (0,300 ") e, em seguida, percorrem a 7,62 mm (0,300") na direcção (negativa), em frente a um comprimento de reservatório completo de 15,24 mm (0,600 "). Compensar o bit a 3,03 mm (0,119 ") ao longo do eixo x (sentido negativo) e repetir o processo para o segundo reservatório.
- Posicione a câmara em sua bordae um furo com um milímetro 1,09 (0,043 polegadas) da broca na extremidade de cada reservatório (4 total) que liga a extremidade do reservatório para o lado da câmara de carga média durante a experimentação.
- Mergulhe a câmara bem em água morna e sabão para ajudar a remover quaisquer contaminantes químicos.
- Embeber e enxaguar a câmara poço de água duplamente destilada para remover qualquer sabão. As câmaras estão agora prontos a usar, tal como descrito acima.
Referências
- Le Douarin, N. M. The avian embryo as a model to study the development of the neural crest: a long and still ongoing story. Mechanisms of Development. 121, 1089-1102 (2004).
- Baker, C. V. . Neural Crest and Cranial Ectodermal Placodes. , (2005).
- Gammill, L. S., Roffers-Agarwal, J. Division of labor during trunk neural crest development. Dev. Biol. 344, 555-565 (2010).
- Kulesa, P. M., Gammill, L. S. Neural crest migration: patterns, phases and signals. Dev. Biol. 344, 566-568 (2010).
- Wang, H. U., Anderson, D. J. Eph family transmembrane ligands can mediate repulsive guidance of trunk neural crest migration and motor axon outgrowth. Neuron. 18, 383-396 (1997).
- Krull, C. E. Interactions of Eph-related receptors and ligands confer rostrocaudal pattern to trunk neural crest migration. Curr. Biol. 7, 571-580 (1997).
- Gammill, L. S., Gonzalez, C., Gu, C., Bronner-Fraser, M. Guidance of trunk neural crest migration requires neuropilin 2/semaphorin 3F signaling. Development, Cambridge, England. , 133-199 (2006).
- De Bellard, M. E., Rao, Y., Bronner-Fraser, M. Dual function of Slit2 in repulsion and enhanced migration of trunk, but not vagal, neural crest cells. The Journal of cell biology. 162, 269-279 (2003).
- Kasemeier-Kulesa, J. C., McLennan, R., Romine, M. H., Kulesa, P. M., Lefcort, F. CXCR4 controls ventral migration of sympathetic precursor cells. J. Neurosci. 30, 13078-13088 (2010).
- Zigmond, S. H. Ability of polymorphonuclear leukocytes to orient in gradients of chemotactic factors. The Journal of Cell Biology. 75, 606-616 (1977).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chicken embryo. J. Morph. 88, 49-52 (1951).
- Boyden, S. The chemotactic effect of mixtures of antibody and antigen on polymorphonuclear leucocytes. The Journal of Experimental Medicine. 115, 453-466 (1962).
- Davis, E. M., Trinkaus, J. P. Significance of cell-to cell contacts for the directional movement of neural crest cells within a hydrated collagen lattice. Journal of Embryology and Experimental Morphology. 63, 29-51 (1981).
- Zicha, D., Dunn, G. A., Brown, A. F. A new direct-viewing chemotaxis chamber. Journal of Cell Science. 99, 769-775 (1991).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados