É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Organotípicas culturas de mesencéfalo ventral Slice Embrionárias: Um Sistema para o Estudo de Desenvolvimento Neuronal dopaminérgicos In vitro
Neste Artigo
Resumo
Um método para gerar fatias organotípicas da E12.5 mesencéfalo embrionário murino é descrito. As culturas fatia organotípicas pode ser usado para observar o comportamento de neurônios dopaminérgicos ou outros neurônios do mesencéfalo ventral.
Resumo
O mouse é um organismo excelente modelo para estudar o desenvolvimento do cérebro dos mamíferos, devido à abundância de dados moleculares e genéticos. No entanto, o cérebro do rato em desenvolvimento não é adequado para fácil manipulação e de imagem in vivo desde o embrião de rato é inacessível e opaco. Culturas fatia organotípicas de cérebros embrionárias são, portanto, amplamente utilizada para estudar o desenvolvimento do cérebro de camundongos in vitro. Ex-vivo de manipulação ou o uso de camundongos transgênicos permite a modificação da expressão do gene para que subpopulações de células neuronais ou gliais podem ser rotulados com proteínas fluorescentes. O comportamento de células marcadas podem então ser observadas utilizando lapso de tempo de imagem. Lapso de tempo de imagem tem sido particularmente bem sucedido para estudar comportamentos de células que sustentam o desenvolvimento do córtex cerebral na tarde estágios embrionários 1-2. Embrionárias sistemas fatia organotípicas cultura em regiões do cérebro fora da parte frontal do cérebro são Establis menos bemhed. Portanto, a riqueza de dados time-lapse imagem descrevendo a migração celular neuronal é restrito a parte frontal do cérebro 3,4. Ainda não é conhecido, se os princípios descobertos para o cérebro dorsal são verdadeiras para áreas do cérebro ventral. Ventral do cérebro, os neurônios são organizados em grupos neuronal ao invés de camadas e muitas vezes eles têm que se submeter complicadas trajetórias migratórias para chegar a sua posição final. Mesencéfalo ventral não é apenas um sistema bom modelo para o desenvolvimento cerebral ventral, mas também contém populações neuronais tais como neurônios dopaminérgicos que são relevantes nos processos de doença. Enquanto a função e degeneração de neurônios dopaminérgicos tem sido investigada em grande detalhe no adulto e envelhecimento cerebral, pouco se sabe sobre o comportamento desses neurônios durante a sua diferenciação e fase de migração, 5. Descrevemos aqui a geração de culturas fatia do dia embrionário (E) do mesencéfalo ventral de rato 12,5. Estes cult fatiamentos são potencialmente adequado para o monitoramento do desenvolvimento dos neurônios dopaminérgicos durante vários dias in vitro. Destacam-se os passos críticos na geração de fatias do cérebro nesses estágios iniciais do desenvolvimento embrionário e discutir as condições necessárias para manter o desenvolvimento normal de neurônios dopaminérgicos in vitro. Também apresentam resultados de experimentos de tempo de imagem lapso. Nesses experimentos, mesencéfalo ventral de precursores (incluindo precursores dopaminérgicos) e seus descendentes foram rotulados de uma forma de mosaico usando um Cre / loxP baseada induzível sistema de mapeamento destino 6.
Protocolo
Partes do presente protocolo são modificados a partir de Daza et al., 2007 7.
1. Preparativos
- Pode ser preparado um dia de antecedência
- Prepare 1X tampão Krebs (1,5 L): 126 mM NaCl, 2,5 mM KCl, 1,2 mM NaH 2 PO 4: H 2 O, 1,2 mM MgCl 2, 2,5 mM CaCl 2, 11 mM de glucose, 25 mM NaHCO 3; ajustar o pH para 7,4. Filtro de esterilizar (0,22 tamanho dos poros mm) e armazenar a 4 ° C.
- Preparar o meio de cultura (20 mL): 5 mL HBSS, 9 mL de glicose DMEM alta, 850 mL de glicose 30%, 5 mL soro de cavalo (25%). Adicionar 200 mL Penicllin 100X / estreptomicina. Armazenar a 4 ° C.
- Prepare antes de iniciar a dissecção
- Prepare 100 mL de 4% agarose baixa temperatura de fusão (LMP agarose) em 1X tampão Krebs: solução de microondas a até a agarose é completamente dissolvido e, em seguida, coloque a agarose em um banho de água 45 ° C.
- Preencha o vibratome com gelo na bandeja de tampão frio 1X tampão Krebs e iniciar o elemento de refrigeração (mantenha a 4 ° C). Fix uma lâmina de barbear no suporte da lâmina e set-up a área vibratome com um bisturi, pincel uma multa e uma colher perfurada mini-para pegar as fatias. Prepare pratos Petri estéreis (35 x 10 mm) com 1x tampão Krebs para a coleta das fatias. Manter no gelo.
- Set-up a área de dissecção com pratos de Petri estéreis (100 x 15 mm) para dissecção e menor pratos Petri estéreis (35 x 10 mm) para a incorporação, tesoura pequena, duas pinças de multa (Dumont 5), uma colher de mini-perfurado, um vidro Pasteur fogo pipeta polido com uma rodada fechada ponta e 1 L de 1X tampão Krebs no gelo. Limpe todas as ferramentas de dissecção com etanol 70%.
- Adicionar meio de cultura para os poços de uma placa de seis poços (1,5 mL / poço) e coloque-o a 37 ° C incubadora.
- Prepare um prato de seis bem com 1,5 mL / poço estéril 1X tampão Krebs e 15 mL penicilina / estreptomicina (100X) / poço. Em condições estéreis, coloque MilCelular licell Cultura insere nos poços. Coloque a placa de seis bem ao lado do vibratome de modo que as fatias de cérebro podem ser transferidos para as membranas de filtro imediatamente após o corte.
2. Dissecção e incorporação de cérebros embrionários
- Anestesiar um rato fêmea grávida usando isoflurano e sacrifício o mouse por deslocamento cervical (embriões devem estar no estágio E12.5). Dissecar o útero do rato, puxando-se o útero com uma pinça. Use uma pinça para separar as outras mesométrio longe do útero. Coloque o útero gelada tampão Krebs 1X. Use uma pinça fina para separar a parede muscular do útero, membrana Reichert e do saco vitelino visceral do embrião. Remoção dos embriões do útero. Coloque os embriões dissecado em uma placa de Petri estéril separado com 1X Krebs buffer.
- Dissecar o cérebro sob microscópio estereoscópico. Para dissecar o cérebro, primeiro cortaram a cabeça do embrião. Fixar a cabeçapor piercing forceps fina através da cabeça (do nível dos olhos). Use um outro par de pinças para remover cuidadosamente a pele e crânio. Use uma pinça para levante cuidadosamente o cérebro para fora e transferi-lo para uma placa de Petri estéreis com 1X Krebs buffer. É muito importante que a integridade de todo o cérebro é mantida durante a dissecção, uma vez que os danos ao tecido do cérebro criará problemas (como a trituração do tecido) durante o corte na vibratome.
- Lavar o cérebro de vez em 4% com baixo ponto de fusão (LMP) agarose. Incorporar 03/02 cérebros em um momento em fresco 4% LMP agarose. Coloque os pratos incorporação no gelo o mais uniforme possível. Use uma pipeta Pasteur com a ponta-fogo polido rodada para levantar o cérebro até a parte inferior da agarose é solidificado. O cérebro deve se contentar em uma posição plana e horizontal na parte inferior do bloco de agarose.
- Após a agarose foi totalmente solidificado (após cerca de 3 min), a guarnição da agarose ao redor do cérebro e cola o bloco de agarose para o palco espécimedo vibratome. Ao colar os blocos, certifique-se que o lado ventral do cérebro é paralela à plataforma, uma vez que o cérebro deve ser cortada em um plano de corte horizontal.
3. Seccionamento Vibratome
- Use uma lâmina de barbear para cortar. Para obter fatias intactas é muito importante para manter a temperatura a 4 ° C durante o corte.
- Seção 300 mm, espessura horizontal em uma freqüência de 50 Hz, amplitude de lâmina de 1,1 mm e uma velocidade de 25 mm / sec.
- Use o pincel fino para empurrar a fatia em uma colher de mini perfurada para coletar as fatias de cérebro e transferi-los em um prato com estéril gelada tampão Krebs 1X. Escolha a fatia que contém tecido mesencéfalo ventral (ver figura 1). Em um cérebro de camundongo E12.5 existe apenas uma fatia 300 mM horizontal que contém tecido mesencéfalo ventral incluindo neurônios dopaminérgicos.
4. Cultura fatia
4,2-4,5 passos devem ser realizados em condições estéreis.
- Transferir as fatias de cérebro em um insert membrana Millicell de cultura de células em um prato de seis bem com 1x tampão Krebs (ver ponto 1.2.5). Para transferir a fatia de usar a colher de mini-perfurada (Ferramentas Ciência Fine) e um pincel fino. Até 3 fatias podem ser colocados em uma membrana.
- Transferência da membrana com a fatia para a placa de seis poços com meio de cultura (ver ponto 1.2.5). A parte superior da membrana não deverão ser abrangidos pelo meio. O cérebro recebe fatia média de baixo e ar de cima.
- Coloque a placa de seis poços em uma incubadora com 5% de CO 2 a 37 ° C. É muito importante que as fatias são colocadas na incubadora dentro de 2 horas após a etapa inicial da dissecção. Um tempo de preparação mais prolongada pode resultar em sobrevida das fatias.
- Fatias podem ser mantidos in vitro até 3 dias. Mudança de 50% do meio de cultura sobre o 2 º dia.
5. Lapso de tempo de imagem
- Deixe as fatias de recuperar na incubadora por 4-5 horas antes de iniciar lapso de tempo de imagem.
- Por lapso de tempo de imagem, mantenha as fatias sobre a inserção da membrana e transferir a inserir em um milímetro Ibidi 35 μ-prato (fundo do prato é composto de material com alta qualidade ótica).
- Adicionar 1 mL de meio de cultura mais 1,5 mL de ácido ascórbico (200 mM) ao prato. O ácido ascórbico protege as fatias contra fototoxicidade.
- Incubar fatias em uma câmara a 37 ° C com 5% de CO2 durante o lapso de tempo de imagem.
6. Resultados representante
A figura 1 ilustra a preparação de culturas fatia de organotípicas E12.5 cérebro do rato. A Figura 2 mostra horizontal fatias organotípicas (aguda e após vários dias em cultura) obtidos formulário cérebro de camundongo E12.5. Para efeito de comparação, as seções do cérebro congelado nas fases de desenvolvimento equivalentesão mostrados. Neurônios dopaminérgicos do mesencéfalo são visualizados com imunoistoquímica para tirosina hidroxilase (TH). Mesencéfalo projeto neurônios dopaminérgicos para alvos na parte frontal do cérebro. Essas projeções começam a formar a E12.5 e estender para o cérebro anterior durante os dias subseqüentes. Nós consideramos o desenvolvimento de projeções prosencéfalo como uma boa indicação para o desenvolvimento normal de neurônios dopaminérgicos em cultura. No mesencéfalo fatias horizontais neurônios dopaminérgicos estendem projeções para a sua área apropriada do prosencéfalo alvo. Após 3 DIV (dias in vitro), ou quando as áreas-alvo do prosencéfalo estão danificados, as projeções aberrante estendem para o mesencéfalo dorsal. Exemplos de cortes coronais de E12.5 mesencéfalo são mostrados na Figura 3. Neurônios dopaminérgicos visualizado com imunomarcação para TH estendem projeções aberrante para o mesencéfalo dorsal. A Figura 4 mostra uma análise de proliferação, as células necróticas e apoptóticas nas culturas fatia organotípicas. BrdU immunostaining para visualizar células em proliferação demonstra que as células proliferam em condições de cultura após uma DIV. Proliferação é reduzida após 4 DIV. Após 3 DIV, muitas células no mesencéfalo ventral sofrer necrose (propidium coloração iodeto) e apotosis (imunomarcação para caspase-3 clivada). Figura 5 mostra os caminhos migratórios de YFP marcado neurônios monitorados em um experimento de imagens de lapso de tempo em uma fatia aguda .
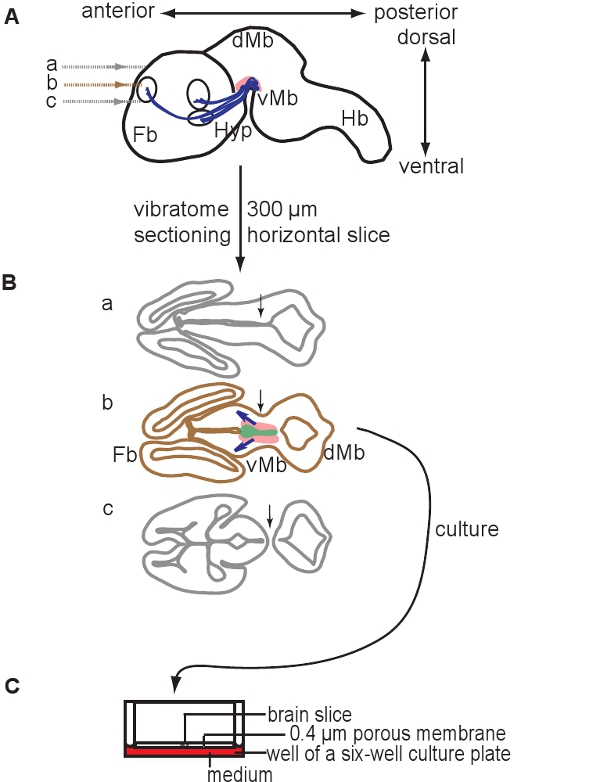
Figura 1. Esquemático ilustrando a preparação de culturas fatia organotípicas. 300 mm, fatias de cérebro horizontal são preparados por seccionamento um cérebro E12.5 usando um vibratome. (A) corte sagital esquemática de um cérebro de camundongo E12.5. Níveis de seções são indicadas. A área que contém neurônios dopaminérgicos é representado na cor rosa, as projeções são indicados em azul. (B) Esquema dos três fatias que podem ser obtidos a partir de dorsal para ventral e that contêm tanto prosencéfalo (Fb) e mesencéfalo (Mb). Note-se que apenas uma fatia contém neurônios dopaminérgicos (b fatia). A fatia apropriada podem ser identificados com base na posição dos ventrículos ea continuidade do mesencéfalo e prosencéfalo tecido (setas, compare b seção com uma seção e c). A área que contém neurônios dopaminérgicos é indicado em rosa, a área contendo precursores dopaminérgicos é representado em verde, azul setas indicam projeções em desenvolvimento. (C) A fatia que contém neurônios dopaminérgicos é cultivado em inserções de membrana. Abreviaturas: mesencéfalo, VMB ventral; DMB, mesencéfalo dorsal; Hyp, hipotálamo; Hb, rombencéfalo.
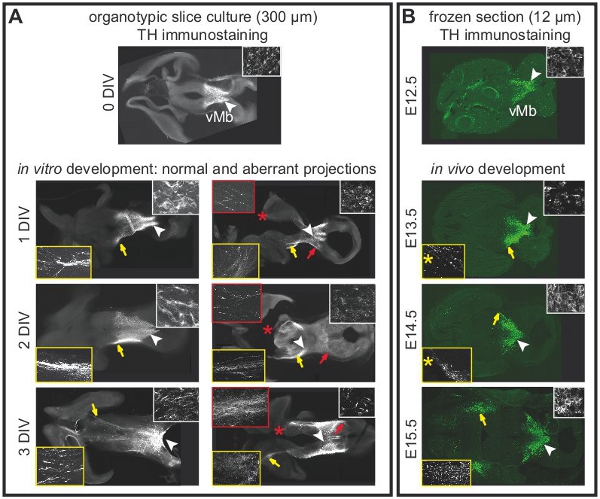
Figura 2. Projeções de neurônios dopaminérgicos do mesencéfalo em culturas fatia organotípicas dependem da integridade do cérebro anterior. Imunoistoquímica para tirosina hidroxilase (TH) para rotular neurônios dopaminérgicos. (A) fatia aguda (0 DIV)mostrando a localização normal de neurônios dopaminérgicos no mesencéfalo ventral. A seta branca indica a área que é mostrado na maior ampliação na inserção. Projeções para o prosencéfalo ainda não desenvolveram. Depois de uma DIV, as projeções para o prosencéfalo começam a se formar. Projeções se estendem até o prosencéfalo em 2-3 DIV. Setas brancas indicam a localização dos corpos celulares mostrado na maior ampliação no inserções (quadro branco). Setas amarelas destacam as projeções normal em fatias intactas mostrado na maior ampliação no inserções (quadro amarelo). Projeções aberrante desenvolver-se em fatias com prosencéfalo danificado. As setas vermelhas indicam as projeções aberrante para o mesencéfalo dorsal mostrado na maior ampliação no inserções (quadro vermelho). Dano é indicado com asteriscos vermelhos. Após 3 DIV, a maioria fatias (n = 07/05) apresentaram projeções aberrante para o mesencéfalo dorsal. (B) imunocoloração TH na horizontal seções cérebro congelado em diferentes estágios de desenvolvimento para mostrar o desenvolvimentodas projeções dopaminérgicas in vivo. Setas brancas indicam a localização dos corpos celulares mostrado na maior ampliação no inserções (quadro branco). Setas amarelas realçar a posição das projeções mostradas na maior ampliação no inserções (quadro amarelo). O nível de congelação foi escolhido para se aproximam do nível das culturas fatia organotípicas. Note que um único seções congeladas (12 mm) não representa a fatia inteira organotípicas (300 mm). Portanto, as projeções mostradas na E13.5 e E14.5 foram observados em seções 120 mM ventral mais do que a seção que contém os corpos celulares (asteriscos amarelo).
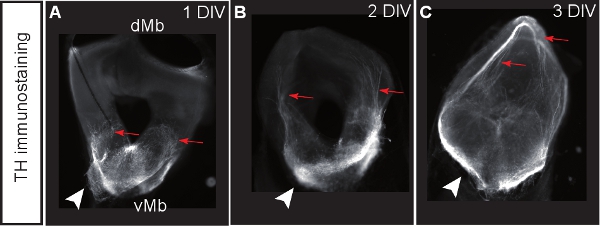
Figura 3. Culturas Midbrain coronal fatia coradas para tirosina hidroxilase (TH) como marcador de neurônios dopaminérgicos. (AC) Fatias após DIV 1, 2 ou 3. Neurônios dopaminérgicos desenvolver projeções aberrante para o mesencéfalo dorsal (rsetas ed). Setas mostram a localização dos corpos celulares dopaminérgicos.
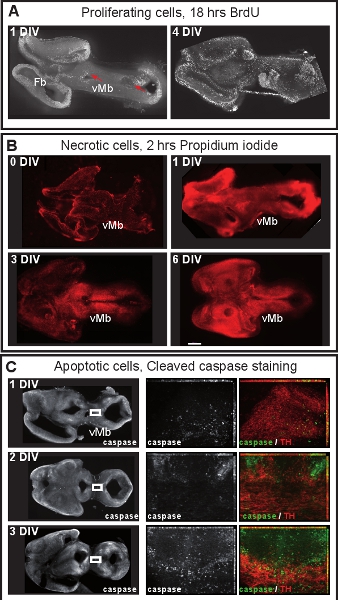
Figura 4. Proliferação celular e viabilidade celular em culturas de mesencéfalo organotípicas fatia. (A) células em proliferação foram marcadas pela adição de BrdU (50 ng / mL, Sigma) ao meio de cultura por 18 h. Fatias foram posteriormente histoquímica para BrdU. Depois de uma DIV, as células BrdU rotulados estão localizados nas zonas ventricular (setas vermelhas). Após 4 DIV, células em proliferação são mais dispersas e uma zona ventricular distintas não é mais mantido. (B) células necróticas foram marcados através da adição de iodeto de propídio (1μg/μL, Sigma) ao meio de cultura durante 2 horas e visualizados por microscopia de fluorescência. Depois de uma DIV, o mesencéfalo ventral (VMB) não é necrótica, mas as células propidium muitos rotulados de iodeto pode ser visto no mesencéfalo dorsal e cérebro anterior. Após 3 DIV a viabilidade celular diminui na midbra ventraldentro barra de escala: 500 mm (C) Immunostaing para caspase-3 clivada para visualizar células apoptóticas. Em 1 ou 2 DIV, poucos neurônios dopaminérgicos (TH) são apoptóticos. Após 3 DIV, neurônios dopaminérgicos começar a sofrer apoptose. Painéis no meio e à direita são ampliações de área de box nos painéis esquerdo. As imagens são projeções maiores ampliações intensidade máxima de z-stacks de 14-16 frames. Imagens foram realizadas a cada 0,5 m com uma ApoTome Zeiss set-up.
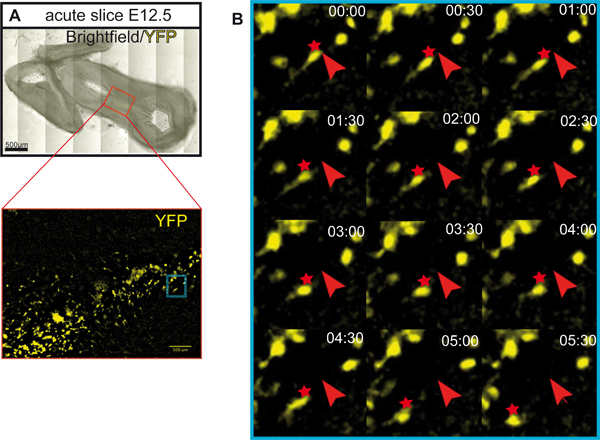
Figura 5. Rota migratória de YFP marcado com os neurônios em uma fatia aguda. (A) Fatia horizontal usado para imagens de lapso de tempo de YFP marcado neurônios. A fatia foi incubada por 5 horas antes da imagem. Células foram rotulados com uma induzível Cre / loxP sistema 6. Shh ratos e camundongos creer 8 ROSA loxP-STOP-loxP-EYFP repórter 9,re usado. Recombinação do alelo repórter ROSA (e expressão EYFP) é induzida em células que expressam creer (Shh células que expressam), mas apenas com a administração de tamoxifeno (Sigma). Neste exemplo, Tamoxifeno (3 mg/40 g peso corporal) foi administrada a ratas grávidas em E8.5. Este set-up experimental resultados principalmente na rotulagem de precursores de neurônios dopaminérgicos e seus descendentes no mesencéfalo ventral 10,11. Barra de escala: 500 mm. (B) Seguindo a rota migratória de YFP marcado com os neurônios em uma fatia aguda. Lapso de tempo imagens de YFP marcado neurônios destino mapeados foram adquiridos a cada 30 minutos durante um tempo total de 5 horas e 30 min em um microscópio Zeiss Axio Observer (CE objetivo PlnN 10x / 0,3). Cortes foram incubados em estufa BOD (incubadora XLS1 Pecon) a 37 ° C e é fornecido com 5% de CO 2 durante a criação de imagens. A posição inicial das células é marcado com setas vermelhas; posições de migração são marcadas com asteriscos vermelhos.
Discussão
O método de cultura organotípicas fatia aqui apresentada fornece um sistema para o curto prazo in vitro de análise de desenvolvimento de neurônios dopaminérgicos e suas rotas migratórias e projeção no mesencéfalo ventral embrionárias. Descobrimos que há uma série de etapas críticas do protocolo que deve ser cuidadosamente atendidos, a fim de obter fatias que permitem o desenvolvimento normal dos neurônios do mesencéfalo ventral dopaminérgicos. O passo mais crítico é a dissecação do cérebro ...
Divulgações
Não temos nada a revelar.
Agradecimentos
Agradecemos a Martine Emond e Isabel Brachmann por sua ajuda no estabelecimento do sistema de cultura organotípicas fatia e Wolfgang Hübner e Liviu Gabriel Bodea para a leitura crítica do manuscrito. Gostaríamos de agradecer a Frank Costantini para o R26 ratos repórter e Cliff Tabin para os ratos creer Shh. Este estudo foi financiado por um Prêmio de Pesquisa do Ministério da Ciência e Investigação de North-Rhine Westphalia (Programm zur Förderung der Rückkehr des wissenschaftlichen Spitzennachwuchses aus dem Ausland).
Materiais
Tabela de reagentes e equipamentos específicos
| Nome do reagente | Companhia | Número de catálogo | Comments (opcional) |
|---|---|---|---|
| DMEM | Sigma-Aldrich | D6429 | |
| Glicose 30% | Sigma-Aldrich | G7528-250 | |
| Soro de cavalo | Invitrogen | 26050-088 | |
| DMEM (4,5 g / L Glc., Com L-Gln, Na Pyr, NaHCO3) | Sigma-Aldrich | D6429-500 | |
| Penicilina estreptomicina / 100x | Sigma-Aldrich | P4333-20 | |
| L-ácido ascórbico | Sigma-Aldrich | A4403 | preparar ações de 200mm e armazenar a -20 ° C |
| UltraPure agarose LMP | Invitrogen | 15517-022 | |
| Insere Millicel | Millipore | PICMORG50 | |
| μ-prato de 35 mm, de baixa | Ibidi | 80136 | |
| Vibratome | Microm | HM 650V | |
| Gilete | Plano GmbH | 121-6 | |
| Histoacryl cola | BRAU9381104 | Braun Aesculap | |
| Dia Colher perfurada 15 mm de diâmetro | Multa Ferramentas Ciência | 10370 -18 | |
| Fórceps 5 Dumoxel | Multa Ferramentas Ciência | 11252-30 |
Anticorpos utilizados para reações imunoistoquímicas:
| Nome do anticorpo | Companhia | Número de catálogo | Comments (opcional) |
| Hidroxilase anti-tirosina coelho | Millipore | AB152 | Diluição 1:500 |
| Rato anti-tirosina hidroxilase | Millipore | MAB318 | Diluição 1:500 |
| Rato anti-BrdU | BD PharMingen | 555627 | Diluição 1:200 |
| De coelho anti-caspase 3 clivada | Tecnologia de sinalização celular | 9661 | Diluição 1:200 |
| Donkey anti-rabbit IgG-Alexa 488 | Invitrogen | A21206 | Diluição 1:500 |
| Donkey anti-mouse IgG-Cy3 | ImmunoResearch Jackson | 715-165-150 | Diluição 1:200 |
Referências
- Noctor, S. C., Martinez-Cerdeno, V., Ivic, L., Kriegstein, A. R. Cortical neurons arise in symmetric and asymmetric division zones and migrate through specific phases. Nat. Neurosci. 7 (2), 136-136 (2004).
- Martini, F. J. Biased selection of leading process branches mediates chemotaxis during tangential neuronal migration. Development. 136 (1), 41-41 (2009).
- Marin, O., Valiente, M., Ge, X., Tsai, L. H. Guiding neuronal cell migrations. Cold Spring Harb. Perspect. Biol. 2 (2), a001834-a001834 (2010).
- Ayala, R., Shu, T., Tsai, L. H. Trekking across the brain: the journey of neuronal migration. Cell. 128 (1), 29-29 (2007).
- Smidt, M. P., Burbach, J. P. How to make a mesodiencephalic dopaminergic neuron. Nat. Rev. Neurosci. 8 (1), 21-21 (2007).
- Legue, E., Joyner, A. L. Genetic fate mapping using site-specific recombinases. Methods. Enzymol. 477, 153-153 (2010).
- Daza, R. A., Englund, C., Hevner, R. F. Organotypic slice culture of embryonic brain tissue. CSH Protoc. , (2007).
- Harfe, B. D. Evidence for an expansion-based temporal Shh gradient in specifying vertebrate digit identities. Cell. 118 (4), 517-517 (2004).
- Srinivas, S. Cre reporter strains produced by targeted insertion of EYFP and ECFP into the ROSA26 locus. BMC Dev. Biol. 1, 4-4 (2001).
- Joksimovic, M. Spatiotemporally separable Shh domains in the midbrain define distinct dopaminergic progenitor pools. Proc. Natl. Acad. Sci. U. S. A. 106 (45), 19185-19185 (2009).
- Blaess, S. Temporal-spatial changes in Sonic Hedgehog expression and signaling reveal different potentials of ventral mesencephalic progenitors to populate distinct ventral midbrain nuclei. Neural. Dev. 6 (1), 29-29 (2011).
- Hippenmeyer, S. A developmental switch in the response of DRG neurons to ETS transcription factor signaling. PLoS Biol. 3 (5), e159-e159 (2005).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados