Method Article
Eletroporação de Mesênquima Craniofacial
Neste Artigo
Erratum Notice
Resumo
Cartilagens craniofacial desenvolver em estreito contato com outros tecidos e são difíceis de manipular em animais vivos. Estamos usando eletroporação para entregar ferramentas moleculares durante o crescimento do esqueleto craniofacial, enquanto ignorando cedo efeitos embrionárias. Esta abordagem irá permitir-nos testar de forma eficiente as moléculas de candidato In vivo.
Resumo
Eletroporação é um método eficiente de entrega de DNA e outras macromoléculas cobrados nos tecidos em momentos precisos e em locais precisos. Por exemplo, eletroporação tem sido utilizado com grande sucesso para estudar o desenvolvimento neural e da retina em Xenopus, frango e mouse 1-10. No entanto, é importante notar que em todos esses estudos, os investigadores não foram alvo de tecidos moles. Porque estamos interessados no desenvolvimento craniofacial, adaptamos um método para alvejar mesênquima facial.
Quando buscamos a literatura, encontramos, para nossa surpresa, poucos relatos de transferência de genes de sucesso no tecido cartilaginoso. A maioria destes estudos foram os estudos de terapia genética, como siRNA ou proteína entrega em linhagens de células condrogênicos, ou, modelos animais de artrite 11-13. Em outros sistemas, tais como a galinha ou o mouse, eletroporação de mesênquima facial tem sido um desafio (pessoal comunicandoíons, Departamento de Desenvolvimento Craniofacial, KCL). Nossa hipótese é que eletroporação em tecidos procartilaginous e cartilaginosa em Xenopus poderia funcionar melhor. Em nossos estudos, nós mostramos que a transferência de genes nas cartilagens faciais ocorre de forma eficiente nas fases iniciais (28), quando o primórdio facial ainda é composta por tecido mole antes da diferenciação da cartilagem.
Xenopus é um sistema muito acessível vertebrados e para análise do desenvolvimento craniofacial. Estruturas craniofaciais são mais facilmente visível em Xenopus do que em qualquer outro modelo de vertebrados, principalmente porque os embriões Xenopus são fertilizados externamente, permitindo análises das primeiras etapas, e facilitando a imagem ao vivo na resolução única célula, assim como a reutilização das 14 mães. Entre os modelos de desenvolvimento de vertebrados externamente, Xenopus é mais útil para a análise craniofacial de peixe-zebra, como larvas Xenopus são maiores e mais fácil de dissect, ea região em desenvolvimento facial é mais acessível à imagem do que a região equivalente em peixe. Além disso, Xenopus é evolutivamente mais próximos do homem do que peixe-zebra (~ 100 milhões ano mais próximo) 15. Finalmente, nestes estágios, girinos Xenopus são transparentes, e expressão simultânea de proteínas fluorescentes ou moléculas permitirá uma fácil visualização das cartilagens em desenvolvimento. Nós antecipamos que esta abordagem irá permitir-nos rapidamente e eficientemente teste moléculas candidato em um sistema modelo in vivo.
Protocolo
Parte 1A. Equipamento
Microscópio: escopo estéreo dissecar ereta com o objectivo de baixa potência
- Tensão / Gerador de Pulso: BTX ECM 830 Sistema de Eletroporação Onda Quadrada
- Extrator da pipeta: P-87 Micropipeta Puller (Sutter Instrument Company, CA)
- Manipulator: grossa, ou combinado grosso e fino dependendo da preparação.
- Micropipeta titular: Ferramentas Ciência Belas
- Eletrodo: homemade
- Eletroporação câmara: homemade
Eletrodos em forma de L:
- Corte 8 cm de alta pureza fio de tungstênio 0,4 mm (Goodfellow) e apor no ponto médio de uma seringa de 1ml utilizando putty (usamos Blu-Tack). Deixe a 4 fios de tungstênio centímetros expostos a partir da ponta da seringa e ponta curva em forma de L, 1 cm de ponta (Fig. 1A).
- Apare a ponta de modo que o fim de medidas de 0,5 mm de comprimento. Tsua dica é o término do eletrodo.
- Correm paralelas excesso de fio de tungstênio para seringa e usá-lo para ligar o gerador de pulso eletrodo.
- Repita o processo fazendo um par de eletrodos.
- Anexar eletrodos ao gerador de pulso de onda quadrada através de cabos DC.
Eletroporação câmara
- Linha de fundo de 90 mm com prato ~ 5 plasticina non-toxic mm.
- Preencha prato com media eletroporação.
- Usando No. 5 relojoeiro pinça de esculpir um poço em forma de T (Fig. 2). O bem longa deve medir ~ 2 mm x 2 mm x 10 mm e a curto ~ 2 mm x 2 mm x 5 mm. O prato eletroporação pode ser lavado e reutilizado.
1B parte. Reagentes
DNA ou macromoléculas cobrado
- Micropipetas: 1 mm de largura 4 "de comprimento vidro borosilicato capilares (WPI, TW100-F)
- Cultura da mídia: Normal Amphibian Media (NAM)
- > 10 ações X: 1100 mM NaCl, 20mM KCL, 10 mM Ca (NO 3) 2 4H • 2 O, 1 mM EDTA.
- Autoclave e armazenar a 4 ° C.
- 1 X NAM: Diluir a partir de 10x estoque regulador, com 0,1 mM NaHCO 3 e 0,2 mM Na 3 PO 4.
- Xenopus laevis girinos, estágio 28
Preparação de DNA:
- Prepare plasmídeos de expressão, utilizando protocolos padrão.
- Ressuspender o DNA para uma concentração final de 1 mg / mL em nuclease livre H 2 0.
* Temos tido sucesso com vetores contendo um promotor CMV fortes, como pCS2 + [16]. Para a análise de linhagem, que geralmente incluem DNA de codificação de uma proteína fluorescente verde (GFP pCS2 +) em uma concentração final de 0,1 g / mL. Concentrações [DNA entre 0,1-3 mg / mL também foram testados. Descobrimos que as concentrações abaixo de 0,8 mcg / mL células ineficiente rotulados, enquanto que as concentrações de DNA maior que 2 mg / m &u; l não melhorar a eficiência eletroporação].
Morfolino preparação de oligonucleotídeos:
(Nota:. MOs precisam ser fluoresceinated (3'-carboxifluoresceína modificada) ou carregada)
- Oligonucleotídeos ressuspender morfolino (MOs) (Genetools, www.genetools.com ) a uma concentração de 2 mM em nuclease livre H 2 0.
- Alíquota da solução de reserva de calor a 65 ° C por 5 minutos.
- Diluir a concentração final de 0,5 mM em água livre de nuclease.
* 0.1-1mM MO soluções foram testadas. 0,5 mM soluções MO foram suficientes para eletroporação de muitas células mesenquimais.
Micropipetas
- Prepare micropipetas de vidro borosilicato capilares (1 mm de largura, 4 "de comprimento, WPI não. TW100-F). Use extrator de agulhas para preparar micropipetas com um cone 12/08 mm de comprimento e ponta fina.
- Ponta esmagar ~ mm 2da ponta com a pinça, criando uma ruptura irregulares.
Mídia
- Meio de incubação: Prepare fresco 04/03 normal Amphibian Media (NAM) de 1x estoque. Adicionar 0,025 mg / ml de gentamicina.
- Eletroporação media: como acima, com 0,1% benzocaína (Sigma, 06950).
2. Eletroporação
Micropipeta configuração
- Preencha micropipeta com ~ 1 ml solução injectável.
- Micropipeta segura em micromanipulador e anexar a microinjetor (Picospritzer II).
- Micropipeta ângulo de 50 ° a partir da mesa.
- Ajuste a pressão de injeção de 20 PSI.
- Calibrar micropipeta para injetar 30 nl por pulso.
Preparação de girino
- Anestesiar estágio 28 larvas por incubação de Xenopus na mídia eletroporação por 5 minutos.
- Transferência de girino anestesiados em câmara de eletroporação cheia de mídia eletroporação. Embrião posiçãodentro do prazo também para que a cabeça repousa no entroncamento com a face dorsal baixo e de lado ventral exposta. A cabeça deve ser ligeiramente elevada em comparação com a cauda.
- Utilizando uma pinça, gentilmente segura girino bem com em torno de plasticina. (Nota:.. Se o girino não é garantido, pode se contorcer e contato do eletrodo durante a eletroporação Neste caso, descartar o girino como tecidos faciais será severamente danificado)
Eletroporação
- Introduza a ponta micropipeta imediatamente posterior à glândula de cimento e em mesênquima facial.
- Injetar 30 nl solução em mesênquima.
- Retrair micropipeta.
- Alinhar rapidamente dicas eletrodo paralelo à cabeça do embrião (Fig. 3).
- Aplicar 8 50 ms pulsos, 20mV quadrados.
- Retrair eletrodos.
- Utilizando uma pinça cuidadosamente liberação de girinos de bem e transfira para 04/03 NAM, 0.025 gentamicina mg / ml.
- Girinos podem ser incubadas em 04/03 NAM, 0,025 mg / ml overnight, ou mais.
- Embriões tela para eletroporação eficiente por microscopia de fluorescência, após 24 horas.
3. Resultados representativos:
O uso de moléculas fluorescentes permite a triagem de embriões electroporated fácil. A Figura 4 mostra um lote típico de MO electroporated girinos ~ 12, 48 e 96 horas após a eletroporação, incubados a 14,5 ° C. Usando microscopia de fluorescência, MOs podem ser visualizados imediatamente após eletroporação e persistir por vários dias após a eletroporação. Em nossa experiência, a fluorescência é fracamente evidente na fase 46 (~ 5 dias depois). Nas cartilagens, fluorescência diminui drasticamente após o início da diferenciação (~ 42 º), no entanto, MO fluorescência persiste mais fortemente em outros tipos celulares, como a endoderme da faringe. Microscopia de fluorescência mostra que oligonucleotídeos são incorporados em vários tecidos craniofacial, incluindo cartilagem. Oligonucleotídeo fluorescência cmuitas vezes um ser visualizado no tecido de cada lado da cabeça. Este é provavelmente devido a rápida difusão da solução injectável em todo o mesênquima frouxo craniofacial antes de eletroporação.
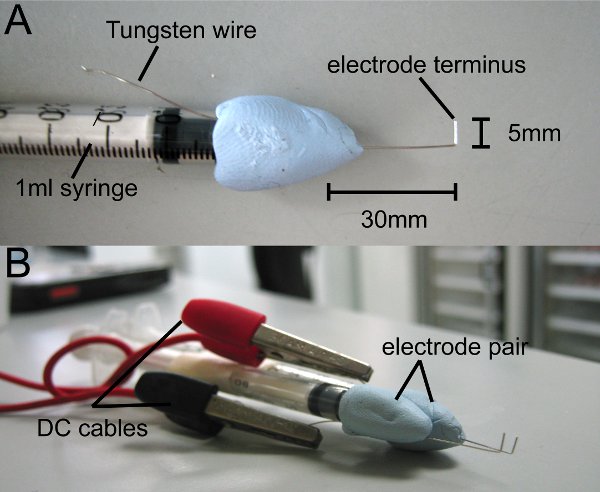
Figura 1 Homemade eletrodos. L-shaped fio de tungstênio é anexado a uma seringa de 1 ml usando non-toxic da argila ou massa de vidraceiro. (A) O término do eletrodo mede 5 mm. (B) Anexar um par de eletrodos, de modo que os términos correm paralelas. Eletrodos são ligados ao gerador de pulsos por cabos DC.

Figura 2 câmara de eletroporação. (A) 90 milímetros prato forrado com plasticina é preenchido com a mídia e uma câmara em forma de T esculpida com uma pinça Não é relojoeiro 5. (B) O lado mais comprido mede 2 mm X 2 milímetros X10 milímetroenquanto as medidas de curto 2 milímetros X 2 mm X 5 mm. A cabeça do embrião repousa no entroncamento, parte ventral para cima.
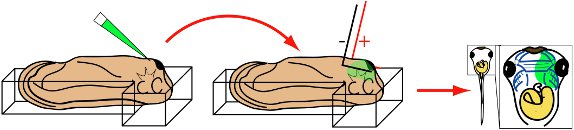
Figura 3 Esquema ilustrando procedimento eletroporação. St. 28 de girinos é colocado na câmara de eletroporação, lado ventral para cima. Micropipeta é inserida em glândula de cimento facial mesênquima subjacente. Injetar. Micropipeta é removido e em forma de L eletrodos são alinhados em paralelo de acompanhamento da cabeça. Aplicar oito de 50 ms, 20 pulsos mV quadrados. Retrair eletrodos. Girinos crescem para estágios desejado. Visualize MOs ou GFP expressão usando microscopia de fluorescência.
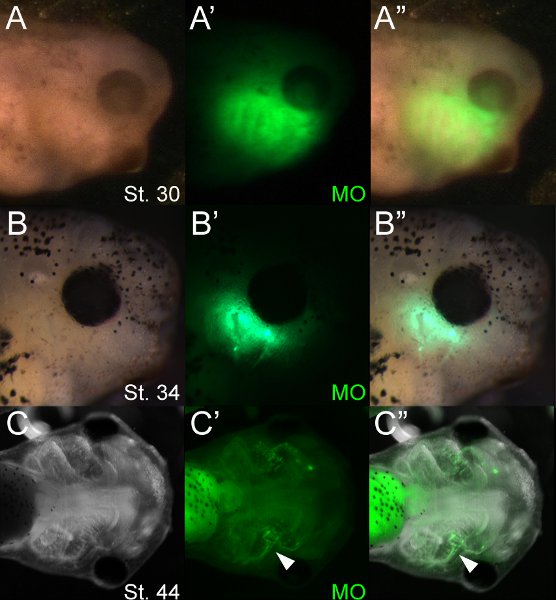
Figura 4 girinos Representante 12 (A), 48 (B), e 96 (C) horas após eletroporação (etapas 30, 34 e 44 respectivamente). (A "-B") Fluorescente MO pode ser visualizado no mesênquima craniofacial em stages 30 e 34. Fluorescência pode ser detectada nas cartilagens na fase 44 (ponta de seta,'c C "). O intestino é altamente autofluorescent.
Discussão
Neste vídeo, demonstramos a viabilidade de eletroporação mediada entrega do gene para o mesênquima facial de Xenopus girinos. Usando essa abordagem, podemos contornar primeiros efeitos no desenvolvimento de manipular a função do gene que nos permite atingir tecidos específicos em momento posterior. Nossos estudos mostram que as populações heterogêneas de células mesenquimais craniofacial pode ser afetado, o que nos permite analisar a linhagem de células electroporated, bem como requisitos de células autônomas para as proteínas de interesse. Combinado com imagens ao vivo, podemos usar essa abordagem para estudar a função do gene, ao longo do tempo, durante o desenvolvimento craniofacial. Esse novo método destaca a rastreabilidade de Xenopus para o estudo da organogênese. Nós antecipamos que este método pode ser amplamente adaptados para estudar a morfogênese e diferenciação de outros tecidos também.
Divulgações
Os autores não têm conflito de interesses.
Agradecimentos
Somos gratos a Nancy Papalopulu e Bonev Boyan de assistência com eletroporação Xenopus. Agradecemos também a Marc Dionne para a leitura crítica, Green Jeremy e John Wallingford para discussões úteis e os membros do laboratório de Liu pelo seu apoio. Este trabalho foi financiado por concessões do BBSRC (BB/E013872/1) e do Wellcome Trust (081880/Z/06/Z) para KJL.
Referências
- Bonev, B., Pisco, A., Papalopulu, N. MicroRNA-9 reveals regional diversity of neural progenitors along the anterior-posterior axis. Dev. Cell. 20, 19-32 (2011).
- Haas, K. Single-cell electroporation for gene transfer in vivo. Neuron. 29, 583-591 (2001).
- Calegari, F. Tissue-specific RNA interference in post-implantation mouse embryos using directional electroporation and whole embryo culture. Differentiation. 72, 92-102 (2004).
- Drinjakovic, J. E3 ligase Nedd4 promotes axon branching by downregulating PTEN. Neuron. 65, 341-357 (2010).
- Falk, J. Electroporation of cDNA/Morpholinos to targeted areas of embryonic CNS in Xenopus. BMC. Dev. Biol. 7, 107-107 (2007).
- Hewapathirane, D. S., Haas, K. Single Cell Electroporation in vivo within the Intact Developing Brain. J. Vis. Exp. (17), e705-e705 (2008).
- Kuriyama, S. Tsukushi controls ectodermal patterning and neural crest specification in Xenopus by direct regulation. of BMP4 and X-delta-1 activity. Development. 133, 75-88 (2006).
- Mende, M., Christophorou, N. A., Streit, A. Specific and effective gene knock-down in early chick embryos using morpholinos but not pRFPRNAi vectors. Mech. Dev. 125, 947-962 (2008).
- Neumann, E. Gene transfer into mouse lyoma cells by electroporation in high electric fields. Embo. J. 1, 841-845 (1982).
- Price, S. R. Regulation of motor neuron pool sorting by differential expression of type II cadherins. Cell. 109, 205-216 (2002).
- Grossin, L. Direct gene transfer into rat articular cartilage by in vivo electroporation. Faseb. J. 17, 829-835 (2003).
- Khoury, M. A comparative study on intra-articular versus systemic gene electrotransfer in experimental arthritis. J. Gene. Med. 8, 1027-1036 (2006).
- Takahashi, D. Down-regulation of cathepsin K in synovium leads to progression of osteoarthritis in rabbits. Arthritis. Rheum. 60, 2372-2380 (2009).
- Sive, H. L., Grainger, R. M., Harland, R. M. . Early Development of Xenopus laevis: A Laboratory Manual. , (2000).
- Wheeler, G. N., Brandli, A. W. Simple vertebrate models for chemical genetics and drug discovery screens: lessons from zebrafish and Xenopus. Dev. Dyn. 238, 1287-1308 (2009).
- Turner, D. L., Weintraub, H. Expression of achaete-scute homolog 3 in Xenopus embryos converts ectodermal cells to a neural fate. Genes. Dev. 8, 1434-1447 (1994).
Erratum
Formal Correction: Erratum: Electroporation of Craniofacial Mesenchyme
Posted by JoVE Editors on 6/28/2013. Citeable Link.
A correction was made to Electroporation of Craniofacial Mesenchyme. There was an incorrect unit used for the voltage.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados