É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Utilização de Nanoestruturas Cristal plasmônicos e Fotônica para Manipulação de Micro-e Nanopartículas melhorada
Neste Artigo
Resumo
Pinças plasmonic e nanoestruturas de cristal fotônico são mostradas para produzir melhorias útil no controle da eficiência e orientação dos opticamente prendendo micro e nano-partículas.
Resumo
Um método para manipular a posição ea orientação das partículas submicrométricas nondestructively seria uma ferramenta incrivelmente útil para a pesquisa biológica básica. Talvez a força mais usado física para conseguir a manipulação de pequenas partículas não-invasiva tem sido dieletroforese (DEP) 1. Entretanto, DEP por conta própria não tem a versatilidade e precisão que são desejados quando da manipulação de células, uma vez que é tradicionalmente feito com eletrodos estacionários. Pinças ópticas, que utilizam um gradiente de campo três dimensional eletromagnética de exercer forças em pequenas partículas, tal versatilidade e precisão desejada. 2 No entanto, uma grande desvantagem desta abordagem é a intensidade da radiação de alta necessário para alcançar a força necessária para prender uma partícula que pode danificar as amostras biológicas 3 A solução que permite captura e classificação com menor intensidade ópticos são optoeletrônicos pinças (OET), mas OET têm limitações com a manipulação fina de pequenas partículas;.. sendo a tecnologia DEP baseada também coloca restrições sobre a propriedade da solução 4 , 5
Este artigo de vídeo irá descrever dois métodos que reduzem a intensidade da radiação necessária para a manipulação óptica de células vivas e também descrevem um método para o controle de orientação. O primeiro método é uma pinça plasmonic que usar um random nanopartículas de ouro array (AUNP) como substrato para a amostra como mostrado na Figura 1. A matriz AUNP converte os fótons incidentes em plasmons de superfície localizada (LSP) que consistem em momentos de dipolo ressonante que irradiam e gerar um campo de radiação modelado com um grande declive na solução celular. Trabalho inicial na superfície prendendo melhor plasmon por Righini et al e nossa modelagem própria têm mostrado os campos gerados pelo substrato plasmonic reduzir a intensidade inicial exigido, aumentando o campo gradiente que armadilhas a partícula. 6,7,8 A abordagem plasmonic permite multa controle de orientação de partículas elipsoidais e células com baixa intensidade óptica por causa da conversão de energia mais eficiente óptica em energia mecânica e um campo de radiação de dipolo-dependente. Estes campos são mostrados na figura 2 e as intensidades baixa armadilhas estão detalhados nas figuras 4 e 5. Os principais problemas com pinças plasmonic são de que o LSP de gerar uma quantidade considerável de calor e as armadilhas é de apenas duas dimensões. Esse calor gera fluxos convectivos e termoforese que pode ser poderoso o suficiente para expelir partículas submicrométricas da armadilha. 9,10 A segunda abordagem que iremos descrever está utilizando nanoestruturas dielétricas periódicas para dispersão de luz incidente de forma muito eficiente em modos de difração, como mostrado na figura 6 11. Idealmente, faria esta estrutura de um material dielétrico para evitar os problemas de aquecimento mesmo experientes com a pinça plasmonic mas em nossa abordagem de alumínio revestido grade de difração é utilizado como uma nanoestrutura dielétrica periódica unidimensional. Embora não seja um semicondutor, não experiência aquecimento significativo e efetivamente preso partículas pequenas armadilhas com intensidades baixa, como mostrado na figura 7. Alinhamento das partículas com o substrato ralar conceitualmente valida a proposição de que um cristal fotônico 2-D pode permitir que a rotação precisa de partículas não esféricas mícron de tamanho. 10 A eficiência destas armadilhas ópticas são aumentadas devido aos campos melhorada produzida pelo nanoestruturas descrito no este papel.
Protocolo
1. Aleatória Au Fabricação Matriz Nanoparticle 8,10,12,14
- A matriz de nanopartículas Au é formada por primeiro criar um modelo que é feito de uma camada densa de forma aleatória adsorvido esferas de látex com diâmetro médio de 454 nm. Isto é conseguido através de evaporação de ouro primeiro em uma lamela de vidro com uma espessura de 20 nm usando o cromo como a camada de adesão.
- A monocamada esfera de poliestireno é então auto-montados, expondo o substrato revestidas de ouro a uma mistura de 1-etil-3-(3-dimetilaminopropil) carbodiimida cloridrato (EDC), látex suspensão esfera e água desionizada.
- O processo de adsorção é permitido para durar cerca de uma hora e as esferas não-absorvidos são lavados com uma quantidade abundante de água.
- A monocamada formada é permitido secar ao ar.
- Finalmente, outro 20 nm de ouro é evaporado sobre a monocamada esfera de látex para formar a matriz de nanopartículas de ouro aleatória.
- Se um SEM está disponível, a matriz AUNP pode ser visto sob a SEM para se parecer com a Figura 1 e um diagrama do processo é mostrado na figura 8.
2. Preparação de amostras biológicas 9,11
- Preparação de amostras para núcleos opticamente captura do mouse célula é mostrado agora.
- Núcleos de células 3T3 rato marcado com corante laranja de acridina foram obtidos a partir do grupo Tewari no Fred Hutchinson Cancer Research Center.
- 10% albumina sérica bovina (BSA) em tampão fosfato salino (PBS) é adicionado ao núcleo das células do mouse em uma concentração de aproximadamente 1: 10 (BSA: núcleos de células de rato). A BSA ajuda a prevenir os núcleos de degola ao substrato.
- Misture a solução utilizando sonicação.
- 5 uL da nossa solução é depositada sobre a lamela matriz de alumínio ralar. É melhor para realizar esta etapa com a grade de alumínio no palco microscópio para que você não tem que transportar a amostra após a solução é depositado.
- Duas pilhas de dois 1 "por um" lamínulas são utilizados para apoiar uma lamela quinta através da qual a amostra é visto.
- Posição da amostra sob o microscópio para visualização.
3. Método para Trapping
- As pinças ópticas são construídas através do envio de 35 mW a laser de hélio neon através de uma Zeiss Axio Imager.D1M equipado com um 17 GFP conjunto de filtros que é modificada para permitir a 633 nm a radiação laser para alcançar a amostra.
- A Zeiss LD CE Epiplan - Neofluar 50x objetivo é utilizado para a imagem do núcleo das células que são cerca de 5 mícrons de diâmetro.
- Após a amostra é colocada no âmbito do objectivo, o foco do microscópio sobre a matriz de nanopartículas de ouro ou grade de difração.
- Traduzir microscópio verticalmente até foco é conseguido sobre os núcleos que você deseja armadilha.
- Posição à vista armadilha do laser sobre a partícula de partícula e deve então manter sua posição na área do laser, mesmo quando a fase é traduzido.
4. Resultados representativos:
O aleatório ouro procedimentos variedade de nanopartículas devem depositar uma monocamada de AUNP do que pode ser visto sob um SEM para parecer com a Figura 1. A força de armadilhas criadas por esses pinças plasmonic pode ser 10-20 vezes a força gerada pela norma pinças ópticas. As intensidades mínimas requeridas pela pinça plasmonic para alcançar o confinamento de partículas são mostrados para as partículas de diversos tamanhos na Figura 4. 9,10 A grade de difração obtidos alinhamento e prendendo com 20 vezes maior do que a eficiência de armadilhas nanopontos ouro e poderia conseguir captura com tão pouco como 17 uW um / 2 (Figura 7) 11.
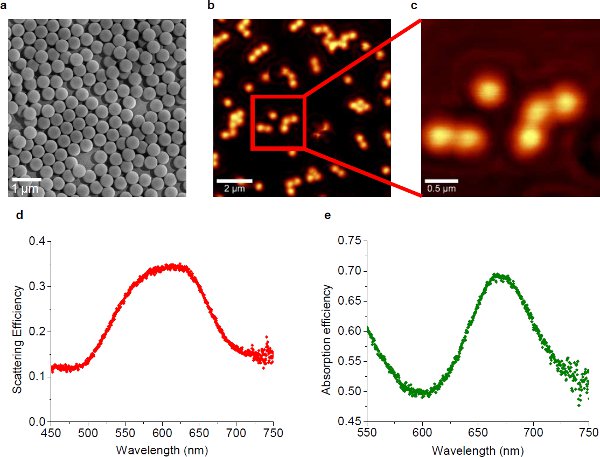
Figura 1 10 (a) micrografia MEV das nanopartículas auto-montagem de ouro. O diâmetro das nanopartículas de ouro individual é de cerca de 450 nm. (B) imagem NSOM do substrato plasmonic onde a distribuição das nanopartículas é esparsa, mostrando a radiação de campo próximo. O comprimento de onda do laser de excitação é 633 nm. (C) exibir uma ampliação alta da área marcada com o quadrado vermelho em (b). (D) eficiência de espectro de espalhamento do substrato plasmonic, mostrando o pico de 624 nm. (E) o espectro de eficiência de absorção do substrato plasmonic, mostrando o pico em 668 nm.
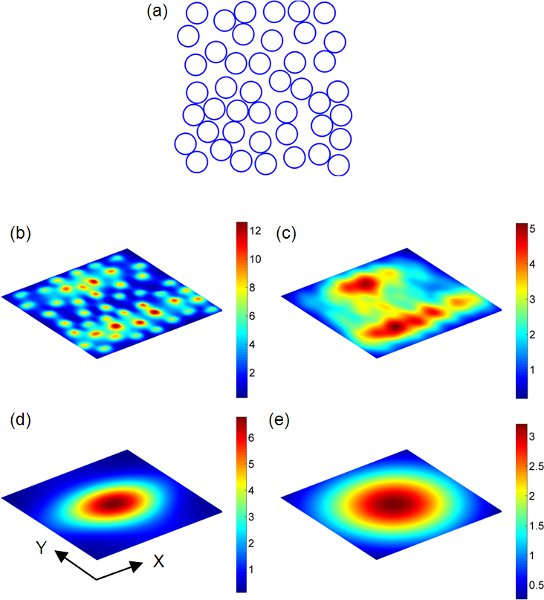
Figura 2 13 (a) Au nanoesferas distribuídos aleatoriamente em um domínio 2D 1 x 1 2 mM. Cada ponto azul representam o centro da nanosphere (a = 60 nm). Distribuições de campo de espalhamento em aviões de observação que são paralelas à matriz nanosphere aleatórios são mostrados em (b) - (e). A matriz de nanoesferas é uniformemente iluminado por uma onda plana no comprimento de onda de 540 nm. O índice de refração do meio envolvente é 1,33. A polarization direção dos pontos de ondas planas ao longo do eixo X (horizontal no (a)). A magnitude do campo elétrico incidente é assumido como sendo um no cálculo. A separação entre o plano de observação ea matriz nanosphere é definido como h. b) h = a. c) h = 2. d) h = λ. e) h = 2λ.
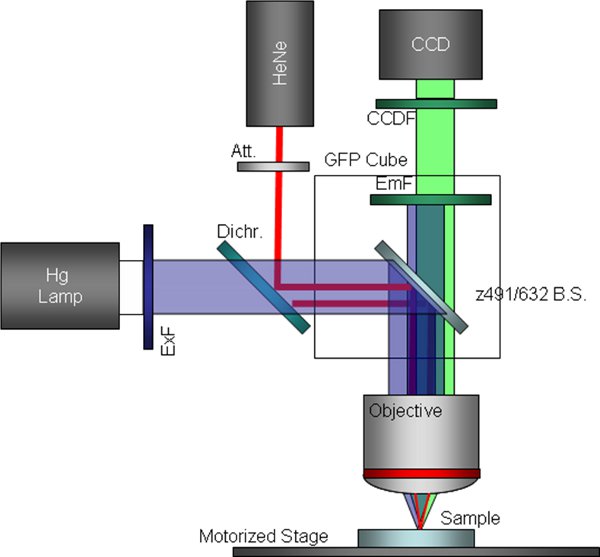
Figura 3 9 esquemática da configuração do microscópio de fluorescência personalizado que inclui um filtro de excitação contornado e um divisor de feixe dicróico substituído. Esta é a configuração utilizada para a captura simultânea e imagens de fluorescência.
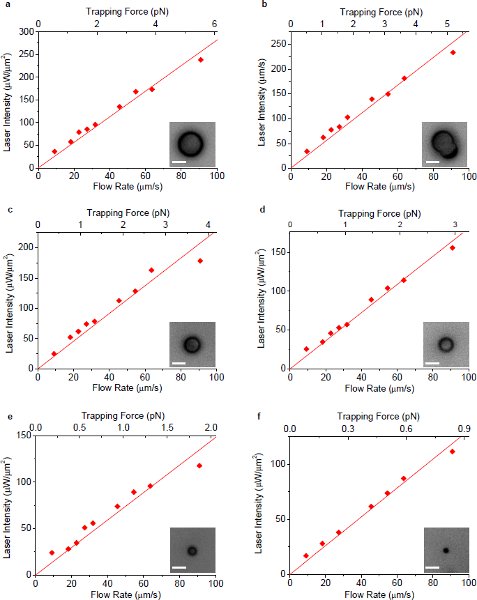
Figura 4 10 A intensidade do laser mínimo para manter a armadilha em função da vazão de fluido envolvente utilizando armadilhas plasmonic. Todas as intensidades ópticas são medidos no plano da amostra sob a objetiva do microscópio. (A) - (f) mostram os resultados da medição de esferas de poliestireno único com diâmetro de 7,3, 6,3 (não-esférico), 5,0, 3,9, 2,5 e 1,1 mM, respectivamente. As inserções mostram as imagens correspondentes microscópicas de partículas. As barras de escala em todas as imagens representam 5 mm de comprimento.
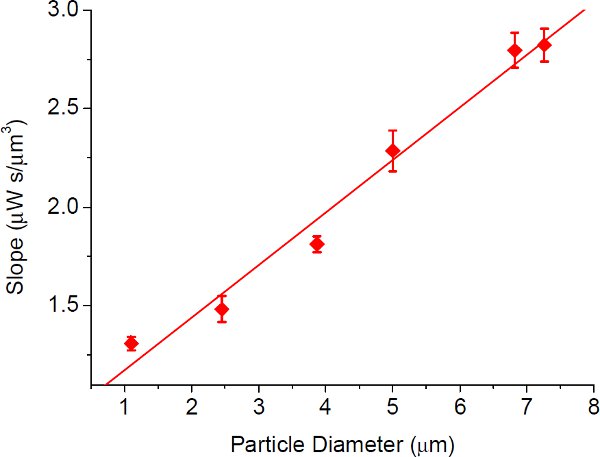
Figura 5 10 A inclinação da linha equipada com origem na figura. 4 versus tamanho de partícula para capturar plasmonic. As barras de erro mostram os desvios-padrão dos ajustes linear. A inclinação da linha ajustada (razão entre o limiar de intensidade óptica ea taxa de fluxo) na fig. 4 tem uma relação aproximadamente linear com o tamanho da partícula, como mostrado na figura, indicando a vantagem de captura plasmonic especialmente para partículas menores.
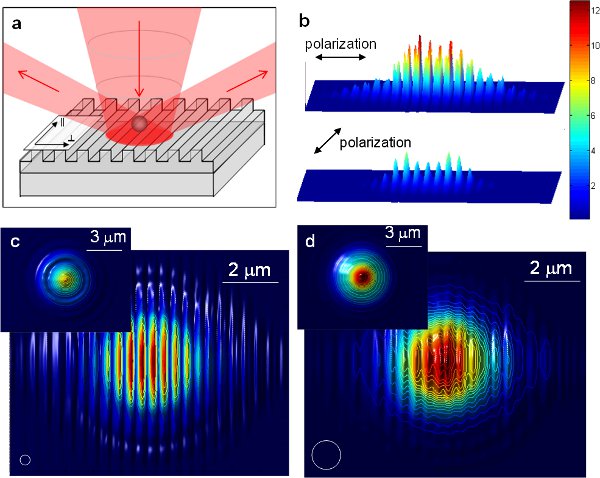
Figura 6 11 (a) Desenho esquemático das armadilhas ópticas melhorada utilizando 1-D nanoestruturas periódicas. O feixe incidente é difratado pela nanoestrutura periódicas em campo distante. (B) distribuição A intensidade de luz com duas polarizações ortogonais nanoestrutura em campo distante. (B) A distribuição da intensidade da luz com duas polarizações ortogonais na superfície de uma grade de alumínio com um período de 417 nm obtido por meio de simulações FDTD. A distribuição é normalizada com a intensidade sobre uma superfície plana de alumínio. (C) e (d) potencial Trapping de partículas diretamente acima da superfície grating contra localização da partícula para (c) de poliestireno de 350 nm de contas e (d) um poliestireno 1 mícron talão. Os círculos brancos ilustrar o tamanho das partículas. Inserções mostram o potencial de captura acima de uma superfície de alumínio plano para o tamanho de partícula mesma comparação. Os valores são normalizados para cada tamanho de partícula. Para todas as figuras de simulação FDTD o campo de visão é de 10 x 8 2 mM.
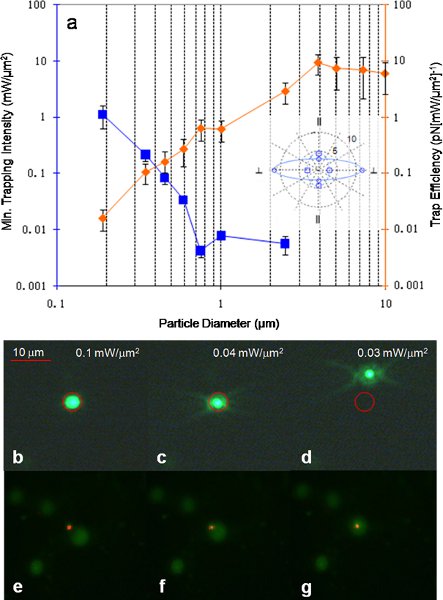
Figura 7 11 (a) eficiência de retenção e intensidade armadilhas mínima medida para esferas de poliestireno de vários tamanhos, com feixe de polarização perpendicular às linhas de grade. O encarte mostra a armadilha de assimetria na eficiência armadilhas para traduzir um 3,87 perpendicular poliestireno hum talão e paralelo às regras da grade. A linha sólida (grande assimetria) é obtido com incide perpendicularmente luz polarizada para a grade ea linha traço (pequena assimetria) é obtido com paralelos incidente luz polarizada para a grade. A unidade está em (pN [mM mW / 2] -1). (B) - (d) demonstração Trapping de um fluorescentes 590 nm de poliestireno talão. O círculo vermelho indica a posição do ponto do laser como a luz do laser era demasiado fraca para ser visto. No início, a partícula é preso dentro do local de maior poder, como o poder é reduzido o movimento browniano das partículas supera a força de armadilhas, permitindo que a partícula de escapar. (E) - (g) demonstração Trapping de um fluorescentes núcleo da célula de câncer de ovário. A intensidade mínima necessária para iniciar captura foi de 16 μW / M 2 obtido usando uma lente objetiva de 20x.
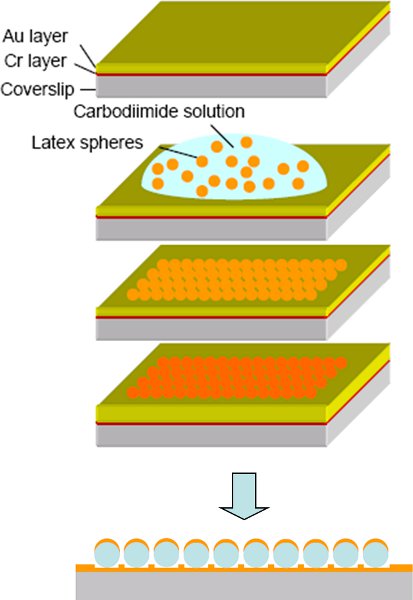
Figura 8 procedimento de Fabricação 14 das nanopartículas tampa em forma de ouro: a evaporação) da camada de Cr e Au fina na lamela de vidro. b) A exposição à suspensão esfera de poliestireno e adsorção de esferas por 1 hora. c) Remoção de esferas não-adsorvidos poliestireno e secagem da superfície. d evaporação) da outra camada de Au no topo das esferas modelo. e) Esquema da matriz de nanopartículas tampa em forma de Au, Au, onde só cobre o lado superior das esferas modelo.
Discussão
A importância destes métodos de captura é que eles diminuem a intensidade óptica necessária para a captura sustentada de algum lugar na ordem de 10 3 μW M / 2 para algum lugar na ordem de 10 μW / M 2. 10,11 As limitações destas técnicas são de que a matriz de nanopartículas de ouro apresenta problemas de aquecimento que deve ser superado. Para superar este problema, uma estrutura de cristal fotônico 2D que é composto de um material dielétrico pode ser usado. Tal estrutura ...
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Gostaríamos também de agradecer a Xiaoyu Miao e Ben Wilson para o desenvolvimento de mais um dos métodos descritos dentro. Este trabalho foi financiado pela National Science Foundation (DBI 0.454.324) e do Instituto Nacional de Saúde (R21 EB005183) e pelo PHS NRSA T32 GM07270 de NIGMS a ECK.
Materiais
| Nome do material | Tipo | Companhia | Número de catálogo | Comentário |
| Axio Imager Microscópio | D1M | Zeiss | D1M | Zeiss Axio Imager.D1M |
| Objetivo microscópio | 50x/0.55 | Zeiss | LD CE Epiplan - Neofluar 50x/0.55 HD DIC | |
| Microscópio Zeiss Câmera | AxioCam MRc | Zeiss | ||
| Helium Neon Laser | 35 mW | Pesquisa Electro-Optics | ||
| Atenuador variável | ND Continuously Variable | ThorLabs | NDC-100C-4M | Para ajustar a intensidade microscópio |
| Filtro Zeiss Set | Filter Set # 17 | Zeiss | 488017-9901-000 | Filter Set # 17 |
| Lâminas de microscopia | 0,5 mm de espessura | VWR | ||
| Núcleos de células 3T3 do mouse | Fred Hutchinson Cancer Research Center | Loja tão frio quanto possível | ||
| Acridina laranja dye | Fred Hutchinson Cancer Research Center | |||
| Albumina de soro bovino | 1-10 de racionamento em PBS | Fred Hutchinson Cancer Research Center | ||
| 454 nm latex esferas de poliestireno | Polysciences, Inc. | |||
| carbodiimida cloridrato (EDC) | 1-etil-3-(3-dimetilaminopropil) | G-Biosciences | BC25-1 | |
| ouro (para a deposição) | ||||
| Grade de difração reflexivo governou | Edmund Optics | |||
| Tampão fosfato salino (PBS) | Fosfato-Buffered Saline Dulbecco (D-PBS) (1X) | Invitrogen | 14190-144 | |
Referências
- Jones, T. B. . Electromechanics of Particles. , (1995).
- Ashkin, A. Optical trapping and manipulation of neutral particles using lasers. Proc. Natl. Acad. Sci. U.S.A. 94, 4853-4853 (1997).
- Neuman, K. C., Chadd, E. H., Liou, G. F., Bergman, K., Block, S. M. Characterization of photodamage to Escherichia coli in optical traps. Biophys. J. 77, 2856-2856 (1999).
- Chiou, P. C., Ohta, A. T., Wu, M. C. Massively parallel manipulation of single cells and microparticles using optical images. Nature. 436, 370-370 (2005).
- Hsu, H. Y., Ohta, A. T., Chiou, P. Y., Jamshidi, A., Nealea, S. L., Wua, M. C. Phototransistor-based optoelectronic tweezers for dynamic cell manipulation in cell culture media. Lab Chip. 10, 165-172 (2010).
- Righini, M., Ghenuche, P. S., Cherukulappurath, V., Myroshnychenko, F. J., Garcia de Abajo, R. Quidant Nano-optical Trapping of Rayleigh Particles Escherichia coli Bacteria with Resonant Optical Antennas. Nano Letters. 9, 3387-3391 (2009).
- Righini, M., Zelenina, A. S., Girard, C., Quidant, R. Parallel and Selective Trapping in a Patterned Plasmonic Landscape. Nature Physics. 3, 477-480 (2007).
- Miao, X., Lin, L. Y. Large dielectrophoresis force and torque induced by localized surface plasmon resonance of a cap-shaped Au nanoparticle array. Opt. Lett. 32, 295-297 (2007).
- Wilson, B. K. . Manipulation of Nanoparticles and Biological Samples through Enhanced Optical Forces [dissertation]. , (2009).
- Miao, X. Y., Wilson, B. K., Pun, S. H., Lin, L. Y. Optical manipulation of micron/submicron sized particles and biomolecules through plasmonics. Optics Exp. 16, 13517-13525 (2008).
- Wilson, B. K., Mentele, T., Bachar, S., Knouf, E., Bendoraite, A., Tewari, M., Pun, S. H., Lin, L. Y. Nanostructure-enhanced laser tweezers for efficient trapping and alignment of particles. Optics. Exp. 18, 16005-16013 (2010).
- Miao, X., Wilson, B. K., Cao, G., Pun, S. H., Lin, L. Y. Trapping and Rotation of Nanowires Assisted by Surface Plasmons. IEEE Journal of Selected Topics in Quantum Electronics. 15, 1515-1520 (2009).
- Miao, X. Y., Lin, L. Y. Trapping and manipulation of biological particles through a plasmonic platform. IEEE Journal of Selected Topics in Quantum Electronics. 13, 1655-1662 (2007).
- Miao, X. . Plasmonics for Micro/Nano Manipulation and Optofluidics [dissertation]. , (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados