É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Modelo do rato de endometriose cirurgicamente induzida pela Auto-transplante de tecido uterino
Neste Artigo
Resumo
Uma descrição da indução cirúrgica de endometriose em camundongos e ratos por auto-transplante de tecido do útero para a cascata arterial do mesentério intestinal.
Resumo
A endometriose é uma doença crônica e dolorosa cuja etiologia permanece desconhecida. Além disso, o tratamento da endometriose pode exigir a remoção laparoscópica de lesões e / ou gestão farmacêutica crônico de dor e os sintomas de infertilidade. O custo associado com endometriose tem sido estimado em 22 bilhões de dólares por ano nos Estados Unidos 1. Para continuar a nossa compreensão dos mecanismos subjacentes a esta doença enigmática, modelos animais têm sido empregados. Primatas espontaneamente desenvolver endometriose e, portanto, modelos de primatas mais semelhantes ao da doença em mulheres. Modelos de roedores, no entanto, são mais rentáveis e prontamente disponíveis 2. O modelo que descrevemos aqui envolve uma transferência autólogo de tecido uterino ao mesentério intestinal (Figura 1) e foi desenvolvido pela primeira vez no rato 3 e mais tarde transferido para o mouse 4. O objetivo do modelo de roedor autólogo de endometriose cirurgicamente induzida é imitarda doença em mulheres. Nós e os outros já haviam demonstrado que o padrão de expressão alterada do gene observada em lesões de endometriose de camundongos ou ratos espelhos que a observada em mulheres com a doença 5,6. Uma vantagem de realizar a cirurgia em ratos é que a abundância de linhagens de camundongos transgênicos disponíveis podem ajudar os pesquisadores a determinar o papel de componentes específicos importantes no estabelecimento e crescimento da endometriose. Um modelo alternativo no qual excisadas humana fragmentos do endométrio são introduzidos no peritônio de ratos imunocomprometidos também é amplamente utilizada, mas é limitado pela falta de um sistema imunológico normal que é pensado para ser importante na endometriose 2,7. Importante, o modelo do rato da endometriose induzida cirurgicamente é um modelo versátil, que tem sido usado para estudar como o sistema imunológico 8, 9,10 hormônios e fatores ambientais afetam 11,12 endometriose, bem como os efeitos da endometriose sobre fertility 13 e 14 a dor.
Protocolo
1. Planejamento para a cirurgia de animais vivos
- Certifique-se que a aprovação apropriada foi recebido para trabalhar com animais de laboratório.
- Camundongos ordem e permitir que pelo menos uma semana de aclimatação ao novo ambiente.
- Camundongos fêmeas alojadas na ausência de exposição a feromônios do sexo masculino pode parar de pedalar, um fenômeno conhecido como o efeito Whitten 15,16. Para manter os ratos ciclismo transferência da cama encharcada de urina masculino para o feminino gaiola a cada cinco dias. Alternativamente, se o open-top gaiolas são usadas, coloque a gaiola do sexo feminino entre duas gaiolas dos machos para manter as fêmeas de bicicleta regularmente.
- Assegurar que os ratos são ciclismo por meio da análise de citologia vaginal diária por pelo menos uma semana antes da cirurgia (Tabela 1) 17.
- Use um lápis de cera para criar oito partições numa lâmina de vidro para que esfregaços vaginais de vários mouses podem ser coletados.
- Lave a vagina com 0,2-0,25 salina normal ou mL de água destilada através de um conta-gotas. Seja sure para colocar o conta-gotas apenas no orifício vaginal, como a estimulação do colo do útero com o conta-gotas pode causar pseudociese. Coloque a lavagem vaginal na lâmina de vidro para análise de tipos de células. Slides podem ser lidos fresco (úmido) ou, alternativamente, fixado por uma série de métodos e examinadas com um microscópio de luz padrão 17.
- Recolher, limpar e esterilizar todos os equipamentos necessários cirúrgico para uma bem sucedida cirurgia asséptica (ver secção Material) 18.
- Prepare a solução de buprenorfina para analgesia em PBS usando técnica estéril para entregar 0,2 mg / kg final. A concentração da solução de buprenorfina deve ser 0,0333 mg / ml assumindo que o adulto médio C57BL / 6 do rato pesa aproximadamente 0,025 kg e um volume de injeção subcutânea de 0,15 ml por mouse. Buprenorfina pode ser preparado com antecedência e armazenado como alíquotas. Note-se que a buprenorfina é uma substância controlada III exigindo uma licença DEA e log inventário detalhado.
- Prepare PBS estéril com penicilina (100 U / ml) e estreptomicina (100 mg / ml).
- Sincronizar os ciclos de cio através da transferência de urina embebida cama do sexo masculino para o feminino gaiolas 72 horas antes da indução 15.
2. Prepare a área cirúrgica para a cirurgia de animais vivos
- Prepare a área cirúrgica, como descrito anteriormente 18.
- Prepare a área de preparação através da definição de tosquiadeiras elétricas, pomada oftálmica, e esfrega cirúrgico.
- Prepare a área cirúrgica, colocando uma almofada de aquecimento de recirculação de água quente na área cirúrgica para manter a temperatura corporal durante toda a cirurgia. Coloque uma almofada impermeável estéril sobre a almofada de aquecimento de recirculação de água quente. Organizar instrumentos cirúrgicos, suturas, estéreis de vidro Placa de Petri, biópsia com punch, gaze esterilizada, clips ferida e ferida aplicador de clipe sobre o campo estéril cirúrgico.
- Prepare área de recuperação, colocando almofadas de recirculação de água quente de aquecimento metade under uma gaiola vazia para permitir ratos para afastar-se do calor, se assim o desejar.
3. Anestesiar e preparar o mouse para a cirurgia
- Registre o peso do mouse e determinar o estágio do cio através da avaliação da citologia vaginal.
- Para indução da anestesia, coloque o mouse em uma câmara de anestesia vazia (gaiola vazia com tampa sólida contendo portal de isoflurano). Ligue isoflurano sistema anestésico não-reinalação e definir o vaporizador para 4% isoflurano (com uma taxa de fluxo de oxigênio de 0,5 a 1 L / min).
- Quando o mouse está sob anestesia mudar o fluxo de isoflurano a um cone (30-60 bainha seringa ml) e do nariz do mouse lugar ea boca no cone na tabela de preparação. Adequada anestesia pode ser mantida com uma menor concentração de isoflurano durante todo o restante da cirurgia (~ 2,5-3,5% de isoflurano). Profundidade adequada de anestesia deve ser determinada por uma resposta negativa ao estímulo pitada dedo do pé.
- Aplicar t pomada oftálmicao evitar o ressecamento dos olhos durante a cirurgia.
- Usando pequenos cortadores elétricos, raspar o local da cirurgia.
- Desinfectar e preparar o local da cirurgia com três golpes alternados de mato clorexidina e álcool 70%.
- Drape animal com um campo estéril.
4. Ligadura uterina
- Faça uma incisão (~ 1 cm) pequena midline usando uma tesoura pequena ou uma lâmina de bisturi terminando 0,5-1,0 cm rostral à abertura vaginal.
- Inserir uma tesoura fechada para a abertura de tal forma que as lâminas são entre a parede do corpo e da parede abdominal. Suavemente blunt dissecar a área ao redor da incisão por lentamente abrindo e fechando a tesoura de tal forma que a parede abdominal é suficientemente destacada da pele. Restantes aderências visível entre a parede abdominal e pele ao redor do local da incisão pode ser cuidadosamente cortada. Falha em adequadamente blunt dissecar o local da incisão fará fechamento da parede abdominal mais difícil.
- F usando pequenosorceps, gentilmente localizar o corno uterino. O útero é dorsal ao intestino, que é o que você verá ao primeiro entrar no local da incisão. Em alguns casos é mais fácil localizar primeiro o ovário ea almofada de gordura associado ovário. Gentilmente puxe o corno uterino e deslize uma pinça aberta debaixo dela, para servir como uma válvula. Se desejar, nota a aparência dos ovários e do útero neste momento para obter informações adicionais sobre o estágio na indução do estro (Tabela 1).
- Deslize suavemente duas peças 6-8 5-0 cm de sutura de seda preto trançado (sem agulha) debaixo do chifre esticada uterina.
- Ligadura segura o chifre na junção útero-tubual (apenas caudal nas trompas de falópio) e na junção útero-cervical (apenas rostral para o colo do útero), usando um nó quadrado em cada localidade. Deixe as pontas da sutura para o momento.
- Cortar a secção do corno uterino entre as duas ligaduras e colocar o tecido em um vidro esterilizado Petri prato ContaIning ~ 100 mL de PBS contendo penicilina (100 U / ml) e estreptomicina (100 mg / ml). Corte as pontas do fio de seda passado. Se a sutura se soltar ou houver sangramento, procure o coto e gravata outro nó.
5. Prepare implantes de endometriose do útero extirpado
- Enquanto o útero extirpado está sendo manipulado, cobrir o abdome com gaze estéril e manter a hidratação com PBS estéril contendo penicilina e estreptomicina, conforme necessário.
- Tira o chifre retirado do útero de gordura.
- Se desejar, pesar o chifre retirado do útero.
- Abra o corno uterino através da inserção de uma lâmina de tesoura pequena (14 comprimento da lâmina mm) para a luz e deslizando a tesoura para baixo o corno uterino, mantendo o chifre com uma pinça.
- Na placa de Petri de vidro, use de 2 mm biópsia com punch para cortar três implantes igual porte.
6. Sutura implantes de endometriose na cavidade peritoneal
- Steril lugargaze e imediatamente acima do local da incisão e completamente molhado com PBS estéril contendo penicilina e estreptomicina.
- Com pequenas, pinça alisa suavemente encontrar o ceco e mover rostralmente ao longo do intestino delgado. Puxe uma seção (4-5 cm) do intestino pequeno que é pelo menos duas artérias longe do ceco e organizá-lo como um fã sobre o pré-gaze molhada para que a cascata arterial do mesentério intestinal é claramente visível. Certifique-se de manter a umidade do intestino em todas as vezes com solução salina estéril. Nota: não use uma pinça de dentes de rato durante o manuseio do intestino.
- Use 6-0 ethilon preto com um P-1, 11 mm, 3 / 8 círculo, inverta agulha cortante para sutura gentilmente um implante para uma artéria de aproximadamente 0,5 cm do intestino.
- Nota: O mesentério intestinal é coberta por uma fina camada de peritônio. Tenha o cuidado de fazer um passe limpo por esta camada, enquanto sutura ao redor da artéria. Puxe sutura através devagar e com cuidado, para não rasgar o peritônio ou rupturaa artéria.
- Completa dois nós de um lance cada um, tomando cuidado para não apertar a sutura muito difícil, pois isso pode resultar em perda de fluxo sanguíneo e subsequente necrose do intestino e morte. Guarnição da sutura dentro de 2 mm do implante. Intestinal molhado novamente para continuar a manter a hidratação antes de passar para implante seguinte.
- Movendo em uma direção rostral, puxe a centímetros do intestino próximos 3-4 e gentilmente substituir a parte que já contém um implante. Ignorar uma ou duas artérias do local do implante anterior e sutura do implante seguinte. Repita o procedimento para o implante terceiros.
- Substituir todos os intestinal na cavidade abdominal.
7. Cirurgias Sham
- Sham cirurgias são realizadas usando os mesmos passos como as cirurgias endometriose, exceto que nenhum tecido é suturado ao mesentério intestinal.
- Chifre do consumo uterina esquerda como no passo 4.
- Os implantes de endometriose (passo 5) não estão preparados na cirurgia sham. Oexcisadas corno uterino podem ser descartados ou utilizados para outros fins, se desejado.
- Suturas, mas não tecidos, são colocados cerca de três artérias na cascata arterial do mesentério intestinal como no passo 6.
8. Fechamento da ferida cirúrgica
- Garantir que todos os órgãos são aproximadamente de volta à sua posição anatômica.
- Use 5-0 sutura vicryl revestido em um ponto não-interligadas contínua para fechar a parede abdominal.
- Use 9 clipes ferida milímetros para fechar a pele.
9. Recuperar animais
- Administrar 0,33 mg / ml buprenorfina em 0,15 g do mouse ml/25 via injeção subcutânea de uma dose de 0,2 mg / kg. A buprenorfina é administrada no pós-operatório para evitar uma maior depressão cardiovascular / respiratório que pode prolongar o processo de recuperação.
- Seque suavemente com o mouse kimwipes ou toalhas de papel, se ela ficou molhada durante a cirurgia.
- Coloque o lado ventral para baixo animais na gaiola partially em cima de uma almofada de recirculação de água aquecida até que o animal é recuperado e recuperou decúbito esternal (dentro de cinco minutos como o anestésico inalante rapidamente desaparece).
10. Cuidados pós-operatório
- Camundongos devem ser observados a cada 15 minutos até que eles são capazes de manter decúbito esternal, depois de hora em hora até que recupere o seu comportamento normal após a cirurgia.
- Camundongos normais deve aparecer dentro de 24 horas de cirurgia. Camundongos devem ser monitorados diariamente por sete a dez dias para sinais de recuperação e boa saúde.
- Indicações de que um animal é mal de saúde, dor, ou sofrimento incluem diminuição da actividade, auto-mutilação, a aparência ungroomed, ou postura arqueada.
- Se um animal não parece estar em boa saúde dentro de 24 horas de cirurgia, quer administrar a buprenorfina (0,2 mg / kg) ou eutanásia do animal. Se o animal não melhorar dentro de 8 horas de suplementar a administração da buprenorfina shoul animaisd ser sacrificado como necrose intestinal é provável.
- Remova os grampos ferida 7-10 dias pós-indução.
- Continuar a acompanhar a ciclicidade estral por exame de citologia vaginal para a duração do experimento. Sincronizar os ciclos de estro 72 horas antes da coleta de urina, transferindo-embebida da cama do sexo masculino para o feminino gaiolas como descrito no passo 1.3.
11. Necropsia e excisão de tecido
- O momento da necropsia é dependente da questão de investigação particular e é discutido nos resultados representativos e discussão.
- Euthanize o mouse por asfixia dióxido de carbono.
- Coleta de sangue por punção cardíaca, utilizando uma agulha de calibre 23 em uma seringa 1cc (se desejado).
- Coletar uma mancha da citologia vaginal, como descrito acima para determinar estágio estro no momento da coleta de 17.
- Corte restantes corno uterino no útero-tubária de junção e no colo do útero, remover gordura, peso, e processo comodesejado (ver 11,14 e 11,15).
- Localize as suturas preto ao redor das lesões de endometriose. Fotografia intacta lesões de endometriose, se desejar.
- Dissecar cuidadosamente as adesões em torno das lesões de endometriose com uma tesoura pequena e uma pinça, tomando cuidado para não lance as lesões. Trabalhar rapidamente e com cuidado para evitar a degradação do RNA.
- Medir e registrar o comprimento ea largura das lesões de endometriose com paquímetro.
- Extirpar as lesões de endometriose e coloque sobre uma toalha de papel umedecido com PBS. Remover qualquer tecido não-endometriotic das lesões. Um posto de vidro dissecando microscópio ou lupa pode ser utilizada para auxiliar na dissecção.
- Pesar os três fluidos cheia de lesões de endometriose antes de remover a sutura.
- Remova cuidadosamente a sutura das lesões de endometriose.
- Para histologia, corrigir formalina um fluido cheio lesão de endometriose por duas horas seguidas por três e meia lava minutos PBS e armazenamento final in etanol 70%. Desidratam e parafina embed.
- Lance duas das lesões de endometriose. Pesar estes novamente. Desde cíclica alterações hormonais podem alterar a quantidade de líquido do cisto, o que dá uma medida do peso úmido de tecido-, além do peso do cisto mais o fluido medido em 11,10.
- RNA para isolamento e estudos de expressão gênica, imediatamente homogeneizar uma das lesões de endometriose lanced (ou ~ 20 mg de tecido uterino) em solução de lise de ligação e armazenar a -80 ° C para o isolamento do RNA futuro com o kit RNAqueous (Ambion) ou outro método como desejado.
- Para o isolamento futuro da RNA, DNA ou proteína, imediatamente snap-congelar a lesão lanced segundo endometriotic (ou ~ 20 mg tecido uterino) em nitrogênio líquido e armazenamento a -80 ° C.
Resultados representante
Lesões de endometriose no modelo do rato da endometriose induzida cirurgicamente morfológica e histologicamente semelhantes aos observados emmulheres. Análise histológica da endometriose em mulheres e do modelo do mouse indica que as lesões de endometriose contêm glândulas endometriais e estroma (Figura 2A). Lesões de endometriose em ratos também contêm acúmulo de hemossiderina em macrófagos, que são uma característica comum de endometriose em mulheres (Figura 2B) 19.
Lesões de endometriose retirados de ratos três dias pós-indução parecem inflamadas e hemorrágico (Figura 3A). Após 2-4 semanas de lesões de endometriose crescimento no modelo do rato são: cisto-como fluido, repleto e rodeado por aderências peritoniais (Figuras 3B e 3C). Comparado com o peso na indução de lesão, o fluido lesões foram preenchidas 306% e 862% maiores em um e dois meses pós-indução e lesões lanced foram 51% e 172% maiores, respectivamente (Figuras 4A e 4B). Temos obtido de fluidos consistentes e cheias lanced pesos lesão de endometriose em um mês pós-indução ao longo de cinco diferentes experimentos (Figura 5). Menos um mês pós-inprodução cheia de fluido (7,44 ± 3,75 mg) e lanced (2,92 ± 1,23 mg), peso lesão de endometriose foram significativamente correlacionados (coeficiente de correlação de Pearson = 0,669, p <0,001).
Idade do mouse não afetou o tamanho da lesão de camundongos entre três e 10 meses de idade. Nem o cheio de líquido ou lanced peso lesão de endometriose em um mês pós-indução foi significativamente correlacionada com a idade do animal (r = -0,136, p = 0,380 e r = -0,063, p = 0,698, respectivamente).
O útero do mouse passa por mudanças em tamanho, retenção de líquidos, a proliferação celular e aparência devido à influência dos hormônios esteróides durante o ciclo estral. Nós comparamos o peso lesão de endometriose com o peso dos restantes chifre intacta uterina de animais em diferentes estágios de estro. Não encontramos uma correlação significativa entre o peso uterino e cheio de líquido ou lanced l endometrioticesion peso em um mês pós-indução (r = -0,046, p = 0,765 e r = 0,232, p = 0,155, respectivamente).
O padrão de expressão gênica observado nas lesões de endometriose de ratos perto espelhos que relatada em mulheres com a doença 5. Por três dias pós-indução genes que regulam a remodelação da matriz extracelular, adesão celular e angiogênese são altamente regulada e muitos desses genes permanecem upregulated através de um mês de crescimento.
Figuras e Tabelas

Figura 1. Indução cirúrgica de endometriose por transferência de tecido autólogo uterina no mouse. O corno uterino é ligada, excisadas, e aberto longitudinalmente para expor o endométrio. Três biópsias de 2 mm 2 são preparados e cada um é suturada a uma artéria na cascata arterial do mesente intestinalry. Por um mês pós-indução das lesões de endometriose são fluidos cheia e rodeada por aderências.
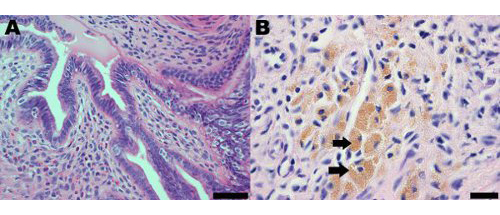
Figura 2 hematoxilina e eosina seção manchada de uma lesão endometrial a partir do modelo do rato de endometriose em um mês pós-indução demonstrando (A) a presença de glândulas endometriais e estroma;. Barra de escala = 50 mm e (B) acúmulo de hemossiderina em macrófagos, alguns dos quais são indicadas por setas; barra de escala = 20 mM.

Figura 3. Lesões de endometriose no modelo do rato após a eutanásia, ou três dias pós-indução (A) ou um mês pós-indução (B e C).
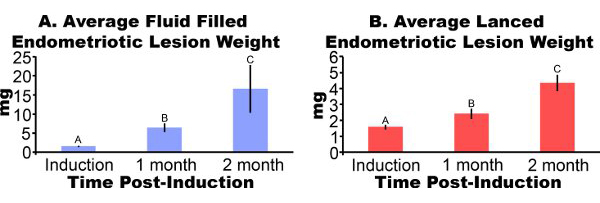
Figura 4. Lesões de endometriose de camundongos induzida cirurgicamente ter endometriosis foram excisadas e pesava menos um ou dois meses pós-indução. Os dados são média ± SEM. Os dados foram log transformados e letras diferentes indicam significância dentro de cada painel, one-way ANOVA seguido pelo menos um lado de Fisher Comparações Mulitple diferença significativa. (A) Cisto gosta, cheio de líquido lesões de endometriose (N = 10, 7 ou 5 para a indução, um mês ou dois meses pós-indução, respectivamente). (B) lanced lesões de endometriose (N = 10, 8 ou 7 para a indução, um mês ou dois meses pós-indução, respectivamente).
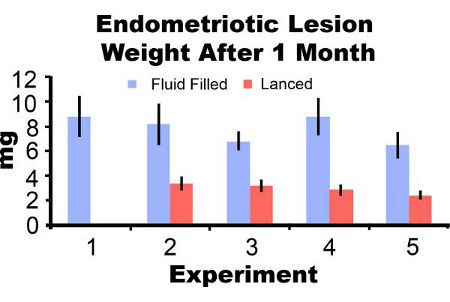
Figura 5. Lesão de endometriose peso molhado com o líquido e lanced menos um mês pós-indução a partir de cinco experimentos separados. Os dados são média ± SEM. Camundongos N = 10, 6, 8, 7 e 7 para fluido lesões preenchido e 0, 7, 10, 8, e 8 para lesões lanced no experimento 1, 2, 3, 4 e 5, respectivamente.

Tabela 1. Observação de estro Stage por citologia vaginal e aparência visual de ovários e útero e de indução.
Aparecimento de ovário e útero será dependente do tempo. A seguir são baseadas no sacrifício de cerca de 8h00 da manhã de cada dia do ciclo. Além disso, as observações são subjetivos e comparando o ovário e cornos uterinos será uma melhor estimativa de cornos uterinos só. Estas observações são destinados a complementar as informações obtidas a partir de leituras diárias citologia vaginal.

Tabela 2. Comparação de cirurgia em ratos e ratinhos.
Discussão
Existem vários parâmetros críticos que devem ser observadas durante a realização da indução cirúrgica de endometriose em camundongos. Primeiro, a endometriose é uma doença estrogênio dependente e, como tal, esta cirurgia deve ser realizada em animais intactos ou, alternativamente, em animais ovariectomizados suplementado com estrógenos 20. Segundo, suturar as biópsias endometriais para a cascata arterial deve ser realizada com extremo cuidado. Nós descobrimos que o uso de apenas dois nós relati...
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Agradecimentos especiais a Chris Bailey Kassotis e Audrey para a revisão crítica do manuscrito e ao Dr. Scott Korte, Beeman Joseph, Curfman Alison, Kimball Paulo, Neibreggue Bridget, Redel Jacob, Schroder Amy, Steinberg Maija e Winkeler Stacey, o auxílio na otimização deste modelo em nosso laboratório. O financiamento foi fornecido pela Clínica Biodetectives Training Grant (NIH T90) (KEP), University of Missouri Life Sciences Research Graduação Programa de Oportunidades, Pesquisa MU Conselho, Research Board MU subvenções e R21HD056441 NIH (SCN).
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente / equipamentos | Companhia | Número de catálogo | |
| Lápis de cera | Pescador | NC9954135 | |
| Lâmina de vidro | Pescador | 12-550-433 | |
| Conta-gotas | Pescador | S79383 | |
| Microscópio de luz padrão para avaliar manchas de citologia vaginal | |||
| Buprenorfina HCL c3 (CARJET) 10X1ml | Butler Abastecimento da Saúde Animal | 022891 | |
| Fosfato estéril salina tamponada (PBS) | Gibco | 14040-117 | |
| 10.000 U / ml de penicilina, estreptomicina 10.000 mg / ml em NaCl 0,85% | Hyclone | SV30010 | |
| Isoflurano | AbbottSaúde Animal | 05260-05 | |
| Isoflurano não-reinalação sistema anestésico | |||
| Recirculação almofada de aquecimento de água quente | |||
| 30 bainha seringa ml | Pescador | 14-823-16G | |
| Pó livre luvas estéreis | Fisherbrand | 19020558 | |
| Pomada oftálmica | Pharmaceuticals principais | 10033691 | |
| Pequenas tesouras elétricas | Wahl | 9861-600 | |
| Matagal clorexidina | Pescador | NC9863042 | |
| Etanol 70% | |||
| Campo estéril Polylined | Hospital Descartáveis Busse | 696 | |
| Tamanho 3 bisturi | Pescador | 22-079-657 | |
| Número de 10 lâminas de bisturi | Pescador | 22-079-681 | |
| Pequenas tesouras cirúrgicas | Roboz | RS-5850 | |
| Pequenas dentadas semi-curvada forceps | Roboz | RS-5135 | |
| 5-0 de sutura de seda preta trançada | Ethicon | K870H | |
| Esterilizado pirex de vidro placas de Petri | Corning | 70160-101 | |
| 2 milímetros biópsia com punch | Miltex | 33-31 | |
| Gaze estéril | Kendall | 1806 | |
| 6-0 preto sutura de monofilamento nylon ethilon | Ethicon | 697G | |
| Drivers de agulha (opcional) | Precision Instruments mundo | 500023 | |
| 5-0 undyed trançado revestido vicryl sutura | Ethicon | J490G | |
| 9 milímetros Autoclip ferida clips | Becton Dickinson | 427631 | |
| Autoclip aplicador e removedor | Becton Dickinson | 427630 | |
| Agulha 23G | Becton Dickinson | 305193 | |
| Seringa 1cc | Becton Dickson | 301025 | |
| Estande de vidro 5X de aumento (opcional) | Pescador | 14-648-23 | |
| 10% de formalina tamponada | Pescador | SF100-4 | |
| Calibrador | Roboz | RS-6466 | |
| Processamento / incorporação cassetes | Pescador | 15-197-700A | |
| Almofadas de espuma de biópsia | Pescador | 22-038-222 | |
| Kit de isolamento RNAqueous RNA | Ambion | AM1912 | |
| Nitrogênio líquido | |||
| Microcentrífuga tirar tampa do tubo topo plano | Pescador | 02-681-240 | |
| Ketamina (opcional) | Simga | K4138 | |
| Domitor (cloridrato de medetomidina) (opcional) | Tocris | 2023 | |
| Antisedan (atipamezol) (opcional) | Sigma | A9611 |
Referências
- Simoens, S., Hummelshoj, L., D'Hooghe, T. Endometriosis: cost estimates and methodological perspective. Hum. Reprod. Update. 13, 395-404 (2007).
- Grummer, R. Animal models in endometriosis research. Hum. Reprod. Update. 12, 641-649 (2006).
- Vernon, M. W., Wilson, E. A. Studies on the surgical induction of endometriosis in the rat. Fertil. Steril. 44, 684-694 (1985).
- Cummings, A. M., Metcalf, J. L. Induction of endometriosis in mice: a new model sensitive to estrogen. Reprod. Toxicol. 9, 233-238 (1995).
- Pelch, K. E. Aberrant gene expression profile in a mouse model of endometriosis mirrors that observed in women. Fertil. Steril. 93, 1615-1627 (2010).
- Flores, I. Molecular profiling of experimental endometriosis identified gene expression patterns in common with human disease. Fertil. Steril. 87, 1180-1199 (2007).
- Giudice, L. C., Kao, L. C. Endometriosis. Lancet. 364, 1789-1799 (2004).
- Lin, Y. J., Lai, L. e. i., Y, H., Wing, L. Y. Neutrophils and macrophages promote angiogenesis in the early stage of endometriosis in a mouse model. Endocrinology. 147, 1278-1286 (2006).
- Fang, Z. Intact progesterone receptors are essential to counteract the proliferative effect of estradiol in a genetically engineered mouse model of endometriosis. Fertil. Steril. 82, 673-678 (2004).
- Fang, Z. Genetic or enzymatic disruption of aromatase inhibits the growth of ectopic uterine tissue. J. Clin. Endocrinol. Metab. 87, 3460-3466 (2002).
- Cummings, A. M., Metcalf, J. L., Birnbaum, L. Promotion of endometriosis by 2,3,7,8-tetrachlorodibenzo-p-dioxin in rats and mice: time-dose dependence and species comparison. Toxicol. Appl. Pharmacol. 138, 131-139 (1996).
- Foster, W. G. Morphologic characteristics of endometriosis in the mouse model: application to toxicology. Can. J. Physiol. Pharmacol. 75, 1188-1196 (1997).
- Cummings, A. M., Metcalf, J. L. Effect of surgically induced endometriosis on pregnancy and effect of pregnancy and lactation on endometriosis in mice. Proc. Soc. Exp. Biol. Med. 212, 332-337 (1996).
- Lu, Y., Nie, J., Liu, X., Zheng, Y., Guo, S. W. Trichostatin A, a histone deacetylase inhibitor, reduces lesion growth and hyperalgesia in experimentally induced endometriosis in mice. Hum. Reprod. 25, 1014-1025 (2010).
- Whitten, W. K. Modification of the oestrous cycle of the mouse by external stimuli associated with the male. J. Endocrinol. 13, 399-404 (1956).
- Whitten, W. K., Bronson, F. H., Greenstein, J. A. Estrus-inducing pheromone of male mice: transport by movement of air. Science. 161, 584-585 (1968).
- Goldman, J. M., Murr, A. S., Cooper, R. L. The rodent estrous cycle: characterization of vaginal cytology and its utility in toxicological studies. Birth. Defects. Res. B. Dev. Reprod. Toxicol. 80, 84-97 (2007).
- Pritchett-Corning, K. R., Mulder, G. B., Luo, Y., White, W. J. Principles of Rodent Surgery for the New Surgeon. J. Vis. Exp. (47), e2586-e2586 (2011).
- Moen, M. H., Halvorsen, T. B. Histologic confirmation of endometriosis in different peritoneal lesions. Acta. Obstet. Gynecol. Scand. 71, 337-342 (1992).
- Cummings, A. M. Methoxychlor as a model for environmental estrogens. Crit. Rev. Toxicol. 27, 367-379 (1997).
- Fowler, R. E., Edwards, R. G. Induction of superovulation and pregnancy in mature mice by gonadotrophins. J. Endocrinol. 15, 374-384 (1957).
- Wilson, E. D., Zarrow, M. X. Comparison of superovulation in the immature mouse and rat. J. Reprod. Fertil. 3, 148-158 (1962).
- Lee, B., Du, H., Taylor, H. S. Experimental murine endometriosis induces DNA methylation and altered gene expression in eutopic endometrium. Biol. Reprod. 80, 79-85 (2009).
- Somigliana, E. Endometrial ability to implant in ectopic sites can be prevented by interleukin-12 in a murine model of endometriosis. Hum. Reprod. 14, 2944-2950 (1999).
- Hirata, T. Development of an experimental model of endometriosis using mice that ubiquitously express green fluorescent protein. Hum. Reprod. 20, 2092-2096 (2005).
- Story, L., Kennedy, S. Animal studies in endometriosis: a review. Ilar. J. 45, 132-138 (2004).
- Cummings, A. M., Hedge, J. M., Birnbaum, L. S. Effect of prenatal exposure to TCDD on the promotion of endometriotic lesion growth by TCDD in adult female rats and mice. Toxicol. Sci. 52, 45-49 (1999).
- Cummings, A. M., Metcalf, J. L. Effects of estrogen, progesterone, and methoxychlor on surgically induced endometriosis in rats. Fundam. Appl. Toxicol. 27, 287-290 (1995).
- Sharpe-Timms, K. L. Endometriotic lesions synthesize and secrete a haptoglobin-like protein. Biol. Reprod. 58, 988-994 (1998).
- Yavuz, E., Oktem, M., Esinler, I., Toru, S. A., Zeyneloglu, H. B. Genistein causes regression of endometriotic implants in the rat model. Fertil. Steril. 88, 1129-1134 (2007).
- Dmitrieva, N. Endocannabinoid involvement in endometriosis. Pain. 151, 703-710 (2010).
- Efstathiou, J. A. Nonsteroidal antiinflammatory drugs differentially suppress endometriosis in a murine model. Fertil. Steril. 83, 171-181 (2005).
- Becker, C. M. Endostatin inhibits the growth of endometriotic lesions but does not affect fertility. Fertil. Steril. 84, 1144-1155 (2005).
- Becker, C. M. Short synthetic endostatin peptides inhibit endothelial migration in vitro and endometriosis in a mouse model. Fertil. Steril. 85, 71-77 (2006).
- Sharpe-Timms, K. L. Using rats as a research model for the study of endometriosis. Ann. N.Y. Acad. Sci. 955, 318-327 (2002).
- Stilley, J. A., Woods-Marshall, R., Sutovsky, M., Sutovsky, P., Sharpe-Timms, K. L. Reduced Fecundity in Female Rats with Surgically Induced Endometriosis and in Their Daughters: A Potential Role for Tissue Inhibitors of Metalloproteinase 1. Biol. Reprod. 80, (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados