Method Article
Implantação intracraniana com 3D subseqüentes In Vivo Bioluminescent imagem de Gliomas murino
Neste Artigo
Resumo
Implantação intracraniana de GL261 células em camundongos C57BL / 6 produz gliomas malignos que recapitulam muitas das características de glioblastoma multiforme humano. Usamos GL261 células expressando estavelmente luciferase para nos permitir usar In vivo Imagem para acompanhar a progressão do tumor. A cirurgia e 3D In vivo Imagens são demonstradas.
Resumo
O mouse glioma 261 (GL261) é reconhecido como um sistema modelo in vivo que recapitula muitas das características de glioblastoma multiforme humano (GBM). A linhagem de células foi originalmente induzida pela injeção intracraniana de 3-metil-cholantrene em uma linhagem C57BL / 6 do mouse singeneicos 1 e, portanto, imunologicamente competentes camundongos C57BL / 6 pode ser usado. Enquanto usamos GL261, o protocolo a seguir podem ser usados para a implantação e monitoramento de qualquer modelo de mouse intracraniana tumor. GL261 células foram projetadas para expressar estavelmente firefly luciferase (GL261-luc). Criamos também o mais brilhante linha GL261-luc2 celular por transfecção estável do gene luc2 expressa do promotor CMV. Camundongos C57BL/6-cBrd/cBrd/Cr (variante albina de C57BL / 6) do National Cancer Institute, Frederick, MD foram utilizados para eliminar a atenuação da luz causada por pele negra e pele. Com o uso de C57BL albino / 6 ratos; em imagem in vivo utilizando o espectro IVIS in vivo imo envelhecimento do sistema é possível a partir do dia da implantação (Caliper Life Sciences, Hopkinton, MA). O GL261 e GL261-luc-luc2 linhagens celulares mostraram o mesmo comportamento em vivo como o dos pais GL261 células. Algumas das características compartilhadas histológico presente em GBMS humano e este modelo de camundongo incluem: necrose tumoral, pseudopalisades, neovascularização, invasão, hipercelularidade e inflamação 1.
Antes da implantação animais foram anestesiados com uma injeção intraperitoneal de cetamina (50 mg / kg), xilazina (5 mg / kg) e buprenorfina (0,05 mg / kg), colocado em um aparelho estereotáxico e foi feita uma incisão com um bisturi sobre o linha média do crânio. A burrhole foi feito posterior ao bregma 0,1 milímetros e 2,3 milímetros para a direita da linha média. A agulha foi inserida a uma profundidade de 0,4 milímetros de 3mm e retirado a uma profundidade de 2,6 milímetros. Dois mL de GL261-luc ou GL261-luc2 células (10 7 células / ml) foram infundidos ao longo de três minutos. O burrhole foi fechadacom bonewax ea incisão foi suturada.
Após a implantação estereotáxica as células bioluminescentes são detectáveis a partir do dia da implantação e do tumor podem ser analisadas usando o recurso de reconstrução de imagem 3D do instrumento IVIS Spectrum. Animais recebem uma injeção subcutânea de 150μg luciferina / kg de peso corporal 20 min antes da imagem. Carga tumoral é quantificado usando bioluminescência médio do tumor ao longo do tempo. Tumor-rolamento camundongos foram observados diariamente para avaliar a morbidade e foram sacrificados quando um ou mais dos seguintes sintomas estão presentes: insuficiência letargia, de deambular, postura arqueada, a falta de noivo, resultando em anorexia> perda de 10% do peso. Os tumores eram evidentes em todos os animais em necropsia.
Protocolo
1. Cultura de células
- A linhagem celular GL26 foi obtido a partir da Divisão de Tratamento e Diagnóstico do Câncer (DCTD) National Cancer Institute (NCI), Frederick, MD. Para facilitar a medição quantitativa da taxa de crescimento do tumor GL261 células foram feitas usando o bioluminescentes Lentiphos HT System (Clontech Laboratories, Inc., Mountain View, CA) com o Lenti-X HT Embalagens Mix (Clontech Laboratories, Inc.) eo FUW- GL plasmídeo (a generosa doação do laboratório de JB Rubin, MD, PhD). As células foram mantidas em meio Dulbecco Modificado de Águia (DMEM) com 10% de tetraciclina sem soro fetal bovino (FCS; Clontech Laboratories, Inc.). GL261 células também foram estavelmente transfectadas com o gene de codificação luc2 usando o pGL4.51 [luc2 / CMV / Neo] condições vector (Promega Corp, Madison, WI) e FuGENE Reagente Transfection 6 (Roche Applied Science, Indianapolis, IN) seguir especificado pelo o fabricante. O gene luc2 é uma versão otimizada do códon firefly Luciferasi que fornece uma saída de luz significativamente maior do que o gene luc padrão. Transfectants estável foram selecionados e mantidos em meios DMEM contendo 10% SFB e 100 mcg / ml Geneticin (G418, Invitrogen Corporation, Carlsbad, CA).
- Antes da implantação da cultura de células são colhidas por trypsinzation, lavado uma vez em DMEM sem soro e ressuspenso em DMEM sem soro com uma concentração de 1 x 10 7 células / ml.
2. Cirurgia Setup 2
- Um ambiente estéril é mantida durante toda a cirurgia, incluindo todos os instrumentos cirúrgicos, suprimentos, luvas, cortinas, etc.
- C57BL/6-cBrd/cBrd/Cr dez semanas de idade (C57BL albino / 6) os ratos são comprados do National Cancer Institute em Frederick Programa de Produção Animal e utilizado em um peso médio de 20 gramas (NCI, Frederick, MD).
- Os animais são anestesiados por injeção intraperitoneal de xilazina (5 mg / kg), ketamina (50 mg / kg) e buprenorfina (0,05 mg / kg). Parapinch e é feito para garantir que o animal é anestesiado adequadamente antes da cirurgia é iniciada. Movimento (mesmo que pequena) de qualquer parte do animal é uma indicação de uma redução do nível de anestesia. Animal é imediatamente dado um adicional de 3,3 xilazina mg / kg e 26,6 ketamina mg / kg. Temperatura do corpo é mantido usando uma lâmpada e compressas estéreis cobrindo o corpo.
- Uma vez que o animal esteja devidamente anestesiado, eles são colocados sobre a cama amortecida do headframe estereotáxica (Modelo 900 de Pequenos Animais estereotáxica, David Kopf Instruments) [Figura 1].
- Uma pequena quantidade (1 / 4 de polegada) de AKWA Pomada Oftálmica Lubrificante Lágrimas é aplicado sobre a córnea.
- O animal está garantido no quadro estereotáxico, abrindo a boca do animal (colocando o dedo indicador eo polegar em torno da mandíbula do animal) e deslizando os dentes da frente superior no recuo no quadro estereotáxico. O grampo é apertado para proteger a cabeça do animal para o fone de ouvido certificando-se que thcabeça e está alinhada e os olhos estão centrados, certificando-se no entanto a não exercer força excessiva sobre a cabeça do animal.
- O 2 mangueira é gravada para baixo perto narinas do animal. Fluxo de oxigênio é de 0,5 l / min.
- A parte inferior das costas e da cauda é gravada até a cama estereotáxica tomando cuidado para não comprometer a respiração.
- O local da incisão cirúrgica é raspada. Sticks povidine Iodo-Swab são usados para lavar a área entre os olhos voltando para a área entre as orelhas com iodo, certificando-se o iodo não escorre nos olhos do animal.
- As células são preparadas para o implante imediatamente antes da cirurgia e são periodicamente misturado para garantir que eles não resolvem.
- A 10 mL, 50 mm Instrumento de precisão Mundial (WPI), Sarasota, FL, 26 seringa com agulha chanfrada é carregado com o inóculo celular. Se as células parecem ser aglutinados, pode ser necessário para recarregar a seringa.
- A seringa 10 ml é então colocado no Ultram UMP3-1icroPump micro injector (WPI, Sarasota, FL).
3. Implantação intracraniana 2
- A incisão na pele é feita usando um tamanho de 15 lâmina de bisturi e pinças dentadas. Uma incisão é feita 10-15 milímetros longitudinalmente a partir de entre os olhos do animal, em direção as orelhas do animal expor o bregma (junção das suturas sagital e coronal, na parte superior do crânio). Certifique-se de identificar corretamente o bregma para ele pode ser facilmente confundido com a área do seio que é distal ao bregma [Figura 2].
- Depois que o animal é sedado ele recebe uma injeção intra-incisional de 0,25% (2,5 mg / ml) de bupivacaína.
- A burrhole é feita 0,1 milímetros posterior ao bregma e 2,3 milímetros para a direita da linha média por lentamente torcendo um calibre 16 1 ½ polegadas de agulha com a mão, aplicando pouca pressão para a agulha, enquanto torcer até o crânio é penetrada eo cérebro está exposto.
- A agulha da seringa é movida para baixo para a posição usando o ste microdrivetitular seringa reotactic até que apenas toca a superfície do cérebro. A partir desta posição, a agulha é avançada no cérebro a uma profundidade de 3 mm e mantido no lugar por 3 minutos.
- A agulha é retirada 0,4 milímetro a uma profundidade total de 2,6 mm abaixo da superfície do cérebro, criando uma pequena bolsa onde as células estão a ser infundido. É opcional a este ponto para obter uma imagem de raios-X da agulha no animal para garantir a colocação correta e profundidade.
- A suspensão de células é administrada durante três minutos usando o injector micro ajustado para um volume de 2.000 nL (2 mL), com uma taxa de perfusão de 667 nL / minuto.
- A agulha é deixada no local por 2 minutos para evitar fugas do local de infusão.
- A agulha é retirada lentamente completamente.
- O burrhole é preenchido com cera de osso através de um dissector Penfield.
- A incisão é suturada com um 4-0 (1,5 métrico) de sutura vicryl certificando-se sem grandes lacunas são deixadas na pele. Vicryl é um material de sutura que se dissolvems, e, portanto, as suturas não precisam ser removidos quando a incisão é curado.
- Após a cirurgia os animais são colocados em uma gaiola sob uma lâmpada de aquecimento que é colocada na altura exigida para aquecer a superfície do fundo da gaiola a 30 ° C. Quando os animais são totalmente acordado (a julgar pelo movimento normal na gaiola) são devolvidos ao ambiente do grupo. Ibuprofeno oral é adicionado à água, por cinco dias no pós-operatório. 100 mg de ibuprofeno crianças (100mg/5ml) é adicionado a uma garrafa de 473 ml de água padrão de roedores. Os animais são observados diariamente e fotografada e pesados a cada 3 dias. Duas semanas de observação pós-implantação é aumentada para duas vezes por dia. Os animais são sacrificados quando mostram sinais de declínio da saúde que inclui postura encurvada, mobilidade reduzida e perda de peso visível do corpo (≥ 20%). Estes sintomas são uma resposta publicada ao tumor e reproduzível aparecem aproximadamente 1 dia antes da morte devido ao tumor.
4. In vivo 3
- Iniciar o [imagem viva] software.
- O IVIS Imaging System é inicializado, clicando no [Inicializar Sistema IVIS] botão no lado inferior direito do painel de controle.
- Selecione [Luminescent] Modo de imagem no lado superior esquerdo do painel de controle.
- Para determinar o tempo ideal de imagem após a injeção de um estudo cinético luciferina é necessário [Figura 3]. Esta descrição é para firefly luciferase;
- Injetar 10μl / g peso corporal de D-luciferina firefly (15mg/ml em PBS; Caliper Life Sciences Catálogo XR-1001 ou um produto similar de outro fornecedor) para o animal, como descrito abaixo.
- Espere 3 minutos, e depois anestesiar o mouse, colocando-o na câmara de anestesia de gás (2% de gás isoflurano em O 2).
- Desligue a anestesia de gás para a câmara e abrir a válvula de anestesia e do vácuo ao colector IVIS. Colocar imediatamente o animal sedadosobre a plataforma de imagem de temperatura controlada, certificando-se narina dos camundongos é devidamente colocado no coletor de anestesia de gás. A primeira imagem deve ser tomado cerca de 5 minutos após a injeção luciferina. Até 5 animais podem ser visualizados ao mesmo tempo no instrumento IVIS Spectrum. Se menos de 5 animais estão a ser trabalhada, é possível ligar o distribuidor não utilizado (s) para conservar o gás isoflurano.
- Continuar a tirar fotos a cada 3 minutos, criando uma seqüência de até uma hora para gerar uma curva de cinética de expressão luciferina.
- Clique no botão [Setup Sequence] botão no painel de controle.
- O editor de seqüência aparece.
- No painel de controle, especifique as definições para a primeira imagem de bioluminescência na seqüência.
- Nós recomendamos começar com Binning Médio.
- Também recomendamos Auto-exposição para determinar o tempo de exposição ideal.
- Selecione [Atraso] botão no editor de uma seqüênciand especificar um tempo de atraso de 3 minutos entre cada aquisição.
- Clique em [Add] no editor de seqüência. Parâmetros de aquisição são então adicionados à tabela.
- Repita o passo 4 para cada imagem na seqüência.
- Uma vez que a curva é estabelecida, o tempo ideal de imagem pode ser determinada traçando a intensidade do sinal (intensidade) versus tempo. Animais de imagem no momento de maior in vivo fóton contar para obter o sinal mais forte e mais preciso.
- Os primeiros experimentos utilizado injeção (ip) intraperitoneal de luciferina, no entanto, as injeções ip ocasionalmente resultaram em resultados intermitente mostrando pouca ou nenhuma bioluminescência no tumor. Trabalhamos com a hipótese de que a ausência ocasional do sinal aleatório deveu-se à entrega da luciferina para o intestino ou outros órgãos internos. Por isso, começou a via subcutânea (sc) luciferina injeções e viu reprodutibilidade maior imagem [Figura 3].
- Vinteminutos após a injeção sc, os animais são anestesiados, colocando-os em uma câmara com 2% de gás isoflurano em O 2 até que eles não respondem.
- O animal anestesiado (s) são movidos para a câmara de imagem. Pomada oftálmica deve ser usado para o estudo cinético por causa do comprimento da imagem. Não é necessário para os procedimentos de outras imagens, porque eles são de curta duração.
- A imagem é adquirida no binning médio com um tempo de exposição de 5 minutos. A opção de aquisição de automóveis também pode ser usado.
- Se o sinal é saturado e / ou desmaio em binning média, o tempo binning ou exposição pode ser ajustado.
- Os arquivos de programa e os comentários de imagem subseqüentes são salvos no diretório do computador do usuário.
5. Imagem 3D 3
- Clique na guia [Imagem Wizard] na [Setup Sequence] janela do painel de controle.
- Selecione [Bioluminescência] modo de imagem na tela de imagem e iniciar o Assistente de click [Next].
- No "Bioluminescência - DLIT" janela do assistente de imagem, selecione o [Firefly] sonda repórter. A emissão / excitação do espectro selecionados fonte firefly aparecerá com as seis seleções de filtro correspondentes a serem adquiridos.
- A última tela aparecerá com opções padrão que incluem parâmetros de exposição automática e uma aquisição de Campo de configurações padrão Ver C. funcionam muito bem, no entanto, essas configurações podem ser modificadas se necessário.
- Clique em [Next] e da janela do editor de seqüência será preenchida com a seqüência de seis regiões do espectro em 20 nm filtros de largura (560 nm, 580 nm, 600 nm, 620 nm, 640 nm, e 660nm). Pressione [Adquirir Sequence]. O primeiro filtro (560 nm) vai incluir um padrão de luz estruturada usando um galvanômetro laser para estabelecer a topografia da superfície.
- Selecione [Topografia da Superfície] guia na paleta de ferramentas. Suavização da superfície pode ser aplicada a conta, por qualquer ângulo agudo criado durante o processo de reconstrução. Osuavização padrão baixo é recomendado.
- Clique em [Criar] ea caixa de análise de tomografia vai aparecer. Desenhar uma caixa de corte que inclui todo o animal e depois clique em [Next].
- A ferramenta de limite vai aparecer como uma máscara roxa sobre a região selecionada. A máscara deve ser automaticamente configurado para combinar com a fotografia do animal. Se necessário, ajustar o limite da máscara para caber mais adequadamente o contorno do animal.
- Clique em [Finish] e reconstruída a malha irá aparecer. A reconstrução pode ser guardada na aba resultados.
- Na sequência da criação da topografia da superfície do animal, proceder à [DLIT Reconstrução 3D] suspensa sobre a paleta de ferramentas.
- Sob o [Análise] guia selecionar todos os seis comprimentos de onda para executar a reconstrução. Desmarque imagens que rendeu pixels saturados ou contagens abaixo de 600. Deixar as configurações em [Parâmetros] guia como padrão.
- Sob a guia [Propriedades], "Muscle" deve ser listada como a opção padrão paraPropriedades de Tecidos r, e "Firefly" deve ser listado como o espectro da fonte.
- Clique em [Reconstruir] no separador Analisar, ea reconstrução 3D da superfície do animal e da reconstrução correspondente da fonte de sinal deve aparecer [Figura 4].
- Para determinar a localização e intensidade de sinal, selecione o botão Voxels na guia Ferramentas de 3D da paleta de ferramentas.
- Desenhar um quadrado em torno de todos os voxels exibidos e as medições de fluxo total é mostrado na parte inferior da guia volume.
- Clique em [Centro de Massa] para identificar a localização do sinal da voxels selecionado. Coronal, sagital e fatias transaxial do animal vai aparecer e usando o [Display Cursor Medida] a distância da superfície do animal para o centro voxel pode ser medido.
- Por favor, consulte o Manual do Usuário do Software Vivendo imagem para obter mais informações sobre o co-registro de atlas de órgãos e outros recursos avançados.
6. Um dos dadosNÁLISE 3
- Depois que a imagem é adquirida e salvo, acessar o arquivo do programa, clicando no botão [Procurar] e selecionando o arquivo.
- As informações da imagem pode ser encontrado em [View] → [Informações da imagem].
- A intensidade do sinal podem ser quantificados, selecionando o botão Região de Interesse (ROI) [ROI Tools]. Verifique se a imagem é analisada sob o modo [Photon], selecionando "Photon" na lista drop-down no canto superior esquerdo do painel de controle de imagem.
- Selecione o [Medida ROI] botão do "tipo" drop-down list. Selecione a forma ROI de interesse; opções incluem Circle, Square, e ou Grade. Cobrir todas as áreas de intensidade na imagem adquirida.
- A posição ROI é definido arrastando a seleção de forma ROI para a região que contém o sinal bioluminescente.
- A intensidade do sinal do ROI é calculado clicando no botão [Medida] botão. A etiqueta exibe a intensidade ROI. ROI pode ser gerida e salvo using o software imagem viva.
7. Resultados representativos:
Implantação de células de sucesso é evidente quando as células implantadas são detectáveis usando o espectro IVIS no dia da cirurgia. Ambos GL261 e GL261-luc-luc2 células são detectáveis, no entanto, o gene luc2 irá fornecer um maior nível de bioluminescência [Figura 5]. Imagens tiradas logo após o implante pode ter não-específicos de sinalização nas patas do animal e do nariz, que deve ser desconsiderada como pano de fundo. Sinal situado no local de implantação é real e que o sinal vai aumentar com o tempo [Figura 6]. O declínio na intensidade do sinal no dia 6 é reproduzível e, provavelmente, devido à perda de tumor levar por algumas das células implantadas. Medidas quantitativas de carga tumoral são reprodutíveis em que eles devem subir de forma constante até que o animal finalmente sucumbe à doença. No entanto, as curvas de crescimento dependerá em grande parte do estado de células implantadas, ou var e menores inevitável ESPONSABILIDADE no procedimento de implante. Nosso laboratório optou por animais implantados imagem a cada três dias.
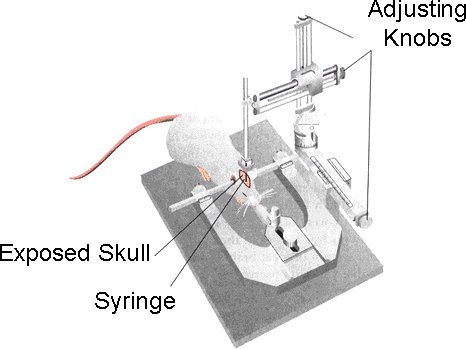
Figura 1. Após o mouse está devidamente anestesiado, ele é colocado no quadro estereotáxico. O cabeça de rato está protegido usando a braçadeira de boca.

Figura 2. Depois que a pele é aberto os principais marcos anatômicos são identificados, inclusive incluir o bregma, as suturas coronal e sagital. O burrhole é feita 2,3 milímetro à direita do bregma pela lentamente torcendo um calibre 16 1 ½ polegadas, com agulha de uma pequena quantidade de pressão até que o crânio é penetrada eo cérebro está exposto.
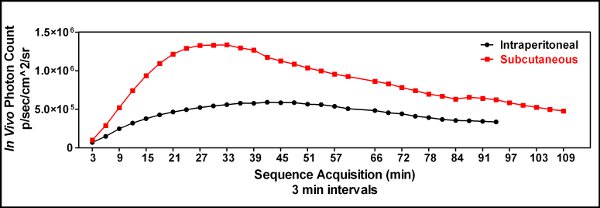
Figura 3. Uma comparação cinética do subcutâneo (iles/ftp_upload/3403/3403fig3_1.jpg "alt =" Figure3.1 "/>) versus intraperitoneal (  ) Luciferina injeção foi realizada para demonstrar a utilidade de uma injeção subcutânea luciferina e identificar o momento ideal para a imagem da administração luciferina seguinte. Três minutos após a luciferina foi injetado o mouse estava sedado, colocada no instrumento Spectrum IVIS e fotografada a cada 3 minutos até uma hora e cada 6 minutos depois que para gerar uma curva de cinética de bioluminescência. Isto demonstrou que a via subcutânea de administração luciferina foi superior a uma injeção intraperitoneal em nossas mãos, e que o tempo ideal para a imagem dos animais foi de aproximadamente 25 minutos após a injeção luciferina quando GL261-luc células foram usadas.
) Luciferina injeção foi realizada para demonstrar a utilidade de uma injeção subcutânea luciferina e identificar o momento ideal para a imagem da administração luciferina seguinte. Três minutos após a luciferina foi injetado o mouse estava sedado, colocada no instrumento Spectrum IVIS e fotografada a cada 3 minutos até uma hora e cada 6 minutos depois que para gerar uma curva de cinética de bioluminescência. Isto demonstrou que a via subcutânea de administração luciferina foi superior a uma injeção intraperitoneal em nossas mãos, e que o tempo ideal para a imagem dos animais foi de aproximadamente 25 minutos após a injeção luciferina quando GL261-luc células foram usadas.
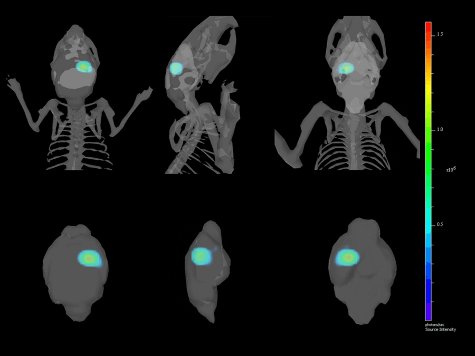
Figura 4. Várias visões de um reconst 3-DimensionalGuliForum da implantação intracraniana de GL261-luc2 células co-registradas com o esqueleto do rato e do cérebro.
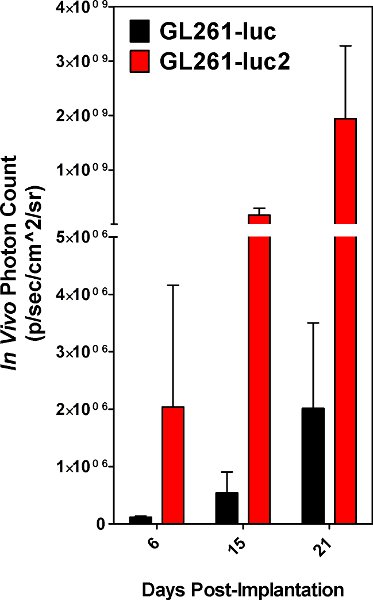
Figura 5. Photon contagens obtidas de tumores resultantes do GL261-luc células vs GL261-luc2 células. Os resultados são uma média de 5 animais.

Figura 6. Gráfico de GL261-luc crescimento de células tumorais em um albino C57BL / 6 mouse. Bioluminescência foi medido a cada 3 dias e plotados como in vivo contagem de fótons versus dias pós-implantação. Fotografias mostram bioluminescência em momentos diferentes. Coloração é uma indicação de bioluminescência (intensidade pixel) que é em relação ao número de células tumorais (barra de cor é mostrado à direita). Depois que o animal sucumbiu à doença do cérebro foi dissecada e luciferina foi adicionado topicamente para obter a imag ex vivoe mostrado na figura inserida.
Discussão
O inóculo de células é infundida a uma profundidade de 2,6 mm da superfície do cérebro depois de criar uma bolsa de 0,4 mm. Para assegurar a colocação adequada e profundidade da agulha um raio-X pode ser tomada através de um C-Arm ou outro dispositivo de imagem semelhante de raios-X intensificando, no entanto, este é opcional. Complicações da cirurgia podem surgir se o animal não está devidamente sedado, altura em que o animal pode se mover durante a infusão de células. Isto pode causar vazamento de mistura de células ou sangramento da trilha da agulha. Vazamento de células provoca o crescimento de células tumorais ectópica. Também é importante para não perfurar o ventrículo o que pode ser feito se o burrhole medial é feita para o 2,3 mm descritos no protocolo 4. Colocação adequada da propagação agulha e celular foi testada através da infusão de um mouse com 2 mL azul de metileno e dissecando o tecido cerebral para verificar a localização do corante infundida.
Neste protocolo temos utilizado a Spectrum IVIS in vivo imagens de sistema e tele Vivendo software de imagem (v 4.0) projetado para uso com este instrumento. (Caliper Life Sciences). Qualquer comparável in vivo do sistema de imagem e ferramentas de análise de imagem pode ser usada para obter resultados semelhantes. Estes sistemas oferecem algumas vantagens sobre a ressonância tradicional magnética (MRI) para acompanhar o crescimento de um tumor experimental intracraniana. O mais óbvio é o custo relativo dos dois instrumentos - máquinas de ressonância magnética animais são muito mais caros e, normalmente, necessitam dos serviços de um técnico especializado MRI. In vivo de imagens, como o que foi descrito aqui pode ser feito pelo usuário final. Os dados bioluminescência é quantitativa, enquanto quantificação de dados de MRI é demorado e um pouco inexata. Além disso, imagens de ressonância magnética mostram edema e inflamação, além de células tumorais e pode ser difícil separar tumor do efeito do tratamento. Por estas razões a obtenção de medições precisas volumétrica do tumor em crescimento pode ser um desafio. Bioluminescência requer ATP, Portanto somente as células tumorais que vivem contribuir para os dados de tamanho do tumor. Apesar disso, existem algumas vantagens de MRI se uma máquina está disponível. As células não precisam ser rotulados com um marcador bioluminescente para ser visualizado por MRI. A capacidade de visualizar peri-tumoral edema pode ser uma vantagem para alguns protocolos experimentais. A força das duas tecnologias é que o uso de uma não exclui a utilização do outro, portanto os dados podem ser obtidos no crescimento do tumor, bem como a presença de peri-tumoral edema e inflamação do mesmo animal, quando as duas tecnologias estão disponíveis para o pesquisador.
Divulgações
Acesso livre para este artigo é patrocinado pela Caliper Life Sciences.
Agradecimentos
Nós gostaríamos de agradecer o Dr. Joshua B. Rubin pelo dom generoso de os plasmídeos para o sistema de lentivírus, assim como Rao Mahil para sugestão útil na preparação das células GL261-luc.
Agradecemos a Estudantes Apoio à Pesquisa do tumor cerebral (SSBTR), The Barrow Neurological Foundation e da Fundação Wallace, por seu apoio generoso.
Experimentos em animais foram realizados de acordo com as diretrizes e regulamentos estabelecidos pelo Institutional Animal Care e do Comitê Use do Hospital São José e Centro Médico.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente ou fornecimento | Companhia | Número de catálogo | Comentários |
| GL261-luc2 Bioware Ultra | Caliper Life Sciences | GL261-luc2 | |
| Modificado Dulbecco Eagle Medium (DMEM) | Invitrogen | 10313039 | |
| Geneticin (G418) | Gibco (Invitrogen) | 11811-023 | |
| Soro fetal bovino (FCS) | Invitrogen | 26140079 | |
| Fosfato Buffered Saline (PBS) | Invitrogen | 70011044 | |
| Ratos C57BL/6-cBrd/cBrd/Cr | NCI-Frederick | ||
| Lágrimas AKWA Pomada Oftálmica Lubrificante | Akorn Inc | 17478-062-35 | |
| Ketaset (cloridrato de cetamina) | Wyeth | 11570775 | |
| Sedazine (cloridrato de xilazina) | Wyeth | 10031894 | |
| Instrumento estereotáxica Pequenos Animais | Kopf Instruments | 900 | |
| UltraMicroPump com SYS-MICRO4 Controlador | Precision Instruments mundo | UMP3-1 | Se não estiver disponível, é possível para infundir manualmente |
| 10μl seringa com 26 gauge agulha chanfrada | Precision Instruments mundo | SGE010RNS | |
| Adison Pinça | Precision Instruments mundo | 500092 | |
| Penfield Dissector | Codman | 65-1015 | |
| 16g 1 ½ Precision Glide Needle | Beckton, Dickinson and Company (BD) | 305198 | |
| Cabo da lâmina cirúrgica | BD | 371030 | |
| Lâmina tamanho 15 | BD | 371315 | |
| Sutura Vicryl 4-0 | Ethicon | VCP496G | |
| Cera de osso | Medline | DYNJBW25 | |
| Iodo-povidine Sticks Swab | Medline | MD93901 | |
| D-Luciferina sal de potássio | Caliper Life Sciences | 122796 | |
| Forâneo (isoflurano) | Baxter | 1001936060 | |
| OPMI Microscópio Pentero | Carl Zeiss, Inc. | Qualquer microscópio cirúrgico será suficiente | |
| Xenogen Spectrum IVIS com sistema de anestesia opcional | Caliper Life Sciences |
Referências
- Candolfi, M. Intracranial glioblastoma models in preclinical neuro-oncology: neuropathological characterization and tumor progression. J Neurooncol. 85, 133-148 (2007).
- Stafford, P., Abdelwahab, M. G., do, K. i. m., Preul, Y., Rho, M. C., M, J., Scheck, A. C. The ketogenic diet reverses gene expression patterns and redudes reactive oxygen species levels when used as an adjuvant therapy for glioma. Nutr Metab. 7, (2010).
- Caliper Life Sciences, Inc. . Living Image Software Version 4.0. VivoVision Systems. , (2010).
- Paxinos, G. . The Mouse Brain in Stereotaxic Coordinates. , (2001).
- Jouanneau, E., Poujol, D., Gulia, S., Le, M. I., Blay, J. Y., Belin, M. F. Dendritic cells are essential for priming but inefficient for boosting antitumour immune response in an orthotopic murine glioma model. Cancer Immunol Immunother. 55, 254-267 (2006).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados