É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Dois tipos de ensaios para detecção de quimiotaxia Sapo Sperm
Neste Artigo
Resumo
Ovos e os revestimentos extracelular em torno de ovos com freqüência liberação de peptídeos, proteínas e pequenas moléculas que se comunicam com o esperma para guiá-los até o óvulo, promovendo assim a fecundação. Usando o esperma de rã que descrever e comparar duas classes de testes usados para detectar quimiotaxia esperma - ensaios de esperma acumulação e ensaios de monitoramento de esperma.
Resumo
Quimiotaxia de esperma em invertebrados podem ser suficientemente robusto que um pode colocar uma pipeta contendo o peptídeo atraente em uma suspensão de espermatozóides e microscopicamente visualizar acúmulo de esperma em torno da pipeta 1. Quimiotaxia esperma em vertebrados, como sapos, roedores e seres humanos é mais difícil de detectar e exige ensaios quantitativos. Tais ensaios são de dois tipos principais - os ensaios que quantificar o movimento de esperma a uma fonte de chemoattractant, os chamados ensaios de acumulação de esperma, e os ensaios que realmente controlar as trajetórias de natação do esperma individual.
Ensaios de acumulação de espermatozóides são relativamente rápida permitindo dezenas ou centenas de testes a ser feito em um único dia, permitindo assim que as curvas de dose-resposta e cursos tempo para ser realizada de forma relativamente rápida. Estes tipos de ensaios têm sido amplamente utilizado para caracterizar muitos sistemas quimiotaxia bem estabelecida - por exemplo, quimiotaxia de neutrófilos para bacpeptídeos terial e quimiotaxia esperma para fluido folicular. Ensaios de monitoramento de esperma pode ser mais trabalhoso, mas oferecer dados adicionais sobre como chemoattractancts realmente alterar os caminhos que o esperma nadar tomar. Este tipo de ensaio é necessário para demonstrar a orientação do movimento de esperma em relação ao eixo gradiente chemoattrractant e visualizar curvas características ou mudanças de orientação que trazem os espermatozóides mais próximos do ovo.
Aqui descrevemos os métodos utilizados para cada um desses dois tipos de ensaios. O ensaio de acumulação de esperma utilizado é chamado de "duas câmaras" ensaio. Espermatozóides dos anfíbios são colocados em uma inserção de placa de cultura de tecidos com um piso de filtro de policarbonato com poros de diâmetro 12 mM. Pastilhas com os espermatozóides são colocados em poços de cultura de tecidos placa contendo tampão e um chemoatttractant cuidadosamente pipetado para o fundo poço onde o piso encontra a parede (ver Fig. 1.). Após a incubação, a inserção superior contendo o reservatório de esperma é cuidadosamente removed, esperma e na câmara de fundo que passaram através da membrana são removidos, peletizada e depois contadas por hemocitômetro ou citômetro de fluxo.
O ensaio de rastreamento de esperma utiliza uma câmara de Zigmond originalmente desenvolvido para a observação de quimiotaxia de neutrófilos e modificados para a observação de espermatozóides por Giojalas e colegas de trabalho 2,3. A câmara consiste de uma lâmina de vidro de espessura em que duas calhas verticais foram usinadas. Estes são separados por uma uma plataforma de observação mm de largura. Após a aplicação de um espermatozóide tampa de vidro, são carregados em uma calha, o agente chemoattractant para o outro eo movimento dos espermatozóides individuais visualizados por microscopia de vídeo. Imagens de vídeo são então analisados usando o software para identificar os movimentos em duas dimensões de células no plano xy como uma função do tempo (conjuntos XYT de dados) que formam a trajetória de cada espermatozóide.
Protocolo
1. Materiais e buffers usados
- Tampão de Ringer oócito (1,5 x OR2) contém 124 mM NaCl, 3,75 mM KCl, 1,5 mM CaCl 2, 1,5 mM MgCl 2, 1,5 mM Na 2 HPO 4, 10 mM Hepes, pH 7,8. Tampão de fertilização (F-1) contém 41,25 mM NaCl, 1,25 mM KCl, 0,25 mM CaCl 2, 0,06 mM MgCl 2, 0,5 mM Na 2 HPO 4, 2,5 mM Hepes, pH 7.8.
- Xenopus laevis água ovo é preparado de acordo com Sugiyama et al. 4. Brevemente descritos, recentemente gerou ovos de rã jellied são rodadas em um pequeno volume de F-1 buffer para 30 minutos eo meio condicionado removidas por micropipeta. Este meio, denominado "água de ovo", também pode ser usado para preparar purificada allurin, o chemoattractant primário neste extrato de geléia. Os espermatozóides são obtidos a partir criados comercialmente Xenopus laevis ou tropicalis Xenopus.
- Veja a Tabela de Materiais para itens específicos necessários em tele ensaio.
2. Um ensaio de duas câmaras para quimiotaxia de esperma de rã
- Anestesiar o sapo por imersão em água contendo 0,07% benzocaína, decapitar usando um par de tesouras carborundum gumes, e medula dupla para garantir a eutanásia. Cortar a pele abdominal para expor muscular. Faça cortes na linha média e lateral no músculo abdominal e retrair. Retrair delicadamente intestinos e gordura para revelar branco, em forma de feijão testículos. Apare tecido conjuntivo usando uma tesoura fina com cuidado para evitar vasos sanguíneos. Remover um testículo, lavar todo o sangue usando 1,5 x OR2 buffer, em seguida, rola o testículo em papel de filtro para remover excesso de buffer e pequenos vasos sanguíneos aderente e coloque os testículos em um prato de plástico Pitre em 0,2 ml de 1,5 x OR2 buffer. Encher uma seringa de 5 ml com 2 ml de 1,5 x OR2 buffer, picar delicadamente 20/10 buracos nos testículos durante a maior parte da superfície de um lado, inserir a agulha na extremidade oposta e gentilmente injetar buffer para expulsar o esperma. Alternativamente, umapode injetar buffer enquanto cutucando os orifícios de saída para expulsar o esperma. Transferir a suspensão de esperma usando uma micropipeta com uma ponta de corte (evitando ruptura do esperma) a um tubo de microcentrífuga e colocar no gelo.
- Estimar o número de espermatozóides de rã obtida por diluição de 1:100 de espermatozóides em 1,5 x OR-2 e tirar uma amostra de 20 mL da suspensão de esperma misturado e contando o número de células usando um hemocitômetro e os grandes 1 mm 2 área. Usando a contagem hemocitômetro e taxa de amostragem calcular a densidade de espermatozóides eo número total de espermatozóides colhidos. Este total é geralmente 2-6 x 10 7 espermatozóides em um volume de cerca de 2 ml, quando ambos os testículos são usados. Diluir a suspensão de esperma estoque com 1,5 x OR2 buffer para obter uma densidade de espermatozóides de 2 x 10 7 / ml. Use o esperma para o ensaio dentro de 2 a 3 horas de preparação. Avaliar a motilidade dos espermatozóides através da diluição de 5 mL de 1:10 espermatozóides com F-1 tampão e movimento visualizar usando óptica de contraste de fase. Pelo menos, 40% a 50% dos espermatozóidesdevem ser móveis. Mesmo os preparativos adequados conterá um grande número de espermatozóides imóveis a maioria dos quais são imaturos.
- Prepare um novo 24 também placa de cultura de tecido de plástico por 700 mL micropipetting de tampão F1 em cada poço. Cada poço deve ser cerca de 15 mm de diâmetro na parte inferior.
- Iniciar uma série de ensaios diluindo 100 ml de suspensão de espermatozóides com 900 mL de tampão F1 em temperatura ambiente (cerca de 21-23 ° C) em um tubo de microcentrífuga para ativar a motilidade dos espermatozóides por choque osmótico. Cada espermatozóide tempo fresco é ativado desta forma, o esperma deve ser utilizado dentro de 1-2 minutos.
- Lugar a 12 mM porosidade inserir (12 mm od) em um buffer cheio assim, certifique-se a colocação de inserção é off-centro, deixando um espaço para um lado. Transferir imediatamente 400 mL de esperma motilidade ativado dentro do poço por uma micropipeta ter uma ponta de corte. Aplicar a suspensão de esperma à parede do elemento filtrante e deixe-o correr para baixo para o filtro na parte inferior do the inserir, a suspensão de esperma não deve ser pipetado diretamente no filtro.
- Cuidadosamente micropipeta 50 ul de agente chemoattractant no poço no espaço entre o bem ea inserção fora do centro de filtro. É preciso ter cuidado para depositar a queda onde o lado e no fundo do poço atender e retirar a pipeta com nenhum distúrbio ao sistema. Especificamente, o êmbolo na micropipeta deve ser empurrada apenas para a primeira parada, de modo a ejectar completamente a amostra, mas nenhuma bolha de ar.
- Repita os passos 2.5 e 2.6 acima para iniciar os ensaios que forem necessárias, em seguida, incube a placa até que o primeiro ensaio começou incubada tem 50 minutos. Tipicamente, pode-se iniciar um ensaio a cada 45 a 60 segundos. Note-se que o ensaio pode ser simplificado por uma pessoa experiente ou por duas pessoas trabalhando juntas. Neste caso, uma ou duas fileiras de ensaios pode ser iniciado com um grande estoque de espermatozóides móveis e mais rápido pipetagem desde que os espermatozóides são sempre usado dentro de 1 a 2 minutos deativação.
- Pare de cada ensaio na seqüência iniciada. Primeiro, cuidado constante do sistema de filtragem com uma mão e com a outra retire cuidadosamente a maioria ou todos da suspensão de espermatozóides na câmara superior por micropipeta ou por aspiração com uma pipeta pasteur. Imediatamente, usando uma pinça fina, retire o elemento filtrante e descarte. Cuidado deve ser usado nesta etapa, pelo menos, os espermatozóides restantes ser varrido através do filtro aumentando artificialmente os valores para a passagem do esperma.
- De cada prato assim, transferir a suspensão de esperma inteiro para um tubo de microcentrífuga. É importante misturar a suspensão de espermatozóides no bem desde antes da retirada de espermatozóides tendem a se depositar no fundo. Adicionar 15 mL de formaldeído 25% para uma concentração final de 0,5% v / v e refrigerar se a contagem de espermatozóides não são feitas no mesmo dia.
- Pellet o esperma em cada tubo usando a 10 rodada segundo botão empurrar em uma microcentrífuga pessoal ter uma velocidade máxima de 2000 x g. Remover todos, mas 100 l de supernatformiga de cada tubo, em seguida, ressuspender o sedimento em que volume. Pegue 20 l da suspensão de espermatozóides, diluídas 1:10 com água destilada, ea contagem de esperma em um hemocitômetro usando uma objetiva de 40x em um microscópio vertical. Use as contagens e os fatores de diluição para calcular o número total de espermatozóides que passou através do filtro em cada ensaio.
3. Sapo ensaio de rastreamento de esperma usando uma câmara Zigmond
- Prepare a estação de trabalho microscópio invertido para filmagem. Nós usamos uma Nikon Elipse TE300 microscópio invertido equipado com um Sony DXC-390 um 3-chip da cor da câmera de vídeo analógica ou um Hamamatsu ORCA-03G câmera monocromática digital. O slide câmara Zigmond deve descansar no palco up-side-down com uma abertura suficiente na placa de palco para acomodar uma tampa de vidro 22x40 mm. Este arranjo é necessária em virtude do fato de que o esperma de rã são incapazes de nadar contra a gravidade. Foco ou uma lente objetiva de 4x ou 10x na plataforma de observação em execução entre as duasbebedouros.
- Teste para se certificar de que a câmera está focada e centrada na plataforma de observação. Se a câmera Sony é utilizado, a saída é enviada para um monitor de vídeo e um conversor A / D (frame grabber) capazes de digitalizar 7 quadros por segundo a partir do sinal de vídeo. O fluxo digital é processada através de um computador rodando a 3 GHz ou superior de preferência com 4 Gb de RAM ou mais. Apesar de usarmos software Scion Image (uma versão personalizada do Windows do NIH Image) controlando um Scion CG-7 frame grabber, estes produtos não estão mais disponíveis. A solução atual é a utilização de software Image J com uma VirtualDub Plug-in para captura de vídeo analógico câmera. Se a câmera é usada Hamamatsu, a sua saída digital é processado pelo software Olympus cellSens e exibida no monitor do computador. Em ambos os casos, os dados são salvos em uma unidade um rígido interno ou externo como uma pilha de tiff 8 bits. Uso de software Scion Imagem requer a conversão da seqüência de imagens Tiff para uma pilha usando Image J.
- O campo microscópico deve incluir a maioria ou todos a largura de plataforma de observação. Use de contraste de fase ou ótica de campo escuro para os melhores resultados. A distância entre a superfície da plataforma de observação e na parte inferior da tampa de vidro deve ser 15 a 20 mM, conforme determinado pelo diferencial de focar em cada superfície.
- Prepare o chemoattractant em uma concentração adequada em tampão F1. Prepare Xenopus laevis esperma como descrito anteriormente e armazenar em 1,5 x OR2 tampão no gelo até o uso.
- Montar a câmara Zigmond. Comece com uma câmara seca e limpa. Usando uma micropipeta lugar uma linha de óleo de silicone (4 mL) cerca de 5 mm de e paralelamente à borda exterior de cada calha. Coloque uma tampa de vidro 22x40 milímetros para a câmara permitindo que o óleo de silicone para espalhar uniformemente até a borda externa de cada calha. Se os experimentos preliminares mostram que furar o esperma é um problema, um pode precisar de revestimento a tampa de vidro com nitrocelulose como sugerido por Fabro et al. 3. Alterntivamente, a inclusão de proteína na buffers usados (por exemplo, BSA 1%) também pode reduzir a aderência de espermatozóides.
- Inverter a câmara e coloque sobre o recorte circular na fase microscópio tomando cuidado para que a tampa de vidro não faz contato com o palco. Esta configuração invertida é necessário trazer o esperma Xenopus da calha para a plataforma. Ao contrário do esperma de mamíferos, os espermatozóides Xenopus não são fortes o suficiente para nadar contra a gravidade para alcançar a plataforma.
- Ativar 20 l de Xenopus espermatozóides em 1,5 x OR2 buffer 1:10 mistura com tampão de F1 em temperatura ambiente. Usando uma micropipeta com uma ponta de corte, transferir imediatamente 70 mL de motilidade espermática ativado no cocho. Isto é conseguido através segurando a micropipeta em um ângulo baixo e colocando a ponta na abertura lateral da calha. A suspensão de células ejetado enche o cocho e ponte por ação capilar. Em seguida, encher o vale oposto da mesma maneira usando uma solução chemoatttractant.
- Começar a filmar dentro de 3 minutos (Xenopus espermatozóides têm uma vida útil limitada motilidade) e continue por 5 minutos. No final da filmagem, desmontar a câmara e lave os bebedouros e plataforma de observação com um fluxo pressurizado de água e depois de etanol a partir de uma garrafa de esguicho. Remover o óleo de silicone das superfícies superiores com toalhetes de papel com cuidado para não contaminar a plataforma de observação e as calhas.
- Se necessário, converter os dados de vídeo capturado a uma seqüência de imagens Tiff ou pilha usando o software Image J. Em seguida, abra o arquivo em J imagem e nos primeiros 21 quadros (3 segundos) escolher até 50 de esperma a ser rastreado. Para evitar viés, escolheu o esperma de todas as regiões do campo de observação e sem conhecimento dos dados de sua trajetória. Captura de trajetórias bidimensional de células no plano xy como uma função do tempo (conjuntos XYT de dados) para cada esperma por apontar e clicar do mouse usando o plug-in MtrackJ módulo para trajetórias Imagem J. Visualize e calcular a trajetóriadistâncias, os componentes dos eixos e velocidades dentro MtrackJ. Alternativamente, realizar estas operações e posterior análise numérica (por exemplo, direcionalidade parâmetros, quimiotaxia e histogramas parâmetro) pela importação de dados XYT põe em Microsoft Excel.
- Trajetórias para cada lote de esperma no Excel para detectar padrões gerais de movimento, incluindo linear, padrões curvilíneos e circulares, bem como recursos como voltas. Utilizar dados XYT conjuntos para calcular a velocidade curvilínea média, viajar net ao longo do X (gradiente) - e Y-eixo e parâmetros de orientação como o ângulo médio de viagem em relação ao eixo de gradiente.
4. Resultados representativos:
Parâmetros técnicos importantes no ensaio da câmara duas são tamanho e forma da câmara, a porosidade da membrana, ea duração da incubação. O tamanho da câmara alta retenção do esperma, não deve ser tão grande em diâmetro quanto a exigir um grande volume de esperma (preferably de 0,5 ml ou menos), nem deve a câmara superior ser tão profundo como criar uma coluna alta de suspensão de células (<1 cm). O volume de tampão em torno da câmara baixa inserir câmara superior deve corresponder exatamente ao nível da suspensão de células na inserção de modo a não criar uma pressão hidrostática transmembrana que artificialmente forçar os espermatozóides através da membrana. Colocação da inserção vazio no fundo bem primeiro, seguido por resultados de esperma de carga em uma pressão inicial para cima hidrostático que impede os espermatozóides de atravessar a membrana durante o carregamento. Escolha do tamanho dos poros da membrana é determinada pelo tamanho do esperma, e a disponibilidade comercial de inserções membrana porosa. Nós achamos que os ensaios com o esperma de rã pode utilizar 8 ou 12 poros de diâmetro de poro 12 mM mM embora possibilitar a circulação de um maior número de espermatozóides permitindo a contagem mais precisa. Tamanhos de poros maiores que 12 mM não parecem estar disponível comercialmente. Uma alternativa à utilização tiinsere a cultura ssue é o uso das membranas Neuroprobe projetado para ensaios de quimiotaxia em placas de 96 poços. Estes oferecem uma taxa de transferência potencialmente maior e uma vasta gama de diâmetros de poros. Embora maior do esperma dos mamíferos parece exigir um maior diâmetro de poro, conseguimos ensaiadas quimiotaxia rato esperma usando pastilhas com 12 mM poros (Burnett, observações não publicadas). Em contraste, tamanhos menores de poros pode ser adequado para menores de espermatozóides (por exemplo, ouriço do mar), embora ainda não tenhamos testado esta possibilidade.
Uma desvantagem do ensaio de duas câmaras de descrever é que os espermatozóides são colocados no compartimento superior, portanto, inevitavelmente, resulta em alguma passagem do esperma pela gravidade, diminuindo assim a relação sinal de fundo. Isto é necessário devido o fato de que o esperma não Xenopus são vigorosas o suficiente em sua motilidade de nadar contra a gravidade como são espermatozóides de mamíferos. Outra dificuldade na dosagem de esperma Xenopus é o fato de que seus l motilidadeife tempo é curto - 5 a 15 minutos após a ativação. Esta restrição é a base para a necessidade de ativar um novo lote de esperma a cada 2 a 3 minutos na realização de ensaios múltiplos. Como resultado, os estudos de curso de tempo têm mostrado que a passagem mais espermatozóides ocorre nos primeiros 20 minutos de ensaio 5. Apesar de usarmos um período de incubação 50 minutos, este prazo poderá ser provável curto-circuito a 20 ou 30 minutos. Em contraste, para os espermatozóides móveis do mouse que permanecem por horas, temos utilizado até um período de duas horas de ensaio com bons resultados (Burnett, observações não publicadas).
No ensaio de duas câmaras com esperma de rã, o número total de espermatozóides passam através da membrana porosa é tipicamente 10 a 20 mil ou cerca de 1 a 2% do esperma colocado no insert câmara superior. Presença de um gradiente chemoattractant na Câmara pode aumentar a passagem dos espermatozóides, tanto quanto 4-10 vezes. A figura 2 ilustra uma curva de resposta dose típica feita com este ensaio. Uma extrato de Xenopus ovo de geléia ("água de ovo") contendo os allurin proteína conhecida chemoattractant (círculos vermelhos), foi colocado na câmara inferior a uma série de diluições. A proteína total de água do ovo contidas em cada ensaio é dado em microgramas / ensaio - a quantidade entregue no volume 50 original mL. Uma vez que a proteína entregues formarão um gradiente de difusão, a faixa de concentração real de proteína que o esperma responder não é conhecida, mas pode ser estimada em 5 a 10 vezes menor do que a concentração de proteína da queda entregues. Por esta razão, denotamos a quantidade de proteína introduzida, não a concentração. Normalmente realizamos ensaios duplicata ou triplicata para cada dose e média o resultado, nós então replicar todo o experimento 3 ou 4 vezes usando o esperma de machos diferentes em cada experimento. A média e erro padrão da média é calculada para cada dose com o erro padrão da média sendo tipicamente 5 a 10% da média. Note-se que proteínas sem knoatividade wn chemoattractant tais como albumina sérica bovina (círculos abertos, fig. 2) pode produzir um baixo nível, o aumento não-específica na passagem de esperma através da membrana. Uma observação interessante é que a curva dose-resposta para a água ovo é multifásicos - uma fase de ascensão e uma fase decrescente. Este tipo de relacionamento multifásica é comum para quimioatrativos espermatozóides; a resposta do esperma humano ao fluido folicular mostra uma relação semelhante 6 bifásica que se pensa ser útil em que altas concentrações de chemoattractant encontradas nas proximidades de um ovo pode servir para diminuir ainda mais em busca respostas por parte do esperma.
Ocasionalmente, vemos que os valores de controle para este ensaio são mais elevados do que o normal, reduzindo assim o aumento vezes produzido por um chemoattractant. Normalmente, este pode ser atribuída a perturbação mecânica do elemento filtrante durante o ensaio. Assim, é importante que se insere não são perturbados ao carregar o esperma ou chemoattractant, durante a incubação do ensaio ou quando a inserção é removido. Particularmente crucial é que o reservatório de esperma na inserção é removido por micropipeta ou sucção antes de levantar a inserção para fora do poço. Isso garante que os espermatozóides não são levados através da membrana porosa na câmara de fundo como a inserção é removido.
Parâmetros técnicos importantes no ensaio de câmara Zigmond incluir a distância entre a plataforma de lamela e de observação, a ampliação da observação de vídeo, o tipo de óptica utilizada, ea taxa de quadros. Distância entre a plataforma de observação é tipicamente de 10 a 15 mm, embora essa distância pode ser variado com a quantidade de óleo de silicone utilizado para fazer a interface entre o vidro da tampa e do slide câmara - quanto mais petróleo, quanto maior a distância. Um avião fina de líquido aumenta a quantidade de tempo necessário para um gradiente para formar, assim como a longevidade do gradiente de uma vez formado. Um avião de líquido mais espesso permite uma mais rápida gformação radient mas o gradiente tem uma vida útil mais curta e menos estabilidade. A dinâmica de formação de gradiente pode ser visualizado utilizando um corante fluorescente ou um dextran fluorescentes na chemoattractant bem e usando a microscopia de fluorescência para ver a dinâmica. O reagente deve ser acompanhada de peso molecular para o chemoattractant sendo utilizado ea dinâmica determinada utilizados para julgar quantos minutos deve ser permitido para a formação de gradiente e registo das manobras de esperma.
A ampliação deve ser utilizado (objetivo 4x ou 10x) em geral baixo se a plataforma de observação inteiro está a ser visualizado como nas condições de ensaio que descrevemos. Por outro lado, maior ampliação (objetiva de 40x ou 63x) pode ser útil se se pretende monitorar segmentos de trajetória relativamente curta, ou se pretender resolver movimentos flagelar. Monitoramento pode ser realizado tanto por métodos semi-manual, conforme descrito neste papel ou através do rastreamento automatizado como praticado em mais soppacotes de software, tais como histicated Metamorph ou Track Imaris. Em ambos os casos, a facilidade de monitoramento é muito dependente do contraste da imagem seja pelo operador ou por software assistida por reconhecimento de objetos. Embora óptica de campo claro pode ser usado em alguns casos, o uso da óptica de contraste de fase ou campo escuro óptica é geralmente necessária. Finalmente, a taxa de quadros depende da resolução de tempo desejado no rastreamento. Se semi-manual métodos são usados como no nosso procedimento, é provavelmente limitada a taxa de quadros relativamente baixa - 4-8 frames por segundo -, devido à natureza do trabalho intensivo de gravação de dados. Por outro lado, as observações taxa de vídeo pode ser necessária para respostas rápidas, como formas de onda flagelar. Freqüentemente, os objetivos experimentais são melhor servidos por fazer experimentos mais lento frame rate e experimentos ritmo mais rápido desde um quadro separadamente também pretende alterar outros parâmetros como a ampliação, a óptica, ou de processamento de imagem digital.
Os resultados típicos para o Zigmond ensaio de rastreamento câmara consiste de um conjunto de trajetórias como aqueles vistos por cinqüenta esperma de rã no vídeo clipe de filme 1. Contra a imagem da plataforma de observação, as trajetórias individuais dos espermatozóides são traçadas em vermelho para um experimento de controle (nenhum presente gradiente chemoattractant). As trajetórias de células bidimensionais no plano xy como uma função do tempo para cada espermatozóide podem ser plotados e registrados pelo MtrackJ e importado para o Microsoft Excel. Para a análise de trajetória, nós designamos o eixo gradiente chemoattractant como o eixo X eo eixo Y como eixo ortogonal, de acordo com a convenção originalmente desenvolvido por Fabro et al. 3. Como mostrado no diagrama da Figura 3, a trajetória real tomada é composto de etapas, a soma de cujo comprimento seja igual à distância percorrida curvilínea na trajetória (azul / flechas de ouro). A distância net e orientação de viagem de cada espermatozóide é um vetor que liga o primeiro eo último ponto da trajetória (seta diagonal vermelha). Oviagens net pode ser separado em seus componentes do eixo X e eixo Y componente (vermelho setas tracejadas, também denominado net delta X e delta net Y, respectivamente).
Quimiotaxia porque no esperma vertebrados pode envolver mudanças relativamente sutis na direção do percurso, um grande número de espermatozóides (100 a 300), selecionados aleatoriamente, são geralmente analisadas para cada condição muitas vezes necessitando de dados agrupados 4-6 experimentos independentes. Para fins de ilustração, no entanto, vamos usar os dados de apenas cinqüenta esperma de rã. A tabela 1 ilustra os parâmetros comuns utilizados para detectar mudanças em viagens de esperma. A viagem significa net ao longo do eixo X vai aumentar significativamente se, na presença de um chemoattractant, a população de esperma como um todo segue trajetórias que se alinhar mais estreitamente com o gradiente. No nosso exemplo, a média de viagens do eixo X líquido aumentou mais de três vezes na presença de água do ovo. Pode-se também traçar um histograma de viagens do eixo X-net para a população de espermatozóides que tem a vantagem tage que subpopulações de espermatozóides menor resposta pode ser detectado. Dois parâmetros desenvolvidos por Fabro et al. 3 também pode ajudar a detectar tais populações. Tanto a percentagem de espermatozóides mostrando líquido positivo de viagens do eixo X (% AX> 0) ea porcentagem de espermatozóides mostrando viagens linear net não superiores a 45 graus a partir do eixo do gradiente (% AX / | ΔY |> 1) pode aumentar drasticamente se a população de espermatozóides inteiro é sensível ao chemoattractant ou por quantidades pequenas, mas ainda significativo, se subpopulações de espermatozóides são sensíveis. Nosso exemplo na Tabela 1 mostra aumentos em ambos os parâmetros para o esperma de rã fifty expostos a um gradiente de água do ovo. Note-se que o movimento não-orientado aleatória dará valores não-zero para ambos os parâmetros de 50% e 25%, respectivamente, valores superiores a este controle (tais como aqueles na Tabela 1) representam um fundo devido a qualquer número de amostras de baixa ou a um viés na orientação de esperma especial ao projeto experimental.
content "> Direcionalidade da viagem de esperma em resposta a agentes chemoattractant pode ser diretamente avaliada por teta, o ângulo entre o vetor de viagens líquido de cada espermatozóide eo gradiente (X)-eixo. Nosso exemplo na Tabela 1 mostra que a teta significa diminuição para a natação de espermatozóides em um gradiente de água ovo indicando que as trajetórias de esperma como uma população eram mais alinhados com o gradiente. similares para viajar eixo X-net (veja acima), thetas para a população de espermatozóides pode ser expressa como uma distribuição, uma abordagem também sensíveis de subpopulações de espermatozóides ágil e que foi recentemente estudado por Gakamsky et al 7.Finalmente, as velocidades curvilínea e instantânea para os espermatozóides individuais também podem ser extraídos a partir dos dados que descrevem trajetórias bidimensional de células no plano xy como uma função do tempo. Pode-se achar que há um aumento na velocidade, bem como uma mudança na orientação do curso, sugerindo uma resposta chemokinetic, bem comouma resposta quimiotática.
Esses dados representam um ponto de partida para análise das trajetórias de esperma. Análise mais aprofundada poderia incluir medidas de linearidade trajetória e curvatura em um momento a momento como base realizado por Bohmer et al. 8 e Shiba et al. 9, a detecção automática de voltas realizadas por Burnett et al. 10, e não-linearidade como avaliada através da análise fractal 11,12. Desde que o esperma nadar essas trajetórias são monitorados em maior ampliação, pode-se também movimentos flagelar imagem e sinais em tempo real de cálcio como realizado por vários laboratórios 8,9,13,14,15,16. Tais estudos têm demonstrado que ambos os invertebrados e os espermatozóides de mamíferos responder a quimioatrativos por curvas fechadas do esperma até gradiente em direção à fonte chemoattractant. Essas voltas são acompanhados por curvas flagelar que alteram a orientação esperma quanto seria um leme, curvas que parecem iniciado por definidos, onda lisinais de cálcio ke propagação através do flagelo. Assim, o objetivo final de rastreamento de esperma é correlacionar a dinâmica do sistema de sinalização com mudanças na propulsão flagelar que servem como base de orientação de espermatozóides em um gradiente quimiotático. Essas metas ainda não foram alcançados em Xenopus esperma que viajam em um movimento helicoidal 17, apresentam curvatura baixa em suas trajetórias 10, e cujos sinais ainda de cálcio a ser monitorada.
Embora tenhamos focado aqui na detalhando os métodos de ensaio que usamos para Xenopus laevis esperma, tanto as duas câmaras de ensaio de acumulação de esperma ea Zigmond ensaio de rastreamento câmara pode ser usado para espermatozóides de mamíferos se certas modificações são feitas. Ambos os testes podem ser realizados a 37 ° C, se desejado, pelo uso de um aquecedor de slides e, no ensaio de câmara Zigmond, um estágio do microscópio mais quentes. Tipicamente, os espermatozóides de mamíferos serão isoladas, capacitados e incubados usando um apropriado buffers de mamíferosquimioatrativos d, mas a análise de dados será semelhante ao que é descrito aqui para espécies de anfíbios. Uma outra diferença é que a câmara de Zigmond normalmente é colocado na vertical sobre o estágio de um microscópio vertical desde o esperma de mamíferos, ao contrário do esperma Xenopus, podem nadar para cima sobre a plataforma de observação. Ainda não testados, estes dois ensaios pode ver a aplicação de esperma de um número de espécies em trabalhos futuros.

Figura 1. Diagrama esquemático do ensaio de duas câmaras. Os espermatozóides são colocados em uma inserção no fundo da qual é um filtro de policarbonato com 12 mM poros. Uma solução chemoattractant é cuidadosamente pipetado para dentro do poço para iniciar a formação de um gradiente de concentração.
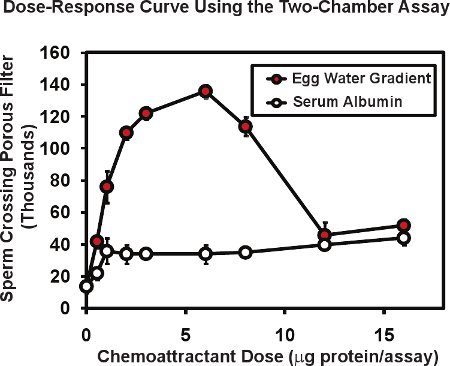
Figura 2. Dados representativos para o esperma de rã utilizando o esperma de duas câmaras chemotaxiensaio s. Água ovo preparados a partir de X. ovos laevis apresenta uma curva dose-atividade multifásico que é característica de quimioatrativos esperma. Bovina passagem dos espermatozóides albumina sérica aumenta apenas ligeiramente - um efeito não específico de proteína. Figura modificada de Al-Anzi & Chandler 5.
Movie 1. Um vídeo mostrando trajetórias de esperma de rã plotado em vermelho na plataforma de observação de uma câmara de Zigmond. A largura da plataforma é de 1 mm. Clique aqui para assistir o clip de vídeo.
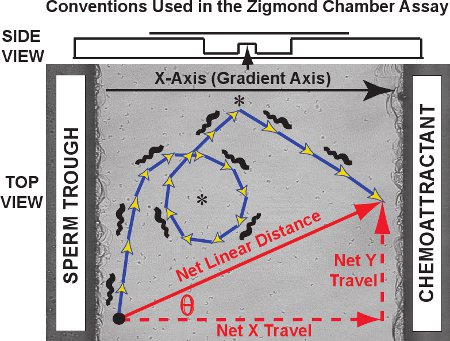
Convenções figura 3. Axis, uma trajetória curvilínea espermatozóide e um vetor para o curso linear net são plotados na plataforma de observação câmara Zigmond. Os dados obtidos são de três tipos. Primeiro, as trajetórias de esperma-se (azul / flechas de ouro) pode revelar su padrões específicosch como círculos e voltas (asteriscos). Distância curvilínea e velocidades curvilinear pode ser medido para o caminho trajetória. Segundo, a distância real linear viajou mais de toda a trajetória, a rede X componente eixo (gradiente) da viagem, o componente líquido do eixo Y de viagens e theta ângulo entre o eixo X eo vetor de viagem líquido pode ser calculado para cada trajetória e comparado como uma distribuição de todos os espermatozóides rastreadas. Terceiro, mudanças instantâneas de velocidade e direção do curso para segmentos dentro trajetórias individuais podem ser estudadas individualmente ou como uma população. Acima, uma vista lateral da câmara é apresentada em um diagrama.

Tabela 1. Parâmetros usados com freqüência na análise de dados da câmara de Zigmond.
Access restricted. Please log in or start a trial to view this content.
Discussão
Quimiotaxia de células de movimento pelo movimento amebóide ou flagelos-powered natação é encontrado em muitos contextos biológicos e estudo deste fenômeno exige a disponibilidade de testes prático e confiável. Alguns exemplos do fenômeno, como a atração de esperma para um ovo de ouriço do mar ou coleta de células do discoideum para formar um corpo de frutificação, têm um impacto visual imediato. Quantificação deste fenômeno tem sido feita em uma variedade de maneiras, como descrito por Eisenbach
Access restricted. Please log in or start a trial to view this content.
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Agradecemos ao WM Keck Laboratory BioImaging para uso de sua estação de trabalho de vídeo microscopia. Este estudo foi financiado pela NSF conceder IBN-0615435.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do item | Companhia | Número Catálogo | Comentários |
| Placas de 24 poços | Becton-Dickinson | 35/1147 | |
| 12 milímetros de diâmetro exterior inserções com 12 mM de poros da membrana | Millipore | PIXP01250 | Nós usamos anteriormente Costar-Corning placa transwell # 3403-agora descontinuado |
| Zigmond câmara | Neuroprobe | Z02 | |
| Óleo de silicone | General Electric | SF1154 | Equivalente a Dow Corning 550 Fluid |
| Imagem J software | Wayne Rasband, Research Services Branch, National Institute of Mental Health | Download gratuito em http://rsbweb.nih.gov/ij | Java programa que roda em Windows, Linux e Mac |
| MtrackJ software | Erik Meijering / ImageScience / Biomedical Imaging Group , Erasmus MC - University Medical Center Rotterdam | Download gratuito em http://www.imagescience.org/meijering/software/mtrackj/ | Java programa que roda em Windows, Linux e Mac |
| Virtual Dub software | GNU General Public Licensed software | Download gratuito via http://www.virtualdub.org/index.html | Instruções de instalação no site da J Imagem em plugins, apenas para Windows |
| cellSens software | Olimpo | Consulte o site: http://www.olympusamerica.com/seg_section/product.asp produto? = 1070 | Controles e adquire imagens de uma variedade de câmeras. Também possui capacidade de processamento de imagem |
Referências
- Ward, G. E., Brokaw, C. J., Garbers, D. L., Vacquier, V. D. Chemotaxis of Arbacia punctulata spermatozoa to resact, a peptide from the egg jelly layer. J. Cell Biol. 101, 2324-2329 (1985).
- Olivera, R. G., Tomasi, L., Rovasio, R. A., Giojalas, L. C. Increased velocity and induction of chemotactic response in mouse spermatozoa by follicular and oviductal fluids. J. Reprod. Fertil. 115, 23-27 (1999).
- Fabro, G., Rovasio, R. A., Civalero, S., Frenkel, A., Caplan, S. R., Eisenbach, M., Giojalas, L. C. Chemotaxis of capacitated rabbit spermatozoa to follicular fluid revealed by a novel directionality-based assay. Biol. Reprod. 67, 1565-1571 (2002).
- Sugiyama, H., Burnett, L., Xiang, X., Olson, J., Willis, S., Miao, A., Akema, T., Bieber, A. L., Chandler, D. E. Purification and multimer formation of allurin, a sperm chemoattractant from Xenopus laevis egg jelly. Mol. Reprod. Dev. 76, 527-536 (2009).
- Al-Anzi, B., Chandler, D. Xenopus laevis egg jelly releases a sperm chemoattractant during spawning. Dev. Biol. 198, 366-375 (1998).
- Ralt, D., Goldenberg, M., Fetterolf, P., Thompson, D., Dor, J., Mashiach, S., Garbers, D. L., Eisenbach, M. Sperm attraction to a follicular factor(s) correlates with human egg fertilizability. Proc. Natl. Acad. Sci. U.S.A. 88, 2840-2844 (1991).
- Gakamsky, A., Schechtman, E., Caplan, S. R., Eisenbach, M. Analysis of chemotaxis when the fraction of responsive cells is small--application to mammalian sperm guidance. Int. J. Dev. Biol. 52, 481-487 (2008).
- Böhmer, M., Van, Q., Weyand, I., Hagen, V., Beyermann, M., Matsumoto, M., Hoshi, M., Hildebrand, E., Kaupp, U. B. Ca2+ spikes in the flagellum control chemotactic behavior of sperm. EMBO J. 24, 2741-2752 (2005).
- Shiba, K., Baba, S. A., Inoue, T., Yoshida, M. Ca2+ bursts occur around a local minimal concentration of attractant and trigger sperm chemotactic response. Proc. Natl. Acad. Sci. U.S.A. 105, 19312-19317 (2008).
- Burnett, L. A., Sugiyama, H., Bieber, A. L., Chandler, D. E. Egg jelly proteins stimulate directed motility in Xenopus laevis sperm. Mol. Reprod. Dev. 78, 450-462 (2011).
- Abaigar, T., Barbero, J., Holt, W. V. Trajectory variance and autocorrelations within single sperm tracks as population level descriptors of sperm track complexity, predictability and energy generating ability. J. Androl. , Forthcoming (2011).
- Mortimer, S. T., Swan, M. A., Mortimer, D. Fractal analysis of capacitating human spermatozoa. Hum. Reprod. 11, 1049-1054 (1996).
- Guerrero, A., Carneiro, J., Pimentel, A., Wood, C. D., Corkidi, G., Darszon, A. Strategies for locating the female gamete: the importance of measuring sperm trajectories in three spatial dimensions. Mol. Hum. Reprod. 17, 511-523 (2011).
- Yoshida, M., Yoshida, K. Sperm chemotaxis and regulation of flagellar movement by Ca2+. Mol. Hum. Reprod. 17, 457-465 (2011).
- Spehr, M., Schwane, K., Riffell, J. A., Zimmer, R. K., Hatt, H. Odorant receptors and olfactory-like signaling mechanisms in mammalian sperm.Mol. Cell. Endocrinol. 250, 128-136 (2006).
- Veitinger, T., Riffell, J. R., Veitinger, S., Nascimento, J. M., Triller, A., Chandsawangbhuwana, C., Schwane, K., Geerts, A., Wunder, F., Berns, M. W., Neuhaus, E. M., Zimmer, R. K., Spehr, M., Hatt, H. Chemosensory Ca2+ dynamics correlate with diverse behavioral phenotypes in human sperm. J. Biol. Chem. 286, 17311-17325 (2011).
- Tholl, N., Naqvi, S., McLaughlin, E., Boyles, S., Bieber, A. L., Chandler, D. E. Swimming of Xenopus laevis sperm exhibits multiple gears and its duration is extended by egg jelly constituents. Biol. Bull. 220, 174-185 (2011).
- Eisenbach, M. Sperm chemotaxis. Rev. Reprod. 4, 56-66 (1999).
- Riffell, J. A., Zimmer, R. K. Sex and flow: the consequences of fluid shear for sperm-egg interactions. J. Exp. Biol. 210, 3644-3660 (2007).
- Corkidi, G., Taboada, B., Wood, C. D., Guerrero, A., Darszon, A. Tracking sperm in three-dimensions. Biochem. Biophys. Res. Commun. 373, 125-129 (2008).
- Himes, J. E., Riffell, J. A., Zimmer, C. A., Zimmer, R. K. Sperm chemotaxis as revealed with live and synthetic eggs. Biol Bull. 220, 1-5 (2011).
- Sun, F., Giojolas, L. C., Rovasio, R. A., Tur-Kaspa, I., Sanchez, R., Eisenbach, M. Lack of species-specificity in mammalian sperm chemotaxis. Dev. Biol. 255, 423-427 (2003).
- Guidobaldi, H. A., Teves, M. E., Uñates, D. R., Anastasía, A., Giojalas, L. C. Progesterone from the cumulus cells is the sperm chemoattractant secreted by the rabbit oocyte cumulus complex. PLoS One. 3, e3040-e3040 (2008).
- Oren-Benaroya, R., Orvieto, R., Gakamsky, A., Pinchasov, M., Eisenbach, M. The sperm chemoattractant secreted from human cumulus cells is progesterone. Hum. Reprod. 23, 2339-2345 (2008).
- Teves, M. E., Guidobaldi, H. A., Uñates, D. R., Sanchez, R., Miska, W., Publicover, S. J., Morales Garcia, A. A., Giojalas, L. C. Molecular mechanism for human sperm chemotaxis mediated by progesterone. PLoS One. 4, 8211-82 (2009).
- Blengini, C. S., Teves, M. E., Uñates, D. R., Guidobaldi, H. A., Gatica, L. V., Giojalas, L. C. Human sperm pattern of movement during chemotactic re-orientation towards a progesterone source. Asian J. Androl. 13, 769-773 (2011).
- Strünker, T., Goodwin, N., Brenker, C., Kashikar, N. D., Weyand, I., Seifert, R., Kaupp, U. B. The CatSper channel mediates progesterone-induced Ca2+ influx in human sperm. Nature. 471, 382-386 (2011).
- Lishko, P. V., Botchkina, I. L., Kirichok, Y. Progesterone activates the principal Ca2+ channel of human sperm. Nature. 471, 387-391 (2011).
- Boyden, S. The chemotactic effect of mixtures of antibody and antigen on polymorphonuclear leucocytes. J. Exp. Med. 115, 453-465 (1962).
- Zigmond, S. H., Lauffenburger, D. A. Assays of leukocyte chemotaxis. Annu. Rev. Med. 37, 149-155 (1986).
- Villanueva-Diaz, C., Vadillo-Ortega, F., Kably-Ambe, A., Diaz-Pérez, M. A., Krivitzky, S. K. Evidence that human follicular fluid contains a chemoattractant for spermatozoa. Fertil. Steril. 54, 1180-1182 (1990).
- Villanueva-Diaz, C., Arizs-Martinez, J., Bermejo-Martinez, L., Vadillo-Ortega, F. Progesterone induces human sperm chemotaxis. Fertil. Steril. 64, 1183-1188 (1995).
- Olson, J., Xiang, X., Ziegert, T., Kittleson, A., Rawls, A., Bieber, A., Chandler, D. E. A. llurin a 21 kD sperm chemoattractant from Xenopus egg jelly, is homologous to mammalian sperm-binding proteins. Proc. Natl. Acad. Sci. U.S.A. 98, 11205-11210 (2001).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados