É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Campo elétrico controlado de migração dirigida de células progenitoras neurais em ambientes 2D e 3D
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Este protocolo demonstra métodos utilizados para estabelecer ambientes 2D e 3D em câmaras de design personalizado electrotactic, que pode acompanhar células In vivo / ex vivo Usando lapso de tempo de gravação no nível da célula única, a fim de investigar galvanotaxis / electrotaxis e outras respostas celulares ao dirigir atuais campos (DC) elétricos (EFS).
Resumo
Endógenos campos eléctricos (EFS) ocorrem naturalmente in vivo e desempenham um papel crítico durante tecido / órgão de desenvolvimento e regeneração, incluindo a do 1,2 sistema nervoso central. Estes EFs endógenos são gerados por regulação celular de transporte iónico combinada com a resistência eléctrica de células e tecidos. Tem sido relatado que aplicada EF tratamento pode promover a reparação funcional de lesões da medula espinal em animais e humanos 3,4. Em particular, EF-dirigida a migração celular tem sido demonstrada em uma ampla variedade de tipos de células 5,6, incluindo as células progenitoras neurais (NPCs) 7,8. Aplicação de corrente direta (DC) FE não é uma técnica comumente disponíveis na maioria dos laboratórios. Nós descrevemos os protocolos de execução de FE DC para celular e culturas de tecidos previamente 5,11. Aqui apresentamos um vídeo de demonstração de métodos padronizados com base em uma intensidade de campo calculada para configurar uma 2Dd ambientes 3D para NPCs, e investigar respostas celulares a EF estimulação em ambas as condições unicelulares de crescimento em 2D, ea fatia de medula espinhal organotípico em 3D. O cordslice vertebral é um tecido destinatário ideal para estudar comportamentos NPC ex vivo, pós-transplante, porque a organização do tecido citoarquitetônicos está bem preservada dentro dessas culturas 9,10. Além disso, este modelo ex vivo também permite que os procedimentos que não são tecnicamente viável para controlar as células in vivo utilizando lapso de tempo de gravação ao nível da célula individual. É extremamente essencial para avaliar comportamentos de células em não só um ambiente 2D, mas também numa condição 3D organotípico que imita o ambiente in vivo. Este sistema permitirá que imagens de alta resolução usando tampa de vidro pratos à base de tecido ou cultura de órgão com rastreamento 3D da migração única célula in vitro e ex vivo e pode ser uma etapa intermediária antes de passar para a viparadigmas vo.
Protocolo
1. Isolamento de células progenitoras neurais
- Dissecar cérebros inteiros de E14-16 camundongos e coloque em meio DMEM/F12 frio basal. Remova todas as meninges sob um microscópio anatômico e cérebros de transferência em uma placa de Petri 35 mm.
- Use fórceps finos para dissociar mecanicamente cérebros em fragmentos de tecido e transferi-los para um tubo de 15 ml, em seguida, centrifugar amostras a 800 rpm durante 3 min para remover os resíduos.
- Adicionar DMEM/F12 bFGF contendo e EGF e tritura-se com uma pipeta de 1 ml.
- Passar a suspensão de células através de um filtro de células para obter uma suspensão de célula única.
- Células placa em frascos de 2-5 x 10 4 células / ml, em seguida realizar um meio completo mudar a cada 3 dias e passagem das células a cada 6 dias.
- Depois de pelo menos 5 passagens, digerir neuroesferas para células individuais utilizando tripsina e EDTA e crescer em câmaras electrotactic poly-D-lysine/laminin-coated (preparada tal como descrito abaixo em 2). Use o meio de cultura contendo N2 suplemento,bFGF e EGF em todos os momentos para manter as propriedades de NPCs.
2. Preparação da câmara de electrotactic
- Prepare 22 x 11 mm tiras de vidro dividindo autoclavados 22 x 22 mm de espessura lamínulas no.1 ao meio usando uma caneta de diamante.
- Criar um copo free-standing bem de dimensões interiores 22 x 10 mm colando quatro verticalmente em pé 22 x 11 mm com tiras de alto vácuo, graxa de silicone. Permitir que os poços completamente secar e endurecer durante a noite.
- No dia seguinte, anexar dois 22 x 11 tiras de vidro mm, paralelamente uns aos outros deixando um intervalo de 10 mm, para a base de um prato de cultura 100 milímetros usando massa de silicone. Vedar a região entre estas tiras pela colocação de um 22 x 22 lamínula mm em cada extremidade, fixada no fundo do prato com massa lubrificante em três lados, mas não que mais próximo do centro.
- Coloque o vidro bem preparado na etapa 2,2 na tampa desliza de forma que as paredes interiores criam um espaço confinado para propagaçãoas células para o fundo da placa. Água à prova de todas as articulações com graxa de silicone. Casaco esta região confinada sequencialmente com poli-D-lisina, em seguida, laminina: adicionar 1 ml de poli-D-lisina para dentro da câmara e deixar durante 5 min para permitir que o poli-D-lisina para se ligar a parte inferior da placa e lavar a câmara com PBS estéril, duas vezes, depois dilui-se a laminina em PBS estéril para se obter 20 mg / ml e usar para cobrir o fundo do prato. Deixe em temperatura ambiente durante a noite.
- No dia seguinte, as células de colheita e de preparar 1 ml de suspensão contendo 1 x 104 células. Remover laminina a partir do vidro bem, permitindo que a secar ao ar completamente, e substituir com 1 ml de suspensão de células. Colocar a cápsula na incubadora a 37 ° C durante um mínimo de 4 horas para permitir a fixação.
- Uma vez que as células são suficientemente confluente remover todo o meio a partir da câmara. Retire cuidadosamente o vidro bem. Formar um telhado sobre as células com cuidado anexando, com graxa de silicone, um autoclave 22 x 22 mm de vidro lamelade ligação entre as duas tiras de 22 x 11 mm. Cobrir as células com algumas gotas de meio para evitar a secagem.
- Formar um reservatório de meio isolado em cada extremidade da câmara de criando duas barreiras estanques massa de silicone que são executados a partir de uma aresta do prato para o outro, sobre o telhado de câmara. Encher a câmara com meio fresco, assegurando um fluxo através de um reservatório de meio para o outro. Retornar o prato para a incubadora durante 12 horas para permitir a recuperação de células.
3. Aplicação de um campo elétrico para a câmara de electrotactic
- Prepara-se uma tampa para cobrir o prato por perfuração de dois furos, um posicionado sobre cada reservatório da câmara de migração.
- Substituir todo o meio na câmara com meio de cultura contendo 25 mM de tampão HEPES e transferir o prato para o sistema de imagem com temperatura controlada. Configure os parâmetros experimentais para time-lapse e multi-posição de gravação. Alinhar a câmara de modo a que o cátodo eo ânodo sãodo lado esquerdo e direito, respectivamente, para assegurar que o vector de EF corre horizontalmente para baixo como visto ao microscópio e registada no sistema de imagem.
- Encher com a solução de duas provetas de Steinberg (58 mM de NaCl, 0,67 mM de KCl, 0,44 mM de Ca (NO3) 2 0,4 H 2 0, 1,3 mM MgSO4 0,7 H 2 0 e 4,6 mM de Trizma base, pH 7,4). Ligue um copo separado para cada reservatório média usando pontes pré-preparadas de vidro (tubos de vidro ~ 13 cm de comprimento e ~ 3 mm de diâmetro, e dobrado em forma de U por aquecimento em uma chama de Bunsen), cheios com 2% (w / v) de solução Steinberg's-ágar, passando através dos orifícios na tampa. Completar o circuito eléctrico através da colocação de Ag / AgCl eléctrodos ligados a uma fonte de alimentação DC em cada copo de solução de Steinberg.
- Coloque o selector de tensão no fornecimento de energia para 0 e ligar. Medir a tensão através da câmara de electrotactic ao ligar-se o selector de tensão, utilizando um medidor de tensão, e ajustar para se adequar aos requisitos experimentais.
- Iniciar lapso de tempo de gravação. Realizar uma troca de meio e reajustar a tensão, se necessário, a cada hora. Meio fresco, drogas ou agentes químicos podem ser adicionados para os reservatórios, conforme necessário. Quando realizar troca de meio, duas opções pode ser considerada como a seguir:
- Opção n º 1 - Para pausar a gravação de lapso de tempo temporariamente, remova cuidadosamente pontes de vidro da câmara para evitar perturbar a tampa de cobertura, use uma pipeta Pasteur esterilizada suavemente substituir todos meio com meio fresco e colocar as pontes de vidro de volta, em seguida, retomar a gravação.
- Opção No.2 - Alternativamente, feito tampa de cobertura com 4 furos (dois posicionado sobre cada reservatório da câmara de migração) também pode ser utilizado para efeitos de troca de meio. Dois para o vidro conexão pontes, os outros dois para mudar médio. Opção 2 permite gravação contínua, sem interferências durante a mudança de meio.
4. Preparação da fatia de medula espinhal organotípico
- Dissecar Lumbcabos de ar da coluna de 2 semanas de idade C57 BL / 6 ratos.
- Corte medula espinhal em 500 mm de espessura com um triturador de tecido McIlwain.
- Fatias separadas de um microscópio anatômico e selecionar fatias com estrutura intacta cabo sagital / axial da coluna vertebral.
- Fatias placa numa placa de Petri contendo 35 milímetros 30 uL Matrigel e colocá-los tão perto do centro quanto possível e mantê-las em um 5% de CO 2 incubadora a 37 ° C durante pelo menos 30 min, até que as proteínas de Matrigel auto-montagem para produzir uma fina película que cobre a superfície da fatia da medula espinhal. É muito importante ter a certeza de que Matrigel foi montado completamente, incubar a placa de Petri a 37 ° C durante mais 30 min, se necessário.
- Adicionar 4-6 ml DMEM/F-12 meio contendo 25 mM de tampão HEPES e 15-20% de soro fetal de vitelo muito suavemente, de modo a evitar o fluxo médio directamente sobre a fatia. Assegurar que a fatia não é inteiramente submerso no meio, deixando a superfície de explantes bem expostos ao ar. Troca de meio duas vezes por semana.
5. Injeção de Hoechst 33342 NPCs marcados na fatia cordão espinhal organotípico
- Preparar a suspensão NPC em 1 × 10 6 células / uL.
- Pré-incubar a suspensão de células em meio com 5 uM Hoechst 33342 durante 30 min.
- Use tubo capilar de vidro para microinject 2 ul de suspensão para a fatia da medula espinal lentamente sob um microscópio. Assegure-se tubo de vidro capilar passa através do matrigel (parte rosa sob microscópio) e atingem para o interior da fatia da medula espinal (tecido cinza sob microscópio), permanecem dentro da fatia da medula espinal por pelo menos 30 segundos para evitar a suspensão de células atropelado. Colocar a placa de Petri contendo fatia da medula espinal em incubadora (37 ° C a 5% de CO 2) e deixá-la durante a noite.
- No dia seguinte, aplicar um EF de 500 mV / mm para a fatia da medula espinal contendo Hoechst 33342 marcadas NPCs na câmara de electrotactic (usando os métodos descritos no3).
6. Os resultados representativos
Quando NPCs foram expostas a uma gama de EFs fisiológicas que mostraram a migração de células altamente dirigido para o cátodo (Figura 1). A mesma observação foi também feita a um nível única célula na medula espinal organotípico fatia modelo ex vivo, um mimético ambiente 3D em condições in vivo (Figura 2).
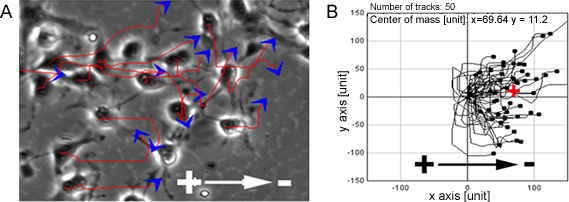
Figura 1. NPCs mostrar migração dirigida na FE. PCs apresentaram migração altamente dirigido para o cátodo quando expostos a FE, linhas vermelhas e flechas azuis representam trajetórias e direção do movimento das células (A). B mostra os caminhos migratórios de NPCs. Bar: 50 um.
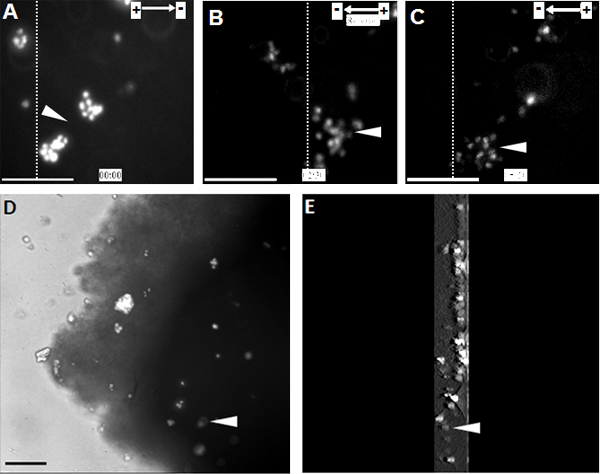
Figura 2. NPCs transplantados mostram a migração dirigida para o cátodo na fatia cordão espinal organotípico . (A) NPCs marcadas com Hoechst 33342 foram transplantadas para a fatia cordão espinal organotípico no ponto de partida do tratamento EF. NPCs migrado direccionalmente no sentido do cátodo durante 2,5 horas, altura em que a polaridade EF foi invertida (B). Alterando a polaridade EF desencadeou uma forte reversão de electrotaxis em direção ao cátodo nova (C). (D) da imagem de NPCs transplantados no interior da fatia da medula espinal no final da gravação de lapso de tempo. (E) A reconstrução 3D de NPCs transplantadas dentro da fatia da medula espinhal. 3D secções de digitalização eram 300 mm de espessura, a partir do meio e que termina na parte inferior da fatia. As linhas pontilhadas indicam as posições relativas da mesma população de células transplantadas, no início, a inversão, e os pontos finais do tratamento EF (A - C, respectivamente). Cabeças de seta indicam a mesma população de Hoechst 33342 NPCs marcados. Bar: 50 um.
Discussão
Os protocolos que usamos são baseadas em estudos anteriores 5,11. Usando esses métodos de cultura, estável e elétrico condições atuais pode ser mantida enquanto a aplicação de um EF através de pontes de ágar, solução Steinberg e Ag / AgCl, para células ou fatias cultivadas em câmaras electrotactic custom-concebidas de dimensões padronizadas e precisas. A profundidade das câmaras pode ser ajustada para acomodar diferentes espessuras amostra 11, e, no caso de células, o tamanho da c?...
Divulgações
Não temos nada a divulgar.
Agradecimentos
Este trabalho foi financiado pela Royal Society URF concessão UF051616, Reino Unido e do Conselho Europeu de Investigação StG concessão 243261 a BS. O trabalho em laboratório MZ é também apoiada por um Instituto de Medicina Regenerativa da Califórnia concessão RB1-01417.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários |
| FGF-básico Humano Recombinante | Invitrogen | PHG0026 | 20 ng / mL |
| EGF humano recombinante | Invitrogen | PHG0311 | 20 ng / mL |
| N2 suplemento líquido (100X) | Invitrogen | 02048 | |
| DMEM/F12 médio (glucose elevada) | Invitrogen | 31330-095 | |
| Poli-D-Lisina | Millipore | Um-003-E | |
| Natural do mouse laminina | Invitrogen | 23017-015 | |
| Fator de crescimento reduzido da membrana basal Matrix (Matrigel) | BD Biosciences | 354230 | |
| Tampão HEPES | Gibco | 15630 | |
| McIlwain tissue chopper | O Laboratório de Engenharia de Mickle Co Ltd | TC752-PD | |
| A Dow Corning massa de silicone de alto-vácuo | Sigma-Aldrich | Z273554 |
Referências
- Huttenlocher, A., Horwitz, A. R. Wound healing with electric potential. N. Engl. J. Med. 356, 303-303 (2007).
- McCaig, C. D., Rajnicek, A. M., Song, B. Controlling cell behavior electrically: current views and future potential. Physiol. Rev. 85, 943-943 (2005).
- Borgens, R. B., Jaffe, L. F., Cohen, M. J. Large and persistent electrical currents enter the transected lamprey spinal cord. PNAS. 77, 1209-1209 (1980).
- Shapiro, S., Borgens, R., Pascuzzi, R. Oscillating field stimulation for complete spinal cord injury in humans: a phase 1 trial. J. Neurosurg. Spine. 2, 3-3 (2005).
- Zhao, M., Song, B., Pu, J. Electrical signals control wound healing through phosphatidylinositol-3-OH kinase-gamma and PTEN. Nature. 442, 457-457 (2006).
- Yao, L., Shanley, L., McCaig, C. Small applied electric fields guide migration of hippocampal neurons. J. Cell. Physiol. 216, 527-527 (2008).
- Li, L., El-Hayek, Y. H., Liu, B. Direct-current electrical field guides neuronal stem/progenitor cell migration. Stem Cells. 26, 2193-2193 (2008).
- Meng, X., Arocena, M., Penninger, J. PI3K mediated electrotaxis of embryonic and adult neural progenitor cells in the presence of growth factors. Exp. Neurol. 227, 210-210 (2011).
- Bonnici, B., Kapfhammer, J. P. Bone marrow stromal cells promote neurite extension in organotypic spinal cord slice: significance for cell transplantation therapy. Neurorehabil. Neural Repair. 22, 447-447 (2008).
- Shichinohe, H., Kuroda, S., Tsuji, S. Bone marrow stromal cells promote neurite extension in organotypic spinal cord slice: significance for cell transplantation therapy. Neurorehabil. Neural Repair. 22, 447-447 (2008).
- Song, B., Gu, Y., Pu, j. Application of direct current electric fields to cells and tissues in vitro and modulation of wound electric field in vivo. Nature Protocol. 2, 1479-1479 (2007).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados