É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
RNAi mediada knockdown do gene e
Neste Artigo
Resumo
Neste protocolo combinamos RNAi mediada silenciamento de genes com um In vivo Ensaio diurese para estudar a knockdown efeitos dos genes de interesse tem sobre a excreção de fluido do mosquito.
Resumo
Este protocolo vídeo demonstra uma técnica eficaz para knockdown um determinado gene em um inseto e realizar um bioensaio romance para medir a taxa de excreção. Este método pode ser usado para obter uma melhor compreensão do processo de diurese em insectos e é especialmente útil no estudo da diurese no sangue de alimentação-artrópodes que são capazes de assumir uma grande quantidade de líquido em uma farinha de sangue única.
Este gene knockdown RNAi mediada combinado com um ensaio in vivo de diurese foi desenvolvido pelo laboratório Hansen para estudar os efeitos de RNAi mediada knockdown de genes Aquaporin sobre Aedes aegypti diurese mosquito 1.
O protocolo é configurado em duas partes: a primeira demonstração ilustra como a construção de um dispositivo de injeção simples mosquito e como preparar e injetar dsRNA para o tórax de mosquitos para RNAi mediada knockdown do gene. A demonstração segundo ilustra como determinartaxas de excreção em mosquitos usando um bioensaio in vivo.
Protocolo
Parte I - RNAi mediada knockdown do gene na idade adulta do mosquito Aedes aegypti. Para visão geral experimento veja a Figura 1.
1. Síntese dsRNA
- Sintetizar dsRNAs específicas contra genes de dsRNAs de juros e controle. Nota: Sugerimos iniciadores em desenvolvimento para os fragmentos de PCR na gama de 300 a 500 pares de bases localizado na extremidade 3 'do cDNA específico 2 e com a sequência de iniciador de T7 ligado na extremidade 5' (5'-TAA TAC GAC TCA CTA TAG GG-3 '). Singularidade dos fragmentos deve ser confirmado por análise BLASTN 3.
- Utilizar a Ambion Megascript T7 Kit de Transcrição de Alto Rendimento (Ambion, a tabela de reagentes) que utiliza-polimerase de T7 RNA para a reacção de transcrição para sintetizar ARNdc. Nota: Os reagentes semelhantes e kits estão disponíveis em outros lugares.
- Para purificar ARNdc, precipitado com cloreto de lítio, seguindo as instruções com o kit de Megascript.
- Depois purificatiónica, dissolver o sedimento ARNdc em água estéril. Para assegurar a viscosidade adequada para microinjecção, a concentração de ARNdc não deve exceder 2 ug / uL.
2. Preparação de injecção
- Um simples micro injector pode ser construído utilizando tubos, uma tesoura, uma agulha de metal, uma seringa de 1 ml, e uma 1 ml em plástico pipeta de ponta (ver Figura 2). O tubo deve ser cortado para ~ 40 cm de comprimento. Alternativamente, um injector automático de micro pode ser usado como Drummond Nanojet II 4.
- Cortar a ponta da seringa (cubo de agulha) em 2 ml marca escala e remover a cabeça do êmbolo de borracha a partir do êmbolo.
- Faça um furo com uma agulha de metal na cabeça do êmbolo de borracha e coloque a cabeça do êmbolo de borracha de volta no centro da agulha.
- Coloque o cubo da agulha em uma extremidade do tubo e colocar uma ponta de pipeta de 1 ml de plástico na outra extremidade, a qual será usada como a peça para a boca (alternativamente, um 10 ml syRinge pode ser usado para produzir a pressão de ar necessária para a injecção).
- Colocar uma agulha capilar de vidro, no furo na cabeça do êmbolo de borracha e quebrar a ponta da agulha fora de modo a largura é suficientemente grande para líquido a fluir através dele. Nota: O tamanho óptimo da ponta da agulha tem de ser determinada empiricamente -, se a largura da agulha é demasiado grande isso irá resultar em trauma e uma elevada taxa de mortalidade de mosquito, se a largura da agulha é muito pequeno, será impossível para penetrar o exoesqueleto de mosquito.
- Submergir a agulha de injecção na amostra ARNdc preparada e extrair a amostra de líquido para dentro da agulha de injecção por sucção o líquido para cima com a peça de boca (ou uma seringa). Nota: Este passo é idêntico para todos os reagentes líquidos que são injectados nos mosquitos, incluindo tampão PBS, que é utilizado in vivo no protocolo de ensaio de diurese (ver abaixo).
3. Coletar e Anestesie mosquitos
- Coleçãomosquitos de t com um aspirador alimentado por bateria para um frasco de coleta. Coloque uma tampa sobre o frasco de coleta e coloque o frasco em uma almofada limpa CO 2 para anestesiar os mosquitos. Nota: Como alternativa os mosquitos podem ser anestesiados em gelo.
4. Injeção de Mosquito
- Abra o frasco de coleta e colocar os mosquitos diretamente no bloco de CO 2 e esperar até os mosquitos são anestesiados.
- Descarte todos os homens.
- Alinhar os mosquitos no lado para permitir um acesso mais fácil para injecção.
- Agarre mosquitos pelas pernas ou asas para evitar ferimentos. Você também pode usar um pincel fino ou pena para manipular os mosquitos.
- Quando pronto para injectar o mosquito em primeiro lugar, suavemente suportar um lado do tórax com a pinça e inserir a ponta da agulha para o outro lado do tórax (Figura 2). É melhor injetar uma porção fina da cutícula e evitar empurrar a agulha paraó profundo no tórax.
- Uma vez que a agulha está no lugar, soprar o líquido para dentro do mosquito. A quantidade desejada pode ser determinada através da monitorização do menisco de líquido na agulha. O número de milímetros necessárias para um volume específico pode ser determinada por cálculo do volume do cilindro da agulha capilar de vidro (πr 2 h). A quantidade eficaz de ARNdc que é tipicamente usada para injecção é de 1 ug.
- Uma vez que o líquido é injectado mosquito, cuidadosamente retrair a agulha. Se um formas líquidas grandes gotículas do lado de fora do tórax, o mosquito deve ser descartado. Em seguida, repita esse processo com o mosquito que vem.
5. Recuperação Mosquito e Armazenamento
- Após a injecção, colocar os mosquitos em um recipiente para armazenagem. Por exemplo, uma cera de forrado pint copos de papelão (copos de sopa) com malha de recobrimento protegido com a tampa de cartão. A tampa tem uma parte cortada para a malha que cobre a ser exposto. Uma vez que todo o mosquitoes são colocados no recipiente, colocar o recipiente numa câmara de ambiente controlado, após a incubação e fornecer os mosquitos com uma fonte de alimento, tal como 20% de sacarose bolas de algodão embebidas colocados em cima da cobertura de malha. Antes de realizar o ensaio in vivo de diurese, privar os mosquitos dsRNA com injeção de uma fonte de água por 12 horas para normalizar o estado de hidratação de cada mosquito.
- A eficiência de ARNdc mediada knockdown do gene pode ser variável. Silenciamento gênico pode começar um dia após a injeção e pode durar até 6 dias após a injecção 4. O tempo ideal para atingir knockdown gene máxima tem de ser determinada empiricamente para cada gene utilizado. Geralmente, temos que esperar 3 dias após a injeção do dsRNA antes de prosseguir.
Parte II - In vivo ensaio diurese em adulto do mosquito Aedes aegypti
Nota: Este protocolo foi desenvolvido pelos autores eutilizado para RNAi mediada knockdown de proteínas Aquaporin no mosquito da febre amarela Aedes aegypti 1. Para evitar a variabilidade entre os mosquitos individuais, mosquitos devem ser analisadas em grupos. Por razões técnicas, recomendamos grupos de 5 mosquitos por tratamento - há uma quantidade limitada de tempo para realizar a medição de peso antes de mosquitos começam a excretar urina após a injeção.
6. Coletar e Anestesie mosquitos
- Antes da coleta dos mosquitos, registrar o peso de um frasco coleção vazia com uma tampa com uma balança de precisão analítica. Este frasco vai ser utilizado para todas as medições subsequentes.
- Collect 5 mosquitos fêmeas para dentro do frasco de recolha pesados com um aspirador. Coloque a tampa sobre o frasco de coleta e deixá-lo sentar-se no bloco de CO 2 por alguns segundos para anestesiar os mosquitos.
7. Pesagem inicial
- Tome tele medição de peso inicial dos 5 mosquitos, colocando o frasco de recolha contendo os mosquitos, com a tampa sobre a balança de precisão.
- Calcular o peso do grupo de 5 mosquitos, tendo o peso dos mosquitos e do frasco com tampa de recolha e subtraindo o peso do frasco de recolha vazio com tampa.
- Abrir o frasco de recolha e colocar os mosquitos directamente sobre a almofada de 2 CO após a gravação do peso dos mosquitos. Se os mosquitos estão começando a acordar durante as medições de peso, definir o frasco no bloco de CO 2 por alguns segundos antes de abri-lo e colocar os mosquitos no teclado.
8. Preparação de injecção
- Configure o injector micro seguindo as instruções dadas no protocolo knockdown RNAi mediada por gene.
- Colocar uma agulha capilar de vidro, no injector micro e quebrar a ponta da agulha fora de modo a largura é suficientemente grande para liquid para fluir.
- Agulha submergir o em tampão PBS e desenhar o tampão para dentro da agulha de injecção, a quantidade desejada a utilizar para este protocolo é de 1,25 ul de PBS para cada mosquito. Nota: Este montante imita a quantidade média de plasma sanguíneo que é absorvido por um mosquito fêmea 5.
9. Injeção de Mosquito
- Alinhe-se os mosquitos para permitir um acesso mais fácil com o injector micro.
- Uma vez que a agulha está no lugar, fundir tampão PBS para o mosquito.
- Uma vez que o líquido é injectado no mosquito, uma gotícula pode formar no lado de fora do tórax. Este gotícula tem de ser cuidadosamente removido antes do passo seguinte.
- Repita este processo de injeção com o mosquito que vem. Com a experiência, a taxa de sobrevivência do mosquito será quase 100% após a injeção.
10. Os mosquitos de pesagem
- Após a injeção, coloque delicadamente os mosquitos no vidro de coletae cap. Fazer a medição de peso primeiro dos 5 mosquitos, colocando o frasco de recolha contendo os mosquitos, com a tampa sobre a balança de precisão.
- Calcular o peso do grupo de 5 mosquitos, tendo o peso dos mosquitos e do frasco com tampa de recolha e subtrair o peso do frasco de recolha vazio com tampa. Nota: os mosquitos começam a excretar urina dentro de 2 minutos após a remoção do bloco de anestesia CO 2, por isso é importante para fazer a medição de peso antes de começar a excretar.
- Coloque mosquitos em um pequeno recipiente onde eles começarão a excretar urina.
11. Segundo e subsequentes medidas de peso
Nota: As medidas de peso dos mosquitos devem ser tomadas em intervalos de 30 minutos, mas este pode ser ajustado para intervalos mais curtos ou mais longos, dependendo taxas de excreção.
- Após 30 minutos, recolher o group de 5 mosquitos com um aspirador para o frasco mesma coleção com tampa. Fazer a medição de peso próximo dos mosquitos, colocando o frasco de recolha contendo os mosquitos, com a tampa sobre a balança de precisão.
- Após a medição, colocar os mosquitos no recipiente mesma exploração para os próximos 30 minutos.
- Repetir este processo para um período de tempo desejado.
12. Taxa de excreção de determinar Mosquito
- A quantidade total de líquido que foi injectado no grupo de 5 mosquitos pode ser calculado subtraindo o peso inicial dos mosquitos a partir do peso imediatamente após a injecção.
- A quantidade de urina, que foi excretada pelo grupo de mosquitos em um ponto de tempo específico pode ser calculado subtraindo o peso inicial dos mosquitos a partir do peso dos mosquitos no ponto de tempo específico.
- A taxa de excreção, num ponto de tempo específico pode ser calculado por diviDing a quantidade de urina excretada, neste ponto do tempo pela quantidade total de líquido injectado (Tabela 1).
13. Os resultados representativos
RNAi mediada knockdown do gene e in vivo ensaio diurese têm sido utilizados pelo laboratório Hansen para estudar os efeitos de aquaporinas em Aedes aegypti diurese mosquito. Três aquaporinas que são expressas em Aedes aegypti Malpighian túbulos foram derrubados com efeitos significativos sobre a taxas de excreção comparados para controlar mosquitos 1. A Figura 4 mostra resultados representativos de uma experiência em que o ensaio de diurese foi utilizado para comparar taxas de excreção entre Aedes aegypti e Culex quinquefasciatus a temperaturas diferentes.
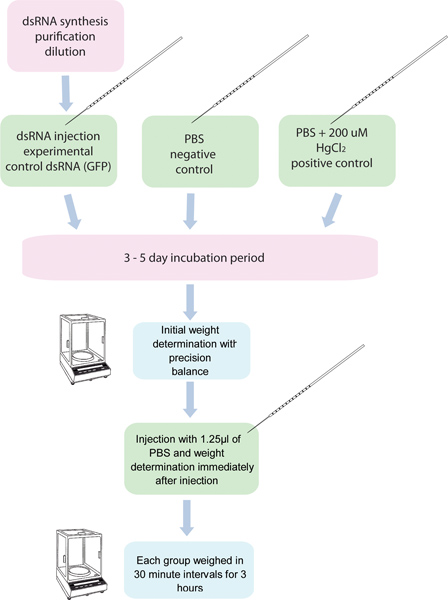
Figura 1. Fluxograma do ensaio RNAi / diurese. 5 grupos de 10 mosquitos each são injectados com ARNdc de um gene específico e de outros cinco grupos de dez mosquitos são injectados com o controle de ARNdc. Outro grupo de mosquitos injectados com 200 uM HgCl 2 em PBS é usado como um controlo positivo. Estes mosquitos são pesados antes da injecção, e após a injecção, em trinta minutos de intervalo durante 3 horas.
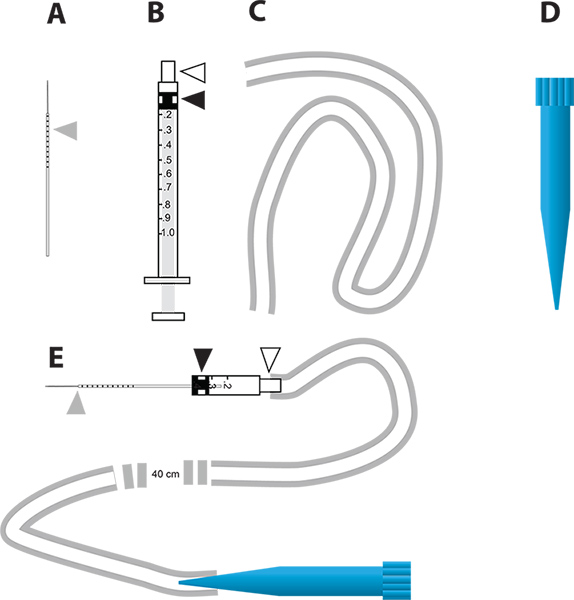
Figura 2. Um dispositivo de injeção simples micro para o knockdown do gene RNAi mediada e ensaio in vivo de diurese. A. As agulhas capilares de vidro utilizado para injecção. O triângulo cinza representa os incrementos de milímetro desenhadas na agulha para indicar a quantidade de líquido injectado no mosquito. B. 1 seringa ml usado para construir o injector micro. O triângulo branco representa o cubo da agulha e do triângulo preto representa a cabeça do êmbolo de borracha ligado ao êmbolo na seringa. C. O tubo usado para prender o porta-voz parao injector. D. 1 ml ponta de pipeta descartável (ponta azul), que é utilizado como o bocal do dispositivo de microinjecção. E. O dispositivo microinjeção que incorpora partes AD. Clique aqui para ver maior figura .
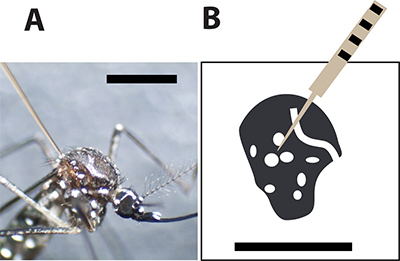
Figura 3. Local da injecção óptima do mosquito. A. Fêmea Aedes aegypti injectados com uma agulha capilar de vidro entre as escalas grandes no tórax. A barra preta indica 1 mm para comparação de tamanho. B. Um desenho do tórax mosquito fêmea e as manchas brancas representam as escamas brancas no exoesqueleto de mosquito. A agulha de injeção deve furar o mosquito entre os pontos para minimizar a taxa de mortalidade durante a injeção.
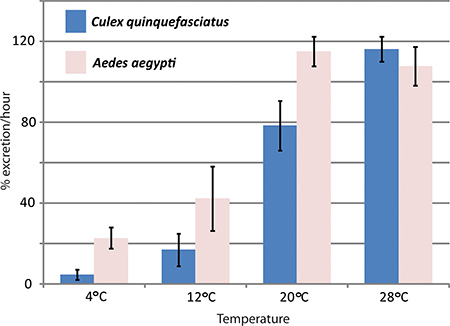
Figura 4. Efeitos da temperaturasas de Culex quinquefasciatus e diurese Aedes aegypti. O ensaio de diurese foi realizada com duas espécies de mosquitos, Aedes aegypti e Culex quinquefasciatus, a temperaturas diferentes. A taxa de excreção durante a primeira hora após a injecção é dada em percentagem.
| Grupo | TARA (G) | não injectada (G) | após a injecção (G) | 1h após a injecção (G) | peso médio (mg) | quantidade injectada (Ul) | quantidade excretada (Ul) | % Excretado |
| 1 | 7,5938 | 7,6057 | 7,6104 | 7,6096 | 2,38 | 0,94 | 0,16 | 17,0 |
| 2 | 7,8252 | 7,8349 | 7,8415 | 7,8403 | 1,94 | 1,32 | 0,24 | 18,2 |
| 3 | 7,8896 | 7,9026 | 7,9077 | 7,906 | 2,6 | 1,02 | 0,34 | 33,3 |
Tabela 1. Aedes aegypti em resultados do ensaio in vivo diurese. Dados brutos de ensaio in vivo de diurese realizada com Aedes aegypti fêmea mosquitos a 4 ° C.
Discussão
O protocolo utilizado RNAi foi desenvolvido no laboratório de Alexander Raikhel da Universidade da Califórnia Riverside 6,7 e é semelhante a um protocolo publicado por Garver e Dimopoulos 4. A abordagem experimental mostrado neste protocolo de vídeo pode ser usado para estudar os genes envolvidos na diurese de insectos em uma configuração em in vivo. Os órgãos excretores dos insetos, os túbulos de Malpighi, têm atraído o interesse de gerações de pesquisadores como um sistema m...
Divulgações
Não temos nada a divulgar.
Agradecimentos
Os autores agradecem Victoria Carpenter por seus comentários críticos deste protocolo.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente ou equipamento | Companhia | Número de catálogo | Comentários |
| MEGAscript T7 Kit de Alto Rendimento | Ambion, Inc. | AM1334 | |
| Tampão PBS | Sigma-Aldrich | P4417 | |
| Tubos de plástico | Fornecedor local | PVC | |
| 1 ml de plástico pipeta | VWR | 83007-376 | Azul ponta |
| 1 ml da seringa | Becton, Dickinson and Company | 309602 | |
| Tesoura | Fornecedor local | ||
| Agulha de metal | Carolina Biologicals | 654307 | Tamanho 5 |
| Fly pad | Genesee Científico | 789060 | |
| Alimentado por bateria aspirador frasco w / coleção | UPMA Labs | IPMM 2000 | |
| Belas pinça de ponta | Instrumentos de precisão do mundo | 14095 | |
| Agulhas capilares de vidro | Instrumentos de precisão do mundo | 1B200-6 | |
| Microscópio de dissecção Stereo | Leica Microsystems | S6D | |
| Balança de precisão analítica | Mettler Toledo | AB54S | |
| Sacarose | Sigma-Aldrich | 84097 | |
| Um litro encerado copos de papelão forradas | Fornecedor local | Fabricados copos de sopa | |
| Rede de malha | Fornecedor local | gaze mosca plástico |
Referências
- Drake, L. L., et al. The Aquaporin gene family of the yellow fever mosquito, Aedes aegypti. PloS one. 5, e15578 (2010).
- Shepard, A. R., Jacobson, N., Clark, A. F. Importance of quantitative PCR primer location for short interfering RNA efficacy determination. Analytical biochemistry. 344, 287-288 (2005).
- Altschul, S. F., et al. Gapped BLAST and PSI-BLAST: a new generation of protein database search programs. Nucleic acids research. 25, 3389-3402 (1997).
- Garver, L., Dimopoulos, G. Protocol for RNAi Assays in Adult Mosquitoes (A. gambiae). J. Vis. Exp. (5), e230 (2007).
- Clements, A. N. Volume 1 Development, Nutrition, and Reproduction. The Biology of Mosquitoes. 2, (1992).
- Hansen, I. A., Attardo, G. M., Park, J. H., Peng, Q., Raikhel, A. S. Target of rapamycin-mediated amino acid signaling in mosquito anautogeny. Proceedings of the National Academy of Sciences of the United States of America. 101, 10626-10631 (2004).
- Hansen, I. A., Attardo, G. M., Roy, S. G., Raikhel, A. S. Target of rapamycin-dependent activation of S6 kinase is a central step in the transduction of nutritional signals during egg development in a mosquito. The Journal of biological chemistry. 280, 20565-20572 (2005).
- Pannabecker, T. Physiology of the Malpighian Tubule. Annual review of entomology. 40, 493-510 (1995).
- Dow, J. New insights into Malpighian tubule function from functional genomics. Comp Biochem Phys A. 150, S135 (2008).
- Dow, J. A. T. Insights into the Malpighian tubule from functional genomics. Journal of Experimental Biology. 212, 435-445 (2009).
- Lawson, D., et al. VectorBase: a data resource for invertebrate vector genomics. Nucleic acids research. 37, 583-587 (2009).
- Beyenbach, K. W. Transport mechanisms of diuresis in Malpighian tubules of insects. J. Exp. Biol. 206 (Pt 21), 3845-3856 (2003).
- Coast, G. M. Continuous recording of excretory water loss from Musca domestica using a flow-through humidity meter: hormonal control of diuresis. Journal of insect physiology. 50, 455-468 (2004).
- Kersch, C. N., Pietrantonio, P. V. Mosquito Aedes aegypti (L.) leucokinin receptor is critical for in vivo fluid excretion post blood feeding. FEBS letters. 585, 3507-3512 (2011).
- Hays, A. R., Raikhel, A. S. A novel protein produced by the vitellogenic fat body and accumulated in mosquito oocytes. Development Genes and Evolution. 199, 114-121 (1990).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados