É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Cirurgia estereotáxica de roedores e animais Melhorias Resultado do Bem-Estar de Neurociência Comportamental
Neste Artigo
Resumo
Cirurgia estereotáxica em roedores permite a administração alvo de drogas ou estimulação elétrica e gravações em despertos, comportando-se animais. Neste vídeo de apresentação iremos demonstrar recentes refinamentos processuais para este procedimento de longa data que a taxa de sobrevivência melhorou com sucesso e perda de peso reduzido pós-cirúrgico.
Resumo
Cirurgia estereotáxica para implantação de cânulas em regiões específicas do cérebro tem por muitas décadas foi uma técnica muito sucesso experimental para investigar os efeitos do neurotransmissor localmente manipulados e vias de sinalização em vigília, os animais se comportando. Além disso, a implantação estereotáxica de eletrodos para a estimulação eletrofisiológica e estudos de gravação tem sido fundamental para a nossa compreensão atual de neuroplasticidade e redes cerebrais no comportamento dos animais. Conhecimento cada vez maior sobre a otimização de técnicas cirúrgicas em roedores 1-4, conscientização pública sobre questões de bem-estar animal e legislação rigorosa (por exemplo, de 2010 a Directiva da União Europeia sobre o uso de animais de laboratório 5) nos levou a aperfeiçoar esses procedimentos cirúrgicos, particularmente com respeito a implementação de novos procedimentos para a suplementação de oxigênio e da monitorização contínua da oxigenação do sangue e os níveis de frequência cardíaca durante a cirurgia, bem comointrodução de um protocolo padronizado para atendimento pós-cirúrgico. Nossas observações indicam que essas modificações resultaram em uma taxa de aumento da sobrevida e uma melhora na condição geral dos animais após a cirurgia (por exemplo, perda de peso menor e um animal mais ativo). Esta apresentação de vídeo vai mostrar os procedimentos gerais envolvidos neste tipo de cirurgia estereotáxica com especial atenção para o nosso várias modificações. Vamos ilustrar esses procedimentos cirúrgicos em ratos, mas também é possível realizar este tipo de cirurgia em ratos ou outros animais de laboratório pequenos usando adaptadores especiais para o aparelho estereotáxico 6.
Protocolo
Nota: técnicas de anti-séptico deve ser empregado durante todo o procedimento. Todos os instrumentos e materiais (cotonetes, gazes, etc) que serão utilizados durante a cirurgia deve ser esterilizado em autoclave. A máscara cirúrgica, gorro cabelo e luvas estéreis devem ser usados. A área de trabalho e do aparelho estereotáxico deve ser cuidadosamente limpos e desinfetados com uma solução de etanol 70%.
1. Procedimentos pré-cirúrgicos
- Configurar o aparelho estereotáxico e todos os materiais necessários. Pré-aquecer a almofada de aquecimento.
- Coloque a cânula em seu apoio e verificar se ele é reto.
- Ligue o sistema de gás - mistura de ar ambiente e oxigênio (30-35% do fluxo total deve ser de oxigênio).
- Pesar o rato e administrar o anestésico. Estamos usando uma mistura de cetamina (37,5 mg / kg) e dexmedetomidina (0,25 mg / kg) administrado por via subcutânea. Para protocolos de anestesia diferente, consulte Flecknell 4 e Hellebrekers et al. 7.
- Após o rato perdeu a consciência, raspar a área que vai da cabeça ouvidos apenas entre os olhos com um barbeador elétrico.
- Coloque o rato sobre a almofada de aquecimento, com o nariz na frente do tubo de ar. Use um oxímetro para garantir que o rato tem um nível de oxigenação adequada do sangue (não deve cair <90%). Por favor, siga as instruções do fabricante para a utilização correcta do equipamento.
- Aplicar creme para os olhos (Duratears Z, Alcon) em ambas as córneas para evitar a desidratação.
- Verificar os reflexos do rato (cauda reflexo ou dedo do pé pinch-reflex, como demonstrado no Walantus et al. 8) para garantir que ele seja adequadamente anestesiados. Se o rato continua a mostrar reflexos fortes, a suplementação de anestesia pode ser necessária.
- Se nenhum reflexo toe pinch é mostrado, coloque o rato no aparelho estereotáxico, ajustar as barras de ouvido para que ele mostra a leitura igual em ambos os lados, e coloque novamente o tubo de ar na frente do animalfixando-a com a barra de nariz. Verifique novamente se o rato mostra um nível de oxigenação do sangue de 90% ou mais. Se não, ajuste ou a tubulação, aproximando-a do nariz, ou aumentar o fluxo de oxigênio. Monitorar o nível de oxigenação do sangue e da freqüência cardíaca durante a cirurgia.
- Monitorar continuamente a temperatura do rato com um termômetro retal (preferencialmente ligado a uma almofada de aquecimento) e registre os valores no início e no final da cirurgia. Ajuste a almofada de aquecimento ou usar um cobertor para manter uma temperatura corporal de 37,5 a 38,5 ° C.
2. Cirurgia
- Injetar o analgésico. Estamos usando uma administração peri-operatória única de carprofeno (4,0-5,0 mg / kg, por via subcutânea). Para diferentes protocolos analgésicos, ver Hellebrekers et al. 7.
- Limpar a área raspada de tele pele do centro para o perímetro cabelos três vezes com um desinfectante (por exemplo, clorexidina 0,5%) e localmente injetar uma mistura de lidocaína (20 mg / ml) e adrenalina (5 mg / ml) para anestesia local e vasoconstrição (para evitar sangramento excessivo).
- Faça uma incisão ântero-posterior de cerca de 2,5 cm na linha média do couro cabeludo, passando de entre os olhos até a parte de trás das orelhas. Use grampos 06/04 bulldog para beliscar fora da pele e manter a incisão aberta. Remover qualquer tecido conjuntivo com uma espátula e / ou cotonetes e limpe a área para expor a superfície do crânio.
- Verifique se a cabeça é o nível: Primeiro, encontre Lambda e coloque a cânula guia exatamente sobre esse local, tocando o crânio. Registro a coordenada dorso-ventral. Em seguida, coloque a cânula guia exatamente sobre bregma, tocando o crânio, e registrar sua coordenada dorso-ventral. Estas duas coordenadas devem ser idênticos. Se a diferença for> 0,3 mm, ajuste a barra de nariz para corrigir isso.
- Make dois pequenos furos para a fixação dos parafusos de caveira usando uma broca de mão esterilizados (um milímetro de aproximadamente 5 para o local anterior cânula em um dos hemisférios e os outros 5 mm posterior ao local da cânula no hemisfério contralateral). Coloque dois parafusos estéril nestes buracos até que eles estão bem ancoradas, sem estar completamente inserida dentro do crânio.
- Com a cânula guia colocado exatamente no bregma, gravar as coordenadas ântero-posterior e lateral. O local correto da guia colocação cânula para cada região do cérebro pode ser calculado somando ou subtraindo bregma, com a ajuda de um atlas estereotáxico 9-11.
- Posição da cânula guia no seu local correto, ligeiramente tocando o crânio. Registro a coordenada dorso-ventral. Para a colocação de cânula bilateral, encontrar próxima do local da cânula no outro hemisfério, e novamente recorde a coordenada dorso-ventral. Ambas as coordenadas devem ser idênticos (ou diferir <0,3 mm).
- Marque os locais cânula no crânio com um lápis estéril e, com o perfurador de mão, fazer os furos rebarba, verificar o tamanho ea localização correta com a ajuda da cânula guia. Uma vez que os buracos são feitos, use uma agulha estéril para perfurar o meninges suavemente para permitir a inserção desobstruída da cânula.
- Coloque a cânula no orifício primeiro e abaixá-lo com cuidado até que ele atinja a cota final ventral. Prepare o cimento dental e generosamente aplicá-la ao redor da cânula e um ou dois parafusos para fixar a cânula. Aguarde até que o cimento secar por completo. Depois, remova cuidadosamente o apoio cânula girando para cima dorso-ventral bar.
- Coloque a cânula segundo para o apoio e vá até o local da cânula no outro hemisfério. Coloque a cânula no orifício e repita o passo anterior. Cobrir os parafusos e uma grande superfície das cânulas com o cimento, e antes que o cimento secar, retirar qualquer excesso da pele.
- Injetar quente (~ 37 ° C) solução salina estéril (~ 10 ml / kg, sc) para garantir a reidratação.
- Depois que o cimento esteja completamente seca, retire o apoio cânula e coloque um alfinete estéril em cada cânula para evitar obstrução.
- Limpar a área da ferida com solução salina estéril e sutura da frente e as costas da ferida.
- Remover o animal do aparelho estereotáxico, substituindo a tubulação de gás na frente de seu nariz. Continuar a acompanhar o nível de saturação de oxigênio e temperatura corporal.
- Se um anestésico injetável com dexmedetomidina é usada, injetam sua atipamezol antagonista (0,25 mg / kg, sc) e aguarde até que o animal acorda (aproximadamente 5 minutos).
- Coloque o rato em uma gaiola de recuperação. Para evitar a hipotermia, coloque a gaiola em uma incubadora a 28 ° C ou em uma almofada de aquecimento em um lugar onde você pode observar o animal por pelo menos uma hora, antes de retornar à sala de viveiro.
3. Cuidados pós-cirúrgicos
- Durante os primeiros 4 dias após a cirurgia, monitor de recuperação do rato, mantendo os registros diários de peso e outras observações a respeito da condição do animal em laboratório ou diários de bordo "diários bem-estar animal".
- Animais que mostram sinais evidentes de infecção doença, do ferimento, perda de peso corporal ou outros sinais de redução de bem-estar devem ser submetidos a cuidados especiais: por exemplo, uma dose extra de analgésicos para minimizar a dor pós-operatória, uma mistura de alimentos em pó e água além de ração padrão para estimular o apetite do rato, e / ou uma injecção subcutânea de solução salina para apoiar a reidratação.
- Se o rato não mostra qualquer melhora após essas intervenções, ou a perda de peso corporal é> 15% (em comparação à cirurgia pré-peso), o sacrifício do animal com uma overdose de anestésico (humana ponto final).
- Ratos normalmente precisam de recuperar, pelo menos, sete dias antes do início dos experimentos comportamentais.
4. Resultados representante
> jove_content "Para determinar se a várias modificações ao nosso procedimento cirúrgico, particularmente com relação à suplementação de oxigênio e do monitoramento contínuo dos níveis sanguíneos de oxigenação, freqüência cardíaca e temperatura corporal, maior a sobrevida do animal e melhorou sua condição geral após a cirurgia, foram comparados os não-sobrevivência taxa de 20 grupos de animais (composto de 20 ratos cada) que foram submetidos à cirurgia depois que implementou essas modificações com a taxa de sobrevivência não de 24 coortes (20 ratos cada) operado com o protocolo padrão. Como é mostrado na Figura 1a , a taxa de sobrevivência não foi significativamente reduzida na amostra de coortes que foi operado com o protocolo modificado (P <0,05; Mann-Whitney, duas caudas). Além disso, como é mostrado na Figura 1b, perda de peso pós-cirúrgica de ratos operados com o protocolo modificado também foi significativamente reduzida quando comparada com a de ratos operados com o procedimento normal (dia pós-operatório 1: P <0,05; dia pós-operatório 2: P <0,01; dia pós-operatório 3: P = 0,17; Student t-tests).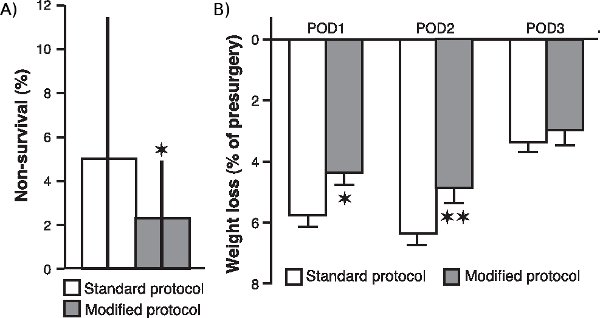
Figura 1. Efeito de modificações cirúrgicas sobre a não-sobrevivência taxa e pós-cirúrgico de perda de peso. (A.) taxa de não-sobrevivência de ratos operados com o protocolo modificado em comparação com a de ratos operados com o protocolo padrão. A taxa de não-sobrevivência (média ± interquartil faixas) foi calculado como o percentual de ratos, por coorte de 20 ratos, que não sobreviveu a cirurgia. * P <0,05, Mann-Whitney bicaudal (n = 20 coortes para o protocolo modificado e 24 coortes para o protocolo padrão). (B) A perda de peso (média ± EPM em percentagem do peso pré-cirurgia), durante o primeiro (Pod1), segundo (POD2) e terceira (POD3) dia pós-operatório. * P <0,05, ** P <0,01, teste t de Student (n = 60 por grupo).
Discussão
O principal objectivo desta apresentação de vídeo é familiarizar os neurocientistas comportamentais com os princípios básicos da cirurgia estereotáxica. Pesquisadores que já estão realizando a cirurgia estereotáxica pode também beneficiar deste vídeo e considerar alguns dos refinamentos processuais para o uso em seu próprio laboratório. Um conhecimento cada vez maior sobre a otimização de técnicas cirúrgicas 1-3, o desenvolvimento de novos anestésicos e analgésicos para uso em medicina hum...
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Os autores agradecem Gerrits Dr. Peter para os desenhos usados no vídeo.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | ||
| Álcool a 70% | VWR | ||
| Antisedan (atipamezole) | Orion | ||
| Sulfato de atropina 0,5 | Pharmachemie BV | ||
| Bulldog pinça hemostática | Aesculap | ||
| Cânulas | Component Supply Co. | ||
| Clorexidina 0,5% | AppepPharma | ||
| Limpeza em pó | Alconox | ||
| Varas de algodão | Hartmann BV | ||
| Dexdomitor (dexmedetomidina) | Orion | ||
| Broca | Dremel 8000 | ||
| Duratears Z | Alcon | ||
| Durogrip Naaldvoerder conversar 130 milímetros | Aesculap | ||
| Durotip Fijne schaar ret.sp / st 110 milímetros | Aesculap | ||
| Gaze | Medicomp (5x5) | ||
| Almofada de aquecimento | Harvard Apparatus | ||
| Pinos de insetos (estiletes) | Entosphinx (Czech Republik) | ||
| Ketamina 10% (ketamina) | Alfasan | ||
| Micro-Halsted ponta reta | Aesculap vet- | ||
| Molinea | Hartmann BV | ||
| NaCl 0,9% | Baxter | ||
| Agulhas (25G) | Terumo | ||
| Oxímetro | Edan Instruments, Inc. | ||
| Pentobarbital | Farmácia da UMCG | ||
| Rimadyl | Pfizer | ||
| Lâmina de bisturi n º 23 | Swann Morton | ||
| NR Scalpelholder. 4 133 milímetros | Aesculap | ||
| Chave de fenda | Loja Hardware convencionais | ||
| Simplex rápida (cimento dental) | Kemdent | ||
| Parafusos crânio | Component Supply Co. | ||
| Espátula | VWR | ||
| Spongestan especiais | Johnson & Johnson | ||
| Stereotacts | Kopf Instruments | ||
| Pinça cirúrgica 100 milímetros | Aesculap | ||
| Material de sutura Safil 5 / 0 | Aesculap | ||
| Seringa de 10 ml | Omnifix | ||
| Seringa de 1ml | Terumo | ||
| 5ml da seringa | Omnifix | ||
| Xilocaína (lidocaína / adrenalina) | Astra Zeneca |
Referências
- Russell, W. M. S., Burch, R. L. . The Principles of Humane Experimental Technique. , (1959).
- Richardson, C. A., Flecknell, P. A. Anaesthesia and post-operative analgesia following experimental surgery in laboratory rodents: are we making progress?. Altern. Lab Anim. 33, 119-127 (2005).
- Stokes, E. L., Flecknell, P. A., Richardson, C. A. Reported analgesic and anaesthetic administration to rodents undergoing experimental surgical procedures. Lab Anim. 43, 149-154 (2009).
- Flecknell, P. A. . Laboratory Animal Anaesthesia - A Practical Introduction for Research Workers and Technicians. , (2009).
- . DIRECTIVE 2010/63/EU OF THE EUROPEAN PARLIAMENT AND OF THE COUNCIL of 22 September 2010 on the protection of animals used for scientific purposes. Official Journal of the European Union. , (2010).
- Geiger, B. M., Frank, L. E., Caldera-Siu, A. D., Pothos, E. N. Survivable Stereotaxic Surgery in Rodents. J. Vis. Exp. (20), e880-e880 (2008).
- Hellebrekers, L. J., Booij, L. H. D. J., Flecknell, P. A., Van Zutphen, L. F. M., Baumans, V., Beynen, A. C. Anaesthesia, analgesia and euthanasia. Principles of Laboratory Animal Science. , 277-311 (2001).
- Walantus, W., Elias, L., Kriegstein, A. In utero intraventricular injection and electroporation of E16 rat embryos. J. Vis. Exp. (6), e236-e236 (2007).
- Paxinos, G., Watson, C. . The Rat Brain in Stereotaxic Coordinates. , (1986).
- Paxinos, G., Watson, C. . The Rat Brain in Stereotaxic Coordinates. , (2007).
- Swanson, L. W. . Brain Maps: Structure of the Rat Brain. , (1992).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados