É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Reprodutível mouse esmagamento do nervo ciático e subsequente avaliação de Regeneração por Análise Whole Mount muscular
Neste Artigo
Resumo
Neste relatório nós descrevemos um método para esmagamento do nervo ciático do rato. Este método usa prontamente disponíveis pinça hemostática e facilmente reproduzível e produz esmagamento do nervo ciático completa. Além disso, nós descrevemos um método para preparar montagens de músculos inteiros adequados para análise da regeneração do nervo após esmagamento do nervo ciático.
Resumo
Regeneração do sistema nervoso periférico (SNP) é amplamente estudada tanto pela sua importância para as doenças humanas e para entender a resposta robusta regenerativo montado pelos neurônios do SNP, assim, possivelmente, iluminando as falhas do CNS regeneração 1. Esmagamento do nervo ciático (axoniotmese) é um dos modelos mais comuns de lesão do nervo periférico em roedores 2. Esmagamento interrompe todos os axônios, mas Schwann lâminas de células basais são preservados para que a regeneração é ideal 3,4. Isto permite que o investigador para estudar precisamente a capacidade de um axónio crescente para interagir com tanto a célula de Schwann e as lâminas basais 4. Ratos foram geralmente os modelos animais preferidos para esmagamento do nervo experimental. Eles são amplamente disponíveis e seu nervo lesado fornece uma aproximação razoável das lesões nervosas humanas 5,4. Embora menor em tamanho do que rato nervo, o nervo do mouse tem muitas qualidades semelhantes. Mais importante, porém, mousmodelos E são cada vez mais valiosa porque a grande disponibilidade de linhas transgénicas permite agora uma dissecção detalhada das moléculas individuais críticos para a regeneração do nervo 6, 7. Antes investigadores usaram vários métodos para produzir uma queda ou lesão do nervo, incluindo simples fórceps, pinças anguladas refrigerados, pinças hemostáticas, braçadeiras e fixações, vasculares, investigador-concebidas 8,9,10,11,12. Os pesquisadores também utilizaram vários métodos para marcar o local da lesão, incluindo sutura, partículas de carbono e partículas fluorescentes 13,14,1. Nós descrevemos o nosso método para obter um esmagamento do nervo ciático reprodutivelmente completa com precisão e persistente marcação do local de esmagamento utilizando uma pinça fina hemostáticos e carbono subsequente esmagamento do local de marcação. Como parte de nossa descrição do procedimento de esmagamento do nervo ciático incluímos também um método relativamente simples de montar todo músculo que usamos para quantificar a regeneração posteriormente.
Protocolo
1. Sujeitos animais
1,1. Tratamento
- Todos os procedimentos com animais deve ser realizada com a aprovação do modelo assistencial local Animal e Comitê de Ética e de acordo com o uso ea Comissão e os Institutos Nacionais da Saúde, com as medidas tomadas para minimizar a dor e desconforto.
- Os nossos ratinhos foram alojados sob condições controladas de temperatura sobre uma luz reversa de 12 horas e ciclo escuro, enquanto alimentados rato Chow e água ad libitum.
- Para os estudos de regeneração adulto, os ratinhos deve ser de pelo menos 6 semanas de idade, quando o esmagamento do nervo ciático é executada. Esta época é além do tempo em que a poda de polyneural junções neuromusculares ter lugar.
- Nestas experiências, utilizou-se 6-8 semanas de idade C57BL / 6 ratinhos adquiridos de Charles River. Ao comparar a regeneração após esmagamento do nervo ciático (isto é: taxa de crescimento axonal) linhagens deve ser o mesmo, como diferenças na regeneração axonal não têm sidoed entre diferentes linhagens produzidas 15,16. Se os ratos geneticamente manipuladas são para ser utilizados, os controlos ninhada são mais apropriados.
1,2. Preparação cirúrgica
- Os animais são anestesiados profundamente para cirurgia, utilizando um cocktail de cetamina (100 mg / kg) e xilazina (10 mg / kg) via injecção intraperitoneal. Cada animal recebe também uma injecção subcutânea de meloxicam (10 mg / kg) para minimizar a dor pós-operatória.
- Ambos os quartos traseiros são cuidadosamente raspada usando uma tesoura cirúrgica (Roboz, RC-5903) e depilação é concluída com Nair creme de depilação (encontrado em farmácia local).
- A pele é limpa com aplicadores de algodão estéreis pontas e esfregar betadine cirúrgica (Fisher Scientific, 19066452).
- Pomada oftálmica (Fisher Scientific, 19.082.795) é aplicada para os olhos, utilizando aplicadores de algodão estéril ponta.
- O rato é colocado sobre uma placa de aço inoxidável limpo, sob a qual foi colocada uma homeot pré-aquecidosistema de cobertor hermic (Harvard Apparatus, 507222F). A temperatura do animal é mantida a 37 ° C.
- Todos os membros são gravadas para baixo, com cuidado para posicionar os membros posteriores simetricamente de modo que a articulação do joelho faz um ângulo recto com o corpo (Figura 1, painel A).
- O campo cirúrgico é coberto com uma cortina estéril. Todos os instrumentos são esterilizados por autoclave ou esterilização talão quente (Ferramentas Ciência Belas, 18000-45) eo cirurgião usa uma máscara, avental e luvas estéreis.
2. Esmagamento do nervo ciático reprodutíveis
- Após a preparação, uma incisão semi-circular através da linha média (Figura 1) é feita na pele. A pele é suavemente dissecada da musculatura subjacente, e dobrada sobre a permanecer fora do caminho durante o procedimento. É mantido húmido utilizando aplicações de 0,1 mL de solução salina estéril (Hospira, 0409-4888-20) durante o procedimento.
- Abrindo o plano fascial entre o glúteo máximo eo chefe anterior da coxa bícepss revela o nervo ciático (Figura 1, painel A). Para um controle cirúrgico, o nervo ciático contralateral devem ser expostos e mobilizados, mas deixou intacto. A musculatura glútea é então re-oposição e suturada com um 6-0 de seda trançada, fios não absorvíveis (Roboz, SUT-1073-1011).
- O nervo ciático experimental é então exposta da mesma maneira, com afastadores no lugar para facilitar a visualização (Figura 1, painel B). Os afastadores são esterilizados antes da utilização.
Nota: embora os sistemas retractor estão comercialmente disponíveis, são muitas vezes bastante caros. Fomos capazes de fazer um sistema retrator satisfatórias, utilizando suprimentos de hardware de baixo custo e alfinetes de insetos (ver secção de Materiais). - O nervo ciático é então suavemente libertado a partir do tecido conjuntivo envolvente com tesoura iridectomia.
- Usando uma multa 5/45 (Ferramentas Ciência Belas, 11251-35) fórceps, o nervo é colocado sobre a mandíbula inferior de uma pinça hemostática super-finas (Ciência bom demaisls, 13020-12). Os três fascículos são sequencialmente alinhados, e não em cima uns dos outros (Figura 1, B inserção). As pinças hemostáticas foram gravados com uma marca de 1,5 mm de sua ponta. A porção mais externa do ciático é colocado em linha com esta marca antes de esmagamento. Isto assegura um esmagamento de largura uniforme, e que o nervo não se estende para além das maxilas da pinça hemostáticos quando achatada, devido à força de esmagamento. Se o nervo se estende para além da ponta do nervo pinça será apenas parcialmente esmagada.
- O esmagamento é feita perpendicular ao nervo em 45 mm a partir do terceiro dedo, tal como medido por um segmento que se aproxima do caminho do nervo ciático. O nervo é esmagada de uma vez por 15 segundos a 3 cliques dos pinça hemostática. O cuidado é tomado para não esticar o nervo. Quando os hemostats são re-aberto, o nervo inteiro deve ser translúcido no local de esmagamento.
- Um segundo par de pinças hemostáticas (idêntico ao primeiro) que tenha sido pré-mergulhados emcarbono em pó (Fisher Scientific, C272-500) é usado para marcar o local do esmagamento. O nervo é esmagado no local da queda mesmo por 15 segundos em 3 cliques. Sem marcação de carbono deve se estender além do limite da paixão inicial. Isto é particularmente importante se precisa de marcação do local de esmagamento é necessária. Antes de usar, pó de carbono é esterilizada por exposição à luz UV durante duas horas e, seguidamente, é tratado usando uma técnica estéril.
- Para pré-molhar as pinças em carbono, mas impede carbono generalizada no local cirúrgico, as pinças são abertos em carbono em pó, então suavemente fechado (mas não clicado) fechadas, eo carbono, no exterior das hemostats é varrido utilizando gaze estéril . Os fórceps são verificadas sob, pelo menos, ampliação 3x para verificar que as superfícies de trituração são uniformemente revestidas de carbono em pó. Se necessário, eles são re-mergulhadas e limpou.
- A musculatura glútea é re-oposição e suturada da mesma maneira como o lado contralateral.
- Finalmente, a incisão na pele é fechada com 9 mm clipes reflexo (Instrumentos de Precisão do Mundo, 500346; aplicador: 500345). Se 9 mm clipes reflexas são encontrados para restringir o movimento, menores clipes de reflexo ou 6-0 (Roboz, SUT-1073-11) pode ser usado em vez disso.
3. Cuidados pós-operatório
- Seguindo o procedimento, os animais são colocados em uma almofada de aquecimento a 37 ° C até que eles mostram sinais de movimento.
- Eles são então movido de volta para a sua gaiola de origem, onde a água e alimentos são prontamente acessíveis no chão sob a forma de hidrogel e alimentar humedecida.
4. Semi-Thin Preparação
- Após uma overdose de pentobarbital (300 mg / kg) a musculatura da perna é removida para expor o nervo ciático *. Com o nervo restante in situ, o quarto traseiro é imerso em paraformaldeído a 2% e glutaraldeído a 2% em tampão fosfato 0,1 M em gelo durante 30 minutos.
* Se completar a preparação muscular de todo o monte, os músculos são colheitaed antes de expor o nervo ciático. - O nervo é cuidadosamente removido, com cuidado para manipular apenas a extremidade proximal. Em seguida, o nervo é pós-fixadas no fixador mesmo durante três horas adicionais.
- Após a fixação do nervo é lavada três vezes em tampão fosfato 0,1 M.
- O nervo é imerso em tetróxido de ósmio a 2% em tampão fosfato 0,1 M durante uma hora.
- O nervo é então desidratada por imersão sequencial em etanol cada vez mais concentrada (50%, 70%, 80%, 95%, 100%, 100%, 100%). Cada imersão é de 15 minutos.
- O nervo desidratado é incubado por duas vezes em óxido de propileno durante três minutos cada.
- Em seguida, o nervo é imerso numa mistura de 1:1 de óxido de propileno e Incorporar 812 durante pelo menos 6 horas (normalmente durante a noite).
- Em seguida, o nervo é imerso numa mistura de 2:1 de óxido de propileno e 812 Incorporar durante a noite.
- Finalmente, o nervo está imerso em Incorporar puro 812 durante seis horas, em seguida, incorporado no molde apropriado e baked a 60 ° C durante 48 horas.
- 1.0 uM secções são cortadas a partir do coto do nervo distai a uma distância definida a partir do local do esmagamento utilizando uma Ultracut UCT ultramicrótomo (Leica) com uma faca de vidro e coradas com azul de toluidina. Secções finas podem também ser produzidos para exame de ultra-estrutura por microscopia electrónica.
5. Preparação muscular de todo o Monte
- Ratinhos primeiros são sacrificados com uma overdose de pentobarbital (300 mg / kg) e os membros posteriores são removidos os joelhos.
- Quatro músculos do membro posterior são removidos para análise: o tibial anterior (TA), extensor longo dos dedos (EDL), sóleo e fibular longo.
- Todos os músculos são removidos através de dissecação cuidadosa e fixado através da sua tecido conjuntivo para um Sylgard preto (Fisher Scientific, NC9492579) prato revestido. Eles são lavadas em PBS e, em seguida fixados em paraformaldeído a 4% durante 30 minutos.
- O TA é então lavadas em PBS, embebidos em OCT (Fisher Scientific, 14-373-65), e rapidamente congelados em um banho de gelo-acetona e seco.
- Ele é armazenado a -80 ° C durante seccionamento fina no caso de preparação de montagem inteira falhar. Em geral, a TA é demasiado espesso para adequados peças inteiras.
- A EDL, sóleo, fibular longo e são lavadas por 3 x 10 minutos em PBS, colocados em glicina 0,1 M * (Fisher Scientific, AC12007-0010; diluído em PBS) durante 30 minutos, e lavadas 3 x 10 minutos em PBS novamente. Eles são, então, arrefecida em metanol arrefecido em gelo de 100% durante exactamente 5 minutos a -20 ° C, lavados 3 x 10 minutos em PBS, e banhada em bungarotoxina fluorescentemente conjugado alfa-(diluído 1:200 em PBS) durante 30 minutos. Os músculos são lavadas por 3 x 10 minutos em PBS, seguido por um bloco de 1-hora em BSA a 2% (KPL, 50-61-00) e Triton 0,2% X-100 (Dot Scientific Incorporated, 9002-93-1) em PBS *, e incubadas durante a noite, enquanto agitando a 4 ° C em um cocktail de anticorpos primários diluídas no bloco Triton mesmo 2% BSA/0.2%.
* Glycine e soluções de bloqueio são feitas no mesmo dia da colheita, como músculo e agitou-se durante 30-60 minutos à temperatura ambiente antes de usar.- Para marcar axónios e sinapses neuromusculares, usamos uma combinação de um marcador de neurofilamento monoclonal de ratinho (Covance, SMI-312R; diluído 1:1000), um rato marcador vesícula sináptica monoclonal (SV2 DSHB, diluída 1:1000), e alfa rodamina conjugada -bungarotoxina (Sigma-Aldrich, diluiu-se 1:200). Para marcar as células de Schwann reactivos usamos de coelho anti-GAP-43 (Novus Biologicals, NB300-143, diluído 1/500). Os anticorpos primários são visualizadas com uma específica fluoresceína IgG1 subtipo de cabra conjugado anticorpo secundário anti-rato e DyLight 649 conjugado de burro anti-coelho (Jackson ImmunoResearch, diluiu-se 1:200).
- No dia seguinte, os músculos são lavadas em PBS durante 3 x 10 minutos, e incubadas em anticorpos secundários diluída 1:200 (em 2% de solução de Triton BSA/0.2% de bloqueio). Eles são então lavadas 2 x 10 minutos em PBS, followed por uma imersão de 5 minutos em DAPI (Invitrogen, D3571; diluída para 300 nM em água desionizada), e outra de 10 minutos enxaguar em PBS.
- Cada músculo é então dissecado em uma Sylgard preto (Fisher Scientific, NC9492579) prato de petri revestidas. Inicialmente, os tendões são removidos nos seus pontos de inserção no músculo e em seguida, os músculos são diluídos através descascar fibras musculares interiores (Figura 3, os painéis AC). É tomado cuidado para preservar superfície exterior do músculo, incluindo as bandas de placa terminal (Figura 3, os painéis DF). Os músculos resultantes são montadas em lâminas e adicionalmente (Fisher Scientific, 12-550-15) com vectashield (Vector Laboratories, H-1000) e 22 x 40 mm lamelas de vidro (Fisher Scientific, 12-548-5C) seladas por claro unha polonês em dois lados. Quando devidamente montado no slide os contatos da banda placa terminal lamela o.
6. Medindo Regeneração
- A regeneração pode ser estimada em todos os três músculos (fibular, EDL, e sóleo). Nós muitas vezes examina regeneração catorze dias após esmagamento do nervo, um momento em que uma percentagem substancial de NMJs são re-inervado. Ambos os pontos anteriores e posteriores tempo também são adequados, dependendo da questão científica que está sendo perguntado. Em cada músculo, reinervação da banda placa terminal inteira é examinada. Apenas en NMJs superfície da face são pontuados. Nesta forma, pelo menos, 200 NMJs por músculo pode ser rapidamente examinado.
- Para marcar muscular reinervação vamos determinar uma "relação de reinervação". O denominador é o número de desnervados junções neuromusculares como rotuladas por α bungarotoxina-GAP-43 de ligação celular e imunoreatividade Schwann. O numerador é o número de re-inervados NMJs como rotulados por neurofilament/SV2 imunorreactividade. Se necessário, NMJs podem ser classificados como parcialmente (cobertura incompleta do α bungarotoxina por SV2) ou totalmente (a cobertura completa do α bungarotoxina por SV2) re-inervado. Para exemplos de NMJs re-inervados e desnervado ver Figura 3, os painéis G e H.
7. Os resultados representativos
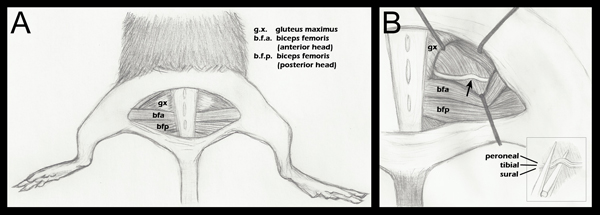
Figura 1. Esquemática da anatomia dos membros posteriores importante para esmagamento do nervo. A. Uma incisão na pele semi-circular foi feita revelando a musculatura subjacente. B. A musculatura glútea foi separada, eo nervo ciático revelou (passo 2.4 acima). Uma seta indica o local do esmagamento aproximada. Colocação retractor é mostrado como um guia geral, e é ajustado durante cada cirurgia para facilitar a visualização do ciático e abordagem da pinça hemostáticos para esmagamento B (inserção):. Colocação do ciático na mandíbula inferior da pinça hemostáticos pouco antes esmagamento (passo 2.5 acima). Fascículos separados são rotulados para demonstrar que são adjacentes horizontalmente, mas não na vertical, durante o esmagamento. Embora três FASCicles são rotulados neste diagrama, pode-se ver também um fascículo quarto, o ramo articular do peroneal. Para um desenho anatômico mais detalhada dos padrões de ramificação do nervo ciático fascículos distal ao ponto de queda, consulte Anatomy Greene do Rato, a Figura 188 17.
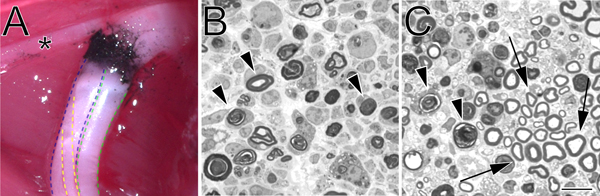
Figura 2. Um local de esmagamento de carbono marcado in situ e azul de toluidina-coradas, semi-finas secções de nervo ciático esmagado. A. Um exemplo de um local do esmagamento in situ (membro posterior esquerdo). Negro de carbono indica o local do esmagamento. O asterisco marca um ramo do nervo tibial que inerva musculatura da coxa e serve como um marco útil durante a cirurgia de esmagamento. A divisão tibial do nervo ciático é delineada em azul, o peroneal em verde, eo sural em amarelo. B. Semi-finas seções demonstrando uma queda completo realizado com força hemostáticops. C. Semi-finas seções demonstrando uma paixão incompleta realizada com pinças anguladas. Em ambos os perfis de imagens em degeneração de mielina são marcados com setas. No painel de setas C marcar exemplos de perfis de mielina preservada e um cluster de axônios poupados. Barra de escala é de 10 mM.
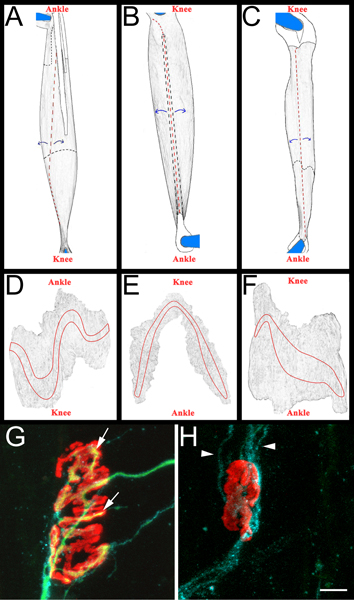
Figura 3 esquemática músculo inteiro de montagem e NMJs representativas AC:.. Imagens renderizadas de EDL (A), fibular longo (B) e (C) músculos sóleo após a remoção do membro posterior. Músculos são indicados a partir de membro posterior direito. Joelho e tornozelo orientação anatômica também estão incluídas para referência. Os tendões são coloridos branco e descrito em uma linha preta sólida quando posicionado na parte superior do músculo. Eles são descritos em uma linha preta tracejada quando elas se estendem por baixo do músculo. Os cortes são mostrados em uma linha tracejada vermelha.Músculo é desenrolada longe dos locais de corte, como indicado pelas setas azuis, e, subsequentemente, diluída. Após o desbaste, o músculo é separado dos pinos cortando em torno do que resta dos tendões fixados DF:. Imagens renderizadas de músculos montagem inteiros após a remoção do tecido conjuntivo e posterior desbaste. As bandas de placa terminal estão descritas em cada músculo GH:. Músculo sóleo montagem inteira catorze dias após esmagamento do nervo ciático demonstrando re-inervados (G) e desnervado junções (H) neuromusculares. Nestes painéis, NMJs, axônios, e células de Schwann são visualizadas como descrito acima na secção 5.5.1. Os receptores de acetilcolina são vermelho, verde axônios e células de Schwann processa azul. No painel de G, as setas indicam as áreas da JNM que foram re-inervados por um axônio. Em painel pontas de seta H indicam GAP-43 processos celulares positivas de Schwann. Note a ausência de axônios. Barra de escala é de 10 mM.
Discussão
Nós apresentamos um método para obter um esmagamento do nervo ciático confiável completa com marcação precisa do local do esmagamento. Como mencionado anteriormente, esmagamento do nervo ciático é um modelo comum de lesão do nervo periférico em ratinhos e ratos. Apesar de cada método de esmagamento tem as suas vantagens e desvantagens, encontramos este método produziu uma queda completa que foi facilmente marcado com um mínimo de equipamento especial (por exemplo, braçadeiras especiais, etc).
Divulgações
Não temos nada a divulgar.
Agradecimentos
Este trabalho foi financiado pelo NIH concede K08NS065157 (a TAF) Além disso, o Centro Penn para lesões músculo-esqueléticas, P30AR050950 Prêmio Número do Instituto Nacional de Artrite, Doenças músculo-esqueléticas e da pele apoiaram este trabalho (TAF e Steven S. Scherer). Finalmente, Shriners Pediatric Research financiamento semente Center (TAF) apoiaram este trabalho. Nós gostaríamos de agradecer o Dr. Young-Jin Son inicialmente para demonstrar todo o processo de montagem e Amy A. Kim por sua ajuda na produção dos desenhos da Figura 1.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome (descrição / quantidade) | Fornecedor | Número de Catálogo | |
| Clipper Mini com No. 0000 Lâmina | Roboz | RC-5903 | |
| Nair Depilação (9 oz.) | Igreja e Dwight Co., Inc. | N / A | |
| Scrub Betadine Cirúrgica (1 galão) | Fisher Scientific | 19066452 | |
| Pomada oftálmica (1 oz.) | Fisher Scientific | 19082795 |
Os instrumentos cirúrgicos:
| Nome (descrição / quantidade) | Fornecedor | Número de Catálogo |
| FST 250 Hot talão esterilizador | Belas Ferramentas Ciência | 18000-45 |
| Iris Tesoura (11 cm de comprimento) | Instrumentos de precisão do mundo | 500216 |
| Potts-Smith Fórceps (Straight; 18 centímetros; 1x2 Dentes) | Belas Ferramentas Ciência | 11024-18 |
| McPherson Vannas-Tesoura (5 lâminas mm) | Instrumentos de precisão do mundo | 14.124-G |
| Dumont # 5 - Fórceps Dumoxel Padrão Dica | Belas Ferramentas Ciência | 11252-30 |
| Dumont # 5/45 - Fórceps Dumoxel Padrão Dica | Belas Ferramentas Ciência | 11251-35 |
| Ultra hemostats Belas (em linha reta; superfícies internas lisas) | Belas Ferramentas Ciência | 13020-12 |
| Carbono activado em pó (500 g) | Fisher Scientific | C272-500 |
| Tamanho 6-0 com C-1 Agulha (Silk, estéril, Preto, Trançado,Não-absorvível; 18 "Comprimento; Box of 36) | Roboz | SUT-1073-1011 |
| Reflex Aplicador Clip (para 9 clipes mm) | Instrumentos de precisão do mundo | 500345 |
| 9mm aço inoxidável Clipes de Reflexos (100/box) | Instrumentos de precisão do mundo | 500346 |
Animal Care:
| Nome (descrição / quantidade) | Fornecedor | Número de Catálogo |
| 0,9% de cloreto de sódio (Conservante livre; 20 mL) | Hospira | 0409-4888-20 |
| Sistema completo Blanket homeotérmicos com sonda flexível (Medium, 115 VAC, 60 Hz) | Harvard Apparatus | 507222F |
Platfor cirúrgicom e Afastadores:
(Comprado em loja de ferragens local)
| Nome (descrição /) | Quantidade |
| Inoxidável plataforma de aço (moído; ~ 12 "x12" x1 / 8 ") | 1 |
| Ímãs Button (Exemplo: Eclipse E825) | 3 |
| Parafusos de aço inoxidável (3 "Long; diâmetro determinado pelo imã Button) | 3 |
| Porcas de aço inoxidável (sob medida para caber Bolts) | 9 |
| Bandas de borracha (tensão leve) | 3 |
| Pinos de insetos (ambos os extremos dobrados para formar Ganchos) | 3 |
Semi-Thins:
| Nome (descrição / quantidade) | Fornecedor </ Strong> | Número de Catálogo |
| Paraformaldeído (1 kg) | Sigma-Aldrich | P6148-1KG |
| Fosfato de Sódio Dibásico anidro (500 g; utilizado para preparar tampão fosfato) | Fisher Scientific | S375-500 |
| Fosfato de sódio monobásico anidro (1 kg; usado para preparar tampão fosfato) | Fisher Scientific | AC38987-0010 |
| O glutaraldeído (50%; 10 x 10 mL) | Ted Pella, Inc. | 18431 |
| Tetróxido de ósmio (aquoso a 4%, 10 x 10 mL) | Ted Pella, Inc. | 18465 |
| Óxido de propileno (450 mL) | Ted Pella, Inc. | 18601 |
| Incorporar 812 (Kit, para os blocos rígidos / alto contraste de imagem) | Electron Microscopy Sciences | 14120 |
| Toluidine azul (25 g) | Ted Pella, Inc. | 19451 |
Preparação muscular de todo o monte e Imuno-histoquímica:
| Nome (descrição / quantidade) | Fornecedor | Número de Catálogo |
| Paraformaldeído (1 kg) | Sigma-Aldrich | P6148-1KG |
| Fosfato de Sódio Dibásico anidro (500 g; utilizado para preparar tampão fosfato) | Fisher Scientific | S375-500 |
| Fosfato de sódio monobásico anidro (1 kg; usado para preparar tampão fosfato) | Fisher Scientific | AC38987-0010 |
| 10% de BSA Diluente Solução / bloqueio (200 mL) | Kirkegaard e Perry Laboratories, Inc. | 50-61-00 |
| Triton X-100 (100 mL) | Dot Scientific Incorporated | 9002-93-1 |
| Glicina, 98% (1 kg) | Fisher Scientific | AC12007-0010 |
| Tissue-Tek Cryo-OCT Compound (acórdão de 12, 4 garrafas de oz) | Fisher Scientific | 14-373-65 |
| Sylgard DOW 170 (2 Kit lb) | Fisher Scientific | NC9492579 |
| Pinos de aço inoxidável de insetos, Tamanho 1 (100/pkg) | Belas Ferramentas Ciência | 26001-40 |
| Tetrametilrodamina-A-bungarotoxina (0,5 mg) | Sigma-Aldrich | T0195-.5MG |
| Anticorpo monoclonal de ratinho contra a SMI-312 (0,1 mL) | Covance | SMI-312R |
| Anticorpo monoclonal de ratinho contra o SV2 (0,1 mL) | Desenvolvimento de Estudos Hybridoma Bank (DSHB) | SV2 |
| Coelho PolyAnticorpo contra clonal GAP-43 | Novus Biologicals | NB300-143 |
| Flourescein de cabra conjugado IgG anti-ratinho, Fcy subclasse 1 específico | Jackson ImmunoResearch | 11 5-095-205 |
| DyLight 649 Conjugado de burro anti-IgG de coelho | Jackson ImmunoResearch | 711-495-152 |
| 4 ',6-diamidino-2-fenilindol (DAPI, dilactate; 10 mg) | Invitrogen | D3571 |
| Meio de Montagem Vectashield (10 mL) | Vector Laboratories | H-1000 |
| Além disso Superfrost Lâminas de Microscopia (branco, Tamanho: 75 x 25 mm; Pack of 144) | Fisher Scientific | 12-550-15 |
| Óculos Fisherfinest Premium Cover (Tamanho: 40 x 22 mm; Pack de 1 oz.) | Fisher Scientific | 12-548-5C |
Referências
- Pan, Y. A., Misgeld, T., Lichtman, J. W., Sanes, J. R. Effects of neurotoxic and neuroprotective agents on peripheral nerve regeneration assayed by time-lapse imaging in vivo. J. Neurosci. 23, 11479-11488 (2003).
- Magill, C., Tong, A., Kawamura, D., Hayashi, A., Hunter, D. Reinnervation of the tibialis anterior following sciatic nerve crush injury: A confocal microscopic study in transgenic mice. Exp. Neurol. 207, 64-74 (2007).
- Amado, S., Simñes, M. J., Armada-da-Silva, P. A. S., Luís, A. L., Shirosaki, Y. Use of hybrid chitosan membranes and N1E-115 cells for promoting nerve regeneration in an axonotmesis rat model. Biomaterials. 29, 4409-4419 (2008).
- Luís, A. L., Rodrigues, J. M., Geuna, S., Amado, S., Simðes, M. J. Neural cell transplantation effects on sciatic nerve regeneration after a standardized crush injury in the rat. Microsurgery. 28, 458-470 (2008).
- Luís, A. L., Amado, S., Geuna, S., Rodrigues, J. M., Simðes, M. J. Long-term functional and morphological assessment of a standardized rat sciatic nerve crush injury with a non-serrated clamp. J. Neurosci. Methods. 163, 92-104 (2007).
- Baptista, A. F., de Souza Gomes, J. R., Oliveira, J. T., Santos, S. M. G., Vannier-Santos, M. A. A new approach to assess function after sciatic nerve lesion in the mouse - adaptation of the sciatic static index. J. Neurosci. Methods. 161, 259-264 (2007).
- Ronchi, G., Raimondo, S., Varejão, A. S. P., Tos, P., Perroteau, I. Standardized crush injury of the mouse median nerve. J. Neurosci. Methods. 188, 71-75 (2010).
- Berg, A., Zelano, J., Cullheim, S. Netrin G-2 ligand mRNA is downregulated in spinal motoneurons after sciatic nerve lesion. Neuroreport. 21, 782-785 (2010).
- Girolami, E. I., Bouhy, D., Haber, M., Johnson, H., David, S. Differential expression and potential role of SOCS1 and SOCS3 in Wallerian degeneration in injured peripheral nerve. Exp. Neurol. 223, 173-182 (2010).
- Hossain-Ibrahim, M. K., Rezajooi, K., Stallcup, W. B., Lieberman, A. R., Anderson, P. N. Analysis of axonal regeneration in the central and peripheral nervous systems of the NG2-deficient mouse. BMC Neurosci. 8, 80-80 (2007).
- Thornton, M. R., Mantovani, C., Birchall, M. A., Terenghi, G. Quantification of N-CAM and N-cadherin expression in axotomized and crushed rat sciatic nerve. J. Anat. 206, 69-78 (2005).
- Beer, G. M., Steurer, J., Meyer, V. E. Standardizing nerve crushes with a non-serrated clamp. J. Reconstr. Microsurg. 17, 531-534 (2001).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados