Method Article
Microarrays de polímeros para Discovery High Throughput de Biomateriais
Neste Artigo
Resumo
Uma descrição da formação de um polímero de microarray utilizando uma técnica de fotopolimerização on-chip. A caracterização de superfície de alto rendimento utilizando a microscopia de força atómica, as medições do ângulo de contacto da água, raios-X e espectroscopia de fotoelectrões de tempo de voo de espectrometria de massa de iões secundários e um ensaio de ligação celular é também descrito.
Resumo
De mistura é uma operação unitária, que combina dois ou mais componentes numa mistura homogénea. Este trabalho envolve a mistura de duas correntes de líquidos viscosos, utilizando um misturador estático em linha. O misturador é um desenho split-and-recombinam que emprega o fluxo de cisalhamento e extensional para aumentar o contacto interfacial entre os componentes. Um protótipo split-and-recombinam misturador (SAR) foi construído através do alinhamento de uma série de finas cortadas a laser poli (metacrilato de metilo) (PMMA), as placas mantidas no lugar em um tubo de PVC. Misturando neste dispositivo encontra-se ilustrada na fotografia na fig. 1. Corante vermelho foi adicionada a uma porção do fluido de teste e utilizados como o componente secundário sendo misturada no componente (não tingido) principal. Na entrada do misturador, a camada de fluido injectado traçador é dividida em duas camadas à medida que flui através da secção de mistura. Em cada secção subsequente de mistura, o número de camadas horizontais é duplicado. Em última análise, o único fluxo de corante é disperso uniformemente throughout a secção transversal do dispositivo.
Usando um fluido de teste não-Newtoniano de Carbopol a 0,2% e um fluido de marcador dopado de composição similar, a mistura na unidade é visualizada utilizando imagem de ressonância magnética (MRI). A ressonância magnética é uma sonda muito poderoso experimental de química e molecular ambiente físico, bem como a estrutura da amostra nas escalas de comprimento de mícrons em centímetros. Esta sensibilidade resultou em ampla aplicação destas técnicas para caracterizar características físicas, químicas e / ou biológicas dos materiais que vão desde os seres humanos aos alimentos para meios porosos 1, 2. O equipamento e as condições utilizadas aqui são adequados para a imagiologia de líquidos que contenham quantidades substanciais de RMN 1 H móveis tais como a água normal e líquidos orgânicos, incluindo óleos. Tradicionalmente MRI tem utilizado de super imans condutores que não são adequados para ambientes industriais e não portátil, num laboratório (Fig. 2). Os recentes avanços in ímã tecnologia tem permitido a construção de grande volume ímãs industrialmente compatíveis adequados para fluxos de processos de imagem. Aqui, a ressonância magnética fornece concentração de componentes espacialmente resolvidos em diferentes locais axiais durante o processo de mistura. Este documento de trabalho em tempo real, a mistura de fluidos de elevada viscosidade, através da mistura distributiva com uma aplicação para produtos de cuidados pessoais.
Protocolo
1. Preparação de incrustações de baixa fundo
- Pesar 2 g de poli (metacrilato de hidroxietilo) (pHEMA) (Sigma - cultura de células testados) para um tubo de centrífuga de 50 mL. Dissolver em 50 ml de 95% (v / v) de etanol em água. Isso normalmente leva 24 horas de sonicação.
- Dip-revestimento de epóxi-funcional lâmina de vidro (Genetix) com a solução de pHEMA. Os grupos epoxi irá rapidamente formar ligações covalentes com o revestimento de pHEMA. Dip-coating é conseguido mantendo a lâmina de vidro com uma pinça e mergulhando a lâmina para dentro da solução. Tipicamente de 5 mm da lâmina é deixado sem revestimento, o que é útil para a orientação da lâmina e pode também actuar como um controlo positivo, uma superfície aderente. A lâmina é então retirado da solução pHEMA durante um período de 1 s, invertida e deixaram-se secar na posição próxima à horizontal, durante 10 min, antes de colocar no porta-lâminas.
- As lâminas PHEMA revestidos são então deixados em condições atmosféricas durante 1 semana para permitir a evaporação completa da tele solvente.
2. Preparação da solução de monómero
- Pesar 120 mg do fotoiniciador 2,2-dimetoxi-2-fenil-acetofenona e adicionar 3 ml de dimetilformamida (DMF) para fazer uma solução a 4% de fotoiniciador (w / v). Isto é feito melhor fresco antes de iniciar a impressão, de modo a massa e volume da solução pode ser feito variar para se adequar a quantidade de solução de foto-iniciador é necessária. A solução é estável por até um mês.
- As soluções de monómero são feitas através da adição de 1 parte de solução de foto-iniciador a 3 partes do monómero puro. Isto é conseguido através de pipetagem 5 uL de solução de foto-iniciador e 15 mL de monómero em uma placa de 384 poços fonte. Um volume total de 20 uL é ideal para a formação de manchas. Maiores volumes requerem adicional antes blotting manchas uniformes podem ser produzidos. Volumes mais pequenos pode resultar numa carga incompleta do pino.
- Este método está actualmente limitada à utilização de acrilato / metacrilato de monómeros que são solúveis em DMF por virtue destes sendo as únicas combinações que têm sido exploradas, acrilamidas e outros solventes são susceptíveis de ser favorável para o processo de impressão. Para alcançar a concentração de monómero sugerido (75% w / w) de monómeros líquidos são também necessários, embora concentrações mais baixas de monómeros podem ser utilizados para os monómeros sólidos (a concentração do monómero reduzida não parece alterar negativamente a química da superfície do polímero resultante é contudo provável que a temperatura de transição de vidro de peso molecular e é alterada). Monómeros altamente voláteis são também difíceis de usar devido à rápida evaporação do monómero, antes do passo de cura por UV, quando a polimerização. Dependendo do número de soluções de monómero a execução pode levar até 6 horas e no final da execução dos monómeros voláteis foram evaporados a partir da placa de origem. Utilização de monómeros voláteis pode ser conseguida por arrefecimento da fase de impressão e de impressão usando curta é executado apenas.
- Com a exceção de alguns monômeros altamente hidrofílicastais como poli (etileno glicol) de acrilato, a dissolução dos pontos de polímero resultantes em tampões aquosos não foi observada, assim, a utilização de um monómero de reticulação não é necessário, embora não seja excluída.
3. A formação de polímeros de microarray
O procedimento típico para a formação de polímeros de microarray é representado esquematicamente na Figura 1.
- Microarray formação é conseguida utilizando um robot de contacto (Biodot), utilizando uma fase de XYZ (Figura 2). Pinos fendas de 220 um de diâmetro são usados (Arrayit 96B). Todos os pinos devem ser limpos por ultra-sons em diclorometano durante 10 minutos antes da tiragem e da mesma forma o suporte do pino deve ser também limpo.
- Os pinos são carregados no suporte, blotting e lâminas da matriz são carregados e, em seguida, toda a câmara está cheia de árgon, para reduzir o nível de oxigénio abaixo de 2000 ppm, o que é suficientemente baixo para evitar a extinção dos radicais de polimerização por oxigénio. A umidade é maintained em entre 30-40%. Incluindo humidade permite o pHEMA a inchar para permitir que o polímero formado para se interpenetram a camada de pHEMA e tornar-se fisicamente preso à superfície 2.
- A tiragem é iniciado. Cada run consiste de:
- Carregamento da amostra a partir de chapa de fonte. Os pinos são reduzidos nas soluções, a uma velocidade de 25 mm / s, realizada em solução de 2,5 s e depois retirada a uma velocidade de 25 mm / s (Figura 2).
- Pinos devem ser apagados antes de imprimir para remover a solução de monómero a partir do exterior do pino. Posteriormente ocorre a entrega de monómero a partir da parte Quilled do pino para conseguir a formação de mancha consistente. A seqüência blotting utilizada consiste de 33 contatos com uma lâmina de vidro limpo. Para as quatro primeiras posições do número de contactos feitos é de 10, 5, 4 e 3, respectivamente. Os próximos quatro posições dois contatos são feitos e nos últimos três posições um contato é feito. Tempo total para cada contato é 10 ms e velocidade de aproximação e retirada é de 175mm / s. Até este ponto os pontos formados devem ter uma forma consistente e geometria. Falha neste ponto indica pinos imundos ou contaminantes poeira nas soluções monoméricas.
- As soluções de monómero são então impressa sobre as lâminas de vidro revestidas PHEMA (Figura 2). Um contacto é feito por um ponto no movimento do pino de 175 mm / s e o tempo de contacto de 10 ms, o que, dependendo da viscosidade e da energia superficial da solução de monómero dá um diâmetro do ponto médio de 400 um. Normalmente de 3 matrizes idênticas são impressos em cada lâmina de vidro e um total de 10 lâminas são impressas num único ensaio. Isso equivale a 30 pontos por ciclo.
- Os pinos são lavados em DMF. 2,5 L de DMF fresca é fornecida para a execução de lavagem inteiro. Os pinos são lavados num banho de fluxo, com agitação.
- Concomitante com a lavagem, as lâminas impressas de fresco são irradiados com um UV de onda curta (365 nm) a fonte, a uma densidade de 30 mV / cm 2 para a duração do período de lavagem que dura 30 s.
- Aepois todas as soluções de monómero são impressas as matrizes são irradiados com UV (365 nm) para 10 min.
- As matrizes impressas de fresco são mantidos a baixa pressão (
4. Caracterização de superfícies de alto rendimento (HTSC)
Um esquema geral das técnicas SCAT é mostrado na Figura 3. Central à abordagem automatizada transferência, é elevado o alinhamento do microarray polímero com o aparelho de caracterização. Em todos os casos, isto é conseguido utilizando uma câmara que apresenta uma vista de cima da matriz. Inicialmente, a matriz é rodado para alinhar com o movimento XY do palco. Um ponto de canto da matriz é então localizado e designadas coordenadas específicas. A posição de cada ponto de polímero pode então ser previsto utilizando as dimensões da matriz.
- Água ângulo de contato (WCA) medições
- WCA medições são tomadas usando o método da gota séssil numautomatizado Krüss DSA 100 instrumento. Uma única gota de água, com um volume de ~ 400 pL é dispensada utilizando uma cabeça de impressão piezo-driven em cada ponto de polímero. O diâmetro de um ponto de polímero é tipicamente 300 mm, e o diâmetro da base da gota de água no local de polímero é tipicamente 100 um, assim, apenas uma medição pode ser obtido por mancha de polímero.
- Um estágio XY permite o posicionamento automático de cada ponto de polímero sob a cabeça de impressão 7. Isto é conseguido utilizando uma câmara situada por cima da amostra, que proporciona uma vista de cima da matriz. Inicialmente, a posição da câmara tem de ser ajustado para alinhar a distribuição da gotícula de água para o centro da visão da câmara e, em seguida, a matriz pode ser alinhada com a cabeça de impressão.
- Uma câmara de alta velocidade grava o perfil lateral da gotícula ao bater na superfície e subsequentemente evaporar. O quadro que capta o impacto inicial da gota é utilizado para medir o ângulo de contacto. Um círculo é montado na profi gotale e o ângulo de contacto subsequentemente determinada.
- Tempo-de-vôo Secundária Ion Mass Spectrometry (TOF-SIMS)
- Amostra é carregada em fase. Isso envolve, em primeiro lugar alinhando o palco com limpo Al folha, o que contribui com compensação de carga, e em seguida, segurando a lâmina no lugar pelo uso de guias de parafuso de metal.
- Fase de amostra é colocado no interior da câmara de transferência do ToF-SIMS e permitiu a bombear para baixo até 1,6 x 10 -6 mbar. A amostra é então transferida para a câmara de análise principal, que tem, tipicamente, uma pressão de vácuo de 1,0 x 10 -8 mbar.
- ToF-SIMS medições são realizadas usando um ION-ToF instrumento IV operado através de um Bi monoisotópico 3 + fonte de íons primário operado a 25 kV no modo "ajuntado". Um pulsado um pA feixe iónico primário é rastered sobre a área de análise, com tanto positivos como negativos iões secundários recolhidos a partir de uma área de 100 x 100 uM de cada ponto de polímero no microarray para a 10-second tempo de aquisição. Massas de iões foram determinados utilizando um analisador de alta resolução de tempo de vôo-permitindo designação de massa preciso. A resolução de massa típico (em m / z 41) foi de pouco mais de 6000. Electrões de baixa energia (20 eV) foram utilizados para compensar a carga de superfície causado pelo feixe de iões carregados positivamente primário nas superfícies isolantes 8.
- Microscopia de força atômica (AFM)
- Um grande fase AFM com uma fase automática é necessária para a análise dos conjuntos de lâminas de vidro. Um microscópio de dimensão ou ICON é ideal para esta finalidade.
- Amostra é colocada no palco e posição estágio está hospedada para o canto superior direito da matriz.
- A posição do canto inferior esquerdo da matriz encontra-se, o que permite que a posição de todos os outros pontos para ser interpolado.
- Uma lista posição é gerada e alimentada na característica de auto-amostragem do software.
- AFM medições são tomadas usando um instrumento Nanoscope 3000A no aproveitamento mode. Pontas de silício com uma frequência de ressonância de cerca de 300 kHz e uma força constante de 40 N / m são usados (Tap300Al, Sensores de orçamento). Regiões uM 5x5 do polímero são medidos 9.
- A raiz quadrada da média de rugosidade (RMS) é medido através desta região para cada imagem usando SPIP software de processamento em lote. Cada imagem é inicialmente aplainada antes da medição de rugosidade.
- Todas as imagens de visão exigem um manual para identificar os artefactos de imagem que podem ter de ser removido a partir de medições da rugosidade. Durante esta etapa, as imagens podem também ser classificados com base em características de superfície comum 9.
- Espectroscopia de raios X de fotoelétrons (XPS)
- Um slide microarray está afixada a uma barra de amostra utilizando uma fita de dupla face e subsequentemente carregados para a câmara de amostra de um instrumento Kratos XPS Axis Ultra.
- Entrar na câmara de amostragem e esperar até que ele atinja uma pressão abaixo de 10 Torr -8.
- A operação adequadaparâmetros, tais como uma fonte de raios-x monochromated (Al, 1486,6 eV), o ânodo e o potencial de corrente (10kV e 15mA), o tamanho da abertura (110μm), a energia de passagem (80 eV para digitalização de largura e 20 eV por varredura de alta resolução) são seleccionado. A fonte de raios-X é focada através de dois cantos opostos do microarray e optimizar o sinal de oxigénio a partir da amostra. As posições x e y de pontos individuais é, então, determinado e registrado como uma lista de posição.
- Um gráfico de programa é escrito e depois correr para a aquisição de dados, incluindo exames de largura e digitalizações de alta resolução para elementos específicos.
- A espectroscopia Raman
- Os espectros de Raman são tomadas para cada ponto de polímero usando um microscópio Raman LabRAM HR (Horiba Jobin Yvon). Inicialmente, o sinal de Raman é calibrado utilizando uma pastilha de silício e o deslocamento Raman de Si em 520,7 centímetros -1.
- A amostra é então colocada sobre o palco e o foco do laser (comprimento de onda = 523 nm) é ajustada para maximizar o deslocamento Raman CHem 2950 cm-1.
- A posição do centro do ponto superior esquerdo no microarray é então definida como a origem e um mapa do microarray é configurada usando a função de matriz no software labRAM HR.
- 10 Os espectros foram adquiridos cumulativamente para cada amostra, com um tempo de irradiação de 0,5 s.
5. Ensaio bacteriano
A matriz pode ser exposto a diversos ensaios biológicos, incluindo adesão e proliferação de células-tronco, outros tipos de células e bactérias 3,10,4. Descrevemos aqui um ensaio de ligação de bactérias, o qual é mostrado esquematicamente na Figura 4.
- A estirpe bacteriana transformada com GFP expressa plasmídeo é cultivada durante a noite a 37 ° C em 10 mL de meio LB num tubo de 50 ml Falcon com agitação a 200 rpm.
- O OD 600 de cultura bacteriana é medido e cultura durante a noite suficiente é inoculada em 15 mL de meio RPMI-1640 definidos para resultarem uma OD 600 de final de 0,01.
- As matrizes são pré-lavado em água destilada esterilizada durante 10 minutos para remover quaisquer componentes solúveis a partir das matrizes (monómero unpolymerised, oligómeros e solvente)
- Lâminas de matriz lavados são colocados numa placa de Petri limpo e esterilizado UV durante 10 min.
- Uma lâmina com a matriz é colocada em uma placa de Petri e 15 mL de RPMI-inoculadas 1640 é adicionado. Simultaneamente outra lâmina é colocada numa placa de Petri e incubadas com os não-innoculatd RPMI-1640 como controlo.
- As lâminas são incubadas a 37 ° C durante 72 horas com agitação a 60 rpm.
- As lâminas são lavadas duas vezes com 15 ml de PBS estéril.
- As lâminas são lavadas duas vezes com 15 mL de água destilada estéril.
- Slides são secos ao ar.
- Os slides são visualizados utilizando um GenePix Autoloader Scanner 4200AL (Molecular Devices, EUA) com um laser de excitação de 488 nm e filtro de emissão padrão azul (510-560nm). Um representante polímero imagem autofluorescência émostrado na Figura 2. Isto deve ser feito o mais rapidamente possível para evitar a deterioração da GFP. Se isto não for possível, as células devem ser submetidos a fixação. Além disso, a inclusão de controlos positivos apropriados com uma resposta conhecida bacteriana é imperativo para ser capaz de normalizar os resultados, e permitir experiências realizadas em dias diferentes para ser quantitativamente comparáveis. A intensidade total da fluorescência a partir de pontos de polímero é adquirida utilizando GenePix Pro 6 (Molecular Devices, EUA). Isto é feito para ambas as lâminas foram incubadas com bactéria e apenas meios. Para encontrar a fluorescência devido ao crescimento de bactérias a fluorescência do controlo media é subtraída da fluorescência medida no slide incubada com bactérias.
- As lâminas podem também ser coradas com corante de 20 uM de ácido nucleico SYTO17 (Invitrogen, UK), à temperatura ambiente durante 30 minutos e fotografada utilizando uma Carl Zeiss LSM 700 Microscópio Laser Scanning com ZEN software de imagem 2009 (Carl Zeiss, Alemanha). A cobertura das bactériasna superfície é determinada através de fonte aberta Image J 1,44 software (National Institute of Health, EUA).
6. Resultados representativos
As condições de impressão foram otimizados para imprimir os microarrays mais altos polímeros de qualidade. A humidade deve ser mantida entre 30-40%. A delaminação de manchas de polímero em meios aquosos, foi observada frequentemente para matrizes impressas a uma humidade inferior a 30%, o que sugere que esta humidade não é suficiente para inchar a camada de pHEMA e permitam a retenção física do polímero ao substrato. A humidade pode ser aumentada ainda mais para alterar o diâmetro dos pontos de polímero, mas isso depende da química de monómeros. Por exemplo, quando volumes iguais de solução de polimerização foram impressos e como a humidade foi aumentado de 40 para 80% do diâmetro do ponto diminuiu de 430 ^ m a 370 | iM de um monómero que contém um grupo hidrófilo de etileno glicol, enquanto para um volume igual moNomer hidrofóbico alifático contendo uma estrutura de anel de carbono, o diâmetro do ponto aumentou de 290 um a 350 um (Figura 5).
O grau de polimerização pode ser controlada por meio de espectroscopia de Raman para medir a C = C deslocamento Raman que é detectada a 1640 cm1, a qual deve ser normalizada com o C = O deslocamento Raman a 1720 cm -1. Os espectros de Raman foi medida para os pontos de polímero polimerizadas por exposição a UV variada (Figura 6). O C = C: C = O rácio diminuiu à medida que a exposição UV aumentou de 0 a 50 s, após o que nenhum decréscimo adicional no C = C: C = O rácio foi observada com a irradiação UV adicional (Figura 6). Os espectros de Raman foram também medidos para os pontos de polímero polimerizadas em variado de O 2 e o nível de C = C Figura 7A deslocamento Raman foi observado como o nível de O 2 foi reduzido para 2000 ppm, no entanto, qualquer redução adicional foi observada para um nível inferior a 2 O presente ( ). A espectroscopia Raman também demonstraram a capacidade de extracção o vácuo step para remover monômero não polimerizado. Antes da extracção o vácuo C = C deslocamento Raman foi maior para o polímero polimerizado em 3300 ppm em comparação com 2000 ppm (Figura 7A), contudo, após a extracção a vácuo a altura do deslocamento Raman é indistinguível (Figura 7B), sugerindo que todo o monómero não polimerizado foi removido durante a etapa de extracção por vácuo. Para resumir, as condições de polimerização incluem uma humidade de 30-40%, a exposição de UV superior a 50 s, a um nível inferior a 2 O 2000 ppm, com um passo de extracção por vácuo após a impressão, durante 7 dias.
Depois da extracção de impressão e de vácuo do sucesso da polimerização de manchas de polímero pode ser determinada por microscopia de luz simples para identificar e morfologias local anómalas. Normalmente, deve aparecer manchas circular e uniforme, como mostrado na Figura 8, à esquerda. A causa provável para uma alteração na geometria é um pino danificado ou sujo. Por um pequeno número de combinações de monómeros temos observado manchas disformes, para e-XEMPLO um ponto central, com um satélite de pequenos pontos, mostrados na Figura 8, à direita, ou uma forma de ovo frito onde há um ponto central, na parte superior de grande porte, planas local. Isto pode ser causado pela separação de fases antes da impressão, relativa a diferenças na viscosidade de tensão, hidrofilicidade volatilidade, ou a superfície dos monómeros, e sugere que a combinação de monómeros não é compatível com este formato. Mapeamento químico adicional de pontos de polímero por meio de técnicas tais como ToF-SIMS é também um passo importante e, por vezes, o controlo da qualidade necessárias para determinar a distribuição de substâncias químicas dos materiais através das manchas e da matriz. Esta técnica pode identificar excessivo espalhamento de alguns materiais não visíveis por microscopia de luz e identificar a separação de fase no interior de pontos de polímero individuais.

Figura 1. Esquemático mostrando os vários passos envolvidos na formação de um polymer local.
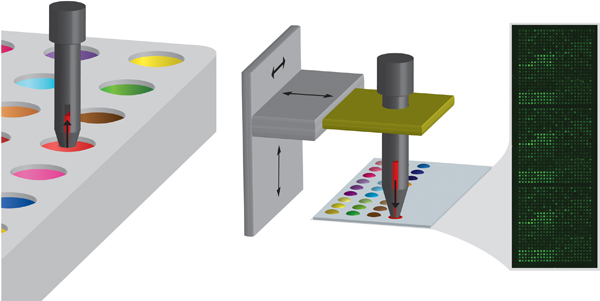
Figura 2. Esquemática da metodologia de impressão pin envolvendo inicialmente carregar o pino com o monómero de uma placa de origem e depois depositando o monómero em um substrato, fazendo contacto. O pino é controlado por um braço robotizado XYZ. A inserção mostra uma imagem típica da autofluorescência de uma matriz após a produção.

Figura 3. Esquemático destacando as técnicas associadas com HTSC e também de bioensaios para o estudo de microarrays de polímero.

Figura 4. Esquemática do ensaio de fixação bacteriana.
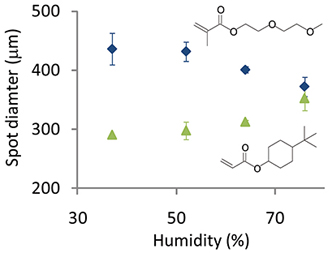
Figura 5. Pdiâmetro do ponto olymer impresso com humidade variada de dois monómeros diferentes: 4-terc-butilciclohexilo e de acrilato de di (etileno glicol) metacrilato de éter etílico.
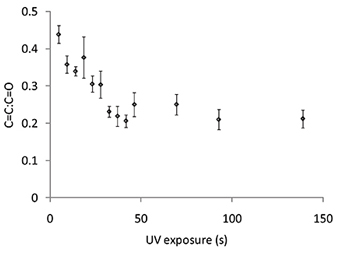
Figura 6. A razão entre a intensidade de Raman para a C = C deslocamento Raman a 1640 cm1 e a C = O deslocamento Raman a 1720 cm-1 a partir de manchas de polímero de acrilato de 4-terc-butilciclohexilo com exposição a UV variada. As barras de erro o desvio é igual a um padrão (n = 3).
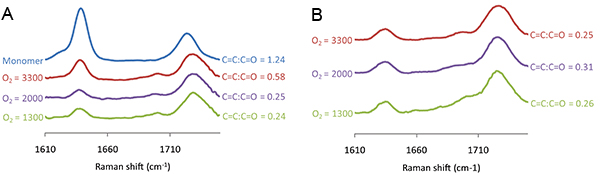
Figura 7. Os espectros Raman medido por manchas de polímero de acrilato de 4-terc-butilciclohexilo impresso em variados níveis de O 2, indicados à esquerda de cada espectro (A) antes e (B), após extracção por vácuo. A razão entre a intensidade de Raman para a C = C deslocamento Raman em 1640 cm1 e o C = O de deslocamento Raman a 1720 cm -1 é mostrada no lado direito de cada espectro.

Figura 8. Uma imagem de microscopia de luz de dois pontos de polímero. A mancha da esquerda mostra uma mancha bem formada, enquanto que a mancha do lado direito é um exemplo de um local que contém uma distribuição muito desigual de monómero. A barra de escala é 500 mm.
Discussão
Microarrays de polímeros têm sido utilizados com sucesso para a descoberta de novos materiais por centenas de triagem de novo polímero em um ensaio biológico e identificar 'hit' materiais que podem ser posteriormente ampliado para dispositivos úteis. Neste caso, a caracterização de superfície descritos, podem ser empregues para o subsequente ensaio biológico e exclusivamente sobre o 'hit' materiais para estudar os materiais com mais detalhe. Esta estratégia pode ser de interesse se HTSC não está disponível para o experimentalista que emprega esta abordagem. No entanto, para utilizar totalmente microarrays de polímero de estudar materiais biológicos, interacções toda a matriz de centenas de materiais devem ser analisados antes de ensaios biológicos que utilizam metodologias SCAT, os quais podem subsequentemente ser utilizados para observar gerais de estrutura-função de tendências.
Impressão de contacto baseia-se no pino de metal de deslizamento para cima e para baixo livremente dentro do suporte de pino. Pin e pino limpeza titular é primordial é garantir pMPRIMIR ocorre com sucesso e deve ser rigorosamente realizada. Antes de se iniciar uma impressão execute o movimento apropriado do pino dentro do suporte de pino pode ser testado através da realização de um ensaio, sem monómeros presentes. O passo de limpeza deve continuar até que o movimento do pino é obtida de forma reprodutível.
Considerável atenção deve ir para a concepção da mistura de monómeros. A fim de produzir facilmente uma biblioteca combinatória de polímeros, centenas de co-polímeros são formados por mistura de um monómeros de poucos em diferentes razões. Tipicamente nós produzimos 576 bibliotecas membros como esta forma uma matriz de 24 x 24, que é adequada para a geometria de uma lâmina de vidro. A fim de produzir uma biblioteca combinatória, que explora o espaço mais combinatório o método mais fácil é a mistura de monómeros 24 emparelhadas com uma proporção de 2:1. Alternativamente, a inclusão de gradientes de composição dentro da matriz são úteis para permitir que as observações de tendências, que permite que as composições de monómero a ser óptimos determined. Como um exemplo deste 22 monómeros podem ser utilizados como o primeiro componente de uma mistura de co-monómero que é sequencialmente diluídas com 1 de 6 segundos componentes. Se 5 diluições são usados, por exemplo misturando os primeiro e segundo componentes em proporções de 90:10, 75:25, 50:50, 25:75 e 10:90, isto resultaria em 488 soluções de copolímero únicas. Para levar o total de até 576, repetições dos homopolímeros dos monómeros utilizados podem ser introduzidos, o que muitas vezes é uma amostra de referência importante. 576 As soluções de monómero deve ser dispensado em 2 384 poços. Para a programação do robô é fácil ter duas placas idênticas em termos da posição dos monómeros, pelo que as soluções de monómero deve ser dividida entre as duas placas.
Uma quantidade significativa de tempo pode ser guardado na preparação dos pratos de origem através da utilização de pipetas multicanal, e a concepção das placas de origem deve ser determinada de forma a explorar a utilização de pipetas multicanal.
Para alcançar HTSC automatizada das matrizes a posição à vista com êxito deve ser alinhado com o aparelho de caracterização. Tipicamente o passo de uma matriz de acrilato é 500-1000 um e o diâmetro do ponto de polímero é 300 um. A maioria das fases XY têm uma resolução inferior a 10 um, assim existe tolerância adequada para o aparelho de caracterização da superfície de forma fiável o acesso as posições da matriz uma vez que as dimensões correctas foram inseridos no programa posicionamento da amostra. A limitação ao posicionamento automatizado é, de facto, a impressão precisa de matriz. Para garantir a impressão precisa, é importante para evitar o movimento do substrato na fase de impressão, quer através de aspiração a vácuo ou grampos de mola, juntamente com as dimensões apropriadas de deslizamento (nota de que tanto um dos EUA e da UE tamanho do diapositivo padrão existe).
ToF-SIMS é uma técnica extremamente superfície sensível que vai observar qualquer contaminação em amostras. Assim, o cuidado deve ser tomado upmostpara evitar o contacto com a superfície. As amostras só devem ser manuseados, mas a superfície de interesse não contactou com, com luvas limpas (de preferência polietileno) e com uma pinça recém-feita. Nós normalmente lavar com clorofórmio e hexano. Armazenamento da amostra antes da medição é melhor realizado em um suporte de amostras que contém as lâminas separadas, por exemplo o 5. Suporte de slides ou 20 porta-lâminas
As matrizes são concebidas especificamente para ser compatível com muitos formatos de ensaios biológicos e leituras, ou seja, o substrato utilizado é uma lâmina de microscópio ideal para scanners de fluorescência e microscopia de luz. Isto significa que o formato é bem adequado para explorar vários materiais biológicos interacções. Além disso, o formato permite que centenas de materiais a serem examinados em paralelo. Isto permite que muitos materiais mais a ser rastreada que os métodos convencionais de química em que cada novo material é peneirado individualmente. A maior possibilidade biológico-material interações permitems para a elucidação dos mecanismos de interacções biológicas de superfície, bem como para encontrar o material óptimo para uma dada aplicação.
Divulgações
Não temos nada a revelar.
Agradecimentos
Financiamento do Wellcome Trust é gentilmente reconhecido (número de concessão 085245/Z/08/Z). Nottingham Nanotecnologia e Nanociência Centro é gentilmente reconhecido por dar acesso ao sistema Raman e para a Agência de Desenvolvimento de East Midlands para financiar este equipamento.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente / equipamento | Companhia | Catálogo / Número do Modelo | |
| Lâminas epóxi | Genetix | K2652 | |
| Fale de impressora | Biodot | XYZ3060 Plataforma | |
| Pino de metal | ArrayIt | 946MP6B | |
| ToF-SIMS instrumento | ION-TOF | ||
| Instrumento XPS | Kratos | ||
| WCA aparelho | Krüss | DSA 100 | |
| AFM | Bruker | Ícone dimensão | |
| RPMI-1640 cultura meios celulares | Sigma-Aldrich | R0883 | |
| SYTO17 | Invitrogen | S-7579 |
Referências
- Hook, A. L., Anderson, D. G., Langer, R., Williams, P., Davies, M. C., Alexander, M. R. High throughput methods applied in biomaterial development and discovery. Biomaterials. 31, 187-198 (2010).
- Anderson, D. G., Levenberg, S., Langer, R. Nanoliter-scale synthesis of arrayed biomaterials and application to human embryonic stem cells. Nature Biotechnology. 22, 863-866 (2004).
- Mei, Y., Saha, K., Bogatyrev, S. R., Yang, J., Hook, A. L., Kalcioglu, Z. I., Cho, S. W., Mitalipova, M., Pyzocha, N., Rojas, F., Van Vliet, K. J., Davies, M. C., Alexander, M. R., Langer, R., Jaenisch, R., Anderson, D. G. Combinatorial development of biomaterials for clonal growth of human pluripotent stem cells. Nature Materials. 9, 768-778 (2010).
- Pernagallo, S., Wu, M., Gallagher, M. P., Bradley, M. Colonising new frontiers-microarrays reveal biofilm modulating polymers. Journal of Materials Chemistry. 21, 96-101 (2011).
- Yang, J., Mei, Y., Hook, A. L., Taylor, M., Urquhart, A. J., Bogatyrev, S. R., Langer, R., Anderson, D. G., Davies, M. C., Alexander, M. R. Polymer surface functionalities that control human embryoid body cell adhesion revealed by high throughput surface characterization of combinatorial material microarrays. Biomaterials. 31, 8827-8838 (2010).
- Urquhart, A. J., Anderson, D. G., Taylor, M., Alexander, M. R., Langer, R., Davies, M. C. High throughput surface characterisation of a combinatorial material library. Advanced Materials. 19, 2486-2491 (2007).
- Taylor, M., Urquhart, A. J., Zelzer, M., Davies, M. C., Alexander, M. R. Picoliter water contact angle measurement on polymers. Langmuir. 23, 6875-6878 (2007).
- Urquhart, A. J., Taylor, M., Anderson, D. G., Langer, R., Davies, M. C., Alexander, M. R. TOF-SIMS analysis of a 576 micropatterned copolymer array to reveal surface moieties that control wettability. Analytical Chemistry. 80, 135-142 (2008).
- Hook, A. L., Yang, J., Chen, X., Roberts, C. J., Mei, Y., Anderson, D. G., Langer, R., Alexander, M. R., Davies, M. C. Acrylate polymers with hydro-responsive topography. Soft Matter. 7, 7194-9197 (2011).
- Pernagallo, S., Unciti-Broceta, A., Diaz-Mochon, J. J., Bradley, M. Deciphering cellular morphology and biocompatibility using polymer microarrays. Biomedical Materials. 3, (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados