É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Labeling imuno dos microtúbulos no Dendrites neurônio sensorial, traquéias, e Músculos no Drosophila Wall Corpo Larva
Neste Artigo
Resumo
Para compreender como as formas de células complexas, como dendritos neuronais, são alcançados durante o desenvolvimento, é importante ser capaz de precisão organização de microtúbulos ensaio. Aqui nós descrevemos um método imuno etiquetagem robusta para analisar a organização dos microtúbulos dos dendritos arborização dendrítica neurônio sensorial, traquéia, músculos e outros Drosophila Larva tecidos parede do corpo.
Resumo
Para entender como as diferenças de formas complexas de células são alcançados, é importante seguir precisamente organização de microtúbulos. A Drosophila parede do corpo larval contém vários tipos de células que são modelos para o estudo celular e morfogênese do tecido. Por exemplo traquéias são usados para examinar morfogênese tubo 1, ea arborização dendrítica (DA) neurônios sensoriais da larva Drosophila tornaram-se um sistema primário para a elucidação da geral e neurônio-específico de classe mecanismos de diferenciação 05/02 dendríticas e degeneração 6 .
A forma de ramos dendríticos podem variar significativamente entre as classes de neurônios, e até mesmo entre os diferentes ramos de um único neurônio 7,8. Estudos genéticos em neurônios DA sugerem que a organização do citoesqueleto diferencial pode subjacentes diferenças morfológicas na forma ramo dendríticas 4,9-11. Nós fornecemos um método de etiquetagem robusta imunológica a umssay in vivo organização de microtúbulos em DA neurônio sensorial dendrite arbor (Figuras 1, 2, Movie 1). Este protocolo ilustra a dissecção e imunomarcação de larva de primeiro ínstar, uma fase em conseqüência dendrito ativo neurônio sensorial e organização ramificação está ocorrendo 12,13.
Além da coloração neurônios sensoriais, este método obtém etiquetagem robusta de organização de microtúbulos nos músculos (Filmes 2, 3), traquéia (Figura 3, Movie 3), e tecidos outra parede do corpo. É valioso para pesquisadores que desejam analisar a organização de microtúbulos in situ na parede do corpo quando se investiga os mecanismos que o tecido de controle e forma da célula.
Protocolo
1. Preparação de reagentes
Notas antes de começar: dissecção e coloração imuno-histoquímica são realizadas em uma câmara magnética ea larva é preso utilizando os pinos de insetos com formato especial. Instruções detalhadas sobre a construção de uma câmara magnética, ea preparação desses pinos pode ser encontrada nas referências relacionadas 14,15. Em resumo, um buraco quadrado 1x1cm é cortada em uma folha magnética e uma lamela afixada na parte traseira da folha para fazer uma pequena câmara. Os lados da câmara são selados com cola epóxi, após esta cola não definiu a câmara é lavado várias vezes com etanol 70% antes de usar. Pinos de insetos dissecção são preparados por flexão na forma requerida e então colados em uma guia de metal 14,15. Em alternativa a uma guia de metal, temos utilizado uma invertida de cabeça chata pin desenho de aço com uma alça feita a partir de uma ponta de corte amarela. O uso deste arranjo câmara magnética permite fechar controle over posicionamento do pino e do tecido que se estende durante a dissecção.
Para dirigir a expressão do gene repórter em subconjuntos diferentes de investigadores DA neurônios pode usar várias linhas diferentes Gal4 (resumido por Shimono e colegas 16). Muitas dessas linhas estão disponíveis em centros de estoque público. Neste protocolo representante, realizamos imunocoloração de uma linha em que duas classes contrastantes de DA neurônio são co-marcado: o mais simples de classe I e mais complexo de classe IV (P10-Gal4 17,18, UAS-mCD8:: Kusabira-Orange (KO)).
- Prepare Ca + + livre HL3.1 salina
- Em mM: 70 NaCl, KCl 5, 20 MgCl 2, 10 NaHCO 3, 5 HEPES, 115 sacarose, trealose e 5; pH 7,2 19. Filtro-esterilizar e armazenar a 4 ° C. Nota: Ca + + livre solução impede a contração muscular durante a dissecção.
- Prepare tampão PHEM 2x
- Em mM: 130 PIPES, HEPES 60, 20 EGTA, 4 MgSO4; pH 7,0. Filtro-esterilizar e armazenar a 4 ° C.
Nota: Estes materiais não se dissolvem até que a aproximação do pH 7.0.
- Em mM: 130 PIPES, HEPES 60, 20 EGTA, 4 MgSO4; pH 7,0. Filtro-esterilizar e armazenar a 4 ° C.
- Prepare o fixador recém imediatamente antes da fixação.
- A fim de preparar uma solução de 25ml, paraformaldeído 2g primeiro mix, 100μl 1M NaOH e água 10ml em tubo Falcon 50ml.
- Agite fixador em um banho de água 55 ° C, com agitador até que a solução é clara. (Volume total será de cerca de 11,5 ml.)
- Fixador fresco no gelo.
- Adicionar 12.5ml tampão PHEM 2x.
- Ajustar o pH para 7,0 com HCl 1M.
- Preencha a solução com água até que o volume é 25ml.
- Filtrar a solução usando papel Whatman.
2. Dissecação das larvas
Nota antes de começar: redes de microtúbulos, e em particular os dendritos sensorial, vai colapso rapidamente após o início da dissecção. CAhieving dissecção rápida em menos de cinco minutos, seguida pela fixação imediata são fatores chave para o sucesso deste protocolo.
- Lavar a larva na água e rapidamente movê-los para essa queda usando um laço de cabelo.
- Orientar a larva até lado dorsal e no lado ventral no vidro. Nota: Esta orientação é examinar os neurônios aglomerado ventral. Para examinar os neurônios aglomerado dorsal, inverter a orientação.
- Utilizar o centro de insetos pino a pino a extremidade anterior perto da boca ganchos. Coloque o pino perto do fim para obter melhores resultados.
- Coloque uma gota de solução salina HL3.1 na câmara de dissecção.
- Cortar a ponta posterior da larva fora com microtesoura. Nota: Este passo abre uma abertura na parte posterior da larva que irá permitir o acesso para a microtesoura (passo 2.7).
- Pegar com a pinça a região do intestino que agora está saindo da abertura na extremidade posterior da larva. Retire cuidadosamente o intestino todo.
- Coloque oponta de uma lâmina do microtesoura através da abertura e corte ao longo da linha mediana ventral para o anterior.
- Utilizando os pinos de canto, pinos nos cantos agora livre, posterior primeiro, depois anterior. Simultaneamente esticar suavemente abrir o filé larval.
3. Fixação, o bloqueio, coloração e montagem de filetes larval
Notas antes de começar: Todos os passos de fixação e coloração são realizadas na câmara de dissecção. Durante este processo, tome cuidado para não bater os pinos de insetos segurando a larva, pois isso pode levar a danos nos tecidos. Para evitar a experiência de secar, faça todos os passos coloração em um recipiente Tupperware pequena, rodeada por lenços umedecidos.
- Aspirar o Ca + + livre HL3.1 buffer usando uma ponta amarela. Imediatamente adicione o fixador usando outro pipetteman.
- Pipeta suavemente para cima e para baixo para misturar o fixador com os traços remanescentes de Ca + + livre HL3.1 tampãona câmara. Imediatamente aspirado-lo e em seguida, adicione fixador fresco para dentro da câmara.
- Incubar à temperatura ambiente por 20 minutos.
- Lavar 10mins 6x no PBST (0,1% Triton X-100 em PBS).
- Bloco com soro de cabra 5% em PBST por 20 minutos em temperatura ambiente.
- Substitua a solução de bloqueio com anticorpos primários diluídos em soro de cabra 5% em PBST. Os anticorpos primários utilizados são mouse anti-α-tubulina (DM1A) e de ratos anti-CD8 (5H10) ambos diluídos a 1 / 1000.
Nota: O investigador pode desejar substituir o rato tubulina anti-α-(DM1A) com o mouse anti-Futsch (22C10) 20,21 diluído 1 / 1000, em algumas circunstâncias (ver discussão).
- Incubar overnight (por pelo menos 16h) a 4 ° C.
- Lavar 10mins 6x no PBST.
- Adicionar solução de anticorpo secundário diluído em soro de cabra 5% em PBST. Os anticorpos secundários utilizados são Alexa Fluor 488 cabra anti-camundongo IgG e Cy3 burro anti-rato IgG. Manter a amostra coberta para evitar fluoróforofoto-branqueamento 22.
- Incubar quer no RT por duas horas, ou durante a noite a 4 ° C seguido por uma hora em temperatura ambiente.
- Lavar 10mins 6x no PBST.
- Coloque o filé larval no slide cutícula voltada para baixo, montado em glicerol 80%, e selar os lados da lamela com unha polonês para uma montagem de 'quick'.
Nota: Para limpar o tecido melhorou, e uma amostra permanente e estável, montagem em DPX como descrito anteriormente 23.
4. Resultados representativos:
Fluorescente de coloração foi analisada sob um microscópio confocal. Nas Figuras 1-2, diferentes ramos dentro de um mandril dendrite tem organização do citoesqueleto diferentes. A Figura 1 mostra uma região do mandril de uma classe IV DA neurônio no estádio 1 º estágio larval. O mandril todo é marcada com mCD8:: KO e detectado com um anticorpo anti-CD8 e fluorescentes secundário (Cy3). Tubulina é detectada através de anticorpos anti α-tubulina e fluorescent secundário (Alexa Fluor 488). Os ramos principais são positivos para tubulina, alguns ramos laterais finas são tubulina-negativos. Um filme é um conjunto de cortes seriados através de uma coloração semelhante de uma classe I DA neurônio. A Figura 2 mostra uma região do mandril de uma classe IV DA neurônio corados com anticorpos contra Futsch e CD8 no estádio 1 º estágio larval. Os ramos principais são Futsch-positivos, alguns ramos laterais finas são Futsch-negativos. Figura 3. Traquéias na parede do corpo larval mostram uma organização de microtúbulos complexo. Filmes 2 e 3 mostram cortes seriados de coloração através dos músculos da parede do corpo e da traquéia.
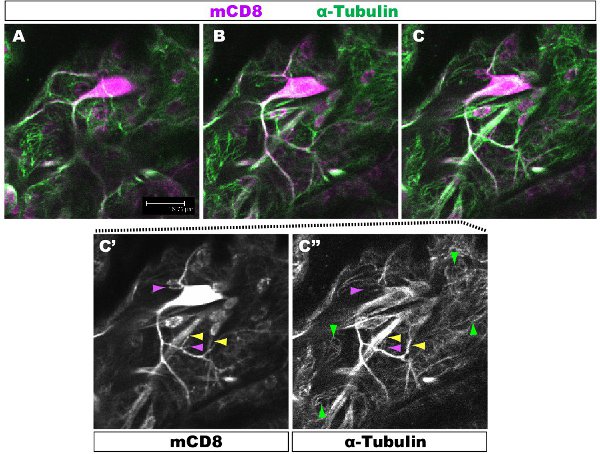
Figura 1. Fig. 1 mostra uma região do mandril de uma classe IV DA neurônio no estádio 1 º estágio larval. O mandril todo é marcada com mCD8:: KO e detectados utilizando anticorpos anti-CD8 e fluorescentes secundário (Cy3). Tubulina é detectada através de anti-&-túbulosn anticorpo fluorescente e secundário (Alexa 488). AC painéis seqüenciais confocal z-seções (0.5μm),'c-C ", manchando de anticorpos único a partir do painel Exemplo de ramos com C. (amarelo ponta de seta) ou sem (roxo seta) microtúbulos são realçados. Red arrowheads microtúbulos destaque no subjacentes células epiteliais.
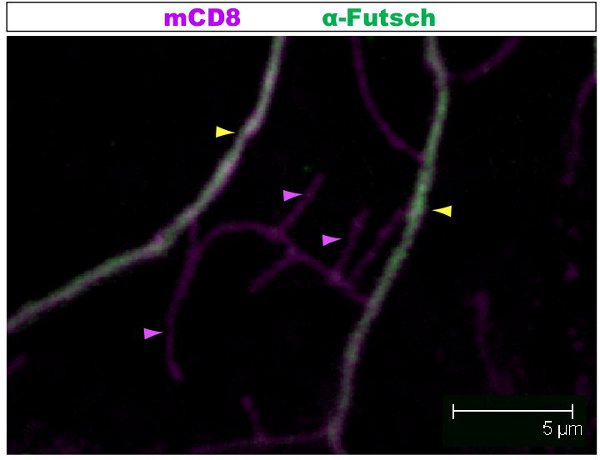
Figura 2. Fig. 2 mostra uma região similar do mandril de um neurônio da classe IV corados com anticorpos contra Futsch e CD8 no estádio 1 º estágio larval. O mandril todo é marcada com mCD8:: KO e detectados utilizando anticorpos anti-CD8 e fluorescentes secundário (Cy3). Futsch é detectada através de anticorpos anti-Futsch e secundário fluorescente (Alexa 488). Os ramos principais são Futsch-positivos, alguns ramos laterais finas são Futsch-negativos. Exemplo de ramos com (seta amarela) ou sem (roxo seta) Futsch são realçados.
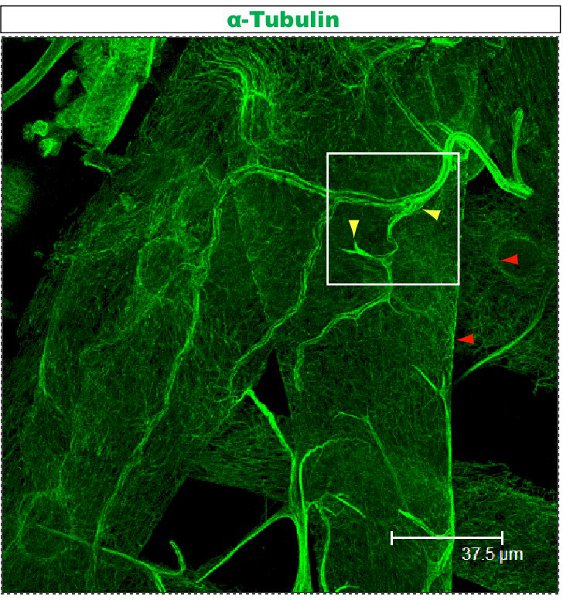
Figura 3. Traquéia coradas utilizando o protocolo anti-tubulina descrito acima. Esta larva é de terceiro instar e dissecados como descrito anteriormente 23,24. Movie 3 mostra alargada cortes seriados do campo marcado por um quadrado.
Movie 1. Seções Serial rastreamento coloração tubulina em todo o arbor dendríticas de uma classe que eu neurônio. O mandril todo é marcada com mCD8:: KO (Magenta) e detectados utilizando anticorpos anti-CD8 e fluorescentes secundário (Cy3). Tubulina (Green) é detectado com um anticorpo anti-α-tubulina e fluorescentes secundário (Alexa Fluor 488). Escala: de um lado da imagem de vídeo corresponde a 46.88μm na seção. Clique aqui para ver o filme.
Filme 2. Seções Serial rastreamento coloração tubulina em bodmúsculos y parede de uma larva de terceiro instar. Tubulina é detectada através de anti-α-tubulina anticorpo fluorescente e secundário (Alexa Fluor 488). Escala: de um lado da imagem de vídeo corresponde a 46.88μm na seção. Clique aqui para ver o filme.
Movie 3. Seções Serial rastreamento coloração tubulina em um corpo de parede da traquéia de uma larva de terceiro instar, marcado com um quadrado no Figure.3. Tubulina é detectada através de anti-α-tubulina anticorpo fluorescente e secundário (Alexa Fluor 488). Escala: de um lado da imagem de vídeo corresponde a 46.88μm na seção. Clique aqui para ver o filme.
Discussão
Para entender o quão complexo formas de células são alcançados, é importante ser capaz de precisão organização de microtúbulos ensaio. Aqui nós descrevemos um método etiquetagem robusta imuno ensaio para a organização de microtúbulos dos dendritos arborização dendrítica de neurônios sensoriais. Além da coloração neurônios sensoriais, este método obtém coloração imuno robusto de traquéia, músculos e tecidos outra parede do corpo.
Nós usamos esse protocolo para exa...
Divulgações
Não temos nada a revelar.
Agradecimentos
Agradecemos a RIKEN para financiamento. P10-Gal4 foi um presente tipo de Alain Vincent (Université Paul Sabatier, Toulouse, França).
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Catálogo número | Comentários (Opcional) |
|---|---|---|---|
| Fórceps | Dumont | 11251-20 | |
| Microtesoura | FST | 15000-08 | |
| Do mouse anti-α-tubulina (Clone: DM1A) | Sigma | T9026 | Diluição 1 / 1000 |
| Rato anti-Futsch (Clone: 22C10), sobrenadante | Desenvolvimento Estudos Hibridoma Banco | 22C10 | Diluição 1 / 1000 |
| Rat anti-CD8 (Clone: 5H10) | Caltag | MCD0800 | Diluição 1 / 1000 |
| Alexa Fluor 488 anti-mouse IgG | Invitrogen | A-11001 | Diluição 1 / 500 |
| Cy3 IgG anti-rato | Immunoresearch Jackson | 712-166-150 | Diluição 1 / 200 |
Referências
- Schottenfeld, J., Song, Y., Ghabrial, A. S. Tube continued: morphogenesis of the Drosophila tracheal system. Curr. Opin. Cell. Biol. 22, 633-639 (2010).
- Gao, F. B., Brenman, J. E., Jan, L. Y., Jan, Y. N. Genes regulating dendritic outgrowth, branching, and routing in Drosophila. Genes Dev. 13, 2549-2561 (1999).
- Corty, M. M., Matthews, B. J., Grueber, W. B. Molecules and mechanisms of dendrite development in Drosophila. Development. 136, 1049-1061 (2009).
- Moore, A. W. Intrinsic mechanisms to define neuron class-specific dendrite arbor morphology. Cell. Adh. Migr. 2, 81-82 (2008).
- Grueber, W. B., Jan, L. Y., Jan, Y. N. Tiling of the Drosophila epidermis by multidendritic sensory neurons. Development. 129, 2867-2878 (2002).
- Nishimura, Y. Selection of Behaviors and Segmental Coordination During Larval Locomotion Is Disrupted by Nuclear Polyglutamine Inclusions in a New Drosophila Huntington's Disease-Like Model. J. Neurogenet. 24, 194-206 (2010).
- Ramon y Cajal, S. . Histology of the nervous system of man and vertebrates, 1995 translation. , (1911).
- London, M., Hausser, M. Dendritic computation. Annu. Rev. Neurosci. 28, 503-532 (2005).
- Jinushi-Nakao, S. Knot/Collier and cut control different aspects of dendrite cytoskeleton and synergize to define final arbor shape. Neuron. 56, 963-978 (2007).
- Li, W., Gao, F. B. Actin filament-stabilizing protein tropomyosin regulates the size of dendritic fields. J. Neurosci. 23, 6171-6175 (2003).
- Ye, B. Differential regulation of dendritic and axonal development by the novel Kruppel-like factor Dar1. J. Neurosci. 31, 3309-3319 (2011).
- Parrish, J. Z., Xu, P., Kim, C. C., Jan, L. Y., Jan, Y. N. The microRNA bantam functions in epithelial cells to regulate scaling growth of dendrite arbors in drosophila sensory neurons. Neuron. 63, 788-802 (2009).
- Sugimura, K. Distinct developmental modes and lesion-induced reactions of dendrites of two classes of Drosophila sensory neurons. J. Neurosci. 23, 3752-3760 (2003).
- Budnik, V., Gorczyca, M., Prokop, A. Selected methods for the anatomical study of Drosophila embryonic and larval neuromuscular junctions. Int. Rev. Neurobiol. 75, 323-365 (2006).
- Sullivan, W., Ashburner, M., Hawley, R. S. . Drosophila Protocols. , (2000).
- Shimono, K. Multidendritic sensory neurons in the adult Drosophila abdomen: origins, dendritic morphology, and segment- and age-dependent programmed cell death. Neural. Dev. 4, 37-37 (2009).
- Colomb, S., Joly, W., Bonneaud, N., Maschat, F. A concerted action of Engrailed and Gooseberry-Neuro in neuroblast 6-4 is triggering the formation of embryonic posterior commissure bundles. PLoS One. 3, 2197-2197 (2008).
- Dubois, L. Collier transcription in a single Drosophila muscle lineage: the combinatorial control of muscle identity. Development. 134, 4347-4355 (2007).
- Feng, Y., Ueda, A., Wu, C. F. A modified minimal hemolymph-like solution, HL3.1, for physiological recordings at the neuromuscular junctions of normal and mutant Drosophila larvae. J Neurogenet. 18, 377-402 (2004).
- Hummel, T., Krukkert, K., Roos, J., Davis, G., Klambt, C. Drosophila Futsch/22C10 is a MAP1B-like protein required for dendritic and axonal development. Neuron. 26, 357-370 (2000).
- Zipursky, S. L., Venkatesh, T. R., Teplow, D. B., Benzer, S. Neuronal development in the Drosophila retina: monoclonal antibodies as molecular probes. Cell. 36, 15-26 (1984).
- Brent, J., Werner, K., McCabe, B. D. Drosophila Larval NMJ Immunohistochemistry. J. Vis. Exp. (25), e1108-e1108 (2009).
- Karim, M. R., Moore, A. W. Morphological Analysis of Drosophila Larval Peripheral Sensory Neuron Dendrites and Axons Using Genetic Mosaics. J. Vis. Exp. (57), e3111-e3111 (2011).
- Brent, J. R., Werner, K. M., McCabe, B. D. Drosophila Larval NMJ Dissection. J. Vis. Exp. (24), e1107-e1107 (2009).
- Tao, J., Rolls, M. M. Dendrites have a rapid program of injury-induced degeneration that is molecularly distinct from developmental pruning. J. Neurosci. 31, 5398-5405 (2011).
- Yamamoto, M., Ueda, R., Takahashi, K., Saigo, K., Uemura, T. Control of axonal sprouting and dendrite branching by the Nrg-Ank complex at the neuron-glia interface. Curr. Biol. 16, 1678-1683 (2006).
- Mattie, F. J. Directed microtubule growth, +TIPs, and kinesin-2 are required for uniform microtubule polarity in dendrites. Curr. Biol. 20, 2169-2177 (2010).
- Pawson, C., Eaton, B. A., Davis, G. W. Formin-dependent synaptic growth: evidence that Dlar signals via Diaphanous to modulate synaptic actin and dynamic pioneer microtubules. J. Neurosci. 28, 11111-11123 (2008).
- Williams, D. W., Tyrer, M., Shepherd, D. Tau and tau reporters disrupt central projections of sensory neurons in Drosophila. J. Comp. Neurol. 428, 630-640 (2000).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados