Method Article
Preparação Individual Drosophila Ovos Câmaras de imagens ao vivo
Neste Artigo
Resumo
O Drosophila Ovo câmara é um excelente modelo para estudar os mecanismos de localização do mRNA. A fim de capturar os eventos dinâmicos que sustentam os processos de localização, resolução de imagem rápida alta de tecido vivo é necessária. Aqui, apresentamos um protocolo para a dissecção e imagens de amostras ao vivo com o mínimo de interrupção.
Resumo
Imagens de células vivas é uma técnica importante aplicado a uma série de tecidos de Drosophila utilizados como modelos para investigar tópicos tais como especificação eixo, a diferenciação das células e organogénese 1. Correta preparação das amostras experimentais é crucial, muitas vezes negligenciada etapa. O objectivo da preparação é para assegurar a relevância fisiológica e para estabelecer as condições de imagem óptimas. Para manter a viabilidade do tecido, é crítico para evitar a desidratação, a deterioração, a hipóxia sobreaquecimento ou meio 2.
A Drosophila câmara de ovo é um sistema bem estabelecido para examinar as questões relativas, mas não se limitando, a padronização do corpo, a localização do mRNA e organização do citoesqueleto 3,4. Para câmaras de ovos início e meados de palco, montagem em óleo halocarbono é bom para a sobrevivência na medida em que permite a livre difusão de oxigênio, evita a desidratação e hipóxia e tem excelentes propriedades ópticas para a microscopia. Imenvelhecimento de proteínas fluorescentes é possível através da introdução de transgenes para a câmara de ovo ou injecção física de RNA marcadas, proteínas ou anticorpos 5-7. Por exemplo, a adição de MS2 construções para o genoma de animais permite a observação em tempo real de mRNAs no oócito 8. Estas construções permitem na rotulagem in vivo de ARNm através da utilização do RNA bacteriófago MS2 interacção lacete haste com a sua proteína de revestimento 9.
Aqui, apresentamos um protocolo para a extração dos ovários, bem como isolar ovaríolos individuais e câmaras de ovos da Drosophila fêmea. Para uma descrição detalhada de Drosophila oogênese sé Allan C. Spradling (1993, reimpressa 2009) 10.
Protocolo
1. Preparação Drosophila prévia para dissecção (De acordo com E. Gavis, Princeton University)
- Descarte os adultos a partir de uma garrafa pouco semeado e transferir o frasco a 25 ° C antes da sua experiência. Uma vez que novos adultos começaram a emergir, esperar dois dias.
- Pegue um frasco contendo aproximadamente 10ml mosca de alimentos sólidos e adicionar 0.5-0.7 gramas de fermento seco (ver tabela) em um ângulo de 45 graus. Não cubra toda a superfície do alimento da mosca com o fermento.
- Adicionar algumas gotas de água para a levedura, suficiente para hidratar (Figura 1A). Colocar o frasco a 45 graus e permitir que cerca de 3 minutos para a levedura para absorver a água (Figura 1B).
Nota: Alternativamente, a levedura de pré-mistura um colar em um recipiente separado e adicionar o colar para o frasco com uma espátula.
- Anestesiar as moscas no frasco através da injeção de gás de CO 2. Quando eles param de se mover, derrubar as moscas inconscientes para o CO 2 para classificação (Figura 1C).
- Isolar 10-15 fêmeas e 5 machos do genótipo desejado sob um escopo dissecando com um pincel de ponta fina (Figura 1D). Os machos são óbvias pela presença de claspers, uma estrutura escuro saliente, por sua posterior.
- Adicionar moscas seleccionados para o frasco de yeasted (Figura 1E). Lugar a 25 ° C durante 24-60 horas. Incubar por períodos mais curtos de tempo para um maior percentual de jovens para as câmaras de estágio meados de ovo e longos períodos de tempo para câmaras de ovos em fase tardia.
2. Dissecção ovário Drosophila
- Colocar uma pequena gota de óleo em um halocarboneto No. 1,5, 22 x 50 lamínula mm (Figura 2A). Ajuste o lamínula preparada para o lado onde não será no caminho.
- Anestesiar as moscas no vil yeasted pela injeção de gás CO 2 e ponta em uma almofada de CO 2.
- Use afiadas bem-cheirados pinça para agarrar um indivíduo do sexo feminino engordados no anterior do abdômen (não entre ªabdómen e tórax e) (Figura 2B-C).
- Segure a fêmea com as pinças e ver sob um microscópio de dissecação, cerca de 2-3 cm acima da lamela preparado.
- Ainda segurando na anterior, utilizar um segundo conjunto de pinça para remover o tecido na posterior extrema do sexo feminino (Figura 2D). Nota: O tecido Gut normalmente irá puxar para fora com a extremidade posterior. Seque a tecido removido das pinças.
- Mantendo o feminino na anterior, use a pinça dizimado a apertar ou massagear o abdômen, trabalhando a partir da anterior para a posterior. Massajar o abdómen da mesma maneira como a remoção de pasta de dentes a partir da extremidade de um tubo.
- Dois grandes estruturas opacas será empurrado a partir do abdómen e vara no final da pinça (Figura 2E F-). Estes são os ovários emparelhados.
- Tocar nos ovários para o óleo de halocarboneto sobre a lâmina abaixo.
- Repita a dissecção 1-2 vezes para dar um total de 4-6 ovários no óleo sobre a lamela (Figure 2G).
3. Ovaríolos Isolando
Nota: Cada ovário contém cerca de 16 ovaríolos compostas de 6 a 10 câmaras de ovos de diferentes estágios organizados como contas num fio 10.
Nota: Antes do isolamento dos ovaríolos, ajustar a fonte de luz sobre o microscópio de dissecação de modo que a iluminação atinge a um ângulo raso para a amostra. Isto dá contraste com a amostra e permite a visualização das câmaras de ovo jovens fase.
- No óleo, separar as duas ovários através da remoção do tecido de ligação na extremidade posterior (fases de idade) com uma pinça fechada (Figura 3A).
- Orient ovário um indivíduo com os mais antigos estágios para a fase mais jovem e esquerda para a direita. As câmaras de fase jovem ovo no ovário são transparentes e formar a extremidade mais aguçado do ovário.
- Com uma pinça na mão dominante, gentilmente segure o posterior de um ovário, de preferência pelos restos do diatecido conjuntivo e. Enquanto mantém o ovário no local com a pinça, use uma sonda de dissecação (ou agulha de tungstênio) trazer à tona ovaríolos individuais (Figura 3B-D).
Nota: ovaríolos individuais vai quebrar entre as fases jovens (germário para a fase 10), como as fases mais velhos são demasiado grandes para serem separadas do ovário completo.
Nota: A perfuração um oócito fase tardia com a sonda de dissecação irá resultar no citoplasma vazando para o óleo e fazer a extracção de ovaríolos individuais muito exigente. Se um oócito fase tardia é perfurada, vá para um ovário fresco.
- Uma vez que o ovaríolo é livre do ovário, usar a sonda de dissecação para arrastá-lo para o centro da gota de óleo e orientar na orientação desejada para a experiência. Nota: ovaríolos de petróleo vai se estabelecer e aderir ao vidro.
- Repetir este processo (3,3-3,4), até que existem 15-25 ovaríolos individuais. Nota: Isto pode exigir a dissecção do multiple ovários. Todo o processo deverá ter menos de 15 minutos.
Nota: É aconselhável para dissecar cada um ovário de várias moscas em vez de dissecar ambos os ovários de moscas menos para aumentar o número n de moscas para o experimento.
Nota: O manuseio indevido do ovaríolo irá resultar em oócitos insalubres e pode levar a artefatos no experimento.
Nota: Os oócitos vai começar a exibir alterações fenotípicas devido ao estresse 40 minutos depois de ter sido dissecados a partir do ovário (compare Figura 7E a F).
- Uma vez que ovaríolos estão em uma orientação adequada (Figura 3E), usar a sonda de dissecação e pinça fechada para mover o tecido do ovário excesso para fora do óleo. Este material pode ser eliminado a partir da pinça sobre uma toalha de papel.
4. Isolando individuais câmaras nas fases finais de ovo (segundo E. Gavis, Princeton University)
- Com um par de pinças na Dominformiga mão, segure a parte posterior de um ovário isolado, de preferência pelos remanescentes do tecido conjuntivo. Mantendo o ovário no lugar com os fórceps, introduzir a sonda de dissecação para dentro da extremidade posterior do ovário perto das pinças (Figura 4A). Evite perfurar nenhuma câmara de ovos através da inserção da sonda entre as câmaras de ovos em fase tardia.
- Puxar a agulha de dissecação através do ovário até que ele sai nas câmaras fase inicial de ovo (Figura 4B). Quando feito corretamente, a sonda irá remover o tecido conectivo que mantém as ovaríolos e câmaras de ovos final de etapa no lugar.
- Repita o passo 4,2 até os ovaríolos estão espalhados sobre a lamela. Nota: Quando câmaras de ovos não são mais empilhados em cima uns dos outros, este passo é completa.
- Utilizando a sonda de dissecação, separar os oócitos tardios para permitir fácil para imagiologia (Figura 4C).
Nota: A perfuração um oócito enquanto dissecando câmaras de ovo em fase tardia não é tão condenando como com dissecando iovaríolos ndividual para as fases mais jovens.
Nota: Para câmaras de estágio de 14 ovos, use a pinça para agarrar os apêndices dorsais de orientação.
5. Preparação para injecção
Nota: Para a injeção de oócitos no estágio médio, oriente a ovaríolos perpendicularmente ao eixo longo da lamínula.
- Ligue o microscópio de imagem [no nosso caso um Core DeltaVision de Precisão Aplicada] e carregar as configurações de imagem apropriadas (Figura 5A-B).
- Ligue o aparelho de injecção (Figura 5C).
- Carregar a agulha de injecção com uma ponta de carga (Figura 5D-E). Soluções a serem injectados deve ser centrifugado brevemente a alta velocidade para evitar depósitos que podem bloquear a agulha de injecção.
- Coloque a agulha de injecção carregado para o injector. Tome cuidado para evitar quebrar a agulha (Figura 5F).
- Para ajudar com agulhas desentupimento, coloque um pequeno pedaço de vidro 2x10 milímetros de um corte ou uma lamela quebradot lado uma da gota de óleo contendo os ovaríolos. Certifique-se este fragmento de vidro é coberto de óleo. Este vidro servirá para ram a ponta da agulha contra para quebrar ou desobstrução da agulha.
6. Injeção de RNA fluorescente
Antes de começar: Definir o aparelho de injecção e do manipulador de micro-controlos tais que a agulha de injecção está posicionado sobre o centro do campo de visão.
- Montar a amostra a ser injectado na platina do microscópio.
- Selecione o objetivo de 20x. Objectivos de ampliação mais elevadas ou mais baixas podem também ser utilizados.
Nota: Se estiver usando uma etapa automatizada com capacidade de ponto de visitação é aconselhável marcar todas as fases do 8-9 oócitos para injeção antes de começar. Isto permite a visitar fácil e injecção de oócitos seleccionados.
- Abaixe a agulha de injeção, até tocar o óleo. Centro ponta da agulha sobre a lente objetiva.
- Transformarfora as luzes da sala e acender a luz brilhante de campo para o microscópio. Selecione o primeiro ponto (oócitos) na lista de pontos marcados. Ao olhar através das oculares, o foco sobre o oócito (Figura 6A).
- Baixar a agulha manualmente até que está no mesmo plano do foco como o oócito e próxima visível para o oócito.
- Usando os controles de manipuladores, mover o ponto da agulha de injecção até que esteja dentro do oócito. Um movimento rápido esfaquear é muitas vezes mais bem sucedidos do que um avanço lento. Uma vez dentro, ejectar um pequeno volume da agulha e visualmente avaliar os efeitos, repetir, conforme necessário. Se a injecção for bem sucedida, o citoplasma dentro do oócito serão deslocados, se tal não for evidente, de repetição. Não é necessário para a imagem de fluorescência para determinar se o material tenha sido injectado. Após a injecção, remover a agulha do interior do oócito (Figura 6B-G).
- A quantidade exacta de fluido injectado é difícil de quantificar. Para aumentar o volume injetado, adjur a pressão ou o tempo do pulso de injecção, quebrar a ponta da agulha para aumentar a abertura ligeiramente ou usar pulsos a injecção repetida.
Nota: O processo de injeção todo deve demorar menos de 10 segundos quando executado corretamente. Extensa facadas ou persistente com a agulha para dentro de oócitos irá resultar em graves danos para a câmara de ovo.
- Antes de seleccionar o oócito próxima marcado, elevar o suficiente agulha de injecção de alta no óleo de modo a não contactar oócitos outros no caminho de viagens.
- No ovócito novo, repita o passo 6.6. Continue desta forma até que todos os ovócitos necessários são injetados.
Nota: Se um erro é cometido durante a injecção, passar para a próxima marcada oócito. Não perca tempo em oócitos danificadas.
Nota: A agulha pode ficar entupido durante uma sessão de injecção. Neste caso, mover a agulha adjacente à peça de vidro quebrado no óleo sobre a lamela. Inteligênciah, o vidro ea agulha no mesmo plano focal, suavemente ram a agulha no vidro (Figura 6H). Teste que a agulha é unclogged pressionando o botão de injecção e ver se qualquer fluido sai do ponta da agulha.
- Quando todos os oócitos foram injectados, mover manualmente a agulha para cima, para fora do óleo e orientar-lo para fora do caminho do feixe para o microscópio. Assegure-se que é em uma orientação segura, para evitar danos nos olhos.
Nota: Se um período prolongado de tempo decorrido entre o isolamento de ovo câmara de injecção e do oócito, os oócitos será difícil de injectar e exibem alterações fenotípicas associados com o stress. Questões semelhantes podem surgir com a manipulação grosseira do oócito ou injeção de volumes em excesso (comparar Figuras 6I, J, K).
7. Live projeto experimental de imagens
- Selecione o oócito injetada primeiro da lista. Teste que a injeção estava dentro do oócito por um quadro de imagem de fluorescência (as na Figura 6G).
- Configure os parâmetros experimentais, tais como: comprimento de onda de excitação, o caminho de emissão, tempo de excitação, Z-stack eo tempo entre as coletas. Nota: Para mais informações sobre isso, ver Parton R., et al. (2010) 2.
- Reúna o conjunto de dados.
8. Os resultados representativos
In vitro sintetizado Alexa-546 GRK RNA injectado um Me31B :: GFP ovo câmara (Figura 7A). O RNA localiza-se o anterior dorsal do oócito e forma uma tampa em torno do núcleo (Figura 7B). Para mais exemplos de localização RNA ver MacDougall N., et al. (2003) 11.
Oócitos no estágio de meados e final expressando a proteína fluorescente etiquetado (Tau-GFP, Figura 7C) ou sistemas de marcação de RNA (GRK * mCherry, Figura 7D) podem ser visualizados sem injeção.

Figura 1.

Figura 2.
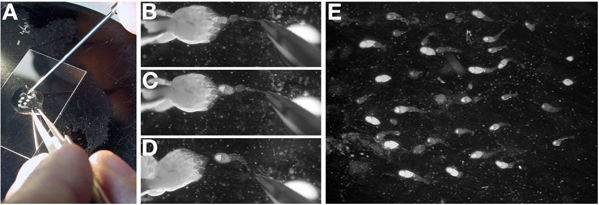
Figura 3.
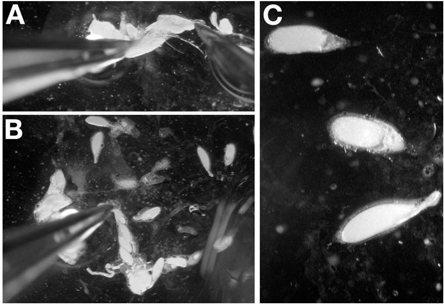
Figura 4.

Figura 5.
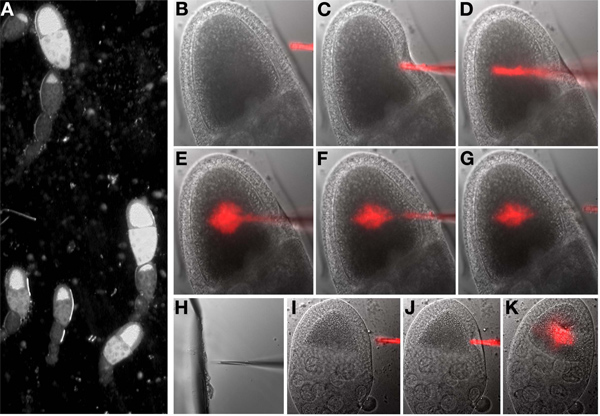
Figura 6.
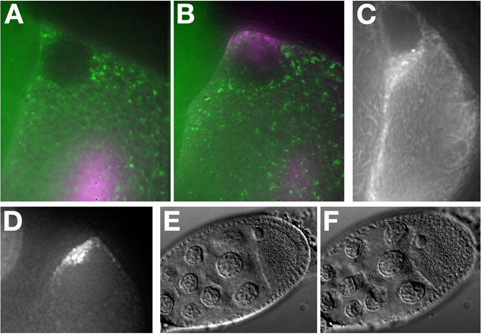
Figura 7.
Discussão
Imagens de células vivas é um ensaio poderoso para examinar os processos celulares em tempo real. Além disso a observação de campo brilhante simples, a adição de etiquetas fluorescentes para proteínas e RNAs de interesse tem levado a muitos avanços. Aqui nós descrevemos um protocolo para oócitos de vida de imagem individuais que podem ser utilizados em combinação com os ensaios genéticos e bioquímicos.
Neste protocolo, também explicam como manipular experimentalmente oócitos de vida por injeção. Há muitas possibilidades para o material a injectar, incluindo in vitro sintetizado fluorescentes RNA marcadas para ensaio da capacidade de uma estrutura secundária de RNA para localização directa (Ball e Davis, não publicado) e os anticorpos que inibem a função das proteínas 6. O trabalho futuro provavelmente irá ver a introdução de componentes de rotulagem e outros maquinaria celular para oócitos de vida que permitam mecanismos moleculares a ser testado.
t "> Preservar a viabilidade ea saúde do tecido é essencial quando se trabalha com células vivas. Neste protocolo, destacamos uma série de passos que podem levar ao estresse da câmara de ovos. Por exemplo, apesar de óleo sendo superior para imagens, cultura prolongada no óleo podem conduzir ao stress na câmara de ovo. Isto pode ser facilmente monitorizado sob a exposição de campo claro examinando a morfologia nuclear e posição, a membrana de oócitos que irá distorcer e bolha sob stress (comparar Figura 7E (átono) para Figure7F ( salientou)). etapa 9 câmaras de ovo mostram RNA localização e migração de células fronteira 12 horas sobre múltiplos. No entanto, uma fase de 7/8 câmara de ovo vai começar a exibir efeitos nocivos no halo óleo de carbono depois de cerca de 40 minutos do ovário sendo removido do do sexo feminino. câmaras fase tardia de ovo, fase 11 a 14, pode desenvolver-se normalmente em óleo ou meios aquosos por causa da secreção da casca do ovo a partir das células foliculares a estes 13 fases. Tem sido reported que a adição de insulina para meio de insectos aquosa pode manter etapa 9 oócitos por até 6 horas e 14 germaria até 14 horas e 15. Em todos os casos, de manobra agressivo da câmara de ovo deve ser evitada, uma vez que salienta os oócitos e reduz a sua viabilidade. Imagem menos câmaras de ovos e tendo o cuidado de tratar cada delicadamente é a melhor maneira para assegurar a viabilidade ideal.Divulgações
Não temos nada a divulgar.
Agradecimentos
Este trabalho foi financiado por uma Bolsa de Investigação Wellcome Trust Sênior I. Davis.
Materiais
Ferramentas utilizadas na dissecção deve ser limpo, mas não precisam ser autoclavado. Limpe as ferramentas com ETOH e deixe-os secar antes de começar.
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários |
| Pincel de ponta fina (Artistas Sable, redondo, tamanho 00 ou 0) | Disponível a partir de fontes de estabelecimentos mais arte | Uma escova de boa qualidade é importante | |
| Halocarbon Products Corporation, Série 95 | Halocarbon Products Corporation, 887 Kinderkamack Road, River Edge NJ 07661 | Distribuidor europeu: Solvadis (GMBH) Certifique-se oxigenar por borbulhamento de ar através do petróleo. | |
| Cubra escorregar-No. 1,5, 22 x 50 milímetros | Internacional-No1-VWR Cat = 631-0137-22-50 milímetros | Menzel-Glaser-22-40 milímetros-400-070T MNJ | |
| Dumont No.5 - Dumostar | Belas Ferramentas Ciência | 11253-20 | "Biologie" dica também é boa, mas mais frágil |
| Dissecando sonda | Belas Ferramentas Ciência | 10140-01 | |
| Microscópio de dissecção | Olimpo | SZ61 | |
| CO2 pad | Disponível através de http://www.flystuff.com / (A divisão de Genesee Científica) | 59-114 (789.060 Dutscher) | Distribuidor europeu: Dutscher www. dutscherscientific. com / Também é relativamente fácil de costume construir suas próprias almofadas mosca |
| KimCare | Kimbery Clark-KimCare-médicos toalhetes | KLEW3020 | |
| Microscópio DeltaVision- | Precisão Aplicada | DC-CORE | |
| Micromanipulador | Micromanipuladores Burleigh da Lumen Dynamics Grupo inc. 2260 Argentia Road, Mississauga, Ontário, Canadá L5N 6H7 | Burleigh PCS-5000, TS-5000-300 | http://www.ldgi-burleigh.com / (Anteriormente Exfo) |
| Aparato de injecção | Tritech Research, Inc. 2961 Veteran Ave Los Angeles, CA 90064 | Minj-1 | Modificado com um suporte para levar Eppendorf Femptotips |
| Agulha de injeção | Eppendorf estéril Femtotips I e II | 930000043 | Diversas dicas são melhores para diferentes aplicações |
| Carregando dicas 20 uL | Eppendorf | 5242956.003 | |
| De fermento biológico seco | Fermento Fleischmann | # 2192 |
Referências
- Arias, A. M. Drosophila melanogaster and the development of biology in the 20th century. Methods Mol. Biol. 420, 1-25 (2008).
- Parton, R. M., Valles, A. -. M., Dobbie, I. D., Davis, I., Goldman, R. D., Swedlow, J. R., Spector, D. L. Pushing the Limits of Live Cell Imaging in Drosophila. Live Cell Imaging: A Laboratory. , 387-418 (2010).
- Johnston, D. Moving messages: the intracellular localization of mRNAs. Nat. Rev. Mol. Cell Biol. 6 (5), 363-375 (2005).
- Jansen, R. mRNA Localization: Message on the Move. Nat. Rev. Mol. Cell Biol. 2, 247-256 (2001).
- Van De Bor, V., Hartswood, E., Jones, C., Finnegan, D., Davis, I. gurken and the I factor retrotransposon RNAs share common localization signals and machinery. Dev. Cell. 9 (1), 51-62 (2005).
- Delanoue, R., Herpers, B., Soetaert, J., Davis, I., Rabouille, C. Drosophila Squid/hnRNP helps Dynein switch from a gurken mRNA transport motor to an ultrastructural static anchor in sponge bodies. Dev. Cell. 13 (4), 523-538 (2007).
- Jaramillo, A. M., Weil, T. T., Goodhouse, J., Gavis, E. R., Schupbach, T. The dynamics of fluorescently labeled endogenous gurken mRNA in Drosophila. J. Cell. Sci. 121 (Pt. 6), 887-894 (2008).
- Forrest, K. M., Gavis, E. R. Live imaging of endogenous mRNA reveals a diffusion and entrapment mechanism for nanos mRNA localization in Drosophila. Curr. Biol. 13, 1159-1168 (2003).
- Bertrand, E. Localization of ASH1 mRNA particles in living yeast. Mol. Cell. 2 (4), 437-445 (1998).
- Spradling, A. C., Bate, M., Martinez-Arias, A. Developmental genetics of oogenesis. The Development of Drosophila melanogaster. 1, 1-70 (1993).
- MacDougall, N., Clark, A., MacDougall, E., Davis, I. Drosophila gurken (TGFalpha) mRNA localizes as particles that move within the oocyte in two dynein-dependent steps. Dev. Cell. 4 (3), 307-319 (2003).
- Tekotte, H., Tollervey, D., Davis, I. Imaging the migrating border cell cluster in living Drosophila egg chambers. Dev. Dyn. 236 (10), 2818-2824 (2007).
- Weil, T. T., Parton, R., Davis, I., Gavis, E. R. Changes in bicoid mRNA anchoring highlight conserved mechanisms during the oocyte-to-embryo transition. Curr. Biol. 18, 1055-1061 (2008).
- Prasad, M., Jang, A. C., Starz-Gaiano, M., Melani, M., Montell, D. J. A protocol for culturing Drosophila melanogaster stage 9 egg chambers for live imaging. Nat. Protoc. 2 (10), 2467-2473 (2007).
- Morris, L. X., Spradling, A. C. Long-term live imaging provides new insight into stem cell regulation and germline-soma coordination in the Drosophila ovary. Development. 138 (11), 2207-2215 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados