É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Crescimento de Mycobacterium tuberculosis Biofilmes
Neste Artigo
Resumo
Mycobacterium tuberculosis forma biofilmes de drogas tolerantes quando cultivadas em certas condições. Aqui descrevemos métodos para cultura de M. biofilmes de tuberculose e que determinam a freqüência de persistentes drogas tolerantes. Estes protocolos serão úteis para estudos posteriores sobre os mecanismos de tolerância à droga em M. tuberculose.
Resumo
Mycobacterium tuberculosis, agente etiológico da tuberculose humana, tem uma capacidade extraordinária para sobreviver contra estresses ambientais, incluindo antibióticos. Embora a tolerância ao estresse de M. tuberculose é um dos provavelmente contribui para a quimioterapia 6-mês longo da tuberculose 1, os mecanismos moleculares subjacentes ao fenótipo característica do agente patogénico permanecem incertos. Muitas espécies microbianas evoluíram para sobreviver em ambientes estressantes por auto-montagem em superfície altamente organizada, em anexo, e estruturas matriciais encapsulados chamados biofilmes 2-4. Crescimento em comunidades parece ser uma estratégia de sobrevivência preferida de micróbios, e é conseguida por meio de componentes genéticos que regulam fixação superfície, as comunicações intercelulares, e síntese de substâncias poliméricas extracelulares (EPS) 5,6. A tolerância ao estresse ambiental é provavelmente facilitada pela EPS, e talvez pelo fisiolóadaptação tecnológico de bacilos indivíduo a microambientes heterogêneos dentro da complexa arquitetura de biofilmes 7.
Em uma série de trabalhos recentes, estabeleceu que M. tuberculosis e Mycobacterium smegmatis têm uma forte propensão para crescer em organizados estruturas multicelulares, chamado biofilmes, que pode tolerar mais de 50 vezes as concentrações inibitórias mínimas das drogas anti-tuberculose isoniazida e rifampicina 8-10. M. tuberculose, no entanto, intrigantemente requer condições específicas para formar biofilmes maduros, em proporção de 9:1 particular de headspace: meios bem como a troca limitada de ar com a atmosfera 9. Requisitos de especializados condições ambientais poderia possivelmente ser ligada ao facto de que a M. tuberculosis é um patógeno humano obrigatório e, portanto, se adaptou aos ambientes de tecido. Nesta publicação, demonstrar os métodos para cultura de M. tuberculosebiofilme em uma garrafa e um formato de placa de 12 poços, que é conveniente para estudos bacteriológicos, bem como genéticos. Nós descrevemos o protocolo para uma estirpe atenuada de M. tuberculose, mc dois 7000, com supressão nos dois loci, panCD e RD1, que são críticas para crescimento in vivo do agente patogénico 9. Esta variedade pode ser usado com segurança em uma contenção BSL-2 para a compreensão da biologia básica do patógeno tuberculose, evitando assim a exigência de uma instalação de BSL-3 caro. O método pode ser estendida, com modificação adequada em meios de comunicação, a crescer biofilme de outras espécies de micobactérias cultiváveis.
Em geral, um protocolo uniforme de biofilmes cultura de micobactérias vai ajudar os pesquisadores interessados em estudar as características básicas resistentes de micobactérias. Além disso, um método claro e conciso do crescimento de biofilmes de micobactérias também irá ajudar o inv clínica e farmacêuticaestigators para testar a eficácia de um fármaco potencial.
Protocolo
1. Biofilmes de crescimento de M. tuberculose em uma garrafa de 250 ml com tampa de rosca
- Preparação Media: Dissolver 0,5 g de KH 2 PO 4, 0,5 g de MgSO4, 4g de L-asparagina, 2g de ácido cítrico, 0,05 g de citrato de amónio férrico, 60mL de glicerol em 900ml de água. Ajustar o pH a 7,0 com NaOH. Autoclave, arrefecer e imediatamente antes de se iniciar a experiência, adicionar ZnSO estéril 4 a uma concentração final de 0,1% w / v Desde mc 2 7000 é um auxotrofo pantotenato esta estirpe também requer ácido pantotênico em 10μg/mL de concentração final.
Nota: Esta é uma composição padrão de mídia Sauton de usados para M. tuberculosis. No entanto, se for necessário outros meios especializados pode também ser utilizado para outras espécies micobacterianas.
- Inóculo preparação: Crescer M. tuberculosis em 7H9OADC com 0,05% de Tween-80 durante uma semana, ou OD 600 de 0,7 a 1,0. O CuLTURE pode ser directamente utilizado como inoculo a uma diluição de 1:100.
- Pipetar 25 ml de meios de comunicação para um Sauton 250mL garrafa de poliestireno parafuso capped (Corning). Adicionar 250μl do inoculo para o meio, a tampa da garrafa muito firmemente e colocá-la intacta numa humidificada a 37 ° C incubadora durante 3 semanas. Observar a garrafa uma vez em cada dia para assegurar que não há qualquer contaminação.
- No final da terceira semana, soltar a tampa da garrafa, para permitir um maior crescimento de M. tuberculosis na interface. Se a tampa não está solto, nesta fase, em seguida, a concentração de oxigénio insuficiente no recipiente irá retardar o crescimento adicional de bactérias.
2. Crescimento de M. biofilmes de tuberculose em 12 poços
- Prepare a mídia e inóculo de mc 2 7000, conforme descrito nas seções A1 e A2.
- Misture 60ml de mídia com 600μl do inóculo. Dispensar 4.5mL da mistura em cada poço da placa. Cobrir a placa com tampa. Enrole a placa várias vezes com parafilme. Incubar a placa não perturbada no incubador humidificado a 37 ° C durante 5 semanas.
3. Determinar a freqüência de persistentes drogas tolerantes em M. tuberculose biofilmes
- Crescer M. biofilmes de tuberculose em um formato de 12 bem como descritos na secção B. Isso vai demorar um total de cerca de 5 semanas.
- Uma vez que os biofilmes são maturados (após 5 semanas de incubação) injectar a escolha do antibiótico na concentração desejada para o meio sob as biofilmes utilizando um microtip de uma pipeta.
Nota: O volume dos meios de comunicação sob as películas reduz a cerca de 3,0 mL. Assim, os investigadores devem, por conseguinte calcular a quantidade de droga.
- Agite ligeiramente a placa de modo a que o antibiótico é completamente difundido no meio. Para obter resultados estatisticamente significativos, injetar a antibióticosótica em quatro poços. Em paralelo, injectar o mesmo volume de solvente em que o antibiótico foi dissolvido em outros quatro poços, e deixar os últimos quatro cavidades da placa intacto. Cobrir a placa com a tampa e colocar novas camadas de parafilme em torno do prato. Coloque-o de volta na incubadora por um período de tempo desejado.
- No final da incubação, a placa de abrir e adicionar Tween-80 para a concentração final de 0,1% (volume / volume) em cada um dos poços. Redemoinho toda a placa suavemente para a dispersão uniforme do detergente. Incubar a placa à temperatura ambiente durante 15 minutos. Misturar o conteúdo de cada poço com uma pipeta várias vezes de modo que todo o conteúdo pode ser uniformemente transferidos para um tubo de 15 mL cónico.
- Girar para baixo o conteúdo do tubo a 4000rpm durante 10 minutos à temperatura ambiente. Ressuspender o sedimento em 5 mL de tampão de lavagem fresca (PBS com 10% de glicerol e 0,05% de Tween-80). Repita as lavar três vezes. Ressuspender o sedimento em 5 mL de tampão de lavagem. Mantenha-o na cadeira de balanço para overnight a 4 ° C.
Nota: Embora a baixa temperatura foi originalmente desenvolvida para o M. smegmatis (para minimizar o seu crescimento durante a dispersão) e utilizado para o M. tuberculosis, bem como, as espécies de crescimento lento pode provavelmente ser embalado à temperatura ambiente sem qualquer impacto no resultado. Balançando a temperatura ambiente pode ser necessário se trabalhar em BSL-3 instalações.
- Prepara-se uma seringa estéril equipado com microponta (2-200μl) cortando a sua extremidade larga para o tamanho apropriado, encaixando-lo para a seringa e envolvê-lo com parafilme. Passe todo o conteúdo do tubo através da seringa ponta-equipada e recolher em um tubo fresco 15ml. Repita este passo 5 a 6 vezes até que você observar uma suspensão bastante homogênea.
- Preparar diluições em série da suspensão e da placa as diluições em placa 7H11OADC para determinar o número de colónias viáveis em cada poço. Incubar as placas durante três semanas, em 37 ° C incubadora. Determinar a frecy de persistentes na população de biofilme pelo cálculo da razão entre o número de colónias obtidas em antibiótico tratados com os obtidos em solventes placas tratadas.
4. Os resultados representativos
Quando em cultura em um frasco de crescimento, de M. tuberculosis pode ser visto na base da garrafa, até ao final da primeira semana. Ao final da segunda semana, o crescimento de bactérias irregular na interface ar-media pode ser visto, embora o crescimento na interface ar-media é consistentemente visível no final da terceira semana (Fig. 1A). Nesta altura, a fixação das bactérias à parede do recipiente é também observada. A partir deste ponto, o crescimento da cultura ocorre principalmente na interface ar-media. O líquido sob a superfície de crescimento é clara. Tipicamente, a estrutura amadurece até ao final da quinta semana (Fig. 1B). Se a incubação é prolongada, as estruturas começará a afundar-se para o fundo do recipiente. Curiosamente,aperto da tampa até que o fim da terceira semana é um passo importante no processo, e por razões desconhecidas uma garrafa solta-capped significativamente retarda o início do crescimento na interface 9.
No formato de 12 poços, um biofilme robusta na interface ar-media é visto em cada um dos poços no final de cinco semanas (Fig. 2A). Se as placas não são completamente envolto em seguida, o crescimento do biofilme diferencial é observada. No pior dos casos, a evaporação meios significativo pode parar o crescimento das bactérias (Fig. 2B). Assim, o acondicionamento da placa é necessário tanto para prevenir a evaporação, bem como para fornecer um ambiente para a formação de biofilme (ver parágrafo anterior).
O número de bacilos viáveis em biofilmes determinados com esta técnica é bastante reprodutível. Resposta de M. tuberculose biofilmes varia com a natureza dos antibióticos. Para um antibiótico bactericida, tais como rifampicina, perda de viabilidade segue um bipha sic tendência 9. Um rápido declínio na viabilidade durante os primeiros três a quatro dias, seguido por uma fase de persistente em que uma pequena percentagem da população permanecem completamente recalcitrante aos antibióticos, independentemente da concentração do antibiótico ou o tempo de exposição. A Figura 3 mostra o número de bacilos viáveis em biofilmes maduros após uma exposição de 7 dias para 50μg/mL (50 vezes mais elevada do que a MIC) de rifampicina.

Figura 1A aparência. Precoce do M. bacilos da tuberculose na interface ar-media de bactérias após 3 semanas de incubação.

Figura 1B. Maturados biofilmes de M. tuberculosis na interface ar-media após cinco semanas de incubação.
820/3820fig2A.jpg "/>
Figura 2A. Com 5 semanas de idade biofilmes de M. tuberculose cultivadas em 12-formato bem.
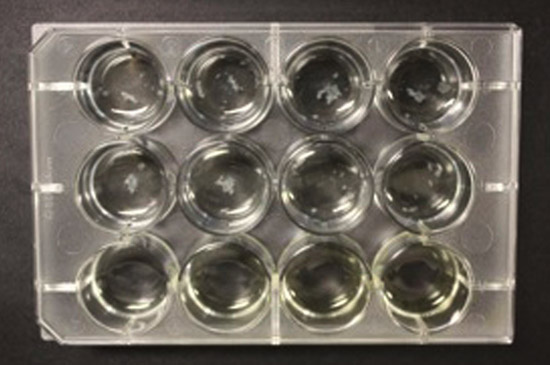
Figura 2B. Uma tentativa fracassada de crescer biofilmes de M. tuberculosis em 12-bem a chapa sem parafilme.
Figura 3. Enredo Um representante com a frequência da persistentes drogas tolerantes em M. tuberculose biofilmes cultivadas em 12-formato bem e expostos a 50μg/mL de rifampicina, durante sete dias.
Discussão
A tuberculose (TB), causada pela infecção do Mycobacterium tuberculosis, continua a ser uma grande ameaça à saúde pública global. Quase um terço da população mundial é estimada para ser assintomática infectada pelo patógeno, cerca de 9 milhões de novos casos aparecem na clínica todos os anos com sintomas de tuberculose ativa e cerca de 1,7 milhões morrem da infecção a cada ano 11. O enorme fardo da doença é essencialmente contribuído por falta de uma vacina e uma quimioterapia mui...
Divulgações
Não temos nada a divulgar.
Agradecimentos
O trabalho foi realizado com apoio financeiro do Instituto Nacional de Saúde e American Lung Association.
Materiais
| Name | Company | Catalog Number | Comments |
| Incubator | VWR international | Model # 1923/25 | |
| Polystyrene culture bottles | Fisher Scientific | 03-374-300 | |
| 12-well tissue culture plate | VWR international | 62406-165 | |
| 50-mL conical tubes | VWR international | 89039-660 | |
| Rocker | Thermo Fisher Scientific, Inc. | 57019-662 | |
| Chromatographic refrigerator | VWR international | 55702-520 | |
| petri dish | VWR international | 25384-342 | |
| KH2PO4 (monobasic) | EMD Millipore | PX1565-1 | |
| MgSO4 | Fisher Scientific | M65-500 | |
| L-asparagine | Sigma-Aldrich | A4284-100G | |
| citric acid | Sigma-Aldrich | C1857-100G | |
| ferric ammonium citrate | Sigma-Aldrich | F5879-100G | |
| glycerol | EMD Millipore | GX0185-5 | |
| NaOH | Sigma-Aldrich | S8045-500G | |
| ZnSO4 | Sigma-Aldrich | Z4750-500G | |
| D-pantothenic acid | Sigma-Aldrich | P2250-25G | |
| Difco Middlebrook 7H9 Broth | BD Biosciences | 271310 | |
| Middlebrook OADC Enrichment | BBL | 212351 | |
| Tween-80 | Fisher Scientific | T164-500 | |
| 250mL storage bottle | Corning | 430281 | |
| 12 well plates | Falcon BD | 353043 | |
| rifampicin | Sigma-Aldrich | R3501-1G | |
| methanol | JT Baker | 9070-05 | |
| 10mlLsyringe | BD Biosciences | 301604 | |
| 1-200μL pipet tips | VWR international | 89079-458 | |
| parafilm M | VWR international | PM-996 | |
| 15mL centrifuge tube | Greiner Bio-One | 188-285 | |
| Difco Mycobacteria 7H11 Agar | BD Biosciences | 283810 | |
| NaCl | Fisher Scientific | BP358-1 | |
| KCl | Sigma-Aldrich | P9333-500G | |
| Na2HPO4 (dibasic) | Sigma-Aldrich | S0876-500G |
Referências
- Saltini, C. Chemotherapy and diagnosis of tuberculosis. Respir. Med. 100, 2085-2097 (2006).
- Hall-Stoodley, L., Stoodley, P. Biofilm formation and dispersal and the transmission of human pathogens. Trends Microbiol. 13, 7-10 (2005).
- Costerton, J. W., Stewart, P. S., Greenberg, E. P. Bacterial biofilms: a common cause of persistent infections. Science. 284, 1318-1322 (1999).
- Blankenship, J. R., Mitchell, A. P. How to build a biofilm: a fungal perspective. Curr Opin Microbiol. 9, 588-594 (2006).
- Henke, J. M., Bassler, B. L. Bacterial social engagements. Trends Cell Biol. 14, 648-656 (2004).
- Kolter, R., Losick, R. One for all and all for one. Science. 280, 226-227 (1998).
- Branda, S. S., Vik, S., Friedman, L., Kolter, R. Biofilms: the matrix revisited. Trends Microbiol. 13, 20-26 (2005).
- Ojha, A. GroEL1: a dedicated chaperone involved in mycolic acid biosynthesis during biofilm formation in mycobacteria. Cell. 123, 861-873 (2005).
- Ojha, A. K. Growth of Mycobacterium tuberculosis biofilms containing free mycolic acids and harbouring drug-tolerant bacteria. Mol. Microbiol. 69, 164-174 (2008).
- Ojha, A. K., Trivelli, X., Guerardel, Y., Kremer, L., Hatfull, G. F. Enzymatic hydrolysis of trehalose dimycolate releases free mycolic acids during mycobacterial growth in biofilms. J. Biol. Chem. 285, 17380-17389 (2010).
- Dye, C., Lonnroth, K., Jaramillo, E., Williams, B. G., Raviglione, M. Trends in tuberculosis incidence and their determinants in 134 countries. Bull World Health Organ. 87, 683-691 (2009).
- Jindani, A., Dore, C. J., Mitchison, D. A. Bactericidal and sterilizing activities of antituberculosis drugs during the first 14 days. Am. J. Respir. Crit. Care Med. 167, 1348-1354 (2003).
- Carter, G., Wu, M., Drummond, D. C., Bermudez, L. E. Characterization of biofilm formation by clinical isolates of Mycobacterium avium. J. Med. Microbiol. 52, 747-752 (2003).
- Hall-Stoodley, L., Lappin-Scott, H. Biofilm formation by the rapidly growing mycobacterial species Mycobacterium fortuitum. FEMS Microbiol. Lett. 168, 77-84 (1998).
- Alibaud, L. Temperature-dependent regulation of mycolic acid cyclopropanation in saprophytic mycobacteria: role of the Mycobacterium smegmatis 1351 gene (MSMEG_1351) in CIS-cyclopropanation of alpha-mycolates. J. Biol. Chem. 285, 21698-21707 (2010).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados