É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Análise da maturação das células dendríticas e migração pulmonar durante a inflamação alérgica das vias aéreas
Neste Artigo
Resumo
Nós descrevemos uma estratégia para monitorar a maturação e migração de células dendríticas pulmonares em resposta à ovalbumina na configuração de ovalbumina inflamação das vias aéreas induzida alérgica. Esta estratégia pode ser modificado para avaliar a migração de células dendríticas pulmonares nas configurações de infecção.
Resumo
As células dendríticas (DCs) são os principais agentes envolvidos na iniciação da resposta imune adaptativa por ativação de células T antígeno-específicas. DCs estão presentes nos tecidos periféricos em estado estacionário, no entanto, em resposta à estimulação de antigénio, DCs assumir o antigénio e rapidamente migram para os nódulos linfáticos drenantes onde eles iniciam resposta de células T contra o antigénio 1,2. Além disso, DCs também desempenham um papel-chave na iniciação auto-imune, bem como alérgica resposta imunitária 3.
DCs desempenham um papel essencial em ambos iniciação da resposta imune e indução de tolerância na configuração do ambiente de pulmão 4. Ambiente de pulmão é em grande parte tolerogénico, devido à exposição a vasta gama de antigénios ambientais 5. No entanto, em alguns indivíduos, há um intervalo de tolerância, o que leva a indução de alergia e asma. Neste estudo, descrevemos uma estratégia, o que pode ser utilizado para monitorizar das vias aéreas maturação DC e MIGração em resposta ao antigénio utilizado para a sensibilização. A medição da via aérea maturação DC e migração permite a avaliação da cinética da resposta imune durante inflamação das vias aéreas alérgica e também auxilia na compreensão da magnitude da resposta imune subsequente, juntamente com os mecanismos subjacentes.
A nossa estratégia é baseada no uso de ovalbumina como um agente sensibilizante. Ovalbumina induzida asma alérgica é um modelo largamente utilizado para reproduzir a eosinofilia das vias aéreas, inflamação pulmonar e níveis elevados de IgE encontrados durante a asma 6,7. Após a sensibilização, os ratos são desafiados por administração intranasal de FITC ovalbumina rotulado, que permite a marcação específica de DCs das vias aéreas que ovalbumina absorção. Em seguida, usando vários marcadores específicos DC, podemos avaliar a maturação desses DCs e também pode avaliar a sua migração para os linfonodos de drenagem através do emprego de citometria de fluxo.
Protocolo
1. Sensibilização de camundongos com ovalbumina
- Preparar uma solução de OVA (grau V; Sigma, MO) em PBS estéril a uma concentração de 1 mg / ml (solução pode ser armazenada a -80 ° C).
- A fim de preparar OVA Alum-mistura, toma Alum num tubo e adicionar solução de OVA em uma forma gota a gota, enquanto o tubo de vórtice em uma proporção de 1:1. Agita-se a mistura durante 30 minutos e utilizar imediatamente após a mistura.
- Utilizando uma seringa de 1 ml, 0,2 ml de injectar a mistura em rato cavidade peritoneal e repetir a injecção de novo depois de 2 semanas.
2. Desafio intranasal de camundongos com ovalbumina Identificada FITC
- 7 dias após a segunda injecção de OVA-Alum, os ratinhos estão prontos para serem desafiados intranasalmente com OVA-FITC.
- Preparar uma solução de OVA-FITC (Sigma) utilizando PBS estéril a uma concentração de 1 mg / ml e armazenar em alíquotas a -80 ° C.
- Colocar uma gaze estéril, na parte inferior de um tubo Falcon de 50 ml e em um h químicaood, adicionar 5 ml de Aerrane sobre a gaze. A fim de anestesiar ratinhos, dirigir o animal para dentro do tubo para segundo aproximadamente 5-10.
- Segurar o animal anestesiado em posição vertical e utilizando pontas de pipeta estéreis, Pipetar 100 da solução de OVA-FITC para as narinas de ratinhos de uma forma gota a gota,.
- Repita desafio intranasal com OVA-FITC para os próximos dois dias.
3. Preparação de uma única célula Suspensão dos pulmões e os linfonodos de drenagem
- Sacrificar os ratos usando injeção intraperitoneal de Euthanyl.
- A fim de reduzir a contaminação de macrófagos, que pode complicar análise DC, lavagem pulmonar é realizada. Para a lavagem dos pulmões, traqueias de rato são brevemente exposta e canulada com um cateter e uma seringa; usando PBS gelado com 5 mM de EDTA, o tracto respiratório inferior é enxaguado 3 vezes para remover as células dos espaços alveolares.
- Perfundir os pulmões com 10 ml de PBS contendo 10 U / ml heparem através do ventrículo direito do coração, para remover as células de sangue a partir da vasculatura do pulmão. Executar as perfusões até que os pulmões virar branco, indicativo de remoção da maior parte das células do sangue. Isto é especialmente importante para remover as células contaminantes a partir do sangue periférico.
- Dissecar os pulmões para fora e remover os gânglios linfáticos do mediastino (MLN) e coloque os linfonodos em um prato separado. (Tente minimizar a exposição dos tecidos à luz para evitar extinção de fluorescência FITC).
- Colocar os pulmões em uma placa de Petri e mediu utilizando uma tesoura. Em seguida digerir os pulmões durante 25 minutos a 37 ° C, utilizando 250 U / ml de colagenase D (Roche) e adicionar EDTA (10 mM de concentração final) para os próximos 5 minutos para parar a actividade da colagenase.
- Passar os fragmentos digeridos de pulmões através de um filtro de células de 100 um e realizar a lise hipotónico para remover eritrócitos. A suspensão de células única está pronto para posterior análise de DCs.
- A fim de preparar a suspensão de célula única a partir do MLN, taliviar a MLN utilizando agulhas finas e digerir com colagenase tal como descrito acima, seguido por esforço através de um filtro de célula.
4. A coloração para DC Marcadores para Avaliar a maturação / migração
- A fim de identificar DCs nos pulmões, a coloração é realizada para CD11c e CD11b. Além disso para avaliar a maturação, a coloração é realizada para CD86 e CD80, que são upregulated como DCS sofrer maturação. CD11c + CD11b + células OVA-FITC + no MLN são identificados como DCs pulmonares migratórias dos pulmões para o MLN em resposta ao desafio das vias aéreas OVA.
- Suspender as células a uma concentração de 10 x 10 6 células / ml em tampão FACS (PBS com 1% de FBS e EDTA 1 mM) e uL aliquota de suspensão de células 150 / tubo para a coloração de FACS. Para a identificação dos DCs de pulmão, manchas seguintes são necessários: controle corado (células pulmonares de camundongos não expostos à OVA-FITC), controle de OVA-FITC, controle de CD11c único, controle de CD11b único, CD11b+ CD11c + duplo controlo, CD11b + OVA-FITC + controle duplo, controle de CD11c + OVA-FITC + dupla, MHC II único controle, CD86 único controle, CD80 único controle e amostras coradas para OVA-FITC + CD11c + CD11b + + MHCII , OVA-FITC + + CD11c CD11b + CD86 + e OVA-FITC + + CD11c CD11b + CD80 +.
- Para avaliar a migração DC, realizar a contagem de células absolutos da suspensão de células única a partir de MLN e, subsequentemente, preparar os tubos seguintes: controlo não corado (células MLN de ratinhos não expostos à OVA-FITC), OVA-FITC de controlo, CD11c + controlo único, CD11b + de duplo controlo, CD11b + OVA-FITC + duplo controle, CD11c + OVA-FITC + duplo controle e CD11c + CD11b + de amostras OVA-FITC A +.
5. Os resultados representativos
Os pontos de tempo necessários para a sensibilização intraperitoneal para induzir a inflamação das vias aéreas alérgica é importante e deve ser realizada como descrito na Figura 1. Após sensibilização intraperitoneal e desafio com OVA das vias aéreas, para confirmar a indução da inflamação das vias aéreas alérgica, alguns ratinhos pode ser sacrificado e as análises histológicas pode ser efectuada nas secções de pulmão como mostrado na Figura 2. Presença de células inflamatórias pode ser confirmada por hematoxilina e eosina (Figura 2A) e presença de produção de muco pode ser avaliada por ácido periódico de Schiff-mancha (Figura 2B). No conjunto, este irá confirmar a indução de inflamação das vias aéreas alérgica após o desafio com OVA de OVA-sensibilizados ratos 8. Em contraste, as secções de pulmão a partir de ratinhos tratados com solução salina são esperados para estar livre de qualquer inflamação, juntamente com a ausência de qualquer produção de muco. Além disso, o desafio com OVA seguinte, pulmonar DCs unde RGO maturação e posterior migração para os linfonodos de drenagem. Análise de CD11c + células dos nodos linfáticos mediastinal (MLN) de ratinhos sensibilizados e desafiados com OVA é esperado para mostrar uma maior proporção de células CD11c + em comparação com ratinhos tratados com solução salina (Figura 3A). Além disso, a análise da contagem de células absoluta de CD11c + CD11b + de OVA-FITC + de células no MLN de ratinhos OVA-sensibilizadas e desafiados, espera-se que mostram uma significativamente maior (isto é, várias vezes superior) de contagem que os homólogos de salinas ratinhos tratados ( A Figura 3B).
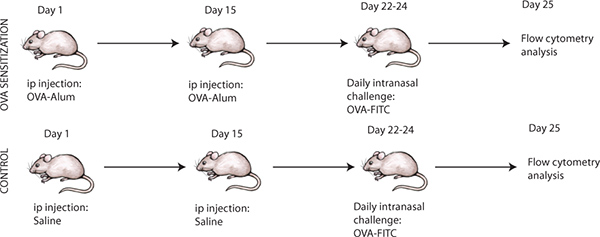
Figura 1. Protocolo experimental para a indução de ovalbumina (OVA) a inflamação das vias aéreas induzida em ratinhos alérgica, juntamente com desafio das vias aéreas com FITC ovalbumina rotulada (OVA-FITC).
fig2.jpg "/>
Figura 2. Sensibilização OVA seguido por desafio das vias aéreas OVA conduz a indução de inflamação das vias aéreas alérgica como identificado por hematoxilina e eosina coloração de secções de pulmão mostrados em (A) e conduz também à produção de muco nas vias aéreas tal como identificado por coloração pelo ácido periódico de Schiff de pulmão secções como mostrado em (B).

Figura 3. OVA-FITC desafio induz DC migração dos pulmões para os gânglios linfáticos do mediastino (MLN). (A) parcelas de citometria de fluxo que descreve proporções de CD11c + células no MLN de controlo ou de OVA-sensibilizadas ratinhos. (B) As contagens absolutas de CD11c + CD11b + células OVA-FITC + no MLN de ratos salina ou OVA-sensibilizados. * P <0,05. Clique aqui para ver maior figura .
Discussão
O método aqui apresentado oferece uma abordagem baseada em citometria de fluxo para análise de DCs pulmonares, com base na entrega de OVA-FITC para o desafio da via aérea. Isto permite a monitorização selectiva de DCs pulmonares, que ocupam OVA-FITC e, portanto, as populações de CC, que são acompanhados são efectivamente as que participam na resposta das vias aéreas imune durante o curso de OVA induzida por inflamação das vias aéreas alérgica. Em ratinhos de controlo, na ausência de inflamação das vias ...
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Este trabalho foi financiado por doações CIHR e CF Canadá ao Dr. Jim Hu e por uma bolsa de estudo de doutorado concedida para Rahul Kushwah pela CF Canadá.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | |
| Ovalbumina | Sigma-Aldrich | A5503 | |
| Alúmen | Thermo Scientific | 77161 | |
| OVA-FITC | Sigma-Aldrich | A9771 | |
| Colagenase D | Roche | 11088858001 | |
| Antibodies | e-Bioscience |
Referências
- Kushwah, R., Hu, J. Role of dendritic cells in the induction of regulatory T cells. Cell Biosci. 20, (2011).
- Kushwah, R., Hu, J. Complexity of dendritic cell subsets and their function in the host immune system. Immunology. 133, 409-419 (2011).
- Lambrecht, B. N., Hammad, H. Taking our breath away: dendritic cells in the pathogenesis of asthma. Nat Rev Immunol. 3, 994-1003 (2003).
- Hammad, H., Lambrecht, B. N. Dendritic cells and epithelial cells: linking innate and adaptive immunity in asthma. Nat. Rev. Immunol. 8, 193-204 (2008).
- Lloyd, C. M., Murdoch, J. R. Tolerizing allergic responses in the lung. Mucosal. Immunol. 3, 334-344 (2010).
- Herz, U. The relevance of murine animal models to study the development of allergic bronchial asthma. Immunol. Cell Biol. 74, 209-217 (1038).
- Herz, U., Lumpp, U., Daser, A., Gelfand, E. W., Renz, H. Murine animal models to study the central role of T cells in immediate-type hypersensitivity responses. Adv. Exp. Med. Biol. 409, 25-32 (1996).
- Nakae, S. TNF can contribute to multiple features of ovalbumin-induced allergic inflammation of the airways in mice. J. Allergy Clin. Immunol. 119, 680-686 (2007).
- Guth, A. M. Lung environment determines unique phenotype of alveolar macrophages. Am. J. Physiol. Lung Cell Mol. Physiol. 296, L936-L946 (2009).
- Kushwah, R., Cao, H., Hu, J. Characterization of pulmonary T cell response to helper-dependent adenoviral vectors following intranasal delivery. J. Immunol. 180, 4098-4108 (2008).
- Kushwah, R., Oliver, J. R., Zhang, J., Siminovitch, K. A., Hu, J. Apoptotic dendritic cells induce tolerance in mice through suppression of dendritic cell maturation and induction of antigen-specific regulatory T cells. J. Immunol. 183, 7104-7118 (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados