É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Avaliação de replicação e função das células beta no Adenovirally transduzidas isoladas ilhotas de roedores
Neste Artigo
Resumo
Este protocolo permite uma para identificar factores que modulam a massa de células funcional de beta para encontrar potenciais alvos terapêuticos para o tratamento da diabetes. O protocolo é constituído por um método simplificado para avaliar a replicação de ilhotas e função das células beta em ilhéus isolados de ratos após a manipulação da expressão do gene com adenovírus.
Resumo
Homeostase da glucose é principalmente controlada pela insulina hormonas endócrinas e glucagon, secretada a partir da beta pancreáticas e células alfa, respectivamente. Massa celular funcional beta é determinado pela massa anatómica beta celular, bem como a capacidade das células beta para responder a uma carga de nutriente. Uma perda de massa funcional das células beta é central para ambas as formas principais de diabetes 1-3. Considerando que as declínio da capacidade funcional das células beta resultados de massa de um ataque auto-imune em pacientes com diabetes tipo 1, diabetes tipo 2, este decréscimo se desenvolve tanto uma incapacidade das células beta a secretar insulina de forma apropriada e destruição das células beta de um quadro de mecanismos. Assim, os esforços para restabelecer a massa de células beta funcional são fundamentais para o melhor tratamento e possíveis curas para o diabetes.
Esforços estão em andamento para identificar caminhos moleculares que podem ser exploradas para estimular a replicação e melhorar a função das células beta.Idealmente, alvos terapêuticos iria melhorar tanto o crescimento das células beta e função. Talvez o mais importante é que para identificar se uma estratégia que estimula o crescimento das células beta está no custo da função das células beta prejudicando (tal como com alguns oncogenes) e vice-versa.
Sistematicamente suprimindo ou superexpressão de expressão de genes-alvo em ilhéus isolados de ratos, é possível identificar potenciais alvos terapêuticos para o aumento da massa funcional das células beta 4-6. Vectores adenovirais podem ser empregues para proteínas eficientemente superexpressam ou knockdown em ilhéus isolados de ratos 4,7-15. Aqui, nós apresentamos um método para manipular a expressão do gene utilizando transdução adenoviral e avaliar a replicação de ilhotas e função das células beta em ilhéus isolados de ratos (Figura 1). Este método tem sido utilizado anteriormente para identificar novos alvos que modulam a replicação das células beta ou função 5,6,8,9,16,17.
Protocolo
1. Transdução adenoviral e cultura de ilhotas de ratos
- Prepara-se uma placa de 6 poços de cultura de tecido não-revestido por adição de 2 ml de meio (RPMI 1640 contendo 8 mM de glucose, 10% de soro fetal bovino, 50 unidades / ml de penicilina, e 50 ug / ml de estreptomicina) para o número necessário de poços. Por exemplo, uma experiência típica pode exigir três poços - um para cada um controlo não-vírus, um controle de vírus (por exemplo, GFP-expressando adenovírus), eo grupo experimental.
- Aqueceu-se a placa a 37 ° C, colocando-a em uma cultura de tecidos incubadora durante pelo menos 30 min.
- Imediatamente após o isolamento de rato ilhota 18,19, o local de 100-200 ilhotas em poços individuais da placa de cultura de 6 poços tecido não-revestido. Sessenta ilhotas são necessários para a secreção de insulina e ensaios de incorporação de timidina. As ilhotas restantes podem ser utilizados para o isolamento de RNA para estudos de expressão génica ou isolamento de proteínas para immunoblotting.
[Nota: A partir deste ponto em diante, siga protocolos institucionais para o manejo, uso e descarte de materiais perigosos.]
- Agite ligeiramente a placa para trazer as ilhotas para o centro do poço.
- Pipetar o adenovírus directamente sobre as ilhotas no centro do prato. Use 100-500 multiplicidades de infecção (MOI, a proporção de células alvo para virais unidades formadoras de placas).
- Deixe o resto ilhotas durante 5 min.
- Colocar a placa na incubadora de cultura de tecido (37 ° C, 5% de CO 2).
- Após 24 h, agite a placa para trazer as ilhotas para os centros dos poços e transferir as ilhotas utilizando uma micropipeta P200 para uma nova poços contendo meio fresco. Se as ilhotas tornar-se ligado à placa, eles podem ser desalojado suavemente com a ponta da pipeta.
[Nota: Para verificar eficiên transdução adequadacy, a utilização de um vírus de controlo expressando GFP é benéfico, tal como ilhotas pode então ser trabalhada por meio de microscopia confocal para verificar a penetração do adenovírus no núcleo das ilhotas.]
- Cultura das ilhotas para uma h 24-72 adicional, dependendo da temporização desejada do experimento a partir de estudos piloto de optimização. Por exemplo, a indução de uma resposta proliferativa podem exigir tempos que variam de 24-72 h ou knockdown do gene de interesse pode exigir 48 ou 72 horas. Transfira as ilhotas de mídia fresco todos os dias.
- Para a 24 h final da experiência, a cultura das ilhotas em meios contendo 1 uCi [metil-3 H] -thymidine/ml meios de comunicação (geralmente 1 uL de timidina / ml a media).
[Nota: A partir deste ponto em diante, siga protocolos institucionais para o manejo, uso e descarte de materiais radioativos.]
2. Teste de secreção de insulina
- Preparar otampão de secreção de ensaio (SAB) de solução stock de 10X (1,14 M de NaCl, 47 mM de KCl, 12 mM de KH 2 PO 4, 11,6 mM MgSO4) e CaCl 2 100X solução stock (0,25 M de CaCl2). Estas soluções de reserva pode ser preparado antecipadamente e guardado à temperatura ambiente.
- Recém-prepará 50 ml de ORS de trabalho (5 mL de SAB 10X, 1 ml de HEPES 1 M, 0,5 ml de 100X de CaCl2, 0,28 ml de BSA 35%, 0,11 g de NaHCO3, e água estéril para 50 ml) num 50-ml cónica do tubo e aquecido a 37 ° C, colocando em um banho-maria a 37 ° C.
- Pipetar 10 ml da ORS de trabalho para um tubo de 15 ml e adicionar 66,8 ul de 2,5 M D-glucose para preparar o glucose elevada (16,7 mM) SAB.
- Adicionar 44,8 ul de 2,5 M D-glucose ao ml restantes 40 da ORS de trabalho para preparar a glicose baixa (2,8 mM) SAB.
- Rotular três tubos de 1,7 ml de microcentrífuga para cada poço da placa de 6 poços e adicionar 1 ml de salino tamponado com fosfato (PBS).
[Nota: Como as ilhotas são radioativos, siga protocolos institucionais para o manejo, uso e descarte de materiais radioativos.]
- Colocar 20 ilhotas em cada tubo de microcentrífuga. Fazer com que cada tentativa de adicionar ilhotas de tamanho comparável a cada tubo de microcentrífuga. Por exemplo, cada tubo pode conter 5 a médio, 10-, pequenas e 5 de grande porte ilhotas (ver Figura 1).
[Nota: Islets pode ser visualizada usando um estereoscópio dissecando ou um microscópio padrão.]
- Após as ilhotas se estabeleceram na parte inferior do tubo por gravidade (~ 2 min), aspirar o PBS com uma micropipeta e descartar.
[Nota: Como uma alternativa para a sedimentação por gravidade, os tubos podem ser centrifugado a 300 xg durante 1 min.]
- Para a pré-incubação, adicionar 400 uL da glu baixocose SAB, colocar os tubos (com as suas tampas abertas) para o tecido incubador de cultura (37 ° C, 5% de CO 2), e pré-incubar durante 60 min. Aspirar a pré-incubação baixa glicose SAB e descarte.
- Para a secreção de insulina basal, adicionar 400 uL da baixa glicose SAB, colocar os tubos (com as suas tampas abertas) para o tecido incubador de cultura (37 ° C, 5% de CO 2), e incubar durante 60 min. Recolher o baixo de glicose SAB e poupar para o radioimunoensaio de insulina.
- Para a secreção de insulina estimulada, adicionar 400 uL da alta glucose SAB, colocar os tubos (com as suas tampas abertas) para o tecido incubador de cultura (37 ° C, 5% de CO 2), e incubar durante 60 min. Recolher o alto de glicose SAB e poupar para o radioimunoensaio de insulina.
3. Ensaio de Incorporação de timidina
- Adicionar 1 ml de PBS; após as ilhotas ter assente no fundo do tubo, por gravidade, aspirar o PBS com uma micropipeta, descartar, e repetir estepasso uma vez.
- Adicionar 500 uL de gelo de ácido tricloroacético frio (TCA, 10% w / v) e incubar em gelo durante 30 min.
- Centrifugar os tubos a 16 000 xg durante 3 min a 4 ° C.
- Aspirar a ATC, adicionar 80 ul de 0,3 N NaOH, e incubar durante 30 min à temperatura ambiente. Durante este tempo, vigorosamente vórtice as amostras para 5-10 s cada 10 min.
- Adicionar 4 ml de cocktail Econo-segura contagem para 7 ml tubos líquidos contagem de cintilação.
- Adicionar 50 ul da amostra para o tubo de contagem de cintilação, limitar o tubo, agitar brevemente, e contar num contador de cintilação líquida.
- Medir a concentração de proteína utilizando o ácido bicinconínico (BCA) de ensaio e 10 ul de amostra de acordo com o protocolo do fabricante.
4. Análise de Dados
- Realizar o radioimunoensaio insulina seguindo o protocolo do fabricante.
- Normalizar a secreção de insulina e os dados de incorporação de timidina com a proteína concentration.
5. Os resultados representativos
Um exemplo da experiência para avaliar a replicação de ilhotas e função das células beta em ilhotas de ratos é mostrado na Figura 2. Este exemplo mostra que a superexpressão adenoviral de "Gene # 6" hipotético robustamente estimula a replicação ilhota sem alterar a função das células beta. No painel superior, os resultados do ensaio de incorporação de timidina demonstrar que o aumento da expressão de "Gene # 6" aumenta a síntese de DNA, tal como medido pela incorporação de timidina. Como a maioria das células no ilhéu do rato são células beta, é provável que este aumento na incorporação de timidina indica um aumento da replicação das células beta. No entanto, as experiências de confirmação deve ser realizado para estabelecer firmemente este. No painel de fundo, os resultados do ensaio de secreção de insulina demonstrar que a superexpressão da "Gene # 6" não alterou uma das funções celulares primárias beta, isto é, insulin secreção de glicose baixa e alta. A qualidade do isolamento dos ilhéus e saúde dos ilhéus após o tratamento com adenovírus é indicado pelo aumento vezes na secreção de insulina em concentrações de glicose de baixa e alta. Se o aumento da expressão da função "Gene # 6" célula deficiente beta, este seria provavelmente como um decréscimo na insulina segregada em concentrações elevadas, estimuladores de glicose (16,7 mM). Uma curva dose-resposta para várias concentrações de glicose pode também ser realizada.
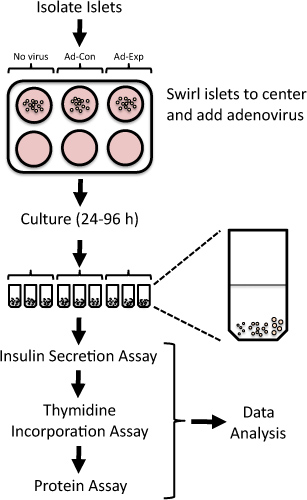
Figura 1. Geral de protocolo para avaliar a replicação de ilhotas e função das células beta em ilhéus isolados de ratos após adenoviral mediadas alterações na expressão do gene. Ilhotas de ratos recém-isoladas são expostos a adenovírus durante 24 horas e então cultivadas até 96 h. Incorporação de timidina são avaliados no 24 h final, seguido pela medição da secreção de insulina noglicose baixa e alta.
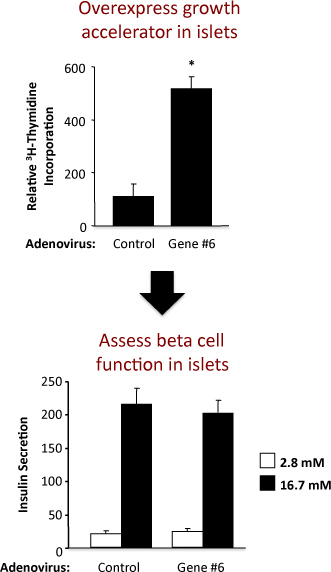
Figura 2. Os resultados de um experimento utilizando um adenovírus e controle de um adenovírus com superexpressão de um gene hipotético rotulados como "Gene # 6". O painel superior mostra a incorporação de timidina e do painel de fundo a secreção de insulina.
Discussão
Vias, que estabelece que pode ser modulada para estimular a replicação e melhorar a função das células beta são relevantes para ambas as formas principais de diabetes. Devido massa celular funcional beta é dependente da existência e função de células secretoras de insulina, avaliando estes determinantes simultaneamente tem as suas vantagens. Este protocolo descreve um protocolo simplificado para identificar se a superexpressão ou supressão de uma proteína leva a alterações na massa funcional das células...
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Este trabalho foi apoiado pela concessão DK078732 do NIH (a FPT).
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários |
| RPMI 1640 meios | Gibco | 11879 | |
| A penicilina / estreptomicina | Gibco | 15140 | |
| 6-bem placa | BD-Falcon | 35-1146 | Non-TC tratada |
| [Metil-3 H]-timidina | Perkin Elmer | NET027Z001MC | 1 mCi / ml |
| Micro-centrífuga tubos | Denville | C2170 | 1,7 ml |
| NaCl | Sigma | 59888 | |
| KCl | Acros | 42409 | |
| KH 2 </ Sub> PO 4 | Acros | 20592 | |
| MgSO4 | Acros | 41348 | |
| CaCl 2 | Acros | 34961 | |
| HEPES | Sigma | H0887 | Solução 1 M |
| 35% de BSA | Sigma | A7979 | |
| De NaHCO3 | Acros | 42427 | |
| d-glicose | Sigma | G8769 | |
| TCA | Fisher Scientific | SA9410-1 | 10% w / v |
| NaOH | Acros | 12426 | |
| Contagem de cintilação tubo | Sarstedt | 58,536 | 7 ml, PP |
| Cintilação tampa do tubo de contagem | Sarstedt | 65,816 | |
| Econo-Safe cocktail contando | RPI | 111175 | |
| RIA Insulina | Siemens | TKIN2 | |
| BCA Assay Kit | Thermo Scientific | 23250 | |
| Equipamento | |||
| Centrifugar | Eppendorf | 5415R | |
| Contagem de cintilação suporte de tubos | Sarstedt | 93.1431.001 | |
| Contador de cintilação líquida | Perkin Elmer | Tri-Carb 2910TR |
Referências
- Ferrannini, E. beta-Cell function in subjects spanning the range from normal glucose tolerance to overt diabetes: a new analysis. J. Clin. Endocrinol. Metab. 90, 493-500 (2005).
- Weyer, C., Bogardus, C., Mott, D. M., Pratley, R. E. The natural history of insulin secretory dysfunction and insulin resistance in the pathogenesis of type 2 diabetes mellitus. J. Clin. Invest. 104, 787-794 (1999).
- Keenan, H. A. Residual insulin production and pancreatic ss-cell turnover after 50 years of diabetes: Joslin Medalist Study. Diabetes. 59, 2846-2853 (2010).
- Bain, J. R., Schisler, J. C., Takeuchi, K., Newgard, C. B., Becker, T. C. An adenovirus vector for efficient RNA interference-mediated suppression of target genes in insulinoma cells and pancreatic islets of langerhans. Diabetes. 53, 2190-2194 (2004).
- Fueger, P. T. Trefoil factor 3 stimulates human and rodent pancreatic islet beta-cell replication with retention of function. Mol. Endocrinol. 22, 1251-1259 (2008).
- Schisler, J. C. Stimulation of human and rat islet beta-cell proliferation with retention of function by the homeodomain transcription factor Nkx6.1. Mol. Cell Biol. 28, 3465-3476 (2008).
- Chan, C. B. Overexpression of uncoupling protein 2 inhibits glucose-stimulated insulin secretion from rat islets. Diabetes. 48, 1482-1486 (1999).
- Cozar-Castellano, I., Takane, K. K., Bottino, R., Balamurugan, A. N., Stewart, A. F. Induction of beta-cell proliferation and retinoblastoma protein phosphorylation in rat and human islets using adenovirus-mediated transfer of cyclin-dependent kinase-4 and cyclin D1. Diabetes. 53, 149-159 (2004).
- Icyuz, M. Adenovirus infection activates akt1 and induces cell proliferation in pancreatic islets1. Transplantation. 87, 821-824 (2009).
- Kaneto, H. Activation of the hexosamine pathway leads to deterioration of pancreatic beta-cell function through the induction of oxidative stress. J. Biol. Chem. 276, 31099-31104 (2001).
- Antinozzi, P. A., Berman, H. K., O'Doherty, R. M., Newgard, C. B. Metabolic engineering with recombinant adenoviruses. Annu. Rev. Nutr. 19, 511-544 (1999).
- Newgard, C. B., Becker, T. C., Berman, H. K., O'Doherty, R. M. Regulation of overexpressed hexokinases in liver and islet cells. Biochem. Soc. Trans. 25, 118-122 (1997).
- Becker, T. C., BeltrandelRio, H., Noel, R. J., Johnson, J. H., Newgard, C. B. Overexpression of hexokinase I in isolated islets of Langerhans via recombinant adenovirus. Enhancement of glucose metabolism and insulin secretion at basal but not stimulatory glucose levels. J. Biol. Chem. 269, 21234-21238 (1994).
- Csete, M. E. Adenoviral-mediated gene transfer to pancreatic islets does not alter islet function. Transplant Proc. 26, 756-757 (1994).
- Csete, M. E. Efficient gene transfer to pancreatic islets mediated by adenoviral vectors. Transplantation. 59, 263-268 (1995).
- Meng, Z. X. Activation of liver X receptors inhibits pancreatic islet beta cell proliferation through cell cycle arrest. Diabetologia. 52, 125-135 (2009).
- Ronnebaum, S. M. A pyruvate cycling pathway involving cytosolic NADP-dependent isocitrate dehydrogenase regulates glucose-stimulated insulin secretion. J. Biol. Chem. , (2006).
- Milburn, J. L. Pancreatic beta-cells in obesity. Evidence for induction of functional, morphologic, and metabolic abnormalities by increased long chain fatty acids. J. Biol. Chem. 270, 1295-1299 (1995).
- Szot, G., Koudria, P., Bluestone, J. Murine Pancreatic Islet Isolation. J. Vis. Exp. (7), e255 (2007).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados