Method Article
A conversão de um ELISA de captura para um ensaio de xMAP Luminex usando um método de rastreio de anticorpos Multiplex
Neste Artigo
Resumo
Um ELISA pode ser facilmente convertido para um ensaio de xMAP Luminex e, através dos benefícios da multiplexação, vários anticorpos podem ser rastreados simultaneamente para identificar um par de anticorpos óptima, resultando em aumento da sensibilidade e gama dinâmica, enquanto reduz o custo do ensaio.
Resumo
O ensaio imunoenzimático (ELISA) tem sido a principal ferramenta para a detecção de analitos de interesse em amostras biológicas, tanto para pesquisas de ciências humanas e diagnósticos clínicos. Contudo, Elisa tem limitações. É tipicamente realizada em uma microplaca de 96 poços, e os poços são revestidos com anticorpo de captura, exigindo uma quantidade relativamente grande de amostra para capturar um antigénio de interesse. A grande área de superfície dos poços ea ligação hidrofóbica de anticorpo de captura pode também conduzir a não-específica ligação de fundo e aumentada. Além disso, a maioria dos ELISAs dependem mediada por enzima de amplificação de sinal, a fim de alcançar a sensibilidade razoável. Tal amplificação não é sempre linear e pode distorcer resultados assim.
Nos últimos 15 anos, uma nova tecnologia surgiu, que oferece os benefícios do ELISA, mas também permite um maior rendimento, maior flexibilidade, volume da amostra reduzida, e menor custo, com um wo semelhanterkflow 1, 2. Luminex xMAP A tecnologia é uma plataforma de micro-array (pérola), permitindo tanto monoplex e ensaios multiplex que podem ser aplicadas tanto para proteína e aplicações de ácido nucléico 3-5. Os grânulos têm o anticorpo de captura covalentemente imobilizada sobre uma área de superfície menor, exigindo menos anticorpo de captura e um menor volume de amostra, em comparação com ELISA, e ligação não específica é significativamente reduzida. Volumes menores de amostra são importantes quando se trabalha com amostras limitantes, como líquor, líquido sinovial, etc 6. Multiplexação o ensaio reduz ainda mais os requisitos de volume de amostra, permitindo vários resultados de uma única amostra.
Recentes melhorias por Luminex incluem: o sistema de MAGPIX novo, uma menor, menos caro, analisador mais fácil de usar; de baixa concentração Magnética MagPlex Microesferas que eliminam a necessidade de dispendiosos placas de filtro e vêm em uma concentração de trabalho mais adequado para o desenvolvimento de ensaios ede baixo rendimento aplicações; eo anticorpo xMAP Acoplamento Kit (ABC), que inclui um protocolo, os reagentes e produtos de consumo necessários para o acoplamento pérolas para o anticorpo de captura de interesse. (Veja a seção Materiais para uma lista detalhada do conteúdo do kit.)
Nesta experiência, nós converter um pré-optimizado ensaio ELISA para TNF-alfa citocina para a plataforma xMAP e comparar o desempenho dos dois métodos 7-11. TNF-alfa é um biomarcador utilizado na medição das respostas inflamatórias em pacientes com doenças auto-imunes.
Começamos por acoplamento quatro anticorpos de captura candidatos para quatro conjuntos de microesferas ou regiões diferentes. Quando misturado em conjunto, estes quatro conjuntos permitir o teste simultâneo de todos os quatro candidatos com quatro anticorpos de detecção separado para determinar a melhor par de anticorpos, os reagentes de poupança, amostra e do tempo. Dois ensaios xMAP são então construído com os dois pares de anticorpos mais óptimas e seu desempenho écomparada com a do ensaio de ELISA original em relação à intensidade do sinal, a gama dinâmica, e sensibilidade.
Protocolo
I. Preparação do Reagente
- Seleção de anticorpos e Preparação
- Identificar os anticorpos a ser utilizadas na experiência.
- Quatro anticorpos de captura: específicos para o TNF-alfa humano, monoclonais ou policlonais, e todas as espécies mesmo hospedeiro.
- Quatro anticorpos de detecção: específicos para o TNF-alfa humano, quer não modificado, biotinilado, ou PE-conjugados.
- Um anticorpo de confirmação: PE-conjugado e específico para as espécies hospedeiras dos anticorpos de captura.
- Reconstituir todos os anticorpos para as concentrações recomendadas pelo fabricante de trabalho.
- Escolha quatro frascos de baixa concentração MagPlex microesferas (pérola) conjuntos ou regiões, por exemplo, números de peça Luminex MC10012-ID, MC10013-ID, MC10014-ID, e MC10015-ID.
- Identificar os anticorpos a ser utilizadas na experiência.
- Anticorpos de acoplamento para MagPlex microesferas, utilizando o anticorpo xMAP (ABC) Kit Acoplamento
Refer o Manual do Usuário do Kit de ABC (Part # 89-00002-00-319) para o processo de acoplamento completo. (Nota: microesferas fotossensível deve ser protegida da luz, sempre que possível.)- Traga os reagentes do kit ABC para a temperatura ambiente e os tubos de etiquetas quatro reacção com os números região do grânulo seleccionados para a reacção de acoplamento. Transferir o conteúdo dos quatro frascos de grânulos MagPlex (1 mL cada ou 2,5 x 10 6 esferas) para os quatro tubos de reacção marcados.
- Lava-se cada um dos conjuntos de grânulo duas vezes em 500 uL de tampão de activação, tal como descrito no kit ABC manual.
- Activar cada conjunto de esferas com 480 uL de tampão de activação, 10 uL de Sulfo-NHS, e 10 uL do reagente de EDC, de acordo com o procedimento no kit ABC manual, e incubar durante 20 minutos. (Nota:. Reagente EDC deve ser reconstituído em 250 uL de tampão de activação imediatamente anterior a este passo)
- Repita o passo anterior com a lavagem agora "ativado" microesferas um total de three vezes com 500 uL de tampão de activação, tal como descrito no manual do kit ABC.
- Preparar quatro soluções separadas, cada uma contendo 7,5 ug (isto é, 3 ug / milhão de microsferas) de anticorpo de captura em tampão de activação.
- Adicionar as soluções de anticorpos de captura para quatro tubos de reacção suas respectivas, cada tubo de vórtice imediatamente, e incubar durante duas horas num rotor.
- Repetir o passo de lavagem prévia com o agora "acoplado" microesferas um total de três vezes com 500 uL do tampão de lavagem que acompanha o kit ABC.
- Após o passo de lavagem final, adicionar 500 uL de Tampão de Lavagem a cada tubo de reacção para proporcionar uma concentração final de estoque de 5 milhões de anticorpo acoplado pérolas por mililitro. Vortex e sonicar os tubos de reacção para dispersar as microesferas.
NOTA: Parcialmente submergindo o frasco fechado em microsfera uma limpeza ultra-sónica cheio com água DI fornece sonicação eficaz para todos os passos de lavagem. (Veja a tabela Materiais eEQUIPAMENTO detalhes). - Armazenar as esferas acopladas a 2-8 ° C e protegida da luz até serem necessários.
- Enumeração de Acoplado Microesferas
- Contar o número de microesferas recuperado após a reacção de acoplamento utilizando um contador de célula ou hemacitómetro. Consulte o manual do usuário do aparelho de contagem para obter instruções adequadas para fazê-lo. A recuperação a partir da reacção de acoplamento é tipicamente mais de 90%.
- Confirmação de acoplamento
- Confirmar a reacção de acoplamento foi bem sucedida por preparação de soluções de ensaio das existências acoplados grânulo para cada conjunto, com a concentração final de 100 / ul pérolas em tampão de ensaio (PBS com BSA a 1%). Preparar diluições do ficoeritrina-(PE-) anticorpo marcado confirmação anti-IgG de espécies em 4 ug / mL em Tampão de Ensaio.
- Alíquota de 50 uL de cada solução de teste em quatro poços de uma de fundo redondo, placa de 96 poços, para um total de 16 poços. Em seguida, adicionar 50 μL de tampão de ensaio em oito dos poços, para medir a fundo, e 50 uL de anticorpo a confirmação diluído aos oito poços restantes.
- Misturar as reacções suavemente pipetando para cima e para baixo várias vezes com um pipetador de canais múltiplos. Cobrir a placa e incubar durante 30 minutos à temperatura ambiente num agitador de placas.
- Colocar a placa sobre um separador de placa magnética durante 1-2 minutos para desenhar os grânulos para fora da solução. Em seguida, remover o líquido, por vigorosamente invertendo a placa, enquanto que no separador, ao longo de um recipiente de resíduos.
- Lavar duas vezes cada poço por adição de 100 uL de Tampão de Ensaio e removendo o sobrenadante a partir da placa de uma forma similar utilizando o separador de placa magnética.
- Ressuspender as pérolas em 100 uL de Tampão de Ensaio suavemente pipetando para cima e para baixo cinco vezes com uma pipeta multi-canal.
- Analise no instrumento xMAP Luminex, tais como o Instrumento MAGPIX. A intensidade do sinal fluorescente desta reacção é directly proporcional à quantidade de proteína na superfície dos grânulos, que fornece uma avaliação rápida da quantidade relativa de proteína acoplada às esferas.
- Acoplamento Biotina para Unmodified Anticorpos para Detecção
- Se usando anticorpos de detecção não modificados, biotinylate estes anticorpos com a Fisher Thermo EZ-Link Reagente Sulfo-NHS-LC-Biotina (Cat. No. PI-21.335) e o procedimento descrito no folheto informativo. Uma vez que biotinilado, os anticorpos de detecção pode mais tarde ser rotulados com estreptavidina ficoeritrina (SA-PE) no ensaio (Passo III.6.) De modo que eles podem ser detectados com o analisador de xMAP.
II. Instalação de Ensaio
- Preparar uma mistura inicial de todos os quatro conjuntos de esferas por adição de 10 uL de cada a 0,96 mL de PBS com BSA a 1% (Tampão de Ensaio. Ver tabela Materiais) para determinar qual é mais eficaz com o Ensaio xMAP.
- Preparar as soluções de detecção de anticorpos por diltribuindo cada um para 1 mg / mL em Tampão de Ensaio.
- Prepare o R & D Systems padrão proteína TNF-α a 2000 pg / mL em tampão de ensaio.
- Dilui-se a estreptavidina-rPhycoerythrin (SA-PE) (fornecido @ 1 mg / mL) a 8 mg / mL em Tampão de Ensaio.
III. Pesquisa de anticorpos
- Adicionar 50 uL da mistura de microsferas anticorpo acoplado a cada um de 16 poços de fundo redondo uma-Costar placa de 96 poços para o ensaio de triagem.
- Adicionar 50 ul de tampão de ensaio para 8 dos 16 poços, para medir a fundo.
- Adicionar 50 ul de R e Sistemas D TNF-α padrão (@ 2.000 pg / mL) para os outros 8 poços, para medir a resposta.
- Incubar durante uma hora à temperatura ambiente, protegida da luz, agitando em um ensaio em placa agitador.
- Adicionar 50 ul de cada um dos quatro anticorpos de detecção para quatro poços (de fundo e dois dois resposta) e incubar durante 30 minutos à temperatura ambiente, protegida da luz, agitando em um ensaio em placa shaker.
- Adicionar 50 ul de reagente de SA-PE a todos os poços e incubar 15 minutos à temperatura ambiente, protegida da luz, agitando em um ensaio em placa agitador.
- Coloque a placa em um separador de placa magnética durante um minuto e, em seguida, remover o líquido por força invertendo a placa.
- Adicionar 100 uL de tampão de análise para cada um dos 16 poços, colocar a placa sobre o separador de placa magnética, durante um minuto e depois remover o líquido, por vigorosamente invertendo a placa enquanto que no separador.
- Adicionar 100 uL de tampão de ensaio para cada um dos 16 poços e ler a placa com o instrumento MAGPIX Luminex, referindo-se o manual do utilizador para o funcionamento correcto.
- Selecione um par de anticorpos que se reúne a potência do sinal desejado.
IV. xMAP ensaio funcional
- Depois de seleccionar o anticorpo de captura melhor, diluir 100 ul de estoque que grânulo-anticorpo acoplado (a partir do Passo IB8) a 10 mL com Tampão de Ensaio.
- Adicionar 50 ul deos grânulos diluídos a 78 poços de fundo redondo dois Costar-96-poços. (78 poços x 2 = placas de 156 poços) Cada placa irá ser utilizado para avaliar o desempenho de um anticorpo de detecção diferente.
- Preparar uma curva padrão de 12 pontos, com início às 8000 pg / mL e terminando no 4 pg / mL, com o R e D Systems TNF-α padrão. Adicionar seis uL 50 repetições de cada diluição a cada uma das placas, além de seis poços com 50 uL de Tampão de Ensaio cada um, como um fundo, para um total de 78 poços / placa.
- Incubar as placas durante uma hora à temperatura ambiente, protegida da luz, agitando em um ensaio em placa agitador.
- Adicionar 50 ul de anticorpo de detecção do primeiro para todos os 78 poços da primeira placa. Repetir para o anticorpo de detecção segundo sobre a segunda placa.
- Incubar as placas durante 30 minutos, à temperatura ambiente, protegida da luz, agitando em um ensaio em placa agitador.
- Adicionar o uL 50 do reagente SA-PE a todos os poços de cada placa.
- Incubaras duas placas durante 15 minutos, à temperatura ambiente, protegida da luz, agitando em um ensaio em placa agitador.
- Colocar as placas em separadores de placa magnética durante um minuto, em seguida remover o líquido, por vigorosamente invertendo a placa enquanto que no separador.
- Adicionar 100 uL de tampão de ensaio para cada um dos 78 poços das placas; colocar as placas em separadores de placa magnética durante um minuto, em seguida remover o líquido, por vigorosamente invertendo a placa.
- Adicionar 100 uL de tampão de ensaio para cada um dos 78 poços das placas e analisar no instrumento MAGPIX, referindo-se o manual do utilizador para o funcionamento correcto.
V. ELISA Ensaio
- Seguindo as instruções fornecidas com o R & D Systems Human TNF-α/TNFSF1A DuoSet ELISA (R & D Part # DY210), medir a resposta gerada pelo padrão fornecido com o kit de R & D. Repita o teste de ELISA mais três vezes, substituindo o R & D Sistemas de captura e detecção de formigaibodies com os anticorpos dos outros fornecedores. Para o par de simplicidade, os anticorpos por fornecedor (por exemplo, Millipore anticorpo de captura com Millipore anticorpo de detecção, anticorpo de captura Abcam com Abcam anticorpo de detecção, etc.)
- Avaliar cada par de forma independente, como exigido pelo formato de ELISA, com cada um dos três padrões de TNF-a proteína.
VI. Os resultados representativos
Este protocolo demonstra como um ELISA típico pode ser convertido para a plataforma xMAP enquanto utilizando a capacidade de multiplex da tecnologia para rapidamente optimizar o ensaio. O ELISA utilizado neste exemplo foi o de Necrose Tumoral Fator Humano-alfa (TNF-α) DuoSet ELISA kit de R & D Systems (R & D Part # DY210).
Além do par de anticorpos fornecido com o kit, três pares de anticorpos outros a partir de fontes diferentes (ver a tabela de Materiais) foram avaliados simultaneamente utilizando a plataforma xMAP. Four dos anticorpos foram designados como anticorpos de captura e foram acoplados a MagPlex baixa concentração microesferas. Os outros quatro anticorpos foram designados como anticorpos de detecção; três dos quais foram comprados como biotina-acoplada ea quarta foi biotinilado como descrito no protocolo.
Os anticorpos para este estudo foram escolhidos com base na disponibilidade e fornecedor. No entanto, em configuração prática, os anticorpos devem ser escolhidos com base na preferência do utilizador individual e da experiência do desempenho passado com que o anticorpo. Embora, nesta experiência não testar a aptidão de um anticorpo como um anticorpo de captura contra o anticorpo de detecção, este protocolo pode ser facilmente modificado para esse efeito.
Os ensaios Luminex xMAP foram realizados como um multiplex para avaliar todos os anticorpos de captura quatro como uma mistura, combinando quatro conjuntos de TNF-α anticorpo acoplado MagPlex microesferas. Os anticorpos de captura foram avaliados com cada um dos quatroOs anticorpos de detecção biotinilados individualmente, de tal modo que a interacção de um anticorpo de detecção com cada um dos quatro anticorpos de captura pode ser determinada simultaneamente. Quatro de tais ensaios, realizados em paralelo, determinou as interacções de todos os quatro anticorpos de detecção com todos os quatro anticorpos de captura. Figura 1 mostra os dados comparativos a partir destes testes de rastreio.
Os resultados indicaram que a par de anticorpos a partir do R & D Systems DuoSet melhor realizada com uma resposta, resultando em 6.183 intensidade média de fluorescência (MFI) unidades. Observou-se também que os anticorpos de detecção de Millipore (86% da resposta par R e D de anticorpo) e Abcam (67%) proporcionou uma resposta razoável no ensaio xMAP, quando combinado com o anticorpo de captura R e D Systems. Os anticorpos de captura de Abcam, Millipore e Novus produziu uma resposta menos desejável no ensaio xMAP.
É importante notar, que a purpose de este estudo não é necessariamente para destacar as diferenças entre anticorpos específicos ou fornecedores, mas apenas para ilustrar que há diferenças observáveis no seu desempenho quando usado em condições similares, e que a plataforma xMAP pode oferecer um meio eficiente de avaliar essas diferenças.
O R & D Systems DuoSet protocolo foi utilizado para comparar os quatro pares de anticorpos em um formato ELISA. O R & D Systems protocolo foi usado com todos os pares de anticorpos porque é um reflexo de protocolos típicos ELISA amplamente usados hoje e é análogo aos protocolos utilizados com a tecnologia xMAP. Os testes de ELISA mostraram que o par de anticorpos a partir de R e D Systems novamente deu os melhores resultados (Figura 2). A par de anticorpos produzidos a partir de Abcam nenhuma resposta e os pares de anticorpos produzidos a partir das respostas Millipore e Novus modestos.
A fim de avaliar qualquer variação na reactividade do anticorpo com a norma, todos os quatro anticorposy pares foram testados com três diferentes padrões recombinantes TNF-alfa de proteína, de três fornecedores diferentes (veja a tabela de materiais). Os dados apresentados na Figura 2 que os recombinantes padrões de TNF-a proteína a partir das três fornecedores deram resultados equivalentes.
A proteína TNF-α a partir de R e D Systems foi utilizado para gerar curvas padrão com o ELISA (Tabela 1) e os ensaios xMAP (Tabelas 2 e 3). Enquanto o ensaio de ELISA foi feito com o par de anticorpos R & D Systems, os ensaios xMAP utilizou o R & D anticorpo de captura e um anticorpo Sistemas de detecção de R & D Systems ou Millipore. A proteína TNF-α a partir de R e D Systems foi diluída para produzir uma gama de concentrações a partir de 8000 a 4 pg / mL. Apenas um par do anticorpo a partir de R e D Systems produziu o resultado esperado no ensaio xMAP, com uma resposta> 20.000 IMF, como mostrado na Tabela 2 eFigura 3. Quando o anticorpo de detecção da Millipore foi utilizada com o Ensaio xMAP no lugar do anticorpo de detecção R e D Systems (Tabela 3), a resposta (6.000 MFI) foi de cerca de 30% da resposta obtida com o anticorpo de detecção, de R e D Systems; como mostrado na Figura 3.
Os dados da Tabela 1 representa a curva padrão do teste ELISA, que tinha um fabricante recomenda gama de TNF-α de 16 a 1000 pg / mL. Esta gama era muito limitado por causa da DO a 1000 pg / mL foi ligeiramente maior do que 2 unidades de OD e espectrofotómetro é incapaz de medir acima de 3 OD. Devido ao limite com o espectrofotómetro, não foi possível aumentar o intervalo do ensaio de ELISA adicional. Além disso, os dados da Tabela 1 indicam que o R e D Systems DuoSet ELISA não é capaz de detectar o TNF-α em concentrações muito menos do que 16 pg / mL. Por outro lado, o ensaio é capaz de xMAP measuring TNF-α a uma concentração de menos de 7,8 pg / mL com o anticorpo de captura a partir de I e D Systems, combinados com o anticorpo de detecção de qualquer R e D Systems ou Millipore.
A gama dinâmica e sensibilidade de ambos os métodos é melhor ilustrado quando traçados numa escala log-log (Figura 4). Uma distinção clara entre a inclinação das respostas de ELISA e as respostas dos ensaios xMAP pode ser visto que indica ainda uma maior capacidade de limitante para a detecção de TNF-α com o ELISA, em ambas as concentrações superiores e inferiores.
Os limites de detecção (LOD) para os dois ensaios funcionais de TNF-a xMAP foram aproximadas através da identificação de mais baixa concentração de TNF-α com um nível de resposta observada (MFI) maior do que o fundo, além de três vezes o desvio seu padrão (SD). Para alcançar a significância estatística, seis repetições foram usados para determinar o SD para métodos tanto o xMAP e ELISA. Tsestimativas eletrônicos de LOD estão otimistas e pretendem promover uma "melhor caso" cenário, com o entendimento de que em condições normais de apenas dois ou três repetições será utilizado. Na Tabela 2, pode ser observado que, quando se utiliza o R e D par Systems, a mais baixa concentração de TNF-α em 3,91 pg / mL produziu uma resposta de 66 IMF, que é maior do que a resposta do fundo + 3DP, reunidos este critério . Quando o anticorpo de detecção Millipore foi utilizada com o anticorpo de captura R e D Systems (Tabela 3), o limite de detecção foi de menos de 7,81 pg / mL. Neste caso, a mais baixa concentração de TNF-2 α produzida uma resposta aceitável de 17 MFI; maiores do que a resposta de menor a concentração de TNF-α mais três vezes o desvio padrão da sua. (10 MFI + 3 (2,4) = 16,29 MFI) Do mesmo modo, o limite de detecção para o R e D Systems DuoSet ELISA foi estimado entre 63 pg / mL e 31 pg / ml (Tabela 1).
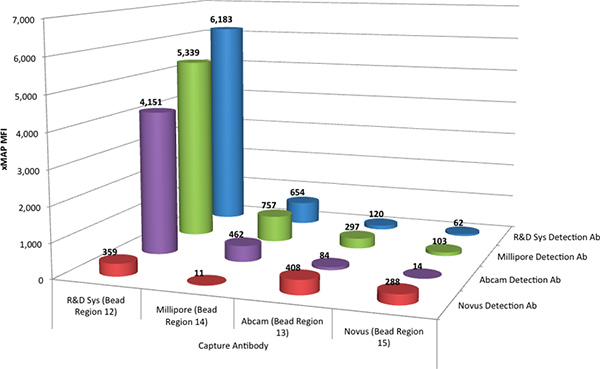
Figura 1. A intensidade média de fluorescência (IMF) da R & D Systems padrão (@ 2.000 pg / ml) para cada combinação possível dos anticorpos de captura quatro (acoplado a quatro regiões de microesferas diferentes) e os anticorpos de detecção de quatro. Clique aqui para ver maior descobrir .
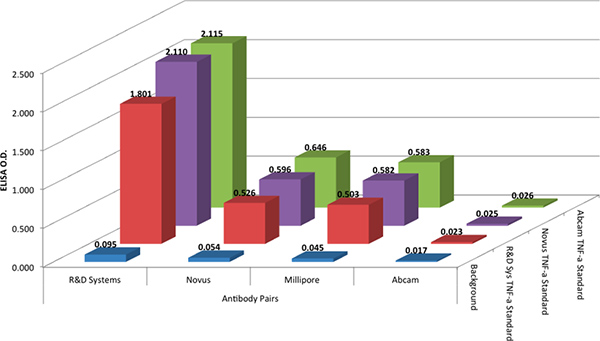
Figura 2. A densidade óptica (OD) de três diferentes padrões recombinantes (@ 1.000 pg / mL) para quatro captura e de detecção de combinações par de anticorpos. Capture e detecção de anticorpos foram arbitrariamente pareados por fornecedor, para simplificar. Clique aqui para ver maior figura .
| pg / mL | OD | Std Dev | 3 SD |
| 1000 | 2,084 | 0,035 | 2,187 |
| 500 | 1,328 | 0,038 | 1,441 |
| 250 | 0,787 | 0,025 | 0,863 |
| 125 | 0,476 | 0,026 | 0,554 |
| 63 | 0,304 | 0,023 | 0,374 |
| 31,3 | 0,212 | 0,025 | 0,287 |
| 15,6 | 0,167 | 0,026 | 0,244 |
| 0 | 0,118 | 0,021 | 0,182 |
Tabela 1 A densidade óptica (DO) da série de diluições de 2 vezes especificado pela R e D bula Sistemas DuoSet, para utilização como uma curva padrão;. Incluindo desvio padrão (DP) eo limite estimado de detecção (LOD), entre 31,3 pg / mL e 63 pg / mL.
| R & D sistemas de captura e detecção de anticorpos | |||
| pg / mL | IFM | Std Dev | 3 SD |
| 8000 | 20.320 | 463 | 21.707 |
| 4000 | 15.594 | 223 | 16.263 |
| 2000 | 11.098 | 79 | 11.336 |
| 1000 | 6.985 | 160 | 7.465 |
| 500 | 4.149 | 80 | 4.390 |
| 250 | 2.233 | 30,0 | 2.323 |
| 125 | 1.199 | 43,8 | 1.330 |
| 63 | 636 | 14,0 | 678 |
| 31,3 | 340 | 12,9 | 379 |
| 15,6 | 183 | 5,9 | 201 |
| 7,8 | 103 | 2,2 | 109 |
| 3,9 | 66 | 2,4 | 73 |
| 0 | 11 | 0,8 | 13,8 |
Tabela 2 A intensidade mediana de fluorescência (MFI) de uma série de diluições do padrão medido por tecnologia xMAP, utilizando o par de anticorpos incluído com o R e D Systems DuoSet;. Incluindo desvio padrão (DP) eo limite estimado de detecção (LOD), menos de 3,91 pg / mL.
| R & D Systems Captura Ab Millipore com Detecção de Ab | |||
| pg / mL | IFM | Std Dev | 3 SD |
| 8000 | 5.800 | 143 | 6.229 |
| 4000 | 3.881 | 120 | 4.242 |
| 2000 | 2.176 | 73 | 2.396 |
| 1000 | 1.138 | 32,1 | 1.234 |
| 500 | 578 | 31,3 | 671 |
| 250 | 289 | 6,2 | 307 |
| 125 | 142 | 3,1 | 151 |
| 63 | 75 | 5,3 | 91 |
| 31,3 | 44 | 3,3 | 54 |
| 15,6 | 28 | 2,6 | 35,5 |
| 7,8 | 17 | 1,5 | 21,2 |
| 3,9 | 10 | 2,0 | 16,3 |
| 0 | 7 | 1,4 | 11,4 |
Tabela 3 A intensidade mediana de fluorescência (MFI) de uma série de diluições do padrão medido por tecnologia xMAP, utilizando o R e D anticorpo de captura Sistemas ea EMD anticorpo de detecção Millipore;. Incluindo desvio padrão (DP) eo limite estimado de detecção (LOD), menos do que 7,81 pg / mL.
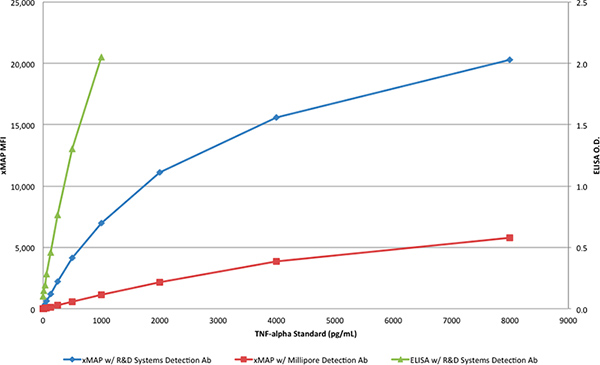
Figura 3. As curvas padrão dos dois ensaios xMAP e do R & D Systems DuoSet ELISA. Clique aqui para ver maior figura .
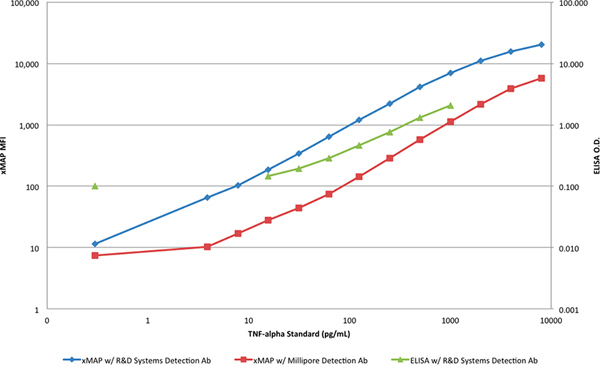
Figura 4. Uma comparação das curvas de xMAP padrão e do ELISA curva padrão em uma escala log-log. para ver figura maior .
Discussão
A conversão de um ensaio de ELISA para a plataforma xMAP Luminex pode ser tão simples como a substituição de estreptavidina peroxidase de rábano (SA-HRP) em um típico kit de ELISA com estreptavidina ficoeritrina (SA-PE), e optimizar o desempenho. Para aqueles que deseja criar um imunoensaio xMAP de baixo para cima, isto pode ser realizado com um protocolo simples, que também permite a avaliação multiplex rápido, um dos pares de anticorpos. Os reagentes para o ensaio xMAP foram facilmente preparado utilizando o kit de Anticorpo xMAP acoplamento para acoplar os anticorpos de captura designados para MagPlex baixa concentração microesferas. O uso de baixa concentração de microesferas reduz o custo do desenvolvimento do ensaio enquanto fornece o desempenho do ensaio mesmo de maior concentração microesferas. A quantidade de tempo necessário para preparar acoplado MagPlex microesferas é de aproximadamente 3 horas, o que é muito mais rápido do que o 22 - 24 horas necessário para revestir o poço de uma placa de ELISA, seguido de tratamentodos poços revestidos. O desempenho do ensaio xMAP é também superior ao ELISA em termos de limite de detecção (<4 pg / mL vs> 31 pg / mL) e gama dinâmica (<4 pg / mL a> 8000 pg / mL vs 16 pg / mL a 1000 pg / mL). Leitores de placas têm uma gama limitada OD que é 3 ou 4 OD, restringindo o limite superior da gama dinâmica para um ensaio.
Sem dúvida, nem todos os anticorpos vai trabalhar em um formato de ELISA e nem todos os anticorpos que funcionam bem em um ELISA são facilmente transferíveis para o formato de ensaio xMAP. No entanto, uma vez que os ensaios xMAP podem ser multiplexados (isto é, executar simultaneamente), é possível avaliar a captura e várias combinações de anticorpos de detecção em simultâneo para identificar a melhor par a ser usado para um ensaio. Este processo poupa tempo significativo e reagentes em comparação com o processo de desenvolvimento de ELISA, que é limitado para a avaliação de um par de cada vez. No caso de dois ou mais pares de anticorpos realizar equivalentemente; outros parâmetros do ensaio podeser considerado para determinar a adequação do par (por exemplo, a disponibilidade, custo, etc.)
Além disso para o desempenho do ensaio melhorado e flexibilidade com o ensaio xMAP, há também poupanças de custos significativas. A quantidade recomendada de anticorpo necessária para revestir um único poço de uma placa de ELISA é 400ng, enquanto que a quantidade requerida para as esferas utilizadas em um poço de um ensaio de xMAP é aproximadamente 7,5 ng. Assim, a quantidade de anticorpo necessária para um ELISA bem irá fornecer mais de 50 resultados do teste, se for utilizado num ensaio xMAP. Para aplicações que envolvam amostras preciosos, xMAP também tem uma vantagem significativa. O volume da amostra recomendado para o ELISA é de 100 L ao passo que o volume necessário para o ensaio xMAP pode ser metade do que, ou menos.
Em resumo, a conversão de um ensaio de ELISA para a plataforma xMAP Luminex é simples, eficiente e de economia de custos, enquanto a produção de um ensaio com uma gama dinâmica superior e sensibilidade.
Divulgações
Este trabalho foi feito em Luminex Corporation com equipamentos fabricados no Luminex Corporation.
R & D Systems & EMD Millipore são parceiros estratégicos da Luminex Corporation; licenciada para desenvolver e comercializar ensaios multiplex xMAP base.
Agradecimentos
Este trabalho foi financiado pela Luminex Corporation.
Materiais
| Name | Company | Catalog Number | Comments |
| Descrição | Vendedor | Número de Catálogo | Comentários |
| Human TNF-α/TNFSF1A DuoSet ELISA kit | R & D Systems | DY210 | Inclui monoclonais e biotina acoplados anticorpos policlonais e recombinante padrão de proteína TNF-α |
| Anticorpo monoclonal para o TNF-α | Abcam | Ab18696 | Captura de anticorpos, clone CH8820 |
| Anticorpo monoclonal para o TNF-α | Abcam | Ab16166 | Biotina anticorpo de detecção acoplado, o clone AS1 |
| TNF proteína alfa | Abcam | Ab9642 | Recombinante padrão de proteína TNF-α |
| Anticorpo monoclonal para o TNF-α | Novus | NBP1-50115 | Captura de anticorpos, clone 4H31 |
| Anticorpo monoclonal para o TNF-α | Novus | NB100-78162 | Biotina anticorpo de detecção acoplado, o clone MAb11 |
| TNF proteína alfa | Novus | NBC1-18460 | Recombinante padrão de proteína TNF-α |
| Anticorpo monoclonal para o TNF-α | EMD Millipore | MAB1141 | Captura de anticorpos, clonar 3C7.2 |
| Anticorpo policlonal para o TNF-α | EMD Millipore | 654250 | Coelho policlonal anticorpo de detecção |
| Estreptavidina-Ficoeritrina | Musgo | SAPE-001 | O reagente de repórter fluorescente para Luminex Assay xMAP |
| MAGPIX w / Software Xponent | Luminex Corporation | MAGPiX Xponent- | Instrumento Luminex |
| Anticorpo xMAP Coupling (ABC) Kit | Luminex Corporation | 40-50016 | Inclui EDC reagente, Sulfo-NHS reagente, tampão de activação, o tampão de lavagem, 1,5 mL tubos de reacção, e pipetas descartáveis |
| MagPlex Microesferas, baixa concentração | Luminex Corporation | MC10012-ID, MC10013-ID, MC10014-ID, MC10015-ID | Baixos grânulos de concentração (@ 2,5 x 10 6 grânulo / mL) |
| EZ-Link Sulfo-NHS-LC-biotina | Thermo Fisher | PI-21.335 | Kit Biotinilação para detecção de anticorpos não modificada |
| Tecan Infinito F200 Leitor | Tecan | Leitor de placas ELISA | |
| Tampão fosfato salino | Sigma-Aldrich | P-3688 | 1% de PBS-BSA, Tampão de Ensaio |
| Uma Pint-Cleaner Compact Ultrasonic, 115 VAC | Cole-Parmer | WU-08.849-00 | Produzir uma freqüência de operação efetiva de 55 kHz |
| Separador Tubo Magnético | Luminex Corporation | CN-0288-01 | Para a separação único tubo 1,5 ml magnética em passos de lavagem de acoplamento |
| Separador de placa magnética | Luminex Corporation | CN-0269-01 | Para a separação de 96 poços da placa magnética em passos de lavagem de ensaio |
Referências
- Fulton, J. R., McDade, R. L., Smith, P. L., Kienker, L. J., Kettman, J. R. Advanced multiplexed analysis with the FlowMetrix system. Clinical Chemistry. 43, 1749-1756 (1997).
- Carson, R. T., Vignali, A. A. Simultaneous quantation of 15 cytokines using a multiplexed flow cytometric assay. J. Immunol. Methods. 227, 41-52 (1999).
- Peck, D., Crawford, E. D., Ross, K. N., Stegmaier, K., Golub, T. R., Lamb, J. A method for high-throughput gene expression signature analysis. Genome Biol. 7, 61 (2006).
- VanDerMeid, K. R., Su, S. P., Krenzer, K. L., Ward, K. W., Zhang, J. Z. A method to extract cytokines and matrix metalloproteinases from Schirmer strips and analyze using Luminex. Mol Vis. 17, 1056-1063 (2011).
- Liu, J., Kibiki, G., Maro, V., Maro, A., Kumburu, H., Swai, N., Taniuchi, M., Gratz, J., Toney, D., Kang, G., Houpt, E. Multiplex reverse transcription PCR Luminex assay for detection and quantitation of viral agents of gastroenteritis. J. Clin. Virol. 50, 308-313 (2011).
- de Jager, W., Prakken, B. J., Bijlsma, J., WJ Kuis, W., Rijkers, G. T. Improved multiplex immunoassay performance in human plasma and synovial fluid following removal of interfering heterophilic antibodies. J. Immunol. Methods. 300, 124-135 (2005).
- Codorean, E., Nichita, C., Albulescu, L., Raducan, E., Popescu, I. D., Lonita, A. C., Albulescu, R. Correlation of xMAP and ELISA cytokine profiles; development and validation for immunotoxicological studies in vitro. Roum. Arch. Microbiol. Immunol. 69, 3-19 (2010).
- de Jager, W., te Velthuis, H., Prakken, B. J., Kuis, W., Rijkers, G. T. Simultaneous detection of 15 human cytokines in a single sample of stimulated peripheral blood mononuclear cells. Clin. Diagn. Lab. Immunol. 10, 133-139 (2003).
- DuPont, N. C., Wang, K. H., Wadhwa, P. D., Culhane, J. F., Nelson, E. L. Validation and comparison of Luminex multiplex cytokine analysis kits with ELISA: Determinations of a panel of nine cytokines in clinical sample culture supernatants. J. Reprod. Immunol. 66, 175-191 (2005).
- Richens, J. L., Urbanowicz, R. A., Metcalf, R., Corne, J., O'Shea, P., Fairclough, L. Quantitative validation and comparison of multiplex cytokine kits. Journal of Biomolecular Screening. 15, 562-568 (2010).
- Rizzi, G., Zhang, Y. J., Latek, R., Weiner, R., Rhyne, P. W. Characterization and development of a Luminex-based assay for the detection of human IL-23. Bioanalysis. 2, 1561-1572 (2010).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados