É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Isolamento dos núcleos dos cardiomiócitos a partir de Post-mortem de tecidos
Neste Artigo
Resumo
Núcleos cardíaca são isolados através de sedimentação densidade e immunolabeled com anticorpos contra o material pericentriolar 1 (PCM-1) para identificar e classificar os núcleos dos cardiomiócitos por citometria de fluxo.
Resumo
Identificação de núcleos de cardiomiócitos tem sido um desafio em cortes de tecido como a maioria das estratégias de contar apenas com proteínas marcadoras citoplasmáticos 1. Eventos raros em miócitos cardíacos, tais como a proliferação e apoptose necessitam de uma identificação precisa dos núcleos dos miócitos cardíacos para analisar a renovação celular e na homeostasia em condições patológicas 2. Aqui, nós proporcionar um método para isolar a partir de núcleos de cardiomiócitos pós tecido mortem por sedimentação densidade e imunomarcação com anticorpos contra o material pericentriolar 1 (PCM-1) e triagem de citometria de fluxo posterior. Esta estratégia permite uma análise com rendimento elevado e de isolamento, com a vantagem de se trabalhar igualmente bem em tecido fresco e material de arquivo congelado. Isto torna possível estudar o material já recolhidos na biobancos. Esta técnica é aplicável e testado em uma vasta gama de espécies e adequados para várias aplicações tais como a jusante de carbono-14 namoro 3, a célula-cycle análise 4, visualização de análogos da timidina (por exemplo, BrdU e UDI) 4, a análise de transcriptoma e epigenética.
Protocolo
1. Isolamento dos Núcleos Cardiac
- Revestimento tubos de ultracentrifugação (Tubos centrífuga Beckman # 363664) com 10 ml de solução de revestimento de 1% BSA / PBS. Tapar os tubos e deixá-los girar durante 30 min num rotor tubo. Remover a solução de revestimento e deixar que o tubos de centrifugação de ar seco (um tubo por coração do rato é necessária para a análise de corações de rato individuais, alternadamente até 5 corações de rato ou 1 g de tecido do coração a partir de uma espécie diferente (por exemplo, humanos) podem ser processados em um tubo).
- Todos os passos seguintes devem ser realizados no gelo. Dissecar o ventrículo esquerdo do coração de rato fresco ou congelado snap-com um bisturi. Nota, este protocolo é optimizado para coração de rato, mas também pode ser adaptado para rato ou do coração humano. Alternativamente, usam-se a 1 g de tecido do coração a partir de uma espécie diferente.
- Apare o espécime em cubículos pequenos, com um bisturi.
- Transfira os pedaços de tecido em um tubo Falcon 50 ml cheia com 15 ml de tampão de lise.
- Homogeneizar atecido do coração com uma T-25 Ultra-Turrax sonda homogeneizador (IKA) com 24.000 rpm durante 10 seg.
- Diluir o homogeneizado com um volume igual de tampão de lise a 30 ml.
- Utilizar um vidro douncer (40 ml) para continuar a homogeneizar o tecido e os núcleos livre. Executar oito traçados com um pilão de grande folga.
- Passe o núcleo bruto isolar através de um 100 mm e 70 mM de nylon de malha de células do filtro (BD Biosciences), consecutivamente.
- Girar para baixo os núcleos isolado bruto numa centrifugadora refrigerada (4 ° C) a 700 xg durante 10 min.
- Remover o sobrenadante cuidadosamente por inversão dos tubos e limpar o interior do tubo com uma toalha de papel. Tenha cuidado para não perturbar o pellet núcleos.
- Dissolve-se o isolado bruto núcleos em 5ml de tampão de sacarose por pipetagem a solução várias vezes para cima e para baixo. Adicionar mais 25 ml de tampão de sacarose para o sedimento dissolvido.
- Adicionar 10 ml de tampão de sacarose recentemente preparada para o tubo de ultracentrifuga revestido (ver passo 1.1).
- Cuidadosamente sobrepor a 10 ml adicional de tampão de sacarose, com a ressuspenso núcleos sedimento dissolvido em tampão de sacarose a partir do passo 1.9.
- Equilibrar os tubos de centrifugação antes de os colocar num rotor JS13.1 livre oscilante e colocar o rotor em uma centrífuga de alta velocidade (Beckman Avanti-S 25).
- Girar a amostra núcleos em 13.000 xg, a 4 ° C durante 60 min.
- Quando a rotação foi concluída, remover os tubos cuidadosamente a partir do rotor e descartar o sobrenadante por inversão dos tubos e limpando os detritos remanescente a partir do interior dos tubos com toalha de papel.
- Dissolve-se o pellet núcleos em 1 ml de tampão de núcleos de armazenamento (NSB mais tampão). Nota: NSB plus contém 1,5 mM espermina na forma de um estabilizador de DNA.
- Prossiga com o passo 2.1, imunocoloração de núcleos de cardiomiócitos.
2. A imunocoloração para Citometria de Fluxo
- Prepare o controlo negativo para a imunocoloração. Tomar uma alíquota de 20 uL para fora da amostra núcleos e umadd ul 980 de NSB mais buffer.
- Adicionar anti-pericentriolar material de um anticorpo (anticorpo de coelho anti-PCM-1, Antibodies Atlas) para a amostra núcleos em uma diluição de 1:500 a immunolabel núcleos de cardiomiócitos. Adicionar o anticorpo de isotipo para a diluição mesmo que o anticorpo anti-PCM-1 para o controlo negativo, preparado no passo 2.1.
- Incubar controlo negativo e tubo de amostra a 4 ° C durante a noite.
- Lavar controlo negativo e amostra, pelo menos, uma vez com NSB mais tampão (tubos de girar para baixo numa centrifugadora refrigerada (4 ° C) a 700 xg durante 10 min. Elimine o sobrenadante e ressuspender o pellet núcleos em 1 ml de tampão mais NSB).
- Adicionar anti-coelho de anticorpo fluorescente secundário (FITC ou APC) para controlo negativo e tubo de amostra em uma diluição de 1:1000.
- Incubar controlo negativo e tubo de amostra a 4 ° C durante 1 h.
- Lavar controlo negativo e amostra, pelo menos, uma vez com NSB mais tampão (tubos de girar para baixo numa centrifugadora refrigerada (4 ° C) a 700 xg durante 10 min. Descartar o sobrenadante e dissolver os núcleos sedimento em 1 ml de tampão mais NSB).
- Continuar com a análise por citometria de fluxo e triagem.
3. Citometria de Fluxo
- Revestimento tubos núcleos de recolha (Falcon de 15 ml) com 1% de solução de BSA / PBS antes de começar a citometria de fluxo de triagem, tal como descrito no passo 1,1.
- Filtrar a amostra eo controlo negativo através de um filtro 30 uM célula e carregar primeiro o controlo negativo para o citómetro de fluxo (afluxo BD). Definir o portão primeiro e segundo para definir núcleos e singuletos (núcleos único), com base na dispersão para a frente (FSC), largura de pulso para a frente de dispersão (FS largura de pulso) e dispersão lateral (SSC) (Fig. 2a e b). Adicionando um DNA mancha (DRAQ5 (1:500)) para a amostra pode ajudar a identificar a população núcleos inicialmente.
- Carregar a amostra immunolabeled e definir a terceira porta para isolar os núcleos dos cardiomiócitos (PCM-1-positve) de não-cardiomiócitos núcleos (PCM-1-negativo). Inicie a triagem(Fig. 2c, d).
Opcional: A fim de analisar o conteúdo de DNA nuclear (ploidia) e para executar a análise do ciclo celular adicionar uma mancha de DNA adequado para os núcleos (por exemplo, Hoechst 33342 ou DRAQ5) (fig. 2e).
- Após a triagem de citometria de fluxo, colocar os núcleos em gelo e re-analisar para determinar a pureza de classificação (Fig. 3a e b).
- Girar para baixo os núcleos classificados nos tubos de recolha a 1500 xg numa centrifugadora refrigerada durante 15 min.
- Dissolve-se o pellet núcleos num tampão compatível com a aplicação a jusante.
4. Os resultados representativos
Morfologia núcleos e integridade pode ser avaliada por manchas de DNA e visualizada por microscopia (Fig. 1). Bem sucedida PCM-1 rotulagem pode ser avaliado por microscopia de epifluorescência e por citometria de fluxo (Fig. 1 e Fig.. 2c e d). PCM-1-positive e populações negativas devem ser bem separadas umas das outras (Fig. 2c, d). Em ventrículo esquerdo murino cerca de 30% de todos os núcleos deve ser os núcleos dos cardiomiócitos (Fig. 2d). Triagem pureza pode ser avaliada por re-analisando os núcleos ordenadas (Fig. 3a e b). Ambas as populações núcleos deve ter uma pureza superior a 95% de triagem.
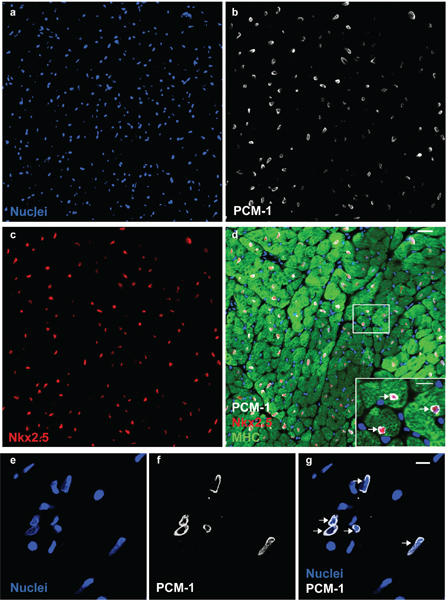
Figura 1. PCM-1 identifica os núcleos dos cardiomiócitos. Núcleos Cardíaca (a) são coradas com anticorpos para PCM-1 (b), e para Nkx2.5 (c) em um coração de rato adulto. (D) PCM-1-rotulado núcleos são cercados por citoplasma dos cardiomiócitos (miosina de cadeia pesada (MHC)) e expressar o fator de transcrição Nkx2.5, documentando a identificação precisa de núcleos de cardiomiócitos pelo PCM-1 coloração (barras de escala 20 microns e 10 iM (d, inserção)). (E) isolados núcleos cardíacas visualizado com o DNA mancha DRAQ5. (Feg) Cardiomyocnúcleos YTE são rotulados com anticorpos contra PCM-1 (barra de escala 10 mm). Note, o padrão de coloração epinuclear de PCM-1 em núcleos dos miócitos em secção de tecido e em núcleos isolados (setas).
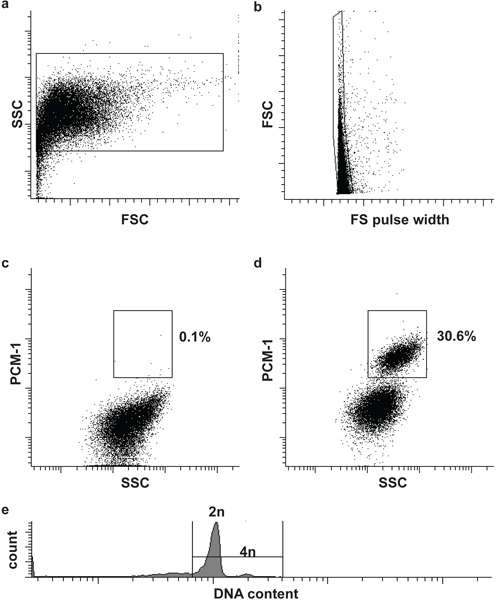
Figura 2. Classificação por citometria de fluxo de núcleos de cardiomiócitos. (A) núcleos cardíaca são identificados por dispersão frontal (FSC) e dispersor lateral (SSC). (B) Um segundo portão identifica núcleos único pelo FSC e largura de pulso FS 5. (C, d) gating fluorescente permite a separação de núcleos de cardiomiócitos (PCM-1-positivo) e não-cardiomiócitos (PCM-1-negativa) núcleos a partir de tecido do coração. (E) cardiomiócito do rato são na maior parte (> 80%) diplóide (2n), apenas um pequeno subconjunto é tetraplóide (4n) 6. Note, cardiomiócitos humanos contêm uma maior frequência de núcleos poliploidia (> 2n) 7,8.

Figura 3. Análise de pureza de classificados núcleos dos cardiomiócitos e não-cardiomiócitos. Re-análise de núcleos não-ordenados dos cardiomiócitos (a) e cardiomiócitos (b). Ambas as populações apresentam um grau de pureza superior a 99% de classificação.
Discussão
A identificação precisa de núcleos de cardiomiócitos é crucial para a análise dos processos regenerativos no miocárdio 2,3. As técnicas convencionais para isolar cardiomiócitos de tecido fresco baseiam-se principalmente a digestão enzimática de proteínas da matriz extracelular e da subsequente purificação a partir de células intersticiais por centrifugação a baixa velocidade. A purificação adicional de cardiomiócitos de vida a partir de células estaminais embrionárias (ESC) pode ser real...
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Nós gostamos de reconhecer Marcelo Toro para a assistência com a citometria de fluxo. Este estudo foi financiado pelo sueco Coração e Pulmão Foundation, da Comissão Européia, FP7 "CardioCell", Sueco de Pesquisa do Conselho, seguros AFA e ALF. OB foi apoiado pelo Deutsche Forschungsgemeinschaft.
Materiais
| Name | Company | Catalog Number | Comments |
| 1. Tampão de Lise | |||
| Nome do reagente | |||
| 0,32 M de sacarose | |||
| 10 mM Tris-HCl (pH = 8) | |||
| 5 mM de CaCl2 | |||
| 5 mM de acetato de magnésio | |||
| 2,0 mM de EDTA | |||
| 0,5 mM de EGTA | |||
| 1 mM de DTT |
| 2. Tampão de sacarose |
| Nome do reagente |
| 2,1 M de sacarose |
| 10 mM Tris-HCl (pH = 8) |
| 5 mM de acetato de magnésio |
| 1 mM de DTT |
| 3. Tampão de núcleos de armazenamento (NSB plus) |
| Nome do reagente |
| 0,44 M de sacarose |
| 10 mM Tris-HCl (pH = 7,2) |
| 70 mM de KCl |
| 10 mM MgCl2 |
| 1,5 mM de espermina |
| Reagentes e Equipamentos | Companhia |
| Isotipo IgG de coelho-CHIP Grau, # ab37415 | Abcam |
| De coelho anti-PCM-1 anticorpo, # HPA023374 | Anticorpos Atlas |
| Burro seg. anticorpo, anti-coelho Alexa 488 Fluor, # A-21.206 ou sec equivalente. anticorpo fluorescente | Life Technologies |
| DRAQ5 | Biostatus |
| Os filtros de células de 30 uM, 70 uM e 100 uM | BD Biosciences |
| Vidro douncer (40 ml) epilão "L" | VWR (Wheaton Industries, Inc.) |
| T-25 homogeneizador Ultra-Turrax | IKA Alemanha |
| Dispersão ferramenta S25 N-18 G | IKA Alemanha |
| Centrífuga Beckman Avanti | Beckman Coulter |
| Tubos Falcon de 15 ml e 50 ml | VWR |
| Tubos de centrífuga Beckman # 363664 | Beckman Coulter |
| JS13.1 rotor livre balançando | Beckman Coulter |
| Citómetro Influx | Beckman Coulter |
| Rotator tubo | VWR |
Referências
- Ang, K. L. Limitations of conventional approaches to identify myocyte nuclei in histologic sections of the heart. American journal of physiology. Cell physiology. , 298-1603 (2010).
- Bergmann, O. Identification of cardiomyocyte nuclei and assessment of ploidy for the analysis of cell turnover. Experimental cell research. 327, 188-194 (2011).
- Bergmann, O. Evidence for Cardiomyocyte Renewal in Humans. Science. 324, 98-102 (1126).
- Walsh, S. Cardiomyocyte cell cycle control and growth estimation. Cardiovascular Research. , 1-31 (2010).
- Spalding, K., Bhardwaj, R. D., Buchholz, B., Druid, H., Frisén, J. Retrospective birth dating of cells in humans. Cell. 122, 133-143 (2005).
- Adler, C. P., Friedburg, H., Herget, G. W., Neuburger, M., Schwalb, H. Variability of cardiomyocyte DNA content, ploidy level and nuclear number in mammalian hearts. Virchows Arch. 429, 159-164 (1996).
- Herget, G. W., Neuburger, M., Plagwitz, R., Adler, C. P. DNA content, ploidy level and number of nuclei in the human heart after myocardial infarction. Cardiovascular Research. 36, 45-51 (1997).
- Adler, C. P., Friedburg, H. Myocardial DNA content. ploidy level and cell number in geriatric hearts: postmortem examinations of human myocardium in old age. Mol. Cell Cardiol. 18, 3953-39 (1986).
- Dubois, N. C. SIRPA is a specific cell-surface marker for isolating cardiomyocytes derived from human pluripotent stem cells. Nature. 29, 1011-1018 (2011).
- Hattori, F. Nongenetic method for purifying stem cell-derived cardiomyocytes. Nature Methods. 7, 61-66 (2010).
- Fransioli, J. Evolution of the c-kit-Positive Cell Response to Pathological Challenge in the Myocardium. Stem Cells. 26, 1315-1324 (2008).
- Elliott, D. A. NKX2-5(eGFP/w) hESCs for isolation of human cardiac progenitors and cardiomyocytes. Nature Methods. 8, 1037-1040 (2011).
- Laflamme, M. A. Evidence for Cardiomyocyte Repopulation by Extracardiac Progenitors in Transplanted Human Hearts. Circulation Research. 90, 634-640 (2002).
- Srsen, V., Fant, X., Heald, R., Rabouille, C., Merdes, A. Centrosome proteins form an insoluble perinuclear matrix during muscle cell differentiation. BMC cell biology. 10, 28 (2009).
- Spoelgen, R. A novel flow cytometry-based technique to measure adult neurogenesis in the brain. Journal of neurochemistry. 119, 165-175 (2011).
- Soonpaa, M. H., Kim, K. K., Pajak, L., Franklin, M., Field, L. J. Cardiomyocyte DNA synthesis and binucleation during murine development. The American journal of physiology. 271, H2183-H2189 (1996).
- Olivetti, G. Aging, cardiac hypertrophy and ischemic cardiomyopathy do not affect the proportion of mononucleated and multinucleated myocytes in the human heart. J Mol Cell Cardiol. 28, 1463-1477 (1996).
- Okada, S. Flow cytometric sorting of neuronal and glial nuclei from central nervous system tissue. Journal of cellular physiology. 226, 552-558 (2011).
- Matevossian, A., Akbarian, S. Neuronal Nuclei Isolation from Human Postmortem Brain Tissue. J. Vis. Exp. (20), e914 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados