É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Um ensaio para a permeabilidade do neuroepitélio Zebrafish Embryonic
Neste Artigo
Resumo
Nós descrevemos uma medição animal vivo todo quantitativa para a permeabilidade do cérebro de zebrafish embrionário. A técnica de análise da capacidade de retenção de fluido cerebrospinal e moléculas de diferentes pesos moleculares no interior do lúmen do tubo neural e quantifica o seu movimento para fora dos ventrículos. Este método é útil para a determinação de diferenças de permeabilidade epitelial e maturação durante o desenvolvimento e na doença.
Resumo
O sistema ventricular do cérebro é conservada entre vertebrados e é composto de uma série de cavidades interconectadas chamado ventrículos cerebrais, os quais formam, durante as primeiras fases do desenvolvimento do cérebro e são mantidas durante toda a vida do animal. O sistema ventricular do cérebro é encontrado em vertebrados, e os ventrículos se desenvolver após a formação do tubo neural, em que o lúmen central, enche-se de líquido cefalorraquidiano (LCR) 1,2. CSF é um líquido rico em proteínas que são essenciais para o desenvolvimento do cérebro e função normais 3-6.
No peixe-zebra, o cérebro de inflação ventrículo começa em cerca de 18 a fertilização pós hr (hpf), depois de o tubo neural está fechado. Vários processos estão associados com a formação de cérebro ventricular, incluindo a formação de um neuroepitélio, a formação da junção estanque, que regula a produção de permeabilidade e CSF. Nós mostramos que o Na, K-ATPase é necessária para a inflação do ventrículo cerebral, afectando todos estes processoses 7,8, ao passo 5a claudina é necessário para a formação da junção estanque 9. Além disso, mostramos que a "relaxamento" do neuroepitélio embrionário, através da inibição da miosina, está associada com a inflação do ventrículo cerebral.
Para investigar a regulação da permeabilidade durante zebrafish inflação ventrículo cerebral, foi desenvolvido um ensaio ventricular retenção de corante. Este método utiliza a injecção ventrículo cerebral em um embrião do peixe-zebra vivos, uma técnica anteriormente desenvolvido no nosso laboratório 10, a fluorescência rotular o fluido cerebrospinal. Os embriões são então trabalhada ao longo do tempo à medida que o corante fluorescente, através dos ventrículos cerebrais e neuroepitélio. A distância da frente de corante se afasta do basal (não luminal) do lado do neuroepitélio ao longo do tempo é quantificado e é uma medida da permeabilidade neuroepitelial (Figura 1). Observamos que corantes 70 kDa e menores vão percorrer a neuroepitélio e pode ser detected fora do cérebro embrionário do peixe-zebra a 24 hpf (Figura 2).
Este ensaio de retenção de corante pode ser usada para analisar a permeabilidade neuroepitelial em uma variedade de diferentes origens genéticas, em momentos diferentes durante o desenvolvimento, e após perturbações ambientais. Também pode ser útil para examinar a acumulação patológica de CSF. No geral, esta técnica permite aos pesquisadores analisar o papel e regulação da permeabilidade durante o desenvolvimento e doença.
Protocolo
1. Preparando-se para microinjeção
- Prepare agulhas microinjeção puxando tubos capilares utilizando Sutter extrator agulha instrumentos.
- Agulha de microinjecção de carga com corante fluorescente (FITC-dextrano).
- Montar a agulha no aparelho micromanipulador e microinjecção.
- Cuidadosamente quebrar agulha microinjeção usando uma pinça para cerca de 2 m de largura, no entanto, isso vai variar dependendo da configuração do microinjetor. Para agulhas nossos microinjecção, esta corresponde à primeira região da agulha a partir da ponta, que não se curva.
- Medir o tamanho da gota de óleo, ajustando o tempo de injecção e pressão, de modo que cada um proporciona uma injecção nl. Definições de exemplo para Harvard Apparatus microinjetor são: P = 1,4 psi equilíbrio, P = 1,4 psi fora, P = 22,9 psi injetar, P = 67,8 psi claras com um tempo de injeção de 0,4-0,7 seg. O diâmetro da nossa agulha usando essas configurações é de aproximadamente 2 m. No entanto, as definições serão microinjetor específico, e variamegundo a agulha de diâmetro.
2. Preparando os embriões
- Revestimento de dois pratos com agarose a 1% em água, para cada condição, furos puxão em agarose com uma ponta de pipeta de 1-200 uL, e remover tampões de agarose. Preencha pratos com a mídia de embriões.
- Usando pinça, embriões dechorionate que são 18 hpf ou mais sob estereomicroscópio. Embriões são encenadas de acordo com Kimmel et al. 11.
- Transferência de embriões dechorionated no prato agarose primeiro revestido.
- Para anestesiar os embriões, adicionar tricaina (0,1 mg / ml) para o prato até embriões parar de se mover (feito de acordo com Westerfield 12).
3. Injetando os ventrículos cerebrais
- Embriões orientar para que você está olhando para o seu lado dorsal, colocando a cauda do embrião dentro do buraco. Se o micromanipulador está do lado direito, em seguida, deslocar o embrião de modo que o prosencéfalo é para a esquerda e para a direita rombencéfalo.
- Posição da agulha ao widest ponto de ventrículo rombencéfalo.
- Cuidadosamente placa telhado perfurar do ventrículo rombencéfalo tendo a certeza de não passar a profundidade do cérebro para a gema (Figura 1A).
- Injectar 1-2 nl de corante fluorescente para os ventrículos, certificando-se que o corante enche todo o comprimento dos ventrículos do cérebro.
- Transferir os embriões para o prato agarose segundo revestido cheio com meios de embriões e re-anestesiar como descrito em 2.4.
- Começar imediatamente a imagem, como descrito na seção 4, a fim de obter uma imagem tempo zero.
4. Imagem
- Embriões orientar com sua cauda no buraco, como descrito em 3.1.
- Use um microscópio de dissecação com luz fluorescente e transmitida tanto para obter uma imagem dorsal campo claro. Mantenha a ampliação constante entre imagiologia de embriões diferentes. Isto permite a comparação direta de análises realizadas utilizando Image J (5,2-6).
- Sem mover o embrião microscópio, ou prato, dê umaimagem fluorescente correspondente.
- Repetir para cada embrião em pontos de tempo desejados.
5. Quantificação de Movimento Dye
- Fundir de campo claro e as imagens fluorescentes em Photoshop como anteriormente descrito por Gutzman e Sive 10.
- Medir a distância os movimentos frente de corante no software Image J disponível em http://rsbweb.nih.gov/ij/ .
- Arquivo mesclado aberto no Image J e use a ferramenta de linha para desenhar uma linha do prosencéfalo dobradiça ponto-a-tingir frente em um ângulo de 10-20 ° de neuroepitélio (Figura 1A). Esta região foi escolhida por ser o primeiro local e mais notável de corante vazar do neuroepitélio de tipo selvagem.
- Selecione a ferramenta de medição para calcular o comprimento da linha.
- Repetir para cada ponto do tempo.
- Calcular a distância a frente de corante líquido movido ao longo do tempo, subtraindo a distância em t = 0 a partir de outros pontos de tempo.
- Lote emgráfico.
6. Resultados representativos
Um exemplo dos resultados obtidos num ensaio de permeabilidade utilizando embriões neuroepitelial do tipo selvagem é mostrada na Figura 1B, D-. Para diferenciar com precisão da permeabilidade, que é útil para testar os corantes com weightsto molecular diferente identificar um tamanho que é apenas ligeiramente permeável de tipo selvagem ou de embriões de controlo (Figura 2). Isto permite a identificação de mutantes genéticos ou condições ambientais que, ou aumento ou diminuição de permeabilidade (Figura 1D, verde e vermelho, respectivamente, de linhas). Para o neuroepitélio zebrafish 24 hpf, 70 kDa vazamentos FITC Dextran lentamente ao longo de 2 horas, enquanto 2.000 kDa não faz e 10 kDa quase imediatamente vaza. Portanto 70 kDa é o peso ideal molecular para identificar as condições que tanto aumentar e diminuir a permeabilidade neuroepitelial.
Se a agulha falha do lúmen do ventrículo, a fluorescência wmal aparecem fora do cérebro em t = 0 (para um exemplo veja Gutzman e Sive, 2009 10). Estes embriões devem ser eliminados uma vez que a tinta não foi injectado inicialmente contido no interior do cérebro e nenhuma conclusão clara sobre o movimento do corante e permeabilidade da neuropeithelium podem ser feitas.
Finalmente, se os embriões têm ventrículos pequenos ou ventrículos cerebrais un-inflados, pré-injecção dos ventrículos com uma solução salina pode ser feito antes da injecção do corante fluorescente. Isto faz a insuflação dos ventrículos tornando visualização posterior dos ventrículos mais fácil quando se injecta com o corante fluorescente. Controlos apropriados devem ser realizados para determinar se a injecção de uma solução salina normal, interrompe o desenvolvimento do tubo neural.
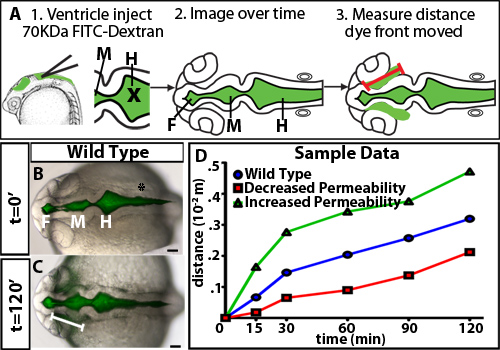
Figura 1. Curso de tempo de diferentes corantes de peso molecular. (A) Diagrama Experimental. Primeiro, Corante fluorescente é injetado nos ventrículos. X = posição de agulha para injecção. Próxima imagens dorsais são capturados ao longo do tempo. Finalmente, a distância percorrida pela frente do corante a partir do prosencéfalo dobradiça ponto é medida (representada por uma linha vermelha). (BC) Incorporada campo claro e fluorescentes imagens dorsal a 22 hpf (t = 0 min, B) e 24 hpf (t = 120 min, C). Linha branca indica a distância da frente de corante do cérebro anterior do ventrículo. (D) de dados de permeabilidade hipotéticos amostra. Azul = tipo selvagem ou controles, vermelho = amostra com permeabilidade diminuiu em relação ao controle, e amostra verde = com permeabilidade aumentada em relação ao controle.
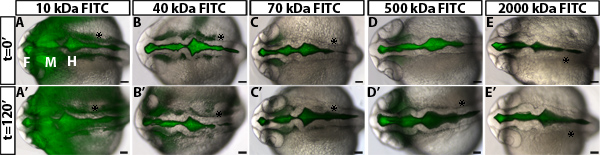
Figura 2. Medição da permeabilidade de diferentes corantes neuroepitelial peso molecular. (AE) brightfield Dorsal resultante da fusão e as imagens fluorescentes de 22 HPF embriões de tipo selvagem em t = 0 min após a injecção, com FITC-dExtran dos pesos moleculares seguintes: 10 kDa (A), 40 kDa (B), 70 kDa (C), 500 kDa (D) e de 2.000 kDa (E). (A'-E ') O mesmo que no embrião (AE) em t = 120 min a 24 hpf. Anterior para a esquerda. F = prosencéfalo, M = mesencéfalo, H = rombencéfalo. Asterisco = orelha.
Discussão
Nós demonstrar a capacidade de quantificar a permeabilidade do cérebro embrionário do peixe-zebra vivos, tal como determinado por um corante injectado de um determinado peso molecular. A nossa observação de que o neuroepitélio zebrafish embrionária é diferencialmente permeável aos corantes de diferentes pesos moleculares sugere que o corante está a avançar através da permeabilidade paracelular. No entanto, não podemos descartar a possibilidade de uma contribuição para a permeabilidade transcelular observa...
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Este trabalho foi financiado pelo Instituto Nacional para a Saúde Mental, e da National Science Foundation. Agradecimentos especiais a membros do laboratório SIVE para muitas discussões úteis e críticas construtivas, e para Olivier Paugois para criação de peixes especialista.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | |
| Dextrano, fluoresceína, Anionic, Lisina fixável | Invitrogen | D7136, D7137, D1822, D1820, D1845 | |
| Tricaina pó | Sigma | A5040 | |
| Tubos capilares | FHC Inc. | 30-30-1 |
Referências
- Harrington, M. J., Hong, E., Brewster, R. Comparative analysis of neurulation: first impressions do not count. Mol. Reprod. Dev. 76, 954-965 (2009).
- Lowery, L. A., Sive, H. Strategies of vertebrate neurulation and a re-evaluation of teleost neural tube formation. Mech. Dev. 121, 1189-1197 (2004).
- Salehi, Z., Mashayekhi, F. The role of cerebrospinal fluid on neural cell survival in the developing chick cerebral cortex: an in vivo study. Eur. J. Neurol. 13, 760-764 (2006).
- Martin, C. Early embryonic brain development in rats requires the trophic influence of cerebrospinal fluid. Int. J. Dev. Neurosci. 27, 733-740 (2009).
- Lehtinen, M. K. The cerebrospinal fluid provides a proliferative niche for neural progenitor cells. Neuron. 69, 893-905 (2011).
- Gato, A. Embryonic cerebrospinal fluid regulates neuroepithelial survival, proliferation, and neurogenesis in chick embryos. Anat. Rec. A. Discov. Mol. Cell Evol. Biol. 284, 475-484 (2005).
- Lowery, L. A., Sive, H. Totally tubular: the mystery behind function and origin of the brain ventricular system. Bioessays. 31, 446-458 (2009).
- Lowery, L. A., Sive, H. Initial formation of zebrafish brain ventricles occurs independently of circulation and requires the nagie oko and snakehead/atp1a1a.1 gene products. Development. 132, 2057-2067 (2005).
- Zhang, J. Establishment of a neuroepithelial barrier by Claudin5a is essential for zebrafish brain ventricular lumen expansion. Proc. Natl. Acad. Sci. U.S.A. 107, 1425-1430 (2010).
- Gutzman, J. H., Sive, H. Zebrafish brain ventricle injection. J. Vis. Exp. , (2009).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Dev. Dyn. 203, 253-310 (1995).
- Westerfield, M., Sprague, J., Doerry, E., Douglas, S., Grp, Z. The Zebrafish Information Network (ZFIN): a resource for genetic, genomic and developmental research. Nucleic Acids Research. 29, 87-90 (2001).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados