Method Article
High Throughput ELISA sequencial para a validação dos biomarcadores da doença enxerto-versus-hospedeiro aguda
Neste Artigo
Resumo
Validação com rendimento elevado de candidatos a biomarcadores múltiplos pode ser realizada por meio de ELISA sequencial de modo a minimizar de congelamento / descongelamento e utilização de amostras de plasma preciosos. Aqui, nós demonstrar como executar sequencialmente ELISAs para seis diferentes biomarcadores de plasma validados 1-3 De enxerto-versus-hospedeiro (GVHD) 4 Na amostra de plasma mesmo.
Resumo
Proteômica estratégias de descoberta imparciais têm o potencial para identificar um grande número de novos biomarcadores que podem melhorar os testes de diagnóstico e prognóstico em um ambiente clínico e pode ajudar a guiar intervenções terapêuticas. Quando um grande número de proteínas candidatas são identificadas, pode ser difícil validar biomarcadores candidatos em tempo hábil e eficiente a partir de amostras de plasma de pacientes que são orientados a eventos, de volume finito e insubstituível, como no início da aguda do enxerto-versus- doença do hospedeiro (GVHD), uma complicação potencialmente fatal de alogênico de células tronco hematopoiéticas (TCTH).
Aqui descrevemos o processo de execução de testes ELISA comercialmente disponíveis para seis proteínas validados GVHD: IL-2Ra 5, TNFR1 6, HGF 7, IL-8 8, elafin 2, e REG3α 3 (também conhecido como PAP1) de uma forma sequencial para minimizar ciclos de congelamento e descongelamento, Tempo de plasma descongelado e uso de plasma. Para esse procedimento foi realizar os testes ELISA em ordem sequencial, conforme determinado pelo fator de diluição da amostra, conforme estabelecido em nosso laboratório utilizando kits ELISA fabricante e protocolos com pequenos ajustes para facilitar ótimo desempenho ELISA sequencial. As concentrações plasmáticas de biomarcadores resultantes podem então ser compilados e analisados para resultados significativos dentro de um grupo de pacientes. Embora esses biomarcadores são atualmente apenas para pesquisa, sua incorporação cuidados clínicos está sendo investigado em ensaios clínicos.
Esta técnica pode ser aplicada para realizar os testes ELISA para múltiplas proteínas / citocinas de interesse na mesma amostra (s) desde que as amostras não necessitam de ser misturadas com outros reagentes. Se kits ELISA não vêm com pré-revestidas, as placas de 96 cavidades de meia assim chapas ou placas de 384 poços pode ser usado para reduzir ainda mais o uso de amostras / reagentes.
Introdução
Doença do enxerto-versus-hospedeiro aguda (GVHD), uma das principais causas de mortalidade não-recaída (NRM) após alogénico transplante de células hematopoiéticas (HSCT), mede-se por uma disfunção em três sistemas de órgãos: a pele, fígado e gastrointestinal (GI) trato 4. GVHD aguda geralmente ocorre entre duas e oito semanas após o transplante, mas podem ocorrer mais tarde, e muitas vezes é clinicamente indistinguível da de outros pós-TCTH complicações, tais como a toxicidade regime de condicionamento, infecção ou efeitos colaterais. Através da utilização de estratégias de proteômica e de alto rendimento de validação usando ELISA sequencial, foram identificados seis proteínas cujas concentrações são elevadas no início das manifestações clínicas da DECH. IL-2Ra, TNFR1, HGF e IL-8, quando combinados em um painel 4 biomarcador pode diagnosticar-GVHD no início dos sintomas clínicos e pode prever a sobrevivência pós-transplante, independentemente da gravidade da GVHD 1. Elafin, um biomarcador para GVHD do skem, pode discriminar entre erupção GVHD e erupção de outras causas, como erupções de drogas e pode prever a sobrevida do transplante 2. Nós recentemente identificado REG3α como um biomarcador de DECH do trato gastrointestinal, o órgão alvo mais associado com NRM. A concentração plasmática de REG3α pode identificar com segurança DECH como a causa para o pós-TCTH diarréia e correlacionar com a gravidade histológica da DECH em diagnóstico biópsias intestinais. As concentrações no GI REG3α início GVHD também pode prever a capacidade de resposta a terapia com GVHD e NRM 3. A incorporação desses biomarcadores validados GVHD em atendimento clínico está sendo investigado em ensaios clínicos.
Estas experiências foram realizadas em pequenas alíquotas de plasma colhidas a partir de pacientes que receberam transplante entre 2000 e 2010 no momento do início GVHD que são insubstituíveis e de quantidade limitada. Devido à natureza precioso destas amostras, temos desenvolvido um metgico da medição das concentrações de proteína de plasma em múltiplos de forma eficiente e reprodutível para eliminar o excesso de ciclos de congelamento e descongelamento, o tempo de descongelamento e utilização de plasma. Esta técnica pode ser aplicada para realizar os testes ELISA para múltiplas proteínas / citocinas de interesse na mesma amostra (s) desde que as amostras não necessitam de ser misturadas com outros reagentes. Se kits ELISA não vêm com pré-revestidas, as placas de 96 cavidades de meia assim chapas ou placas de 384 poços pode ser usado para reduzir ainda mais o uso de amostras / reagentes. Este manuscrito incide sobre os aspectos tecnológicos da medição biomarcadores GVHD.
Protocolo
1. Dia experimento 0: Preparação de amostras e ELISA Revestimento placa de teste com anticorpo de captura para a IL-2Ra, e HGF REG3α
- Amostras de alíquotas de plasma a ser analisadas serão puxados, descongelada e centrifugada a 12000 rpm durante 10 min para separar os coágulos, na parte inferior e na parte superior lipidos do plasma. 150 ul de plasma não diluído irão ser plaqueadas a partir de cada amostra para uma placa de 96 poços de fundo V-(placa de fonte) por pipetagem manual de acordo com os mapas pré-definidos. As alíquotas será enrolado em parafilme e mantida numa câmara húmida a 4 º C durante todo o processo, não mais do que 72 h.
- IL-2Ra e anticorpos de captura de HGF será reconstituído e diluído por a especificação do fabricante e 50 uL irá semeadas em cada cavidade de 96 cavidades respectivas de alta ligação semi-poços que são então seladas e incubadas durante a noite a 4 ° C. Alternativamente, as placas de visita pode ser seco a 37 ° C e armazenados a 4 ° C para utilização posterior, dependemção sobre a estabilidade da proteína.
- Anticorpo de captura REG3α será diluído de acordo com o protocolo do fabricante utilizando tampão fabricante de revestimento e 25 ul serão semeadas em cada poço de uma de 384 poços Nunc Maxi Sorp-placa, que é então selado e incubado durante a noite a 4 ° C.
2. Dia Experiência 1: IL-2Ra ELISA (Figura 1)
- A placa de teste de IL-2Ra foi lavada, bloqueadas com BLOTTO em TBS, e o padrão é reconstituído e uma curva padrão de 8 pontos é preparado segundo o protocolo do fabricante.
- Após lavagem da placa após o passo de bloqueio, 50 ul de plasma não diluído é plaqueada em duplicado da placa de fonte para a placa de ELISA, e 50 ul de cada padrão é plaqueada em duplicado. A placa é selado e incubado durante 2 horas à temperatura ambiente num agitador rotativo placa fixada em 300 rpm.
- O plasma é recuperado a partir da placa de ensaio de ELISA IL-2Ra e colocados de volta no undiluído placa da fonte de plasma. O ELISA é completado por protocolo do fabricante (com volumes ajustados para metade poços) e a densidade óptica de cada poço vai ser lido utilizando um leitor de placas de jogo para 450-570 nm, e os dados guardados e analisados.
3. Dia Experiência 1: REG3α ELISA (Figura 1)
- 10 ul de plasma não diluído é transferido para uma placa de fonte separada v inferior. 90 ul de tampão fornecido pelo fabricante de diluição é adicionada a cada poço para criar uma placa de diluição 1:10 fonte.
- O ELISA é realizado por REG3α protocolo do fabricante (com volumes ajustado para 384 poços) e a densidade óptica de cada poço será lido utilizando um leitor de placas definido para 450-620 nm, e os dados serão guardados e analisados.
4. Dia Experimento 1: Elafin e TNFR1 Revestimento placa de teste com anticorpo de captura
- Elafin e anticorpos de captura TNFR1 será reconstituído e dilbuída por especificações do fabricante e 50 uL irá semeadas em cada cavidade de 96 cavidades respectivas de alta ligação semi-poços que são então seladas e incubadas durante a noite à temperatura ambiente durante Elafin, e a 4 ° C para TNFR1.
5. Experiment Dia 1-2: HGF ELISA (Figura 1)
- Após completar o ensaio ELISA IL-2Ra e assegurando o teste não necessita de ser repetida, 60 ul de plasma não diluído será transferida para uma placa nova fonte e, em seguida, 60 ul de BSA a 1% em 1 x PBS é adicionado a cada poço para tornar um 01:02 prato fonte diluída plasma.
- A placa de teste é lavada HGF, bloqueadas com BLOTTO em TBS, e o padrão é reconstituído e uma curva padrão de 8 pontos é preparado segundo o protocolo do fabricante.
- Após lavagem da placa após o passo de bloqueio, 50 ul de 1:2 de plasma diluído é plaqueadas em duplicado na placa de ELISA, e 50 ul de cada padrão é plaqueada em duplicado. A placa é selada eincubadas durante a noite à temperatura ambiente num agitador rotativo placa ajustada para 300 rpm.
- O plasma diluído 1:02 é recuperado a partir da placa de teste ELISA HGF e colocada de volta na placa de fonte diluída de 1:02 de plasma. O ELISA é completado por protocolo do fabricante (com volumes ajustados para metade poços) e a densidade óptica de cada poço vai ser lido utilizando um leitor de placas de jogo para 450-570 nm, e os dados guardados e analisados.
6. Dia Experimento 2: Elafin ELISA
- 10 ul de plasma não diluído é transferido para uma placa nova fonte e, em seguida, 190 ul de BSA a 1% em 1 x PBS serão adicionados a cada poço para tornar 200 ul de plasma 1:20 dluted.
- O ELISA Elafin como realizado de acordo com o protocolo do fabricante (com volumes ajustado para metade poços), e a densidade óptica de cada poço será lido utilizando um leitor de placas definido para 450-570 nm, e os dados guardados e analisados.
7. Da experiênciay 2: TNFR1 ELISA
- 25 ul de BSA a 1% em PBS, será adicionado à placa de fonte de 1:20 (agora contendo 100 uL de plasma de 1:20) para obtenção de 125 ul de plasma diluído 1:25.
- O ELISA é completado por TNFR1 protocolo do fabricante (com volumes ajustados para metade poços) e a densidade óptica de cada poço vai ser lido utilizando um leitor de placas definido para 450-570 nm, e os dados guardados e analisados.
8. Dia Experiência 2: IL-8 ELISA
- 60 ul de 1:2 de plasma diluído será transferida para uma placa nova fonte e, em seguida, 180 ul de IL-8 diluente é adicionado a cada poço para fazer uma placa de fonte diluída de 1:06 de plasma.
- O ELISA de IL-8 é completado por protocolo do fabricante (com volumes ajustados para metade poços) e a densidade óptica de cada poço vai ser lido utilizando um leitor de placas definido para 450-570 nm, e os dados guardados e analisados.
Uma vez que todos os testes ELISA foram concluídas, sem usod estoque plasma será substituído nas alíquotas descongelados e congelado para utilização futura.
Resultados
O fluxo de trabalho de biomarcadores e cronograma estão detalhados na Tabela 1 e Tabela 2, respectivamente. Depois de concluído, as concentrações de 6 proteínas diferentes foram agora quantificada na mesma amostra de plasma usando um total de 150 uL de plasma. Plaqueamento das amostras em duplicado por teste permite a garantia de qualidade interna, com CV% de menos de 10 sendo ótima. Se realizar o teste ELISA sequencial em placas múltiplas, consistentes densidades ópticas do padrão elevado são preferidos e permitir a fiabilidade inter-chapa melhorada das medições; curva padrão ODs podem ser comparados entre as placas de olhar para avaliar o desempenho inconsistência em ELISA (Figura 2). Os tempos de desenvolvimento, utilizando o substrato tetrametilbenzidina colorimétrica e alta concentração de ODs observada para cada biomarcador no nosso laboratório estão listados na Tabela 3.
tp_upload/4247/4247fig1.jpg "alt =" Figura 1 "/>
Figura 1. Fluxo de trabalho para a IL-2Ra, e ELISAs REG3α HGF. Após as amostras de plasma foram semeadas em placas de IL-2Ra placas de ensaio de ELISA que é recuperada para fazer placas de diluição de fonte para os testes ELISA outros. Para o ELISA de HGF, o plasma é recuperado para preparar a placa de diluição de 1:6 de IL-8. clique aqui para maior figura .
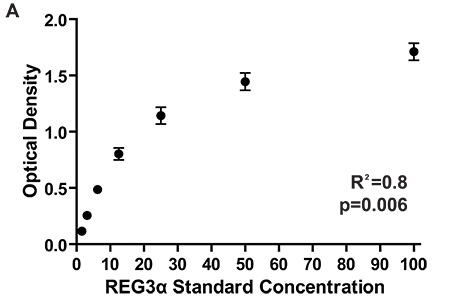
Figura 2. Densidades Ópticas para a curva padrão de 7 placas de ELISA que medem diferentes concentrações REG3α correspondentes aos 1.084 pacientes testados para o GI REG3α relatório inicial biomarcador GVHD 3. ODs consistente entre as placas garantir as proteínas consistentes de concentração entre as placas. As concentrações de proteínasem amostras de plasma são calculadas comparando as densidades ópticas de amostras para as densidades ópticas da curva padrão.
| Dia experiência 0 | 1. Preparar amostras |
| 2. IL-2Ra, HGF e REG3α captura Ab | |
| Dia experimento 1 | 1. IL-2RαELISA |
| 2. REG3αELISA | |
| 3. HGF ELISA (por exemplo revestimento) | |
| 4. Elafin e TNFR captura Ab | |
| Dia experimento 2 | 1. HGF conclusão ELISA |
| 2. Elafin ELISA | |
| 3. TNFR1 ELISA | |
| 4. IL-8 ELISA | |
| 5. Recongelar não utilizadoplasma |
Tabela 1. GVHD Visão geral de fluxo de trabalho Biomarker
| Dia 0 | A preparação da amostra e a incubação durante a noite o corpo de captura | ||||||
| ELISA | IL-2Ra | REG3α | HGF | Elafin | TNFR1 | IL-8 | |
| Tempo (h) | 0,0 | Bloqueio | |||||
| 1,0 | Amostras banhados | ||||||
| 3,0 | Recuperar as amostras de plasma; Detecção Ab | Amostras de bloqueio; preparar (diluição 1:10) | |||||
| 4,0 | Amostras banhados (1:10) | ||||||
| 5 | Estreptavidina-HRP | Detecção de Ab | |||||
| 5,5 | TMB | Estreptavidina-HRP | |||||
| 6 | Leitura placa | TMB | Bloqueadores; amostras preparar (diluição 1:2) | ||||
| 6,5 | Leitura placa | ||||||
| 7 | Amostras banhados (1:2) | Capturar Ab (incubação durante a noite) | Capturar Ab (incubação durante a noite) | ||||
| Dia 2 | |||||||
| Tempo (h) | 0,0 | Reclaim plasma, Detecção de Ab | Bloqueio; amostras de preparar (1:20) | ||||
| 1,0 | Chapeamento amostra (1:2) | Bloqueio; nova diluição de 1:20 para a diluição de amostras 01:25 | |||||
| 2,0 | HRP | Chapeamento amostra (1:25) | |||||
| 2,5 | TMB | ||||||
| 3,0 | Leitura placa | Detecção de Ab | |||||
| 3,5 | Preparar as amostras (1:6 diluição) | ||||||
| 4,0 | Detecção de Ab | Chapeamento de amostra (1:6) | |||||
| 5 | HRP | ||||||
| 5,5 | TMB | ||||||
| 6 | Leitura placa | HRP | Detecção de Ab | ||||
| TMB | |||||||
| 7 | Leitura placa | TMB | |||||
| 7,5 | Leitura da placa | ||||||
| Após a conclusão | Substituir fonte de plasma em alíquotas e congelar para uso posterior | ||||||
Tabela 2. Cronograma para a realização de testes ELISA.
| Factor de diluição do plasma | Concentração Alto Padrão | Tempo substrato Desenvolvimento (min) | Alta OD | Curva | |
| IL-2Ra | 01:01 | 2000 pg / ml | 5 | 1 | Linear |
| HGF | 01:02 | 4000 pg / ml | 22 | 2,1 | 4 parâmetros |
| IL-8 | 01:06 | 200 pg / ml | 12 | 2,7 | 4 parâmetros |
| REG3α | 01:10 | 100 ng / ml | 12 | 1,7 | 4 parâmetros |
| Elafin | 01:20 | 2000 pg / ml | 20 | 1,9 | 4 parâmetros |
| TNFR1 | 01:25 | 800 pg / ml | 8 | 2,7 | Linear |
Detalhes Tabela 3. ELISA para 6 Biomarkers GVHD.
Discussão
O método ELISA sequencial aqui apresentada permite a medição de várias proteínas do plasma em pequenos volumes de plasma que podem ser difíceis de obter e / ou insubstituível tais como amostras de indivíduos humanos com doenças raras ou de amostras de plasma obtidas a partir de ratinhos 9,10. Os ELISAs sequenciais são tipicamente realizadas na ordem do factor de diluição de plasma crescente, com testes ELISA requerem plasma diluído ≥ 1:10, normalmente, não necessitam de ser recuperado, embora isso possa ser feito se desejado. A capacidade de realizar ELISA sequencial é limitada por kits ELISA / protocolos em que o plasma é misturada com os restantes reagentes, ou para os quais tampões de diluição diferentes são requeridas para o plasma, o que se opõe à ablility de reutilizar uma amostra devido a preocupações de que um incompatíveis tampão / reagente irá interferir com o desempenho de um teste particular. Com um planeamento cuidado, de 10 ou mais ELISAs pode ser efectuado com a mesma amostra de plasma.
ent "> Laboratórios individuais podem precisar de ajustar diluições de plasma, a fim de obter resultados interpretáveis baseadas em concentrações plasmáticas esperados da proteína de interesse em amostras dos sujeitos de teste. Diferenças no equipamento de laboratório pode resultar na necessidade de optimizar a incubação e desenvolvimento colorimétrico vezes, o número de lavagens e / ou lavar tempos de imersão, de modo a optimizar qualquer dado ELISA.Para aumentar a taxa de transferência de alta capacidade e precisão e para realizar análises de forma rentável, a utilização de uma plataforma de manuseamento robotizado líquido capaz de análise em 384 placas de poços e um lavador de placas automático com a unidade de empilhamento são recomendados. Este equipamento pode aumentar a precisão e precisão das análises realizadas por vários usuários, e ajudar a fornecer consistência de análise para reduzir variação inter e intra-ensaio.
Usamos ELISA sequencial em plataformas multiplex disponíveis por dois motivos: 1) A maior parte dapares de anticorpos para novas proteínas não podem ser facilmente conjugados com pérolas ou outro material, bem como demorada e cara, 2) ensaios de ELISA individuais são mais precisos do que microarray multiplex ou grânulos, secundária a uma ausência de reactividade cruzada 11. Se um método de confiança é estabelecida para executar multiplexados, grânulo com base em microarrays, pode ser capaz de substituir o processo de ELISA sequencial, mas pode ser limitada pela capacidade para conjugar os anticorpos de grânulos e / ou pelo número de proteínas desejadas de ser analisados.
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Suportado pelo NIH RC1-HL-101102, P01-CA039542, T32-HL007622, a Fundação Hartwell, e Doris Duke Charitable Foundation. Dr. Paczesny é um investigador do Hartwell Eric fundo ea Amy Strelzer Programa de Pesquisa Manasevit.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários |
| Human IL-2 R alfa DuoSet | R & D Systems | DY223 | |
| HGF humano DuoSet | R & D Systems | DY294 | |
| IL-8 humana OptEIA KIT II | Becton Dickinson | 550999 | |
| Ab-Match ASSEMBLEIA Humanos PAP1 (REG3α) Kit | MBL International | 5323 | |
| Ab-Match UNIVERSAL Kit | MBL International | 5310 | |
| Humana sTNFRI/TNFRSF1A DuoSet | R & D Systems | DY225 | |
| Humana Trappin-2/Elafin DuoSet | R & D Syderiva | DY1747 | |
| De 96 cavidades de polistireno de fundo cónico placas | Thermo Scientific | 249570 | Usado para placas de fonte de plasma |
| Costar meio bem alta de ligação de 96 poços | Corning | 3690 | Para a IL-2Ra, HGF, TNFR1 e ELISAs elafin |
| Nunc 384 poços Maxisorp | Nunc | 464718 | Para REG3α Elisa |
| HyClone Tampão fosfato salino, 1x | Thermo Scientific | SH30256.02 | |
| Albumina de Soro Bovino, Fracção V, choque térmico Tratada | Fisher Scientific | BP1600-100 | |
| Bloqueador de BLOTTO em TBS | Thermo Scientific | 37530 | Agente de bloqueio de IL-2Ra e HGF ELISAs TNFR1 |
| DulbeccoSalina tamponada com fosfato | Gibco | 21600-069 | O tampão de lavagem para a IL-2Ra, HGF, Elafin e ELISAs TNFR1 |
| Susbtrate Peróxido de TMB | Kirkegaard and Perry Laboratories | 50-76-00 | |
| Tween 20 | Acros Organics | 233362500 | O tampão de lavagem para a IL-2Ra, HGF, Elafin e ELISAs TNFR1 |
| Ácido sulfúrico | Sigma-Aldrich | 84720 | (Diluída a 2N) para solução de parada |
Referências
- Paczesny, S. A biomarker panel for acute graft-versus-host disease. Blood. 113, 273-278 (2009).
- Paczesny, S. Elafin is a biomarker of graft-versus-host disease of the skin. Science Translational Medicine. 2, 13ra12 (2010).
- Ferrara, J. L. Regenerating islet-derived 3 alpha is a biomarker of gastrointestinal graft-versus-host disease. Blood. , (2011).
- Ferrara, J. L., Levine, J. E., Reddy, P. Graft-versus-host disease. Lancet. 373, 1550-1561 (2009).
- Miyamoto, T. Serum concentration of the soluble interleukin-2 receptor for monitoring acute graft-versus-host disease. Bone Marrow Transpl. 17, 185-190 (1996).
- Holler, E. Role of tumor necrosis factor alpha in acute graft-versus-host disease and complications following allogeneic bone marrow transplantation. Transplant. Proc. 25, 1234-1236 (1993).
- Okamoto, T. Increased hepatocyte growth factor in serum in acute graft-versus-host disease. Bone Marrow Transpl. 28, 197-200 (2001).
- Uguccioni, M. Elevated interleukin-8 serum concentrations in beta-thalassemia and graft-versus-host disease. Blood. 81, 2252-2256 (1993).
- Osuchowski, M. F., Siddiqui, J., Copeland, S., Remick, D. G. Sequential ELISA to profile multiple cytokines from small volumes. J. Immunol. Methods. 302, 172-181 (2005).
- Osuchowski, M. F., Remick, D. G. The repetitive use of samples to measure multiple cytokines: the sequential ELISA. Methods. 38, 304-311 (2006).
- Schweitzer, B. Multiplexed protein profiling on microarrays by rolling-circle amplification. Nat. Biotechnol. 20, 359-365 (2002).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados