Method Article
Optimizado coloração e Proliferação Métodos de Modelagem para Monitoramento Divisão Celular usando Corantes Rastreamento celulares
Neste Artigo
Resumo
O sucesso no uso de corantes de rastreamento celulares para monitorar a função de células imunes e proliferação envolve várias etapas críticas. Descrevemos métodos para: 1) a obtenção de brilhante, uniforme, reprodutível etiqueta ing com corantes de membrana, 2) selecção de fluorocromos e condições de aquisição de dados, e 3) a escolha de um modelo para quantificar a proliferação de células com base na diluição de corante.
Resumo
Corantes de rastreamento de células fluorescentes, em combinação com a citometria de fluxo e de imagem, são poderosos instrumentos com os quais estudar as interacções e destinos de diferentes tipos de células, in vitro e in vivo. 1-5 Embora existem literalmente centenas de publicações usando tais corantes, alguns dos as aplicações de localização mais comumente encontrados celulares incluem a monitorização de:
- caule e quiescência das células progenitoras, proliferação e / ou diferenciação 6-8
- antígeno-driven transferência membrana 9 e / ou a proliferação de precursores de células e 3,4,10-18
- função das células imunes regulamentar e efetor 1,18-21.
Corantes de rastreamento de células disponíveis comercialmente variam muito nas suas propriedades químicas e de fluorescência, mas a grande maioria da queda em uma de duas classes com base no seu mecanismo de marcação celular. "Corantes de membrana", caracterizado por PKH26, são corantes altamente lipofílicos tpartição de chapéu de modo estável, mas de forma não covalente em membranas celulares 1,2,11. "Proteína corantes", que se caracteriza por CFSE, são amino-corantes reactivos que formam ligações covalentes estáveis com proteínas celulares 4,16,18. Cada classe tem suas próprias vantagens e limitações. A chave para seu uso bem sucedido, especialmente em estudos multicolor onde diversas tinturas e são usados para controlar diferentes tipos de células, é, portanto, de entender as questões críticas permitindo o uso ideal de cada classe 2-4,16,18,24.
Os protocolos incluídos aqui destacar três causas mais comuns de maus resultados ou variável ao usar celular de rastreamento de corantes. Estes são os seguintes:
- A falha em conseguir brilhante, rotulagem, uniforme reprodutível. Este é um ponto de partida necessário para qualquer estudo de rastreamento de celular, mas requer atenção a diferentes variáveis ao utilizar corantes membrana que ao utilizar corantes ou reagentes de proteína de ligação de equilíbrio, tais como anticorpos.
- Subótimas combinações fluorocromo umnd / ou falha para incluir controles de compensação críticas. Acompanhamento de fluorescência do corante é tipicamente 10 fevereiro - 10 março vezes mais brilhante que a fluorescência dos anticorpos. Por conseguinte, é essencial a fim de verificar que a presença de corante de rastreio não comprometa a capacidade de detectar outras sondas sendo usados.
- A não obtenção de um bom ajuste com o software de modelagem de pico. Esse tipo de software permite a comparação quantitativa de respostas proliferativas em diferentes populações ou estímulos baseados na frequência precursor ou outras métricas. A obtenção de um bom ajuste, no entanto, requer a exclusão de morto / morrendo células que podem distorcer os perfis de diluição de corante e congruência dos pressupostos subjacentes ao modelo com características do perfil observado corante diluição.
Os exemplos apresentados aqui ilustram como estas variáveis podem afectar os resultados quando se utiliza membrana e / ou de corantes proteicos para monitorizar a proliferação das células.
Protocolo
1. Rotulagem de membrana geral com PKH26 Dye Rastreamento celular (Ref. 25; Figura 1)
- Use a técnica estéril para as etapas 1,1-1,9. Prepara ~ 10 7 células mononucleares de sangue periférico ou linfócitos (hPBMC, hPBL) e utilizando o método padrão do laboratório com a adição de uma centrifugação final 300 xg para minimizar a contaminação das plaquetas. Ressuspender as células em 10 7 / ml em HBSS + 1% BSA e colocar em gelo, reservando-se uma alíquota de 500 ul (5x10 6 células) para uso no Passo 2.
- Coloque 5x10 6 células (500 ul) de uma 12 75 milímetros tubo cónico de polipropileno x. Lavar uma vez com 3,5 ml de HBSS. Aspirar cuidadosamente o sobrenadante, deixando não mais do que 15-25 ul de fluido residual, mas tomando cuidado para não remover as células. Utilizar este tubo para preparar uma suspensão de células de 2 x no Passo 1.4.
- Durante a lavagem das células no passo 1.2, adicionar 0,5 ml de diluente de veículo rotulagem C (a partir do kit PKH26GL) para um tubo de 12 75 milímetros x de polipropileno cónico. Utilize este tubo para prepsão uma solução PKH26 2x no Passo 1.5.
- Adicionar 0,5 ml de veículo Diluente C rotulagem para o sedimento de células lavado a partir do Passo 1.2 e aspirar e dispensar 3-4 vezes para se obter uma suspensão de células individuais (2x células). Evitar a formação de bolhas e excesso de mistura, o que pode reduzir a viabilidade das células e recuperação.
- Imediatamente após a preparação da suspensão de células de 2 x no Passo 1.4, preparar uma solução de (4 ^ M) 2x corante por adição de 2,0 ul de estoque de 1,0 mM PKH26 corante em etanol (a partir do kit PKH26GL) para o tubo de Diluente C preparado na Fase 1.3 e vortex para dispersar uniformemente.
- Imediatamente após a preparação da solução de corante em 2x Passo 1.5, rapidamente pipetar a suspensão de células a partir do Passo 2 x 1,4 na solução de corante 2x e simultaneamente aspirar e dispensar 3-4 vezes para dispersar completamente as células em corante Não:. Adicionar 1,0 mM corante directamente células; despejar as células 2x 2x em corante, ou adicionar células para 2x 2x corante enquanto vórtex. Devido a coloração é quase instantânea, tais métodos produzem menosintensidades uniformes do que o método recomendado (Figura 2).
- Após 1 min, adicionar 1,0 ml de soro inactivado pelo calor ou HBSS BSA 5% para parar a absorção do corante nas membranas celulares. A não utilização de proteína suficiente arrisca-se a formação de agregados de corantes, que podem pelete com as células, durante os passos de lavagem e causar rotulagem não intencional de outras células presentes em uma experiência. Se o meio com 10% de soro inactivado de calor (CM) ou HBSS + 1% BSA é para ser usado como reagente de paragem, realizar a coloração de um tubo de polipropileno de 15 ml e adicionar, pelo menos, 5,0 ml de reagente de paragem para assegurar a adsorção de todos unincorporated corante.
- Centrifugar as células marcadas por 5 min @ ~ 400 x g. Aspirar cuidadosamente o sobrenadante sem remover células. Lava-se a pelete duas vezes com 4 ml de BSA ou HBSS CM +1%, dispersar o sedimento bem antes de nova centrifugação. Para minimizar o extravasamento de corante adsorvido nas paredes do tubo e maximizar a eficiência de lavagem, transferir as células para um tubo de polipropileno de fresco após o first ressuspensão. Nota: as células coradas adequadamente irá apresentar uma coloração distinta rosa no pellet.
- Ressuspender o sedimento de células lavado em 1,0 ml de BSA% HBSS 1. Contar as células, determinar a recuperação de células, e ajustar o volume para dar uma concentração final de 10 7 / ml. Com aspiração cuidadosa, a recuperação de células deve ser ≥ 85%. Se a recuperação de celular é <70%, determinar a causa antes de prosseguir. Retirar uma alíquota de 150 ul (1.5x10 6 células) e colocar em gelo para uso no Passo 2.
2. Preparação de controles configuração do instrumento e Ensaio (Tabela 1)
- Alíquota de 50 ul (5x10 5) de células não coradas a partir da suspensão de células guardadas em Passo 1.1 em cada um de cinco tubos de 1,8 ml de Eppendorf: 1, 3, 4, 5, e 7. Alíquota de 50 ul (5x10 5) de células PKH26 pos do Passo 1,9 em cada um dos três tubos: 2, 6 e 8.
- Adicionar 10 uL de IgG bloco (100 ug / tubo de IgG, ver tabela de reagentes) para tubos de 1-8e incubar durante 10 min à temperatura ambiente (20-25 ° C).
- Adicionar uma quantidade saturante do anticorpo (s) indicado na Tabela 1 para tubos 4, 5, 7, e 8, e incubar todos os tubos de amostras (1-8) durante 30 min à temperatura ambiente e protegida da luz.
- Adicionar 1,5 ml de HBSS BSA 1%, para todas as amostras, sedimentar as células por centrifugação (5 min a 400 xg) e lava-se uma vez com 1,5 ml de HBSS + 1% de BSA, com aspiração cuidadosa para evitar a perda de células.
- Ressuspender a cada amostra em 500 uL de HBSS BSA 1%. Se necessário para amostras a serem analisadas em seu citómetro, transferir para um tubo de 12 mm x 75 fundo redondo. Adicionar 10 ul de 100 ug / ml 7-AAD diária estoque de trabalho (ver tabela de reagentes) para tubos de 3, 6, 7 e 8, como indicado na Tabela 1. Incubar em gelo durante 30 min, antes da utilização na instalação de citometria de fluxo e verificação de coloração (Passo 3).
3. Instalação de citometria de fluxo e verificação de coloração
- Verifique se o fluxo cytomeTer está funcionando adequadamente, utilizando procedimentos estabelecidos pelo laboratório de controle de qualidade diário. Verificar que os sinais podem ser facilmente detectado em cada janela espectral a ser usado, e que as respostas do detector são linearmente proporcional à intensidade de sinal na janela a ser usada para a monitorização da proliferação 14.
- Adquirir FSC vs SSC dados para Tubo 1 usando escalas de exibição lineares. Ajustar a amplificação de cada detector de tal forma que a população de linfócitos cai no quadrante inferior esquerdo do gráfico de pontos, não está fora de escala, em qualquer um dos parâmetros, e não é interrompido por thresholding. Coletar dados ungated FSC vs SSC para todas as amostras em Passos 3,3-3,7.
- Aquisição de dados para Tubo 1, utilizando nenhuma compensação de cor e escalas logarítmicas de exibição para todos os quatro detectores de fluorescência. Ajuste de alta tensão de cada detector (HV) para colocar a autofluorescência de linfócitos não coradas em escala com poucos / sem células acumulando no primeiro canal. Definir um limite de análise para cada histogramacorrespondente a mais brilhante de 2% das células não coradas.
- Usando nenhuma compensação de cor e as configurações de alta tensão estabelecido em Passos 3.2 e 3.3, a aquisição de dados para Tubo 2, coletando FSC, SSC e sinais em todos os quatro detectores de fluorescência. Para o detector usado para monitorizar a fluorescência PKH26, verificar se todas as células PKH26 pos aparecem na escala como um único pico simétrico na 3 ª década rd -4, com poucas células em / no último canal. Se houver múltiplos picos ou forma do pico é enviesada, repetir o passo 1, com especial atenção para o sal de minimização e técnica de mistura (Figura 2). Se necessário, ajustar a concentração de corante.
- Usando as configurações estabelecidas no Passo 3.3, adquirir dados para Tubo 3, coletando FSC, SSC e sinais em todas as quatro detectores de fluorescência. Para o detector usado para monitorizar a fluorescência 7-AAD, verificar que as células-7-AAD pos cair acima do limite de 2% estabelecido no Passo 3.3 (ou seja, que as células não viáveis são bem resolvidosa partir de células viáveis 7-AAD neg).
- Usando as configurações estabelecidas no Passo 3.3, adquirir dados para Tubo 4, coletando FSC, SSC e sinais em todas as quatro detectores de fluorescência. Verificar se as células CD8 pos são bem resolvido a partir de células não coradas (isto é, acima do limite de queda de 2% estabelecido no passo 3.3 para o detector de FITC). Repetir com o tubo 5 e verificar que as células CD8 pos são bem resolvido a partir de células não coradas (ie queda acima do limite de 2% estabelecido no passo 3.3 para o detector APC).
- Configurações usando estabelecidas no Passo 3.3, adquirir dados para Tubos 6, 7 e 8, a coleta FSC, SSC e sinais em todos os quatro detectores de fluorescência.
- Use os arquivos de lista de modo coletados para Tubos 1-5 e seu software de compensação de cor para estabelecer uma cor sobrepõem matriz para cada fluorocromo nos detectores sendo usados para monitorar os três fluorocromos outros. Aplicar esta matriz para o arquivo modo de lista por Amostra 6 e verificar que a presença de PKH26 laboratórioEling não altera a capacidade de detectar 7-AAD células pos.
- Aplicar a cor sobrepõem matriz do Passo 3.8 para o modo de lista de arquivo para a amostra 7 e verificar se: a) três subpopulações bem resolvidos (CD3 CD4 neg neg pos, CD3 CD4 neg pos e CD3 CD4 pos) podem ser identificados com um FITC versus APC gráfico de pontos, e b) a presença de anti-CD3-FITC e anti-CD4-APC não altera a capacidade de detectar a 7-AAD células pos. Se a presença de anti-CD3-FITC altera o limite superior de 2% para os dados recolhidos no detector de PKH26, reajustar o limite, conforme necessário.
- Aplique a cor matriz sobreposição de Passo 3,8 para o arquivo modo de lista para a amostra 8. Se a presença de PKH26 rotulagem altera o limite de 2% para a FITC, 7-AAD ou detectores APC dos estabelecidos utilizando o controlo autofluorescência na etapa 3.3, reajustar o limite (s), se necessário utilizando tubo 7 da Tabela 1, e verificar se ele ainda é possível distinguish CD3 CD4 pos pos, pos CD3 CD4 neg, e CD3 CD4 células neg neg usando o limite ajustado (s).
4. Seleção proliferação Modelo de Monitoramento Divisão celular por diluição de corante
- Determinar o espaçamento entre as gerações, que é dependente do número de canais e décadas logarítmicas no citómetro. Para instrumentos digitais, esse valor, tipicamente de 4 ou 5 décadas, é determinada pelo número de recipientes em que o processador de sinal digital. Em instrumentos analógicos, onde o número de décadas raramente é um número inteiro, modelagem precisa requer o número preciso de décadas de ser experimentalmente determinados. Para fazer isto, os dados a partir de uma mistura de grânulos calibrados fluorescentes com fabricantes-atribuídos intensidades relativas são obtidas nas mesmas configurações de detectores de alta tensão usados na experiência. A posição dos picos do grânulo permite a calibração da escala logarítmica em termos de intfaixa ensity por década log. Especificamente, isto é feito através da representação gráfica do número de canal para cada tipo de grânulo contra o log do fabricante valor atribuído. A inclinação de uma linha de melhor ajuste linear para os valores de dados do grânulo dá o número de unidades de intensidade relativa por canal. Multiplicado pelo número de canais, tal valor será então o número de log de décadas para a escala total, a partir do qual o número de canais que correspondem a uma diminuição de duas vezes na intensidade (isto é, o espaçamento entre a geração filha) pode ser calculado 14.
- Decidir se deseja usar um espaçamento fixo entre as gerações ou para permitir o espaçamento entre a flutuar. Uma configuração (fixo) Standard usará o valor do espaçamento geracional determinado no passo 4.5 a atribuir a localização de cada geração, e é geralmente usado quando o histograma não tem picos distintos. A configuração permite que cada posição do flutuador pico de gerações a ser determinada pela forma do histograma e é normalmente utilizado quando distinguishablpicos de e geracionais são evidentes.
- Decida se usar uma largura de pico fixo para todas as gerações ou uma largura flutuante. A largura fixa utiliza o SD calculada para a amostra de controlo não estimulado para modelar todas as gerações e é tipicamente escolhida quando a amostra não tem picos distinguíveis gerações. A largura flutuante permite que o programa de forma independente variar a DP para cada geração e é melhor usado com picos distintos de gerações.
- Executar um programa que contém um módulo de análise de proliferação (aqui ModFit versão LT 3.3). Carregar o ficheiro estimulada PKH26 pos do conjunto de dados a ser analisada (por exemplo, uma cultura estimulada hr 96 de PKH26 células pos contracorados como para tubo 8 na Tabela 1).
- Seleccionar os parâmetros para análise, neste caso, PKH26 (585/42) fechada sobre viável (7-AAD neg) linfócitos CD3 pos e FSC vs SSC a excluir detritos pequenos e grandes agregados (Figura 3). Na definiçãoestas regiões o cuidado de incluir a área de dispersão de alta frente, onde explosões são normalmente encontrados e note que CD3 expressão pode ser modulada para baixo em culturas estimuladas.
- Criar um modelo de proliferação nova usando o Assistente Proliferação. Usando o arquivo de dados aberto (guia Iniciar), carregar o arquivo de controle não estimulado PKH26 pos e definir a localização do canal de pico na distribuição dos pais corresponde a células não divididas.
- Analisar o arquivo para o controle não estimulado pos PKH26, observando os valores de posição de pico dos pais e largura (desvio padrão). Se uma largura de pico fixo (SD) é desejado, verifique Bloqueio SD.
- Carregar o PKH26 neg controle (por exemplo, uma cultura de 96 horas de células PKH26 neg contracorados como para tubo 7 na Tabela 1). Ajuste o número de gerações, definindo o canal de pico para a geração de mais obtuso acima do neg PKH26 controle. Isso determina a number de gerações filha da modelo com precisão se encaixam e é tipicamente 6-9 gerações.
- Abra o ficheiro de dados para a amostra estimulada (por exemplo, uma cultura estimulada hr 96 de PKH26 células pos contracorados como para tubo 8 na Tabela 1) e confirmam que as regiões para a posição de pico parental e o SD como definido no Passo 4,7 permanecem inalteradas. Se o espaçamento fixo de gerações é desejada, selecione a opção do modelo padrão, caso contrário, selecione a opção flutuante.
- Analisar cada ficheiro experimental no conjunto de dados, utilizando o mesmo modelo definido no passo 4.9. Pequenos ajustes para a posição de pico parental pode ser necessário para o ajuste melhor, tal como definido no plano visual e pelo reduzido valor de qui-quadrado (RCS).
- Gravar as métricas de proliferação desejadas resultantes do melhor ajuste para cada arquivo experimental no conjunto de dados. Para uma descrição abrangente de métricas possíveis ver ref. 22.
Resultados
Corantes de membrana como PKH26 mancha por quase instantânea particionamento em membranas celulares em vez de, por reacção química (por CFSE) ou ligação de equilíbrio (por anticorpos). Falta de atenção para os problemas críticos descritos na Figura 1 pode resultar numa coloração escura ou heterogéneo do tipo mostrado na Figura 2. Em contraste, a utilização de condições de rotulagem optimizado (Figura 1, Tabela 2) resulta em brilhantes distribuições homogéneos adequados para uma variedade de aplicações de localização de células, incluindo células de controlo com base na divisão de diluição do corante (Figura 3). Células mortas / morrendo perder diferentes quantidades de corante de rastreamento, que podem ampliar e / ou intensidades de geração de distorcer filha e complicar a modelagem proliferação base em corante diluição 3,4,16,18. O uso de um corante de viabilidade é, portanto, recomendado para a recolha de dados de diluição de corante em condições em que um número significativo de células mortas podem ser preenviado, como culturas estimuladas (Figura 3) ou amostras mais velhas (Figura 4).
Porque rastreamento rotulagem corante normalmente dá as intensidades de fluorescência de várias ordens de magnitude maior do que a imunofenotipagem, é importante incluir controlos de compensação adequadas (Tabela 1), e para verificar que a presença de rastreamento corante não prejudicar a capacidade de resolver as células de anticorpos positivos e negativos (Figura 4). Para evitar a necessidade de compensação de cor excessiva, é preferível colocar um fluorocromo brilhante, ou um não encontrado em células de interesse, tal como um corante de exclusão por células vivas, no canal espectral (s) adjacente para o corante de rastreio (Figura 4A e B vs. 4C & D). Ao usar o software de modelagem de pico para quantificar extensão da proliferação, a obtenção de um bom ajuste exige pressupostos correspondentes dentro do modelo para as características do prof diluição de coranteiles sendo analisado (Figura 5 e Tabela 3). Com a selecção apropriada de corantes de rastreamento e de reagentes de viabilidade, também é possível caracterizar as respostas proliferativas em múltiplas sub-populações de linfócitos em simultâneo. Por exemplo, conforme ilustrado na Figura 6, a adição de um corante de rastreio segundo simplifica a discriminação entre as células T reguladoras (marcadas com Claret CellVue) e altamente proliferadas células efectoras T (identificado com CFSE) e proporciona muito mais detalhes sobre as suas interacções do que poderia ser obtido utilizando 3 H-timidina rotulagem 18,27.
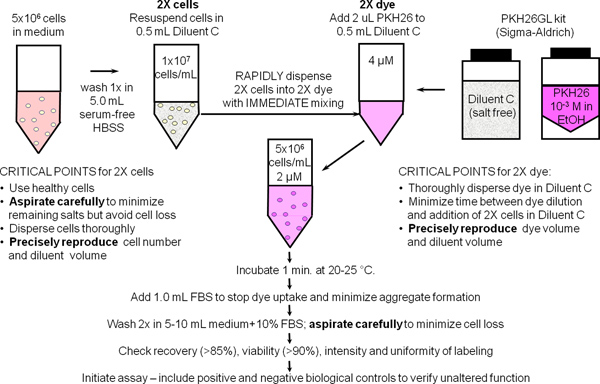
Figura 1. Protocolo de rotulagem geral de membrana para PKH26, PKH67 e corantes CellVue. Particionamento desses corantes altamente lipofílicas para membra celularnes ocorre essencialmente instantaneamente após mistura com as células de coloração quando é levada a cabo em que o veículo C isenta de sal diluente fornecido para maximizar a solubilidade do corante e da eficiência de coloração. Tal como resumido no esquema para esta rotulagem membrana geral com PKH26, coloração brilhante e uniforme e reprodutível é, portanto, mais facilmente obtidos por: 1) minimizando a quantidade de proteína e / ou de sais presentes no passo de coloração e 2) usando uma técnica de mistura que assegura dispersão homogénea de células em rápida do corante (isto é, todas as células simultaneamente expõe a mesma concentração de corante).
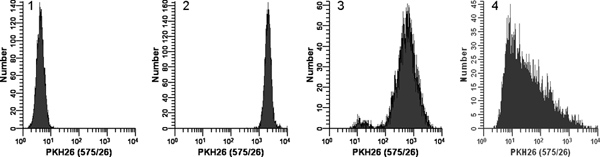
Figura 2. Efeito da coloração condições em PKH26 distribuições de fluorescência (reimpresso de Ref. 18). Replicar amostras de logaritmicamente crescente U, cultos937 células foram coradas com PKH26 (concentrações finais: 1 x 10 7 células / ml, 12-15 uM PKH26) durante 3 min, à temperatura ambiente, com ou sem mistura de imediato após a adição de células de 2 x a 2x corante. Após a lavagem, as células coradas foram analisadas num citómetro de fluxo Beckman Coulter ciano utilizando definições constantes instrumento Histograma 1:. Controlo não coradas com PKH26 tensão detector ajustado para colocar todas as células em escala na primeira década com poucas células / não acumular no primeiro canal. Histograma 2: coloração em 15 mM corante utilizando adição de células 2x para 2x corante com mistura imediato resultou em um manchado, brilhante de forma homogênea, a população simétrica de células colocadas na quarta década, com poucas / ausência de células que se acumulam no último canal (gMFI = . 2548, GCV = 26,2%) Histograma 3: A coloração a 15 uM de corante utilizando a adição de células de 2 x a 2x, mas sem corante misturando imediato resultou em uma intensidade reduzida e um CV amplo (gMFI = 505 , GCV = 116%), bem como uma subpopulação fracamente coradas, possivelmente devido a uma gota de células distribuídas na parede do tubo, em vez de na solução corante 2x Histograma 4:. Um erro de coloração conduziu a 3 ul de corante concentrada etanólica estoque a ser adicionado directamente a 2x células em C Diluente sem mais mistura em vez de ser utilizado para preparar uma solução de corante de 2x em Diluente C. Isto resultou numa concentração final de corante de 12 uM, mas deram coloração extremamente escura e heterogénea (gMFI = 32,9, GCV = 1020%). A inclinação para a direita observada reflecte provavelmente os efeitos combinados de: i) misturar pobres devido à célula amplamente díspar e volumes de corante, e ii) o facto de que as células mais próximas do ponto de distribuição de corante estaria exposta a uma maior concentração de corante do que os mais distância. Clique aqui para ver maior figura .
re 3 "src =" / files/ftp_upload/4287/4287fig3.jpg "fo: conteúdo largura =" 4.5in "fo: src =" files/ftp_upload/4287/4287fig3highres.jpg / "/>
Figura 3. O uso de uma sonda de viabilidade simplifica gating de perfis de proliferação de células T foram marcadas com hPBMC PKH26 (concentração final de células: 3x10 7 / ml; concentração final de corante: 10 | iM).. Após cultura durante 96 horas na presença (estimulado) ou ausência (não estimulada) de anti-CD3 e IL-2, as células foram contrastadas com anti-CD3-FITC, anti-CD19-APC e 7-AAD, e foram analisadas num FACSCalibur citômetro de fluxo (ver referência 13 para detalhes). Compensação de cor foi realizada no momento da aquisição dos dados utilizando circuito de compensação de fio. A extensão da proliferação foi modelada como descrito no Passo 4, utilizando o Assistente Proliferação em ModFit LT3.3. Os dados do PKH26 neg controlo (Tabela 1, Tubo 7) são sobrepostas para referência (cinzento histogramas cheias na coluna 3). Viabilidades para não estimulada e stimulado culturas foram de 76% e 62% (dados ungated para os painéis A e B, respectivamente). Painel A. PKH26 células coradas cultivadas durante 96 horas em meio foram gated para incluir viáveis (7-AAD neg) células CD3 pos (R1). Para além da inclusão de anticorpos e 7-AAD portão exclusão morto célula, uma dispersão frontal (FSC) versus dispersão lateral (SSC) porta (R2) foi utilizada para excluir detritos e agregados. Note a ausência de células mortas no último lote deste painel. O melhor modelo de ajuste para o perfil de proliferação PKH26 (coluna 3) deu um único pico com RCS simetria = 2,1 (Dador 6, Tabela 3), indicando boa, e foi utilizado para definir a posição de partida parental e largura de pico, para análise da estimulado amostra a partir deste conjunto de dados (Painel B). Painel B. Uma alíquota de repetição de PKH26 células coradas foi cultivada com anti-CD3 e IL-2 durante 96 horas e fechado do mesmo modo como no Painel A. Um modelo com posição do pico flutuante e largura de pico flutuante deu o melhor ajuste para os dados com RCS = 1,3 (Dador 6, Tabela 3). Painel C. O ficheiro de dados idêntico ao descrito no painel A foi analisado sem o uso de 7-AAD dados. Quando um primário FSC vs SSC foi usado para parcialmente excluir células mortas e agregados (R2) e um portão secundário para seleccionar eventos positivos CD3 (R3), uma pequena população remanescente de células mortas permaneceram (0,2% de eventos fechados). O melhor modelo de ajuste deu um único pico com RCS = 2,2. Painel D. O ficheiro de dados idêntico ao descrito no painel B foi fechado como no Painel C. Note-se a maior população residual de células mortas na amostra estimulada (1,29% de eventos gated) para esta estratégia de aquisição electrónica. O melhor modelo de ajuste era um com posição de pico flutuante e largura do pico flutuante (RCS = 1,3). Clique aqui para ver maior figura .
ig4.jpg "fo: conteúdo largura =" 5in "fo: src =" files/ftp_upload/4287/4287fig4highres.jpg / "/>
Figura 4. Efeito da escolha fluorocromo e concentração de corante sobre a capacidade de os linfócitos marcados com imunofenótipo PKH26. HPBMC foram isolados a partir de 24 hr-sangue velho e marcado com PKH26, tal como descrito no Passo 1, com a excepção de que a coloração foi realizada em 12 x 75 mm de fundo redondo tubos de poliestireno, em vez de 12 x 75 mm tubos de polipropileno cónicos. Imediatamente após marcação com PKH26, as células foram contrastadas com os reagentes indicados imunofenotípicos e viabilidade, e analisados num citómetro de fluxo usando a estratégia LSRFortessa gating da Figura 3A e a seguinte configuração óptica: 488 nm do laser: FSC-A (488 nm); SSC -A (488/10 BP), FITC-A (530/30 BP); PKH26-A (575/26 BP), 7-AAD-A ou PerCP-A (695/40 BP). 640 nm do laser: APC-A ou Topro-3-A (670/14 BP). Compensação de cor foi realizada no momento da aquisição de dados usando software BD diva. "Auto"indica autofluorescência de controlo sem anticorpo, na janela espectral relevante (APC para os painéis A e B, PerCP para painéis C e D). Os dados do PKH26 neg controlo (Tabela 1, Tubo 7) são sobrepostas para referência (cinzento histogramas cheios, coluna 5). Pós-coloração viabilidades foram semelhantes para todas as amostras (88-92%). Células marcadas com o painel A. PKH26 a uma concentração final de 2 mM foram contrastadas com anti-CD3-FITC, anti-CD4-APC, e 7-AAD ( tubo 8 do quadro 3). Após gating em viáveis (7-AAD neg) linfócitos CD3 pos (coluna 1) e de exclusão de detritos e de agregados com base em FSC e SSC (ver Figura 3A), PKH26 intensidade foi avaliado em combinação com CD4 APC (colunas 2 e 3). Se não compensada (coluna 2) ou compensada (Coluna 3), esta combinação fluorocromo resultou em boa resolução entre as células CD4 pos T e as células T CD4 + neg T), como verificado por ambos um no-antibody, controle autofluorescente (tubo 6 da Tabela 1; Coluna 4), e a trama de duas cores de CD3 vs. CD4 (coluna 6). Painel B. Usando a mesma combinação de fluorocromo como no Painel A, mas aumentando a concentração final de 4 PKH26 uM não afectou adversamente a capacidade de resolver CD4 células T pos de células CD4 T neg. Painel C. A alíquota de células replicam independentemente marcados com PKH26 a uma concentração final de 2 mM foi contrastado com anti-CD3-FITC, anti-CD4-PerCP e Topro-3. Após gating em viáveis (Topro-3 neg) linfócitos CD3 pos (coluna 1) e de exclusão de detritos e de agregados com base em FSC e SSC (ver Figura 3A), PKH26 intensidade foi avaliado em combinação com anti-CD4-PerCP (colunas 2 e 3). Substanciais sobreposição espectral de PKH26 no canal PerCP fica evidente nos dados descompensados (coluna 2), e entre a resolução PKH26 CD4 pos pos e CD4 PKH26 pos neg eventos é marginal após a compensação é aplicada (comparar coluna 3 com o não-anticorpo de controlo, autofluorescente indicada na coluna 4). Painel D. Quando PKH26 concentração é aumentada para 4 mm, já não é possível para usar a combinação de fluorocromo de sobreposição do painel de PKH26 C. espectrais para o canal PerCP exceda a intensidade do sinal de CD4 (coluna 2) e CD4 pos PKH26 eventos pos já não pode ser resolvido a partir de células CD4 neg pos PKH26 T (Coluna 3 vs. Coluna 4). Clique aqui para ver maior figura .
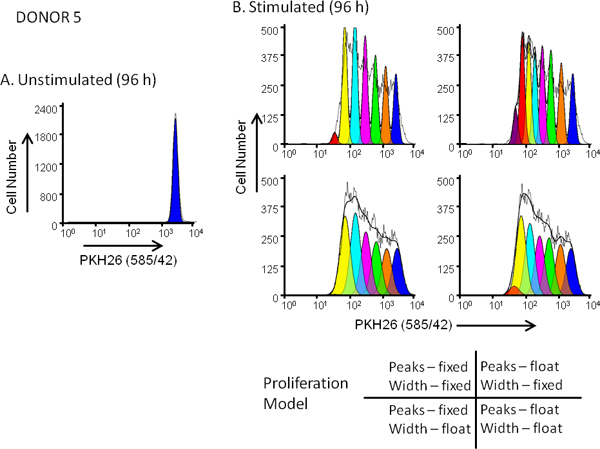
Figura 5. Efeito da selecção do modelo em proliferação. ajuste dos perfis de diluição de corante hPBMC foram marcadas com PKH26 (concentração final de células: 3x10 7 / ml; concentração final de corante: 10 | iM). Após cultura durante 96 horas na presença (estimulado) ou ausência (não estimulada) de anti-CD3 e IL-2, as células foram colhidas contrastadas com anti-CD3-FITC, anti-CD19-APC e 7-AAD e analisadas num FACSCalibur citômetro de fluxo (ver referência 13 para métodos detalhados). Compensação de cor foi realizada no momento da aquisição dos dados usando os circuitos de compensação hardwired. Painel A. O perfil de intensidade PKH26 de uma cultura não estimulada hr 96 para Dador 5, uma resposta moderada, foi fechado como mostrado na Figura 3A e utilizado para fornecer a Proliferação ModFit assistente com uma primeira estimativa da posição e largura para o pico representando indivisas células parentais. Painel B. PKH26 O perfil de intensidade a partir de um paralelo estimulado 96 hr cultura foram analisados utilizando as estimativas a partir dePainel A e 4 diferentes combinações de "proliferação Assistente ', correspondentes a definições fixas ou flutuantes intensidades de pico, e fixas ou flutuantes larguras de pico para as gerações sucessivas filha como mostrado. Tal como resumido na Tabela 3, o modelo que lhe deu o melhor ajuste aos dados observados (menor redução do qui-quadrado; RCS) foi o "flutuante / flutuante" combinação em que não só as posições de pico, mas também os desvios-padrão de picos de geração filha foram autorizados para variar (RCS = 1,5). O mesmo modelo de melhor ajuste para Dador 6, uma resposta elevada (Figura 3B e Quadro 3).
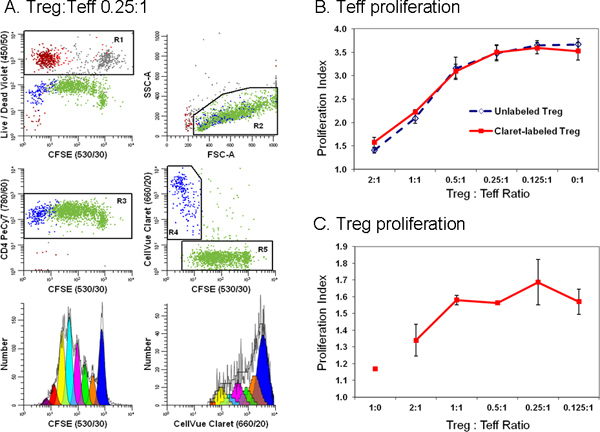
Figura 6. A adição de um segundo corante célula rastreamento simplifica a discriminação entre efectoras e células T reguladoras, num ensaio de citometria de fluxo de supressão(Adaptado de Ref. 18.) Linfócitos Monócitos-depletados preparados a partir de filtros leucaféreses Trima foram coradas com anticorpo anti-CD127-PE, anti-CD4-PE-Cy7, e anti-CD25-APC e fluxo classificadas em populações de efector (Tef.; CD4 pos CD127 brilhante CD25 dim), reguladora (Treg; CD4 pos CD127 CD25 fraca pos) e acessório (CD4 neg) células. Classificados células Treg marcadas com Claret CellVue (concentração final de células: 1x10 6 / ml; concentração final de corante: 1 uM), e Tef ordenadas marcado com CFSE (concentração celular final: 5 x 10 7 / ml, a concentração de corante final, 5 uM) foram co-cultivados em várias proporções, na presença de células acessórias anti-CD3, anti-CD28 e irradiado. Após 96 h, as culturas foram colhidas, contrastado com anti-CD4-PE-Cy7 e Live / Dead Violeta fixável, e analisadas em um citômetro de fluxo LSRII e compensação de cor foi realizada no tempo dos dados AQUISIÇÃOn usando BD DiVa software (ver referência 18 para detalhes, incluindo controles de compensação). Os Índices de proliferação de Tef e Treg foram modeladas como descrito no Passo 4, utilizando o Assistente Proliferação em ModFit LT3.3. Os pontos de dados em painéis B e C representam a média ± 1 desvio padrão de amostras em triplicado dados representativos do painel A. são mostrados para uma das três amostras em triplicado a uma Treg:. Teff proporção de 0,25:1. Reagente Violeta VIVO / MORTO fixável foi usada para excluir as células mortas (R1, lote superior esquerdo; células acessórias = vermelho-marrom, inviável Teff = cinza e inviável Treg = vermelho) de todas as parcelas outros dados. Coloração Claret CellVue foi utilizada para distinguir Treg viável (R4, centro gráfico da direita, azul) de viável, mas altamente proliferaram Teff (R5, centro da parcela direita; verde). Um único parâmetro perfil proliferação CFSE por Teff (gráfico da esquerda inferior) foi gerado por gating em células que eram CFSE pos (R5), CD4 pos (R3), viáveis (não R1), e teve de linfócitos scpropriedades Atter (R2). Um único parâmetro CellVue perfil proliferação Claret para Treg foi gerado por gating em células que eram Claret CellVue pos (R4), CD4 pos (R3), viáveis (não R1), e tinha propriedades de dispersão de linfócitos (R2). Note-se a região de linfócitos generoso (R2) definida de modo a incluir de blastos de linfócitos. Note-se também que o número total de células a serem recolhidos depende da população menor frequência de interesse. Numa experiência de proliferação de células, onde a população de interesse podem ser distribuídas sobre uma ampla gama de intensidades representativas de até sete ou oito gerações de um grande número de células devem ser recolhidas a fim de modelar com precisão e calcular o número de células em cada geração. Quando o estudo de células raras, pode ser necessário executar simplesmente o tubo de amostra quase seco, a fim de recolher o maior número possível de eventos. Para o exemplo mostrado aqui, fazendo isso resultou num total de ~ 25.000 eventos, dos quais 11,923 eram Teff (I Proliferaçãondex 3,85) e 1380 foram Treg (Proliferação Índice 1,83). Painel B. Como esperado, o aumento da proporção de presente Tregs em co-culturas levou a uma maior supressão da proliferação de células de Tef. Resultados semelhantes foram obtidos com ambas as CellVue Claret-coradas (linha contínua), ou Treg (linha a tracejado) não corado, indicando que a coloração com o corante Claret CellVue seguimento não influenciou Treg potência. Painel C. Treg são relativamente anérgica e, como esperado, fez não proliferam quando incubadas com anti-CD3, anti-CD28, e as células acessórias na ausência de células teff (Treg: Teff proporção de 1:0). No entanto, como a proporção da presente Teff em co-culturas aumentou (isto é, como o Treg: razão Teff diminuída), a extensão da proliferação Treg também aumentou. As barras de erro maiores em geral para estes dados, pelo menos em parte, reflectir o grau de proliferação limitada, conduzindo a um menor número de eventos recolhidos relativos às Teff e maior incertoty em modelar o número de células em cada geração. Clique aqui para ver maior figura .
| Tubo n º (Objecto) | PKH26 | Anticorpo (s) | 7-AAD |
| 1 (remuneração de instalação,) | - | - | - |
| 2 (compensação de instalação,) | + | - | - |
| 3 (compensação de instalação,) | - | - | + |
| 4 (compensação) | - | CD8-FITC b | - |
| 5 (compensação) | - | CD8-APC b | - |
| 6 (nenhum controle Ab) | + | - | + |
| 7 (sem acompanhamento con corantecontrole) | - | CD3-FITC CD4-APC ou APC-CD19 c | + |
| 8 (T0 controle) | + | CD3-FITC CD4-APC ou APC-CD19 c | + |
. Tabela 1 Configuração do aparelho Controla a um controles listados são apropriados para um T CD4 4 cores célula de ensaio de controlo de proliferação utilizando:. PKH26 (proliferação de corante), CD3-FITC (marcador pan-T cell), CD4-APC (T-helper marcador de células), a 7-aminoactinomycin D (7-AAD, morto exclusão de células) b substitutos mais brilhante para CD3-FITC e CD4-APC (melhor capacidade para detectar erros de compensação) c Figura 3:.. CD3-FITC e CD19-APC. A Figura 4 d: CD3-FITC e CD4-APC.
| Tipo de célula | A concentração final de células | A concentração de corante final </ Strong> | Referência |
| b hPBMC | 1 x 10 7 / ml | 2 uM PKH67 | 10,17 |
| 5 x 10 6 ml / | 2 uM PKH26 | 12 | |
| 3 x 10 7 / ml | 10 uM PKH26 | 13 | |
| 5 x 10 7 / ml | 30 uM PKH26 | 18 | |
| 1 x 10 6 / ml | 1 Claret CellVue mM c | 18 | |
| 3 x 10 7 / ml | 4 Claret CellVue mM | 13 | |
| 5 x 10 7 / ml | 5 Claret CellVue mM | 18 | |
| As células em cultura | 5 x 10 5 ml / | 0,1 uM PKH26 (1 ° células mamárias) | 8 |
| 1 x 10 7 / ml | 15 uM PKH26 (U937) | 18 | |
| 1 x 10 7 / ml | 12,5 mM -15 PKH26 (U937) | 15 | |
| 1 x 10 7 / ml | 1 uM PKH67 (K562) | 18 | |
| 1 x 10 7 / ml | 1 uM PKH67 (linhas de células T) | 9 | |
| 1 x 10 7 / ml | 10 Claret CellVue uM (YAC-1) | 23 |
Tabela 2. Não produzam nenhuma interferência Condições Membrana Dye-Coloração uma. Uma. Adaptado e atualizado de Ref 18. B Uma lavagem a baixa velocidade (300 xg) foi utilizada para minimizar a contaminação das plaquetas. Células Treg (c fluxo classificados CD4 CD25 pos pos neg linfócitos CD127).
| Configurações de modelo | Resultados do Modelo | ||||||||
| Doador | Tratamento | Posição de pico | SD | Posição dos pais | SD Parental | N º de Picos Equipado | RCS | PI | PF |
| 5 | Unstimulated | Flutuar | Flutuar | 209 | 4,5 | 1 | 5,1 | 1,0 | 0 |
| 5 | Estimulados | Corrigido | Corrigido | 209 | 4,5 | 7 | 35 | 3,9 | 31 |
| 5 | Estimulados | Flutuar | Corrigido | 209 | 4,5 | 8 | 19 | 4,3 | 30 |
| 5 | Estimulados | Corrigido | Flutuar | 209 | 9,2 | 6 | 1,9 | 3,8 | 30 |
| 5 | Estimulados | Flutuar | Flutuar | 209 | 9 | 7 | 1,5 | 3,7 | 29 |
| 6 | Unstimulated | Flutuar | Flutuar | 205 | 4,0 | 1 | 2,1 | 1,0 | 0 |
| 6 | Estimulados | Corrigido | Corrigido | 205 | 4,0 | 6 | 42 | 6,6 | 60 |
| 6 | Estimulados | Flutuar | Corrigido | 205 | 4,0 | 7 | 12 | 7,4 | 60 |
| 6 | Estimulados | Corrigido | Flutuar | 205 | 8,6 | 6 | 6,9 | 6,8 | 62 |
| 6 | Estimulados | Flutuar | Flutuar | 205 | 6,5 | 6 | 1,3 | 6,5 | 59 |
Tabela 3. Impacto do Modelo Proliferação de bondade de ajuste (RCS) e Métricas proliferação. Uma coloração da amostra, coleta de dados e de propagação, como descrito na Figura 3A & B.
Discussão
Os métodos descritos aqui são aqueles encontrados em nossos laboratórios combinados a mais confiável dar ótimos resultados para a rotulagem hPBMC usando corantes membrana 13,16,18 e para fenotipagem subconjunto de linfócitos e proliferação de rastreamento usando membrana ou corantes proteína 2,11,13,16, 18. Como ilustrado nas Figuras 1 e 2, a rotulagem uniforme brilhante é mais prontamente conseguido através da limitação da presença de sais fisiológicos e usando uma técnica de mistura que resulta na exposição rápida e homogénea de todas as células para a mesma concentração de corante. Por causa da coloração com corantes de membrana ocorre por divisão na bicamada lipídica, outras variáveis que alteram a concentração de corante livre pode também ter impacto eficiência de marcação. Por exemplo, na etiquetagem de fundo redondo tubos de poliestireno resultados na lavagem menos eficiente de sais antes da ressuspensão em C Diluente e também da concentração de corante livre reduzida devido a tingir adsorção nas paredes do tubo, particularmentenas menores concentrações de corante. Ambos os factores tendem a dar mais amplas distribuições de coloração do que quando se faz a rotulagem utilizando tubos de polipropileno de fundo cónico (Figuras 3, 4 e resultados não publicados). Idade da amostra e tipo também pode afetar largura do pico, mesmo quando procedimentos de coloração otimizado são usados. Por exemplo, para os CV PKH26 pos linfócitos isolados a partir de sangue recentemente extraído gama 14-20% (Figura 3, Ref. 13 e resultados não publicados), enquanto que para os CV linfócitos isolados a partir de amostras de sangue 24 h de idade ou TRIMA pheresis gama filtros 25-30 % (Figura 4 e Ref. 18).
Coloração uniformidade e a extensão em que as células não viáveis podem ser excluídos da análise tanto afetar se picos filhas diferenciáveis são evidentes no perfil de diluição de corante, que por sua vez afecta a escolha de um modelo de proliferação para ajustar os dados observados (Figuras 5 e 6 ). Embora ModFit (Verity Software House, Topsham, ME) é usado aqui como um exemplo de software usado para gerar métricas como índice de proliferação e Freqüência Precursor (Figuras 3, 5 e 6, Tabela 3), outros pacotes de software também contém os módulos para analisar dados de proliferação. Estes incluem FCSExpress (De Novo Software, Los Angeles, CA) e FlowJo (Tree Star, Inc., Ashland, OR). Todos esses programas usar um pelo não-linear análise quadrados para iterativamente encontrar o melhor ajuste para os dados brutos, alterando a posição, altura e SD (ou largura) de picos gaussianos representando gerações filha seqüenciais. Índice proliferativa (PI) e Freqüência Precursor (PF) são as medidas mais usadas de extensão da proliferação. PI, tal como definido pela ModFit, é uma medida do aumento no número de células durante o curso do ensaio, análogo ao "índice de estimulação" de um ensaio de incorporação de timidina. PF retorna a fracção de células na populat inicialíon que responderam ao estímulo de proliferação. Aconselha-se precaução, no entanto, ao ler a literatura desde a terminologia varia um pouco entre os pacotes de software (por exemplo, FlowJo e ModFit usam diferentes definições e cálculos para o que se entende por "proliferação do Índice") 22.
As questões críticas discutidas aqui para rotulagem e análise de proliferação de membrana com corantes também são encontradas ao utilizar corantes proteína. Por exemplo, uma atenção cuidadosa à técnica de mistura devem também ser observado, junto com a exclusão de células mortas / a morrer, a fim de se obter distribuições uniformes e picos filhas diferenciáveis pelo uso CFSE (Figura 6) 2-4,13,18,24. Escolha adequada de fluorocromos para fenotipagem e avaliação de viabilidade também é importante para evitar o excesso de sobreposição espectral e incapacidade de reconhecer as células de anticorpos positivos, principalmente com corantes emissores visíveis de proteína, como CFSE 2-4,11,13,16,18 . Reduzir a concentração de corante de rastreamento diminui os problemas de compensação, em canais adjacentes espectrais, mas também limita o número de divisões celulares, que podem ser monitorizados antes de intensidades de células filhas começam a sobrepor-se com autofluorescência. Em alternativa, a utilização de corantes de rastreamento de células novas, tais como o vermelho longínquo Claret emissor CellVue (Sigma-Aldrich, St. Louis, MO) ou emissor de violeta CellTrace Violet (Life Technologies, Grand Island, NY) pode reduzir os problemas de compensação (Figura 6). Finalmente, apesar de os corantes de membrana em geral, tendem a apresentar menor toxicidade 11,26, é possível ao longo do rótulo células com uma ou outra classe de corante. Por conseguinte, é sempre necessário verificar que a concentração de corante de rastreio utilizado não alterou a funcionalidade das células a serem rastreadas (Figura 6) 3,13,16,18.
Divulgações
K. Humphrey, JD Tario, Jr. e PK Wallace recebeu reagentes pré-comerciais de células de monitoramento para avaliação da Life Technologies, Inc. e Biociências BD. AD Bantly e JS Moore receberam pré-comercial de células de rastreamento reagentes para avaliação da Life Technologies, Inc. e financiamento do PTI Research, Inc. para a pré-comercial caracterização de células CellVue vários rastreamento corantes. K. Muirhead é empregado por SciGro, Inc., que fornece serviços de consultoria para Phanos Technologies, Inc. (proprietário da PKH e corantes CellVue) e oferece suporte técnico de backup para Inc., Sigma-Aldrich e Molecular tecnologias de direcionamento (distribuidores desses corantes).
Produção e livre acesso a este artigo é patrocinado pela Sigma-Aldrich.
Agradecimentos
Os autores particularmente gostaria de agradecer às seguintes pessoas por suas contribuições técnicas e intelectuais para o desenvolvimento desses métodos através dos anos: Bruce Bagwell (Verity Software House), Nadège Bercovici (IDM), Lizanne Breslin (Zynaxis Cell Science e PTI Pesquisa) , Brian Gray (PTI Research), Jan Fisher (Dartmouth Medical School), Alice Givan (Dartmouth Medical School), Betsy Ohlsson-Wilhelm (SciGro, Inc.), e Maria Waugh (Dartmouth Medical School). Eles também gostaria de agradecer a classe Bowdoin de 2006 dos Cursos Anuais em Métodos de Investigação e Aplicações da citometria de fluxo, o que gerou os dados mostrados na Figura 2.
Citometria de fluxo foi realizada em Citometria de Roswell Park Cancer Institute de Fluxo de Laboratório, que foi criada em parte por doações de equipamentos do Programa de Instrumento NIH Compartilhada, e recebe o apoio do Núcleo Grant (5 P30 CA016056-29) do NacionalInstituto do Câncer do Roswell Park Cancer Institute, e no Citometria de Fluxo Abramson Cancer Center e Laboratório Célula de Recursos Classificação da Universidade da Pensilvânia, que foi criada em parte por doações de equipamentos do Programa de Instrumento NIH Compartilhada, e recebe o apoio do NIH # 2P30 CA016520 do Instituto Nacional do Câncer. O trabalho mostrado nas Figuras 3 e 5 também foi apoiado em parte pela concessão SBIR EB00228 do National Institutes of Biomedical Imaging e Bioengenharia (NIBIB) atribuído à PTI Research, Inc.
Materiais
| Name | Company | Catalog Number | Comments |
| Reagente ou equipamento | Companhia | Número de catálogo | Comentários |
| Comercialmente Comprada | |||
| 7-D Aminoactinomycin | Sigma-Aldrich | A9400 | |
| Albumina de soro bovino (BSA) | Sigma-Aldrich | A4503 | |
| De soro fetal bovino (FBS) | Atlanta Biologicals | S11150 | |
| Solução salina equilibrada de Hanks (HBSS) | Life Technologies | 14175-079 | Cálcio e magnésio livre, sem vermelho de fenol |
| IgG humana fracção Cohn II e III, as globulinas | Sigma-Aldrich | G-4386 | |
| De ratinho anti-humano CD3-FITC | BD Biosciences | 349201 | Concentração de saturação, conforme determinado por titulação de laboratório |
| De rato anti-CD4 humano-APC | BD Biosciences | 340672 | Concentração de saturação, conforme determinado por titulação de laboratório |
| De rato anti-CD4 humano-PECy7 | BD Biosciences | 348799 | Concentração de saturação, conforme determinado por titulação de laboratório |
| De ratinho anti-humano CD8-FITC | BD Biosciences | 347313 | Concentração de saturação, conforme determinado por titulação de laboratório |
| De ratinho anti-humano CD8-APC | Caltag (Life Technologies) | MHCD0805 | Concentração de saturação, conforme determinado por titulação de laboratório |
| De ratinho anti-humano CD19-APC | Caltag (Life Technologies) | MHCD1905 | concentração saturante, tal como determinado por titulação de laboratório |
| De ratinho anti-humano CD25-APC | BD Biosciences | 340938 | Concentração de saturação, conforme determinado por titulação de laboratório |
| De ratinho anti-humano CD127-PE | BD Biosciences | 557938 | Concentração de saturação, conforme determinado por titulação de laboratório |
| CD3 de ratinho anti-humano | eBiosciences | 16-0037-85 | 1,0 mg / ml; azida livre |
| CD28 de rato anti-humano | eBiosciences | 16-0289-85 | 1,0 mg / ml; azida livre |
| PBS | Gibco | 21300-058 | |
| PKH26 kit linker vermelho fluorescente de células que contém 10-3M PKH26 em EtOH e Diluente C | Sigma-Aldrich | PKH26GL-1KT ou MINI26-1KT | Procedimentos da Etapa 1 também se aplicama kits contendo PKH67 ou corantes CellVue outros |
| CellVue Claret vermelho longínquo kit linker fluorescente de células que contém 10-3M Claret CellVue em EtOH e C Diluente | Sigma-Aldrich | MINCLARET 1KT ou MIDCLARET-1KT | |
| 5 - (e-6)-diacetato de carboxifluoresceína, éster de succinimidilo (CFDA-SE) | Invitrogen (Life Technologies) | C34554 | Não fluorescente, clivados por esterases de membrana para formar amino-reactivo fluorescente carboxifluoresceína succinimidil éster (CFSE) |
| VIVO / MORTO Violeta fixável | Invitrogen (Life Technologies) | L34955 | |
| Estéril 12 x 75 mm cônico tubos de polipropileno e bonés | VWR | 60818-102 | Dá uma melhor eficiência membrana coloração corante (corante reduzido adsorção; menos perda de células durante a aspiração sobrenadante) |
| 12 x 75 mm rounfundo d tubos de poliestireno | Becton Dickinson | 21008-936 | |
| Citómetro | BD Bioscience | FACSCalibur LSRFortessa | Qualquer citómetro capaz de detectar FITC, PKH26, e 7-AAD (ex. 488 nm,. In nm 520, 567 nm, e 655 nm, respectivamente) e APC ex. 633-640 nm; eles. 660 nm) |
| Citómetro | Beckman Coulter | LSRII Ciano | Qualquer citómetro capaz de detectar FITC, PKH26, e 7-AAD (ex. 488 nm,. In nm 520, 567 nm, e 655 nm, respectivamente) e APC ex. 633-640 nm; eles. 660 nm) |
| Laboratório Preparado | |||
| 7-Aminoactinomycin D, estoque concentrado | NA | NA | 1 mg / ml em PBS. Congelar em alíquotas e armazenar a -20 ° C. |
| 7-Aminoactinomycin D, worrei estoque | NA | NA | 100 ug / ml em PBS; preparar diária de 1 estoque mg / ml congelado. |
| IgG bloco | NA | NA | HBSS + 10 mg / ml de IgG humana fracção Cohn II e III, as globulinas + 10 mg / ml de BSA. |
Referências
- Poon, R. Y., Ohlsson-Wilhelm, B. M., Bagwell, C. B., Muirhead, K. A., Diamond, R. A., DeMaggio, S. Use of PKH Membrane Intercalating Dyes to Monitor Cell Trafficking and Function. Living Color: Flow Cytometry and Cell Sorting Protocols. , 302-352 (2000).
- Wallace, P. K., Muirhead, K. A. Cell Tracking 2007: A Proliferation of Probes and Applications. Immunol. Invest. 36, 527-562 (2007).
- Hawkins, E. D., Hommel, M., Turner, M. L., Battye, F. L., Markham, J. F., Hodgkin, P. D. Measuring lymphocyte proliferation, survival and differentiation using CFSE time-series data. Nat. Protoc. 2, 2057-2067 (2007).
- Quah, B. J., Warren, H. S., Parish, C. R. Monitoring lymphocyte proliferation in vitro and in vivo with the intracellular fluorescent dye carboxyfluorescein diacetate succinimidyl ester. Nat. Protoc. 2, 2049-2056 (2007).
- Bolton, D. L., Minang, J. T., Trivett, M. T., Song, K., Tuscher, J. J., Li, Y., Piatak, M., O'Connor, D., Lifson, J. D., Roederer, M., Ohlen, C. Trafficking, Persistence, and Activation State of Adoptively Transferred Allogeneic and Autologous Simian Immunodeficiency Virus-Specific CD8+ T Cell Clones during Acute and Chronic Infection of Rhesus Macaques. J. Immunol. 184, 303-314 (2010).
- Juopperi, T. A., Sharkis, S. J. Isolation of Quiescent Murine Hematopoietic Stem Cells by Homing Properties. Meth. Mol. Biol. 430, 21-30 (2008).
- Kusumbe, A. P., Bapat, S. A. Cancer stem cells and aneuploid populations within developing tumors are the major determinants of tumor dormancy. Cancer Res. 69, 9245-9253 (2009).
- Pece, S., Tosonim, D., Confalonieri, S., Mazzarol, G., Vecchi, M., Ronzoni, S., Bernard, L., Viale, G., Pelicci, P. G., Fiore, P. P. D. i. Biological and Molecular Heterogeneity of Breast Cancers Correlates with Their Cancer Stem Cell Content. Cell. 140, 62-73 (2010).
- Gertner-Dardenne, J., Poupot, M., Gray, B. D., Fournié, J. -. J. Lipophilic fluorochrome trackers of membrane transfers between immune cells. Immunol. Invest. 36, 665-685 (2007).
- Bercovici, N., Givan, A. L., Waugh, M. G., Fisher, J. L., Vernel-Pauillac, F., Ernstoff, M. S., Abastado, J. P., Wallace, P. K. Multiparameter precursor analysis of T-cell responses to antigen. J. Immunol. Methods. 276, 5-17 (2003).
- Givan, A. L., Fisher, J. L., Waugh, M. G., Bercovici, N., Wallace, P. K. Use of cell-tracking dyes to determine proliferation precursor frequencies of antigen-specific T cells. Methods Mol. Biol. 263, 109-124 (2004).
- Schwaab, T., Tretter, C. P., Gibson, J. J., Cole, B. F., Schned, A. R., Harris, R., Fisher, J. L., Crosby, N., Stempkowski, L. M., Heaney, J. A., Ernstoff, M. S. Tumor-related immunity in prostate cancer patients treated with human recombinant granulocyte monocyte-colony stimulating factor (GM-CSF). Prostate. 66 (6), 667-674 (2006).
- Bantly, A. D., Gray, B. D., Breslin, E., Weinstein, E. G., Muirhead, K. A., Ohlsson-Wilhelm, B. M., Moore, J. S. CellVue Claret, a New Far-Red Dye, Facilitates Polychromatic Assessment of Immune Cell Proliferation. Immunol. Invest. 36, 581-605 (2007).
- Givan, A. L. A flow cytometric assay for quantitation of rare antigen-specific T-cells: using cell-tracking dyes to calculate precursor frequencies for proliferation. Immunol. Invest. 36, 563-580 (2007).
- Tario, J. D., Gray, B. D., Wallace, S. S., Muirhead, K. A., Ohlsson-Wilhelm, B. M., Wallace, P. K. Novel lipophilic tracking dyes for monitoring cell proliferation. Immunol Invest. 36, 861-885 (2007).
- Wallace, P. K., Tario, J. D., Fisher, J. L., Wallace, S. S., Ernstoff, M. S., , ., Muirhead, K. A. Tracking Antigen-Driven Responses by Flow Cytometry: Monitoring Proliferation by Dye Dilution. Cytometry. 73, 1019-1034 (2008).
- Barth, R. J., Fisher, D. A., Wallace, P. K., Channon, J. Y., Noelle, R. L., Gui, J., Ernstoff, M. S. A Randomized Trial of Ex vivo CD40L Activation of a Dendritic Cell Vaccine in Colorectal Cancer Patients: Tumor-Specific Immune Responses Are Associated with Improved Survival. Clin. Cancer Res. 16, 5548-5556 (2010).
- Tario, J. D., Muirhead, K. A., Pan, D., Munson, M., Wallace, P. K. Tracking Immune Cell Proliferation and Cytotoxic Potential Using Flow Cytometry. Meth. Mol. Biol. 699, 119-164 (2011).
- Fuse, S., Underwood, E. Simultaneous Analysis of In Vivo CD8+ T Cell Cytotoxicity Against Multiple Epitopes using Multicolor Flow Cytometry. Immunol. Invest. 36, 829-845 (2007).
- Schütz, C., Fleck, M., Mackensen, A., Zoso, A., Halbritter, D., Schneck, J. P., Oelke, M. Killer artificial antigen-presenting cells: a novel strategy to delete specific T cells. Blood. 111, 3546-3552 (2008).
- Zaritskaya, L., Shurin, M. R., Sayers, T. J., Malyguine, A. M. New flow cytometric assays for monitoring cell-mediated cytotoxicity. Expert Rev. Vaccines. 9, 601-616 (2010).
- Roederer, M. Interpretation of cellular proliferation data: Avoid the panglossian. Cytometry. 79A, 95-101 (2011).
- Quah, B. J. C., Parish, C. R. The Use of Carboxyfluorescein Diacetate Succinimidyl Ester (CFSE) to Monitor Lymphocyte Proliferation. J. Vis. Exp. (44), e2259 (2010).
- Houlihan, D. D., Newsome, P. N. Critical Review of Clinical Trials of Bone Marrow Stem Cells in Liver Disease. Gastroenterology. 135, 438-450 (2008).
- Brusko, T. M., Hulme, M. A., Myhr, C. B., Haller, M. J., Atkinson, M. A. Assessing the In Vitro Suppressive Capacity of Regulatory. T Cells. Immunol. Invest. 36, 607-628 (2007).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados