Method Article
Time-lapse imagens de fluorescência de crescimento de raiz Arabidopsis com Manipulação acelerada do meio root usando o RootChip
Neste Artigo
Resumo
Este artigo fornece um protocolo para o cultivo de mudas de Arabidopsis no RootChip, uma plataforma microfluídica imagem que combina controle automatizado das condições de crescimento com acompanhamento raiz microscópica e FRET baseado em medição de níveis de metabólitos intracelulares.
Resumo
As funções de raiz como a âncora físico da planta e é o órgão responsável pela captação de água e nutrientes minerais, como nitrogênio, fósforo, sulfato e oligo-elementos que as plantas adquirem a partir do solo. Se queremos desenvolver abordagens sustentáveis para a produção de alta produtividade da cultura, nós precisamos entender melhor como a raiz se desenvolve, ocupa um amplo espectro de nutrientes, e interage com organismos simbiontes e patogênicos. Para alcançar esses objetivos, precisamos ser capazes de explorar as raízes em detalhes microscópicos ao longo de períodos que variam de minutos a dias.
Nós desenvolvemos o RootChip, um polidimetilsiloxano (PDMS) - dispositivo micro based, o que nos permite crescer e raízes de imagem de mudas de Arabidopsis, evitando qualquer esforço físico às raízes durante a preparação para a imagem 1 (Figura 1). O dispositivo contém uma estrutura de canal bifurcada com válvulas micromecânicos para guiar o fluxo do fluidoa partir de entradas de solução para cada um dos oito câmaras de observação 2. Este sistema de perfusão permite que o microambiente de raiz para ser controlado e modificado com precisão e rapidez. O volume das câmaras é de aproximadamente 400 nl, exigindo assim apenas quantidades mínimas de solução de teste.
Aqui nós fornecemos um protocolo detalhado para o estudo da biologia raiz no RootChip utilizando imagens baseadas em abordagens com a resolução em tempo real. Raízes pode ser analisada ao longo de vários dias usando microscopia lapso de tempo. Raízes podem ser perfundidos com soluções nutritivas ou inibidores, e até oito plântulas podem ser analisados em paralelo. Este sistema tem o potencial para uma vasta gama de aplicações, incluindo a análise do crescimento das raízes na presença ou ausência de produtos químicos, de fluorescência baseada em análise da expressão do gene, ea análise de biossensores, por exemplo, FRET nanosensores 3.
Protocolo
Nota: Execute todas as etapas etapas preparatórias em condições estéreis.
1. Preparação de Cones de plástico para germinação de sementes
- Encha de 10 cm de placa de Petri com meio de crescimento contendo agar a 1% para uma espessura de 5 mm. Usamos uma força meia modificado Hoagland meio 4, mas a composição do meio deve ser escolhida para se adequar individuais requisitos experimentais.
- Enquanto o meio é ainda líquido, utilizar uma pipeta multi-canal 10 para encher as pontas das pipetas uL com 5 uL de meio a partir da placa de Petri.
- Armazenar as pontas cheias na caixa de ponta de pipeta até que o meio é sólido, então cortada para 4 mm de comprimento e cones de plástico colocado em pé em uma placa de Petri contendo meio de crescimento sólido.
2. Germinação e crescimento de mudas
- Tona esterilizar sementes em NaOCl a 5% durante 5 min, lavar três vezes com água estéril, em seguida, colocar uma única semente no topo de cada um dos cone meio-cheias.
- Selar a placa com fita micropore (3M) e armazenar a 4 ° C para sincronizar a germinação.
- Após três dias, transferir as placas a uma câmara de crescimento para iniciar a germinação. As nossas condições de crescimento são a 23 ° C com um ciclo de light/8h 16h alta escuro (intensidade de luz: 100 μE m -2 s -1).
- Entre 5 e 7 dias após a germinação, as mudas devem estar prontas para a transferência para o RootChip. Neste momento, pontas de raiz deve estar próximo das saídas inferiores dos cones de plástico. Verifique a saúde de plântulas, comprimento da raiz e, se for o caso, a expressão de um marcador fluorescente sob um microscópio de dissecação.
- Marcar mudas individuais para transferência para o chip. Seleccione dez ou menos no caso de um plântulas é danificada durante a transferência.
3. Transferência de Mudas para a RootChip
- Para esterilizar o RootChip para experimentos de longa duração, embrulheo dispositivo em papel de seda, lugar numa placa de Petri de vidro, e autoclave.
- Uma vez que o RootChip esfriar, cubra-o com meio de crescimento líquido. O RootChip deve ser completamente imerso, mas o nível do fluido deve ser não mais do que 3 mm acima da superfície RootChip.
- Com uma pipeta 20 uL, puxe médio através da entrada de raiz e saída da câmara para encher a câmara de observação com meio.
- Cones de plástico plug selecionado no passo 2,5 para as entradas RootChip. Os cones deve caber nas entradas. Uma vez que o RootChip é montado sobre uma fina camada de vidro óptico, não se aplicam demasiada pressão para o chip.
- Incubar a RootChip durante a noite em meio líquido. Para evitar flutuante, coloque duas lâminas de vidro para o chip. Adicionar uma barra de agitação magnética e fechar o prato.
- Transferir a montagem de um agitador magnético e agitar suavemente o meio.
- O entradas RootChip de intersecção dos canais a um ângulo de 30 ° para o dispositivo normal para facilitate crescimento da raiz para os canais (Figura 1A). Para apoiar ainda mais o crescimento na direcção desejada, inclinar ligeiramente o conjunto colocando uma lâmina de vidro sob a placa de Petri sobre o lado da frente das saídas de chip.
- Para manter o ciclo de luz / escuro, iluminar as plântulas com uma lâmpada de anel (intensidade de luz: 100 μE m -2 s -1) ligado a um temporizador.
4. Ligar o RootChip ao Transportador
- No dia seguinte, encher um frasco, selável pressurizable com meio de crescimento líquido (Figura 1B).
- Inverta a transportadora chip e colocá-lo sobre uma superfície estável. Remover o RootChip a partir do meio líquido e inseri-lo lado PDMS para baixo para dentro da abertura inferior do transportador chip. Orientar o chip de modo que o lado que contém as entradas da camada de controlo está virada para o lado da pressão de conectores de linha de tubagem na parede lateral transportador.
- Seca-se a tampa de vidro noinferior do chip suavemente por blotting com papel de seda. Fixe a RootChip à transportadora com fita adesiva e direito a congregação inteira.
- Conectores da tubulação são feitas por cortar tubos microboro plástico flexível (TYGON, 0,20 "ID x 0,060" OD) em 5 centímetros de comprimento e conectá-los ao aço inoxidável microboro tubos (New England Tubo Pequeno, 0,025 "OD x 0,013" ID x 0,75 " de comprimento). Encha os conectores de tubos com água utilizando uma seringa e ficha cada ligador de tubagem para dentro da entrada correspondente de controle da camada no chip. A água será mais tarde preencher os canais camada de controle e ser usado para transmitir a pressão para as válvulas micromecânicos.
- Ligar as extremidades opostas das linhas em mídia / frasco de solução (s). Aplicar pressão para o frasco de solução com uma seringa de ar. A pressão de ar aumentada dentro do frasco solução irá forçar o líquido para as linhas.
5. Montagem do RootChip ao microscópio
- Coloque a transportadora para a Microscfase ope. Para reduzir a possibilidade de o conjunto deslocando sobre o decurso da experiência, devido a vibrações na sala, o transportador deve encaixam perfeitamente os entalhes do inserto fase.
- As válvulas de chip e do fluxo de meio através do chip são controlados por pressão de ar. Duas linhas com os reguladores são ramificadas fora de uma linha de pressão principal - um é utilizado para controlar o fluxo médio através dos canais, eo outro está ligado a válvulas de solenóide de ar que accionar os válvulas push-up da camada de controlo. As válvulas solenóides são operados a partir do computador através da válvula controladora USB (desenvolvido por Rafael Gómez-Sjöberg, Lawrence Berkeley National Lab). Feche ambos os reguladores de pressão antes de ligar o chip.
- Adicionar alguns mililitros de água para os reservatórios do veículo para manter a umidade alta dentro do conjunto. Esta etapa deve ser repetida ao longo do curso dos experimentos mais longos para manter as plantas sequem. Mantenha o volume baixo para minimizar tele quantidade de líquido que pode ser derramado sobre o microscópio. Para experimentos de longa duração, a saída das tomadas de chips pode ser guiado para os reservatórios da transportadora, ligando os pontos de venda de chips para os reservatórios com microboro tubulação (veja o passo 4.4). Alternativamente, o fluxo de saída que se acumula na superfície do chip pode ser recolhido por pipetagem.
- Prepare folhas quadrados de plástico transparente de protetores da folha (C-Line). Fixe o plástico transparente para o transportador por fita dupla face para manter a umidade elevada na montagem.
- Posicione o anel de luz sobre o chip e manter o ciclo de claro / escuro. A luz anel deve ser desligado antes do início de cada experiência que utiliza marcadores fluorescentes, como a iluminação directa irá interferir com a recolha de imagem.
6. Operação do RootChip usando a Interface LabView
A interface do controlador RootChip para a plataforma de software LabVIEW podeser baixado do nosso site http://dpb.carnegiescience.edu/technology/rootchip .
- As válvulas no chip são fechados por aplicação de pressão para a camada de controlo, neste caso, abrindo as válvulas de ar de solenóide. A interface do controlador permite acionamento das válvulas, clicando no botão abaixo do número da válvula. Verde brilhante indica aplicação de pressão e de fecho de uma válvula de chip (Figura 2B). Ative todas as três válvulas de entrada solução na interface do controlador antes de abrir os reguladores de pressão. Nota: A interface controlador dispõe de um ciclo de feedback, que permite a monitorização do estado do sistema. Esse recurso pode ser ativado clicando no botão "cotejamento" na interface do controlador.
- Abra o regulador de pressão para a camada de controle e, inicialmente definido para 15 psi, em seguida, abra o regulador para a camada de fluxo e, inicialmente definido para 5 psi. DepenDing sobre a taxa de fluxo desejada, as pressões podem ser ajustada mais tarde.
- Abra a válvula de entrada para o meio de crescimento de escolha para lavar as câmaras com o meio.
- Verificar caminhos de fluxo sob o microscópio. Tipicamente, o ar é retido nos canais de fluxo e deve ser removido. Além disso, os canais de a camada de controle ainda conter ar que deve ser forçado para fora e substituído por a água dos conectores tubo (sem saída enchimento). Ambas as tarefas são alcançados através de lavagem cada uma das oito câmaras várias vezes (5 psi) até que todo o ar é forçado a partir dos canais para a PDMS ("desgaseificação"). Nota: O controlador interface pode ser programado para automatizar experimentos. Tais rotinas podem também ser utilizados para desgaseificar o chip.
7. Os resultados representativos
O objectivo principal da RootChip é combinar uma plataforma de imagem e um sistema de perfusão em um único dispositivo com um elevado nível de integração. Para demonstrar a manipulaçãodo microambiente das raízes que corou as câmaras com corante alimentar escuro (1:4 diluição em meio hidropônico) e medida a troca de fluido no interior das câmaras. À pressão recomendada de 5 psi, medimos a uma troca completa dentro de 10 segundos, a uma taxa de fluxo calculado de aproximadamente 1,5 uL / min (Figura 3).
Observou-se também o crescimento das raízes das plântulas, neste caso cultivadas no escuro e fornecido com 10 mM de glucose como fonte de energia externa (Figura 4). Dependendo das condições de crescimento, tais como luz e composição do meio, as plantas podem ser observados no RootChip por até três dias.
O RootChip tem sido utilizado para monitorizar a glucose intracelular e os níveis de galactose em raízes que expressam nanosensores codificados geneticamente, com base no Förster Transferência de Energia de Ressonância (FRET) 5-7. Raízes no chip foram perfundidos com pulsos quadrados de glucose ou galactose solução ( Figura 5). Os níveis intracelulares de açúcares foram monitorizados e são mostrados aqui expresso como uma razão entre a intensidade do Citrino fluoróforo aceitador para a intensidade da ECFP doador. O aumento da proporção indica acumulação de açúcar.
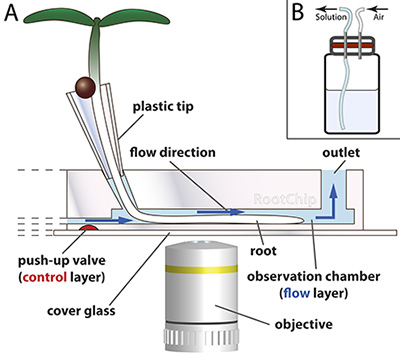
Figura 1. Princípio RootChip.
- O RootChip apresenta oito câmaras de observação para o crescimento e de imagem de raízes. As primeiras sementes germinam em cones de plástico - fabricado a partir de pontas de pipeta de plástico - que são preenchidos com meio sólido. A ponta de raiz cresce através do meio e atinge a câmara onde um fluxo contínuo de meio líquido mantém as condições na câmara constante. Válvulas micromecânica (vermelho) controlar o fluxo. O chip é montado sobre uma tampa de vidro óptico.
Desenho sem escala. (Adaptado com permissão de Grossmann et al., 2011 Plant Cell.) - Scheme de um frasco de solução pressurizable com diafragma (vermelho).
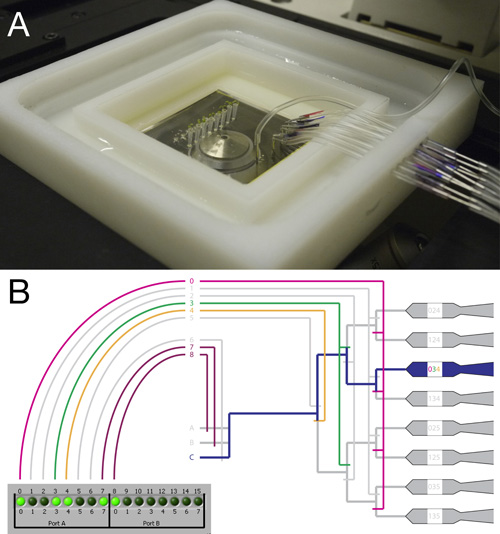
Figura 2. Ligar e montagem do RootChip.
- Vista de cima da RootChip totalmente conectado e transportadora montada em um microscópio invertido.
- Esquema ilustrando o sistema de válvulas e do controlador de interface. Um exemplo para uma válvula de fixação para guiar o fluxo de fluido para uma única câmara é mostrado. Embora as válvulas de 4 a 8 actuam como válvulas, válvulas individuais de 0 a 3 ato em grupos. Com este sistema de uma câmara de indivíduo pode ser tratada através da activação de uma combinação de válvulas.
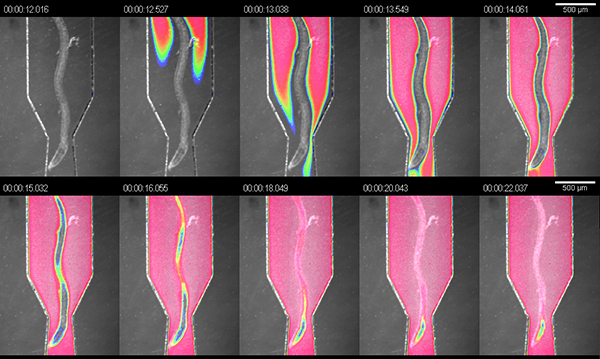
Figura 3. Troca de soluções no ch observaçãoambers. visualização da troca de fluido em uma câmara de observação utilizando uma solução de corante. A imagem é uma sobreposição de campo brilhante e falsa cor-de-intensidade do sinal de coloração.
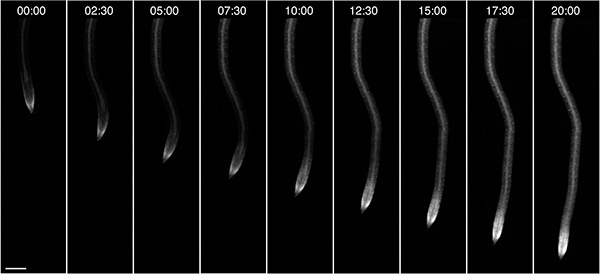
Figura 4. No chip crescimento das raízes. A observação de uma única raiz crescente expressando uma fluorescente FRET nanosensor para a glucose / galactose ao longo de 20 h. Formato da hora: hh: mm; barra de escala: 100 mm.
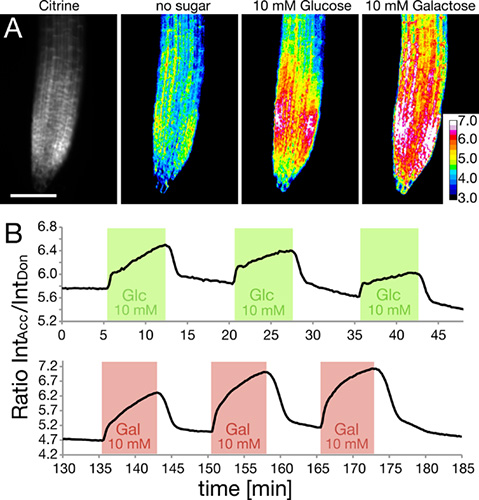
Figura 5. Medindo os níveis de açúcar intracelulares usando FRET nanosensores.
- A quantidade de sensor é mostrado como citrino intensidade dentro da extremidade da raiz (à esquerda). A resposta do intracelular FRET nanosensor para a aplicação de glucose ou galactose solução é mostrado como imagens raciométrica. (Adaptado com permissão de Grossmann et al., 2011 Plant Cell) Barra de escala:. 100 mm.
- Rastreio FRET relação muda em resposta a três pulsos repetidos quadrados de glucose (verde) e galactose (vermelho).
Discussão
As principais vantagens do RootChip sobre os métodos de crescimento convencionais são a preparação minimamente invasiva para a microscopia, a capacidade de reversivelmente e repetidamente alterar o ambiente de raiz, e da capacidade de observação contínua de tecido developmentally competente e fisiologicamente saudável durante um período de vários dias. Anteriormente, as plantas foram cultivadas em meios gelificados verticalmente e transferidos para um sistema de perfusão imediatamente antes da experiência, o que permitiu medir apenas raízes de cada vez 8. Ferramentas microfluídicos têm sido utilizados para Arabidopsis, mas a um nível baixo de integração 9 ou sem controlo de perfusão 10. O RootChip combina um alto nível de integração com a capacidade de automatizar experimentos através de orientação de fluxo preciso. Outra vantagem desta plataforma, característica de todos os dispositivos microfluídicos 11, é que apenas quantidades mínimas de líquido são necessárias para fornecer a raiz com a porca necessáriorients, mesmo para experimentos que abrangem vários dias. O RootChip está concebido como um dispositivo de uso único, mas desde que os custos de produção de chips estão baixos, as pequenas quantidades de reagentes consumidos faz o chip ainda é muito rentável.
Existem alguns passos críticos que devem ser tomadas para garantir a saúde das mudas:
O volume nos cones de plástico é apenas uL 3-4, que vai começar a secar quando exposta ao ar. Por isso, é crítico que os cones são transferidos para o chip de forma rápida e de humidade é mantida elevada até que as raízes tenham atingido as câmaras de observação, o que irá fornecer-lhes água suficiente. Passos 4.2 para 4.5 deve ser realizada rapidamente e sem interrupção para evitar o ressecamento das mudas.
Passos de 3,5 - 3,8 descrever a incubação do chip em meios líquidos durante o qual as raízes crescem para dentro das câmaras de observação. Este passo pode ser ignorada pela montagem do chip no carrier imediatamente e iniciando a perfusão constante com meio de crescimento. No entanto, é recomendável imersão em meio de crescimento durante a noite, uma vez que tem algumas vantagens: 1) cria um ambiente húmido de modo as plântulas são menos provável que se torne dessecado à medida que crescem para dentro da câmara de observação, 2), o chip é embebido em líquido, de modo desgaseificação (passo 6,4) será mais rápido.
É importante a utilização de meios de comunicação com baixas concentrações de soluto. As soluções mais concentradas podem precipitar e entupir os canais, especialmente se o chip é usado em vários dias.
Uma vez que o dispositivo está conectado à linha de pressão de ar, o fluxo de meio é controlado alterando a pressão hidráulica nas válvulas. Para garantir o correcto encerramento das válvulas micromecânicos, é importante escolher uma pressão de comando que é cerca de três vezes maior do que a pressão de fluxo. A pressão de fluxo não deve exceder 15 psi como o fluido vai ser empurrado para fora das entradas de raiz. Altas pressões may também causar delaminação do chip, o que torna o inutilizável chip.
Uma limitação do RootChip é que o PDMS é porosa e hidrofóbico. Enquanto o material é praticamente inerte a soluções aquosas, que podem absorver compostos orgânicos 12. Isso pode interferir com uma troca rápida de soluções como compostos orgânicos podem vazar a partir do material, mesmo quando o fornecimento deste composto foi parado na entrada. Devido à porosidade, a utilização de solventes orgânicos podem causar inchaço do PDMS 12.
Continuamos a optimizar a RootChip e alargar a sua utilidade, por exemplo, com raízes de plantas de cultivo. Acreditamos que melhorando o acesso à raiz para o tratamento e observação, ferramentas microfluídicos como a RootChip vai abrir novas dimensões de pesquisa raiz.
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Agradecemos Philipp Denninger para obter ajuda com o vídeo de preparação e Chaudhuri Bhavna para fornecer linhas de plantas que expressam FRET sensores. Este trabalho foi suportado por concessões do National Science Foundation (MCB 1021677), o Departamento de Energia (DE-FG02-04ER15542) a WBF, o National Institutes of Health e do Howard Hughes Medical Institute para SRQGG foi apoiada por um longo EMBO prazo comunhão. MM foi apoiado pela Fundação Alexander von Humboldt.
Materiais
| Name | Company | Catalog Number | Comments |
| Itens | Fonte | Informações | |
| Chip transportadora, software e outras informações. | Carnegie Institution - DPB | CAD e CNC arquivos para a fabricação transportadora, software controlador e mais informações estão disponíveis para download no site da http://dpb.carnegiescience.edu/technology/rootchip~~HEAD=NNS Portadores também podem ser encomendados a partir deste site. | |
| RootChip | Stanford Fundição | Máscara projetos e protocolos de fabricação estão disponíveis mediante solicitação. Ready-to-use RootChips pode ser encomendado a partir de http://www.stanford.edu/group/foundry/ | |
| Controlador de Chip | -Home built- | O sistema controlador automático de válvula foi originalmente desenvolvido por Rafael Gómez-Sjöberg, Lawrence Berkeley National Lab. Uma instrução detalhada de como construir o seu próprio controlador de válvula atuada pode ser encontrada em https://sites.google.com/a/lbl.gov/microfluidics-lab/valve-controllers |
Referências
- Grossmann, G. The RootChip: An Integrated Microfluidic Chip for Plant Science. Plant Cell. 23, 4234-4240 (2011).
- Unger, M. A., Chou, H. P., Thorsen, T., Scherer, A., Quake, S. R. Monolithic microfabricated valves and pumps by multilayer soft lithography. Science. 288, 113-116 (2000).
- Okumoto, S., Jones, A., Frommer, W. B. Quantitative Imaging with Fluorescent Biosensors: Advanced Tools for Spatiotemporal Analysis of Biodynamics in Cells. Annu. Rev. Plant Biol. , (2012).
- Loqué, D., Lalonde, S., Looger, L. L., von Wirén, N., Frommer, W. B. A cytosolic trans-activation domain essential for ammonium uptake. Nature. 446, 195-198 (2007).
- Okumoto, S. Imaging approach for monitoring cellular metabolites and ions using genetically encoded biosensors. Curr. Opin. Biotechnol. 21, 45-54 (2010).
- Fehr, M., Frommer, W. B., Lalonde, S. Visualization of maltose uptake in living yeast cells by fluorescent nanosensors. Proc. Natl. Acad. Sci. USA. 99, 9846-9851 (2002).
- Takanaga, H., Chaudhuri, B., Frommer, W. B. GLUT1 and GLUT9 as major contributors to glucose influx in HepG2 cells identified by a high sensitivity intramolecular FRET glucose sensor. Biochim. Biophys. Acta. 1778, 1091-1099 (2008).
- Chaudhuri, B., Hörmann, F., Frommer, W. B. Dynamic imaging of glucose flux impedance using FRET sensors in wild-type Arabidopsis plants. J. Exp. Bot. 62, 2411-2417 (2011).
- Meier, M., Lucchetta, E. M., Ismagilov, R. F. Chemical stimulation of the Arabidopsis thaliana root using multi-laminar flow on a microfluidic chip. Lab Chip. 10, 2147-2153 (2010).
- Parashar, A., Pandey, S. Plant-in-chip: Microfluidic system for studying root growth and pathogenic interactions in Arabidopsis. Appl. Phys. Lett. 98, 263703-26 (2011).
- Whitesides, G. M. The origins and the future of microfluidics. Nature. 442, 368-373 (2006).
- Lee, J. N., Park, C., Whitesides, G. M. Solvent Compatibility of Poly(dimethylsiloxane)-Based Microfluidic Devices. Anal. Chem. 75, 6544-6554 (2003).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados