É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Enumeração dos principais Populações de Leucócitos do Sangue Periférico de ensaios clínicos multicêntricos usando um ensaio fenotipagem Sangue
Neste Artigo
Resumo
Neste relatório, demonstrar os passos coloração e análise de um ensaio de fenotipagem em sangue total fresco para enumerar grandes inata e adaptativa populações de leucócitos. Ressaltamos considerações para executar estes procedimentos, no contexto de um ensaio clínico multicêntrico.
Resumo
Criopreservação de leucócitos do sangue periférico é amplamente utilizado para preservação de células para a avaliação da resposta imune, em ensaios clínicos, e oferece muitas vantagens para facilidade e normalização das avaliações imunológicos, mas os efeitos prejudiciais deste processo têm sido observados em alguns subconjuntos de células, tais como granulócitos, células B , células dendríticas e 1-3. Ensaio leucócitos frescos dá uma visão mais precisa do estado in vivo das células, mas é muitas vezes difícil de realizar, no contexto de grandes estudos clínicos. Ensaios com células frescas são dependentes de compromissos voluntários e prazos e, se demorado, sua aplicação pode ser impraticável devido às horas de trabalho necessárias do pessoal de laboratório. Além disso, quando os ensaios são realizados em centros múltiplos, laboratórios com os recursos e treinamento necessários para realizar os ensaios não podem estar localizados em proximidade suficiente para locais clínicos. Para resolver estas questões, temos develvolvido um 11-cor do painel de coloração de anticorpo que pode ser utilizado com tubos de Trucount (Becton Dickinson, San Jose, CA) para o fenótipo e enumerar as principais populações de leucócitos no sangue periférico, produzindo mais robusto informação específica do tipo de célula do que os ensaios, tais como um hemograma completo (CBC) ou ensaios com comercialmente disponíveis painéis projetados para tubos Trucount que mancham por apenas alguns poucos tipos de células. O processo de coloração é simples, requer apenas 100 l de sangue total fresco, e leva cerca de 45 minutos, tornando-se viável para o padrão de processamento de sangue laboratórios para executar. É adaptado do tubo Trucount BD ficha técnica ( versão 8/2010 ). O cocktail de anticorpos de coloração pode ser preparada antecipadamente a granel em um laboratório de ensaio central e enviado para o laboratório de processamento no local. Tubos coradas podem ser fixadase congelada para a expedição para o laboratório central para análise multicolor análise de citometria de fluxo. Os dados gerados a partir deste painel de coloração pode ser usado para controlar as alterações nas concentrações de leucócitos ao longo do tempo em relação à intervenção e pode ser facilmente desenvolvidas para avaliar os estados de activação de tipos específicos de células de interesse. Neste relatório, nós demonstrar o procedimento usado pelos técnicos de processamento de sangue de laboratório para realização da coloração de sangue total fresco e os passos para analisar estas amostras coradas em um laboratório de ensaio central de apoio de um ensaio clínico multicêntrico. Os detalhes do procedimento de vídeo, uma vez que é realizada no contexto de um ensaio clínico draw sangue no HIV Vaccine Trials Network (HVTN).
Protocolo
Nota: Para proteger os anticorpos fluoróforo conjugados da luz, executar todas as etapas de um gabinete de segurança bio-com a luz.
1. Anticorpo Preparação Painel de coloração
- O painel de coloração de anticorpos podem ser encontrados na Tabela 1. Concentração de anticorpos deve ser definido por meio de titulação com sangue total e no uso do equipamento de citometria de fluxo e mesmo procedimentos que serão utilizados para adquirir as amostras coradas fenotípicos.
- Uma vez que os títulos de coloração apropriados são determinados, combinar todos os anticorpos para uma mistura única de um tubo de bloqueio-cap. Adicionar tampão de fluxo de lavagem (PBS de Dulbecco, com 2% de calor de soro bovino fetal inactivado), para perfazer um volume total de 100 ul. Dimensionar a mistura para o número de amostras a serem corados. Esta mistura pode ser armazenada a 4 ° C durante até oito semanas.
2. Coloração
- Se o sangue recolhido é para ser usado para outros fins em addição para este ensaio, defina uma alíquota de lado enquanto os mais sensíveis ao tempo procedimentos são realizados no sangue restante. A alíquota pode ser armazenado à temperatura ambiente durante até 4 horas após a punção venosa sem perda significativa de células.
- Verificar se existe um grânulo intacto pellet no fundo do tubo e Trucount rótulo do tubo para identificar a amostra que está sendo manchadas. Em ensaios clínicos da HVTN, o Laboratório de Sistema de Gerenciamento de Dados (Frontier Ciência e Tecnologia Research Foundation; Amherst, Nova Iorque) é usado para rotular e rastrear amostras coradas.
- Anote os números de lote e datas de vencimento de todos os reagentes. Anote o número de contagem Trucount tubo talão fornecido pelo fabricante no saco de tubos, certifique-se que o número de lote no saco corresponde ao número de lote no tubo.
- Usar a reversão de pipetagem de precisão pipetar 100 uL de sangue total para dentro do tubo Trucount, logo acima do retentor metálico. Evitar manchas de sangue para o lado do tubo.
- Usando técnica (para a frente) regular pipetagem, pipeta 100 uL do painel misto anticorpos (ver Tabela 1) para dentro do tubo Trucount. Tapar o tubo e vórtice a baixa velocidade durante cerca de 15 segundos para misturar. Inspeccionar visualmente o tubo para assegurar que o sedimento do grânulo é completamente dissolvida.
- Incubar o tubo Trucount durante 15 minutos à temperatura ambiente (15-30 ° C), no escuro.
- Se necessário, diluem-se uma alíquota de 10 × solução de lise FACS para 1X utilizando dih 2 O. Adicionar 900 ul de 1 × solução de lise FACS para o tubo.
- Tapar o tubo e agitar no vortex cuidadosamente a baixa velocidade durante cerca de 15 segundos para misturar. Empurre a tampa para baixo firmemente em posição de bloqueio no tubo e vedação com filme de laboratório.
- Armazenar o tubo a -65 ° C a -95 ° C até que a amostra está pronta para a transferência para o laboratório de análise central ou para análise em casa. As amostras são estáveis, nesta fase, durante pelo menos quatro semanas. Se o transporte ou ensaio imediatamente, este passo pode ser omitido.
3. Expedição
Nota: As instruções a seguir utilizam um sistema de transporte isolado de Inc., Saf-T-Pak projetado especificamente para transporte de categoria B isentos substâncias biológicas de acordo com a International Air Transport Association e (IATA) regulamentos. Se analisar as amostras no mesmo local que a coloração ocorreu, vá para a seção 4.
- As amostras podem ser fornecidas imediatamente após a coloração ou depois de terem sido congeladas a -65 ° C a -95 ° C. Enrole cada tubo completamente em papel alumínio e coloque na caixa de espécime manchado. Coloque a caixa de espécime manchada dentro de um saco estanque-poli com material absorvente.
- Colocar o saco à prova de fugas e de poli-conteúdo dentro de um saco Tyvek e vedação com o ar o menos possível no saco.
- Coloque o pacote de amostra (amostra dentro de embalagem secundária) dentro da caixa interna marrom.
- Coloque o interior marrom bboi dentro do peito de isopor, prendendo-o no recuo para evitar deslocamento.
- Encha o peito de isopor com gelo seco (cerca de 8 kg) e coloque a tampa firmemente no peito.
- Segurança fita da caixa de transporte e navio como substância biológica, Categoria B (UN3373) com o gelo seco adequada (UN1845) marcações; seguir IATA PI-650 instruções.
- Após a recepção, as amostras são armazenadas a -65 ° C a -95 ° C até serem analisadas.
4. Descongelamento e Análise por Citometria de Fluxo
- Retirar a amostra corada do congelador a descongelar à temperatura ambiente, no escuro, antes de recolher no citómetro de fluxo. Se a recolha de dados sobre mais do que uma amostra, padronizar o processo para todos os tubos por escalonamento descongelamento para que os tubos não estão sentados à temperatura ambiente durante mais de 1 hora cada.
- As amostras devem ser obtidas utilizando um citómetro de fluxo de quatro a laser equipado com filtros adequados, tais como o LSR BDII. Utilize calibração citómetro padrão e métodos de compensação de fluorescência para coleta de dados 4.
Nota: Não defina limites de dispersão de dispersão para a frente ou de lado durante a coleta de 5. Contas Trucount podem cair abaixo a configuração do limite mais baixo possível para estes parâmetros, causando um subconjunto de contas não devem ser contabilizados durante a análise. Se exigido pelo instrumento, para definir um limite, defina o menor possível Am Ciano limiar de canal. Porque leucócitos CD45 + coradas com o painel será Am Ciano positivo, e os grânulos Trucount também fluorescem no Ciano Am canal, este deve permitir a todos os dados relevantes para ser adequadamente recolhidos.
- Vortex do tubo de amostra durante 5 segundos antes de o colocar no citómetro de fluxo. Contas Trucount fluorescência altamente em muitos canais. Portão as contas durante a coleta, encontrando a população que é altamente positivo para o duplo-PE Cy5 e APC (o colo doisrs que mais facilmente distinguir os grânulos das células pode variar, dependendo de instrumentação). Selecione a porta talão como seu portão parar, e registro de dados até pelo menos 20.000 contas são adquiridos.
- Analisar os dados utilizando software apropriado, tal como FlowJo (Treestar; Ashland, OR). Figura 1 mostra o esquema de propagação utilizado para a análise de diferentes populações de leucócitos a partir de um desenho representativo de controlo do sangue.
5. Cálculos Trucount
- Cada tubo contém uma Trucount pellet liofilizado de partículas fluorescentes. Após a adição de líquido para o tubo e agitação em vórtex, as pérolas devem ser distribuídos igualmente ao longo da amostra. O número de pérolas na pelete varia ligeiramente, o número de lote e podem ser encontrados sobre o saco de armazenamento para os tubos.
- Portão das pérolas Trucount e populações de células, como mostrado na Figura 1 para determinar as contagens de eventos para cada população. Comparando o número de eventos in o portão do talão, o número total de pérolas originalmente no tubo lhe permitirá determinar a proporção da amostra recolhida, a qual pode então ser usada para determinar a concentração absoluta (isto é, células / uL) para cada população. A equação que se segue pode ser utilizado para este fim: concentração celular (# de células / uL de sangue total) = [# eventos / população (eventos # / # grânulo grânulos totais em pellet)] / 100 uL.
6. Resultados representativos
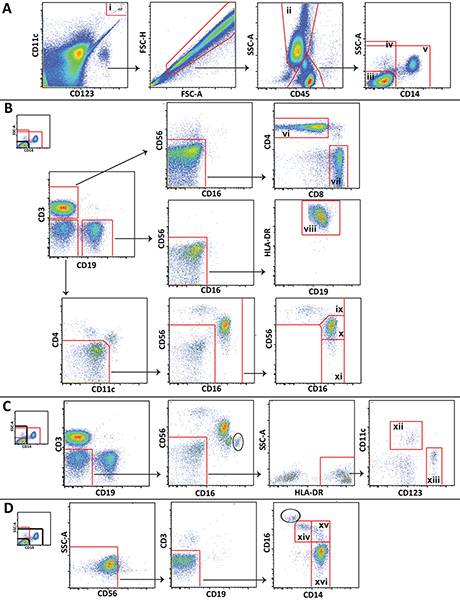
Figura esquema Gating 1. Utilizado para a análise de grandes populações de leucócitos que mostram dados representativos de um voluntário saudável. A) grânulos Trucount (i) são fechado e excluído a partir de células. Granulócitos (ii) são delineadas e lympohcytes e monócitos são divididos em 3 popluations: CD14linfócitos negativos (iii), todas as células CD14 negativas (iv), e não os linfócitos (V). B) CD14 linfócitos negativos são gated para distinguir células T CD4 + (VI), CD8 + T (vii), células B (VIII), CD56 brilhantes células NK (ix), células CD56 dim NK (x), e CD56 negativas células NK (xi). C) Todos células CD14 negativas são gated para distinguir mielóide (xii) e (xiii células plasmocitóide) dendríticas. D) Não são lympocytes fechado para distinguir não-clássicas (xiv), intermediários (xv) e clássica (xvi) monócitos. Clique aqui para ver maior figura .
Mais subconjuntos de células específicas, que não são mostradas na figura 1 (por exemplo, as células NKT ou neutrófilos) também pode ser distinguido através do painel são apresentadas, e o esquema de gating pode ser ampliado ou modificado para satisfazer as necessidades específicas de estudo. Gating passos certos mostrados são exclusivas para este método. Da nota particular, um portão de inclusão eportão exclusão são desenhados em torno das esferas de Trucount e colocado em cima da outra, de um a porta para as pérolas de contagem, e um para excluir os grânulos a partir da análise celular (Figura 1A). Além disso, como os linfócitos, monócitos, granulócitos e não são tão facilmente distinguidos no sangue total como o são em células mononucleares do sangue periférico por dispersão frontal e lateral de dispersão, gating estas células CD45 usando expressão dispersão lateral e é muitas vezes necessário (Figura 1A). Granulócitos contaminantes (círculos) que não podem ser separados a partir de linfócitos e monócitos CD45 e usando dispersão lateral são distinguíveis em algumas parcelas, pela sua expressão de alto CD16 (Figura 1C e Figura 1D). O número de granulócitos contaminantes é normalmente pequeno, e que não interfiram com a propagação de células de monócitos e células NK.
Discussão
Neste relatório, apresentamos um método baseado em talão para enumerar populações de leucócitos no sangue total fresco por citometria de fluxo e cobrir os parâmetros necessários para a sua utilização em um ensaio clínico multicêntrico com a análise da amostra centralizado. Este método baseia-se e otimiza o BD protocolo Trucount e permite seu uso confiável em um ambiente de estudo clínico multicêntrico. O método de coloração é simples e leva cerca de 45 minutos para ser realizado, tornando viável pa...
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Agradecemos Jessica Jones, Erica Clark, Constance Ducar, Donna Smith, Roy Lewis, Lily Apedaile, Joanne Wiesner, Devin Adams, Corey McBain e Stephen Voght para a sua assistência no desenvolvimento deste método manuscrito, e vídeo.
Este trabalho foi financiado pela Fundação Bill e Melinda Gates CAVD concessão 38.645 (MJM) e do Instituto Nacional de Saúde concede UM1 AI068618 e U01 AI069481 (MJM). EA-N. é suportado pelo NIH Grant T32 AI007140. Agradecemos a confiança James B. Pendleton Charitable por sua doação de equipamentos generoso.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | |
| Trucount absolutos Tubos Contando | BD Biosciences | 340334 | |
| FACS 10X de Lise Solução | BD Biosciences | 349202 | |
| Categoria B & Sistema de envio Isento, Duplas | Saf-T-Pak | STP-320 | |
| CD45 anticorpo monoclonal AmCyan | BD Biosciences | 339192 | |
| CD3 anticorpo monoclonal FITC | BD Biosciences | 349201 | |
| CD8 PerCP-Cy 5,5 de anticorpo monoclonal | BD Biosciences | 341051 | |
| CD4 Alexa Fluor 700 Antibo monoclonaldy | BD Biosciences | 557922 | |
| HLA-DR anticorpo monoclonal ECD | Beckman Coulter | IM3636 | |
| CD14 anticorpo monoclonal V450 | BD Biosciences | 560349 | |
| CD19 anticorpo monoclonal PE | BD Biosciences | 555413 | |
| CD16 anticorpo monoclonal APC-H7 | BD Biosciences | 560195 | |
| CD56-PE Cy7 anticorpo monoclonal | BD Biosciences | 335791 | |
| CD11c APC anticorpo monoclonal | BD Biosciences | 559877 | |
| CD123 anticorpo monoclonal PE-Cy5 | BD Biosciences | 551065 |
Referências
- Taylor, M. J., London, N. J., Thirdborough, S. M., Lake, S. P., James, R. F. The cryobiology of rat and human dendritic cells: preservation and destruction of membrane integrity by freezing. Cryobiology. 27, 269-278 (1990).
- Reimann, K. A., Chernoff, M., Wilkening, C. L., Nickerson, C. E., Landay, A. L. Preservation of lymphocyte immunophenotype and proliferative responses in cryopreserved peripheral blood mononuclear cells from human immunodeficiency virus type 1-infected donors: implications for multicenter clinical trials. The ACTG Immunology Advanced Technology Laboratories. Clin Diagn Lab Immunol. 7, 352-359 (2000).
- Boonlayangoor, P., Telischi, M., Boonlayangoor, S., Sinclair, T. F., Millhouse, E. W. Cryopreservation of human granulocytes: study of granulocyte function and ultrastructure. Blood. 56, 237-245 (1980).
- Perfetto, S. P., Ambrozak, D., Nguyen, R., Chattopadhyay, P., Roederer, M. Quality assurance for polychromatic flow cytometry. Nat Protoc. 1, 1522-1530 (2006).
- Brando, B., Barnett, D., Janossy, G., Mandy, F., Autran, B., Rothe, G., Scarpati, B., D'Avanzo, G., D'Hautcourt, J. L., Lenkei, R., Schmitz, G., Kunkl, A., Chianese, R., Papa, S., Gratama, J. W. Cytofluorometric methods for assessing absolute numbers of cell subsets in blood. European Working Group on Clinical Cell Analysis. Cytometry. 42, 327-346 (2000).
- Bull, M., Lee, D., Stucky, J., Chiu, Y. L., Rubin, A., Horton, H., McElrath, M. J. Defining blood processing parameters for optimal detection of cryopreserved antigen-specific responses for HIV vaccine trials. J. Immunol Methods. 322, 57-69 (2007).
- Kantor, A. B., Roederer, M., Herzenberg, L., Blackwell, C., Weir, D. . The handbook of Experimental Immunology. 43, 1-49 (1996).
- Hulspas, R. Flow cytometry and the stability of phycoerythrin-tandem dye conjugates. Cytometry A. 75, 966-972 (2009).
- Le Roy, C., Varin-Blank, N., Ajchenbaum-Cymbalista, F., Letestu, R. Flow cytometry APC-tandem dyes are degraded through a cell-dependent mechanism. Cytometry A. 75, 882-890 (2009).
- Mandy, F., Brando, B. Enumeration of absolute cell counts using immunophenotypic techniques. Curr. Protoc. Cytom. Chapter 6, Unit 6 (2001).
- Vuckovic, S. Monitoring dendritic cells in clinical practice using a new whole blood single-platform TruCOUNT assay. J. Immunol Methods. 284, 73-87 (2004).
- Lichtner, M. Circulating dendritic cells and interferon-alpha production in patients with tuberculosis: correlation with clinical outcome and treatment response. Clin. Exp. Immunol. 143, 329-337 (2006).
- Hosmalin, A., Lichtner, M., Louis, S. Clinical analysis of dendritic cell subsets: the dendritogram. Methods Mol. Biol. 415, 273-290 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados