Method Article
Antígeno Artificial célula apresentadora de ativação mediada (AAPC) e expansão de células T Natural Killer
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Aqui nós descrevemos um método para ativar e expandir células humanas NKT de granel populações de células T com células artificiais apresentando antígeno (AAPC). O uso de CD1d baseado AAPC fornece um método padronizado para a geração de números elevados de células NKT funcionais.
Resumo
Natural killer T (NKT) são células de um único subconjunto de células T que exibem marcadores característicos de ambas as células assassinas naturais (NK) e células T 1. Ao contrário das células clássicas T, células NK reconhecem antigénio de lípidos no contexto das moléculas CD1 2. Células NKT expressam um rearranjo da cadeia invariante TCRα: Vα14Jα18 em ratos e em seres humanos Vα24Jα18, que está associado com cadeias Vp de diversidade limitada 3-6, e são referidos como canónicas ou invariante NKT (i NKT) células. Semelhante às células T convencionais, as células NKT se desenvolvem a partir de CD4-CD8-tímicas células T precursoras após a sinalização apropriada por CD1d 7. O potencial para utilizar células NKT para fins terapêuticos tem aumentado significativamente com a capacidade de estimular e expandir as células NKT humanas com α-galactosilceramida (α-GalCer) e uma variedade de citocinas 8. É importante notar que estas células mantiveram a sua origem phenotype, citocinas secretadas e exibida função citotóxica contra células tumorais. Assim, as células expandidas ex vivo NKT permanecer funcional e pode ser utilizado para a imunoterapia adoptiva. No entanto, células NKT imunoterapia baseada tem sido limitada pela utilização de células autólogas apresentadoras de antigénios e a quantidade e qualidade destas células estimuladoras pode variar substancialmente. Derivados de monócitos DC a partir de pacientes com cancro têm sido relatados para expressar níveis reduzidos de moléculas co-estimulatórias e produzir citocinas inflamatórias menos 9,10. De facto, em vez de DC murina APC autólogas foram utilizadas para testar a função das células NK de pacientes com LMC 11. No entanto, este sistema só pode ser utilizado para os testes in vitro a partir de células NKT não pode ser expandido por DC de murino e, em seguida, utilizada para uma imunoterapia adoptiva. Assim, um sistema padronizado que depende das células artificiais Antigen Presenting (AAPC) poderia produzir os efeitos estimulantes do DC sem as armadilhas do alo-ou xenogénicas cells 12, 13. Relata-se um método para gerar CD1d baseado AAPC. Desde o envolvimento do receptor de células T (TCR) por antígeno-CD1d complexos é uma exigência fundamental da ativação de células NKT, antígeno: CD1d-Ig complexos fornecem um método confiável para isolar, ativar e expandir as populações de células efetoras NKT.
Protocolo
1. Geração de AAPC
- Antes de adicionar proteínas de grânulos, preparar todos os reagentes e tampões: 0,1 M de tampão de borato; 1X D-PBS (sem Ca 2 + e Mg 2 +), (azida de sódio 1X PBS 5% de soro humano AB + 0,02%), solução tampão de lavagem Bead ; meio completo (meio RPMI 100 mM de piruvato de sódio, solução de vitaminas 10 mM não essenciais, solução de 100 mM de MEM vitamina, 1% de 2-mercaptoetanol, 10 mM de ciprofloxacina, 5% de soro AB humano); MACS tampão (1 L de PBS livre de Ca 2 + e Mg 2 +, 5 g de BSA, e 2 mmol de EDTA).
- Enxaguar 1 ml de Dynabeads M-450 esferas de epóxi com 3 ml de 0,1 M de tampão estéril borato (ácido bórico e da água, pH 7,0-7,4) num frasco de vidro de 5 ml de borosilicato transparente roscada.
- Num tubo separado de microcentrífuga de 1,5 ml, adicionar 100 | ig de dímero hCD1d-Ig e 20 moléculas co-estimulatórias ng (por exemplo: anti-CD28mAb) a 1 ml de PBS w / o Ca 2 + ou Mg 2 +.
- Local grânulo contendo frasco de vidro no íman e tampão borato aspirado a partir de pérolas. Adicionar a mistura de proteína a partir do passo 1.2 a ampola de vidro e substituição da tampa. Misturar imediatamente invertendo o frasco, a tampa de cobertura com parafilm e, em lugar de um rotor e incubar durante a noite a 4 ° C.
- No dia seguinte, frasco de vidro no lugar ímã e remover mistura de proteína, enquanto evitando cuidadosamente contas. Lavar os grânulos por adição de 3 ml de tampão de lavagem talão (PBS com 5% de soro AB azida de sódio a 0,02%), e incubação a 4 ° C num rotor durante 5 min. Repita duas vezes.
- Contas podem ser armazenadas nesta mistura de lavagem do grânulo. Para tornar AAPC funcional, remover uma pequena alíquota e contar as pérolas utilizando um hemacitómetro. Verificar que as proteínas são carregadas de forma estável sobre as pérolas através de coloração com anticorpos (ex. PE-conjugado anti-ratinho IgG1) e a realização de análises de citometria de fluxo.
- Para carregar grânulos com antigénio, remover 5 x 10 7 esferas, e adicionar a um pequeno frasco de vidro de 1,5 ml, lavar grânulos com 1 ml de PBS estéril. Resuspend lavado contas com 1 ml de PBS estéril e adicionar antígeno; exemplo: carregue com α-GalCer/KRN7000 (5mg/ml). * Nota: Embora, não ter detectado qualquer problema com lipossolubilidade ou a formação de micelas, lipídios devem ser tratadas de acordo com as recomendações do fabricante. Especificamente, KRN7000 foi reconstituída em DMSO (1mg/ml) para estes estudos. KRN7000 e outros antigénios glicolipídicos podem também ser dissolvidos em 0,2 mg / ml de PBS contendo 0,5% de Tween-20 (sonicar 2 hr. A 37 ° C). IMPORTANTE-O AAPC precisa ser carregado para, pelo menos, 48-72 horas antes da utilização.
2. Isolamento de CD161 + CD3 + Células
- Recolher as células mononucleares do sangue periférico (PBMC). Para a separação Ficoll centrifugação em gradiente de densidade de linfócitos a partir de uma crosta inflamatória ou de embalagem leucoferese, primeiro sangue heparinizado diluído com um volume igual de PBS 1X à temperatura ambiente.
- Adicionar 15 ml de Ficoll (aquecida até à temperatura ambiente) para tubos de 50 ml. Lentamente sobreposição25 ml da mistura de sangue diluído no topo do Ficoll. Centrifugar a 2000 rpm durante 30 min à temperatura ambiente, com o freio.
- Remova cuidadosamente a interface de linfócitos (anel branco entre a mídia e Ficoll) com uma pipeta Pasteur e transferir para um novo tubo de 50 ml cônico.
- Lavar as células, preenchendo-se o tubo de 50 ml com PBS e centrifugação a 1500 rpm durante 5 min. Descartar o sobrenadante e combinar os tubos a partir de um único indivíduo, a um único tubo e lavar as células mononucleares do sangue periférico (PBMC) de novo com 20 ml de PBS. Depois contar o PBMC e ressuspender a uma concentração de 5 x 10 7 células / ml em tampão de MACS (1 L de PBS livre de Ca 2 + e Mg 2 +, 5 mmol g de BSA e 2 EDTA).
- A fim de isolar a fracção de células T, começar com 2 ml de PBMC (10 8 células) e adicionar 100 ul de solução de enriquecimento de células Pan-T do T Humano EasySep Kit Enriquecimento Cell. Incubar à temperatura ambiente durante 10 min.
- Adicionar 100 ul de partículas magnéticas para a solução e incubar à temperatura ambiente durante mais 10 min. Trazer o volume final de solvente a 2,5 ml e colocar o tubo no íman roxo por 5 min. Rapidamente despeje a fracção CD3 + para um tubo cónico de 15 ml.
- Lave as células por adição de 5 ml de tampão arrefecido com MACS, contar o número de células viáveis, e remover-se uma alíquota para a coloração de FACS.
- Para seleccionar as células CD161 +, primeiro ressuspender as células T enriquecidos em 980 ul de tampão arrefecido em gelo MACS, adicionam-se 10 ug de mAb anti CD161, e incubar em frigorífico durante 10 min.
- Centrifugar as células a 1.500 rpm a 4 ° C durante 5 min. Em seguida reconstituir o pellet celular em 800 ul de tampão de MACS. Adicionar 200 ul de microesferas anti-IgG1 de ratinho e incubar a solução durante 10 min a 4 ° C.
- Durante este passo de incubação, misturar uma coluna LS por adição de 3 ml de tampão de MACS.
- Em seguida, lava-se as células por centrifugação de 1.500 rpm a 4 ° C durante 5 min. Resupassar as células em 3 ml de tampão MACS. Em seguida, as células pipetar para a coluna MACS LS separação. Certifique-se de evitar a geração de bolhas pipetando lentamente. Lavar a coluna por adição de 3 ml de tampão de MACS. Repita duas vezes.
- Adicionar 3 ml de tampão fresco e remover MACS coluna do campo magnético. Coluna lugar em um tubo de 15 ml cônico. Insira êmbolo e empurre conteúdo para obter purificadas CD161 + CD3 +. Contagem de células NKT enriquecido fração. Você deve têm 2-4 milhões de células.
3. AAPC mediada por expansão de células NKT
- Defina-se a co-cultura, adicionando 10 6 enriquecidos CD161 + células T CD3 + e 10 AAPC 6 em 16 ml de meio completo (meio completo + IL-2, 100 U / ml). Placa esta mistura por adição de 160 volumes ul / poço final para um 96 polistireno de cultura de tecidos bem tratados, U-placa inferior, com a evaporação de baixo da tampa. Realizar troca de meio a cada 7 º dia, adicionando 80 uL de meio fresco.
- Colheitacélulas, contar e realizar a coloração de FACS no dia 12-14.
- As células NKT podem ser expandidas novamente plaqueadas como descrito acima no passo 3.1, especificamente ressuspender 10 6 células T expandidas e 10 AAPC 6 em 16 ml de meio completo. Placa esta mistura por adição de 160 ul / poço de uma placa de 96 cavidades de fundo U-. Continue a atualizar meio de co-cultura a cada 7 º dia, adicionando 80 uL de meio fresco.
- O melhor é congelar as células NKT adicionais após a segunda ronda de expansão (1 x10 6 / criotubo em 1 ml de DMSO a 5% / 95% de FBS).
4. Teste funcional: AAPC mediada por estimulação das células NKT
- Defina-se 5x10 4 células NKT / poço com 5x10 AAPC 5 em volume de 200 ul final (meio completo), em placa de 96 cavidades de fundo U-.
- Colheita sobrenadante da cultura celular por ELISA após 24-48 h.
Resultados
Descrevemos aqui um método para gerar CD1d-Ig AAPC base, feito por acoplamento covalente de CD1d-Ig e anti-CD28 mAb a contas magnéticas para estimular células NK como um método padrão para a propagação de células NKT (figura 1). Primeiro, deve-se demonstrar que as proteínas de fusão de Ig-CD1d são estavelmente imobilizados na superfície das esferas magnéticas. Como mostrado na Figura 2A, CD1d-Ig e anticorpos anti-CD28 foram ambas expressas na superfície das esferas magnéticas. Para examinar a capacidade estimulante da AAPC, nós co-cultura de células hibridomas NKT com AAPC durante a noite, sobrenadantes colhidos a cultura e medida de produção de IL-2 por ELISA. Descobrimos que CD1d-Ig baseado AAPC foram capazes de estimular os hibridomas de células NKT a níveis iguais ou superiores do que os seus homólogos celulares (Figura 3, os dados não mostrados). Curiosamente, descobrimos que nosso mouse hibridomas de células NK são estimuladas por CD1d humana baseada AAPC (Figura 2B), o que proporciona um método simples para testar cada lote de AAPC.
Em seguida, procurou-se demonstrar o potencial de propagação de AAPC, assim células T humanas foram isoladas do sangue periférico. Primeiro, o CD161 + CD3 + fracção de células T foram enriquecidas por separação esfera magnética. Em seguida, as células T foram estimuladas duas vezes por semana com α-GalCer-carregado AAPC. Importante, verificou-se que mesmo com uma população de células relativamente baixa inicial NKT (0,03%), que foi capaz de expandir as células para ~ 67% Vα24 + Vβ11 + (Figura 3). Nós expandimos as células NK do PBMC de muitos voluntários saudáveis e pacientes com câncer e descobriram que a α-GalCer carregado AAPC foram capazes de expandir a população de células NKT em ambos os grupos. Notavelmente, a taxa de expansão era altamente dependente do doador. Como esperado, a mais elevada da população inicial de células Vα24 +, maior será a percentagem de expansão. Além disso,quando se utiliza uma população inicial de 2 milhões de células CD161 + células T CD3 +, pode-se obter> 10 7 células após dois ciclos de expansão (Tabela 1). Cerca de 80-90% das células expandidas NKT são CD4 +, ~ 5% de CD8 +, e os restantes são presumivelmente CD4-CD8-negativas duplas células NKT. Estas células expandidas NKT podem ser utilizadas para estudos funcionais, tal como mostrado na Figura 4A-C. Descobrimos que o nosso expandidas ex vivo de células NKT permanecer responsivo a α-GalCer estimulação e são produtores potentes de IL-17A, TNF-α e IFN-γ. Deve notar-se que, se a população inicial de enriquecimento de células T é baixa e se é incapaz de realizar a etapa de enriquecimento de CD161, a expansão AAPC mediada não pode produzir os resultados esperados (ver Figura 4D, Dador 1). No entanto, se a percentagem de células NKT circulantes é superior a 0,1%, deve ainda ser capaz de obter uma expansão significativade células NKT i. Colectivamente, estes dados demonstram que CD1d based-AAPC pode ser eficazmente usada para expandir e estimular células humanas primárias NKT.

Figura 1. Diagrama esquemático da CD1d: Ig baseados aAPCs porções extracelulares da molécula de CD1d são fundidos com a região constante de uma proteína de cadeia pesada de imunoglobulina separados por um ligante curta de aminoácidos. Estas moléculas podem ser facilmente carregadas com antígenos lipídicos, tais como α-GalCer, simplesmente, incubando-as com um excesso de lipidos de interesse. AAPC foram feitas por acoplamento CD1d-Ig e anti-CD Abs a esferas magnéticas. Neste sistema, CD1d-Ig é utilizado para fornecer o sinal específico de antigénio cognato através do TCR e anti-CD28 mAb fornece o sinal de co-estimulação.

Figura 2. . FACS coloração de proteínas de superfície sobre aAPCs aAPCs A) foram testados para a presença de CD1d: IgG dímero (através de coloração com a PE-conjugado anti-ratinho IgG1), assim como anti-CD28 anticorpo (utilizando FITC-conjugado anti-IgG2a de ratinho) . histogramas abertos indicam controlo isotipo; histogramas cheios representam os anticorpos indicados. CD1d-Ig AAPC Expressando pode estimular IL-2 por células NK. B) A + Vα14 NKT rato de células de hibridoma, DN32.D3, foi co-cultivadas com um meio, o antigénio solúvel (α-GalCer), descarregado AAPC ou α-GalCer-carregado AAPC. Os sobrenadantes da cultura foram colhidos e padrão sandwich ELISA foi usado para medir a produção de IL-2.

Figura 3. Expansão de células NK por CD1d-Ig revestidos células antígeno artificiais apresentando. (A) Primário CD3 + CD161 + duplas células positivas foram isoladas a partir de PBMC utilizando a separação magnética. As células seleccionadas foram estimuladas com α-GalCer carregado, CD1d-Ig AAPC revestida durante 14 dias. As células foram coradas para Vα24 e Vβ11 estimulação AAPC seguinte. (B) primária de células NKT humano mediado lise de uma linha de células B de linfoma. C1R-CD1d células incubadas com células NKT nas proporções indicadas na presença ou ausência de antigénio, uma GalCer (100 ng / ml) em 96 cavidades de fundo U-placas para 20-24 hr. Célula NKT lise celular mediada foi avaliada por ensaio de libertação 51Cr padrão.
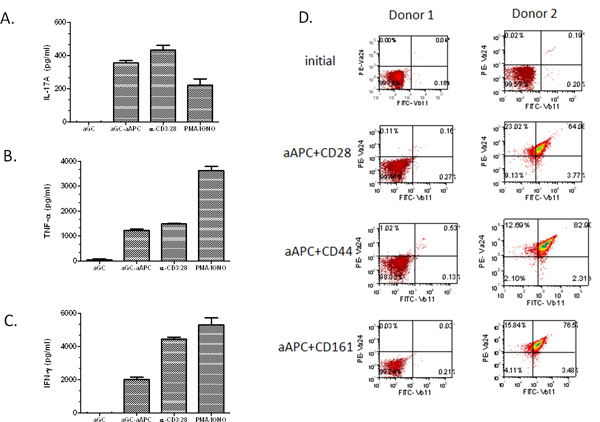
Figura 4. Perfis de citoquinas de células NKT AAPC-expandidas. Após estimulação com α GalCer carregado AAPC, durante duas semanas, as células expandidas NKT (1 x 10 5 / po) foram co-cultivadas com solúvel α-GalCer, PMA / Ionomicina, anti-CD3/28 microesferas, ou α-GalCer carregado AAPC (2 x 10 5 / po) durante 48 horas. (A) IL-17A, (B) de TNF-α, e (C) a produção de IFN-γ foi medida pelo padrão de citocinas ELISA. Os dados apresentados são a produção de citocinas net depois de subtrair os controles negativos (mídia e contas vazias). (D) As células T primárias foram isoladas a partir de PBMC utilizando separação esfera magnética. As células seleccionadas foram estimuladas durante duas semanas, com a indicação de um-GalCer carregado-AAPC. As células foram coradas utilizando Abs específicos para Vα24 + e + Vβ11 e analisadas por citometria de fluxo.
Discussão
AAPC pode ser usado para estudar os requisitos básicos para a activação das células NKT e tem valor clínico potencial para a expansão ex vivo de células T NK para uma imunoterapia adoptiva. Mescher et al. Descreveu um dos primeiros sistemas baseados em grânulos, em que biotinilado de MHC de classe I-péptido murino-construções de cadeia simples foram combinadas com moléculas co-estimuladoras B7.1 e B7.2 biotinilados via estreptavidina para a superfície de microesferas de látex 14, 15. Esta abordagem tem sido utilizada com sucesso para estimular específicas de antigénio de células T a partir de ratos transgénicos. Além disso, uma vez que esta abordagem utiliza uma única cadeia complexo MHC-peptídeo para garantir um carregamento homogénea de moléculas de MHC, cada antigénio do péptido alvo seria necessária uma nova transfecção quanto à expressão do complexo de cadeia única desejado MHC-peptídeo, limitando assim a generalidade da abordagem. É importante ressaltar que o grupo do Dr. Schneck de pioneira no talão baseada-AAPC, através do desenvolvimento de um outro não-celular AAPC talão base, Feito por acoplamento de HLA-Ig, o sinal 1 e anti-CD28, o sinal de 2, sobre as esferas magnéticas. HLA-Ig, uma única forma multimérica de HLA fundida a uma imunoglobulina andaime molecular 16, 17 foi desenvolvido pelo seu grupo. Subsequentemente, desenvolveram MHC-Ig baseado AAPC, que foram mostrados para expandir eficazmente CMV e MART-1 CTL específica 18. Aqui, demonstramos que CD1d-Ig AAPC base pode ser utilizada para expandir as células NKT funcionais. Um estudo foi utilizado um sistema semelhante para examinar a interacção física das células NK com CD1d 19.
Notavelmente, criamos uma célula artificial apresentando antígeno que é adaptável a todos os requisitos que achar necessário para a proliferação de células NKT ideal. O método de expansão AAPC fornece um método simples e confiável para a expansão e enriquecimento de células humanas NKT. Nosso AAPC pode ser modificado para avaliar sistematicamente o papel de um painel de moléculas co-estimulatórias potenciais e avaliar o seu papel na proliferação de células NKTção e função. Assim, AAPC representam uma tecnologia robusta versátil e útil para induzir a expansão de células NK. A geração de aAPCs demora menos de uma semana, e é adequado para a produção de grandes quantidades de grânulos. No entanto, um passo crítico na geração da AAPC é confirmar que CD1d-Ig é estavelmente imobilizado sobre a superfície dos grânulos e para avaliar a sua funcionalidade para garantir a consistência de lote para lote. Uma limitação potencial do sistema é que não existe um mecanismo para desligar a estimulação, excepto a remoção mecânica dos grânulos. Especificamente, o bloqueamento do receptor de células T (TCR) com o antigénio: Complexo CD1d/MHC tipicamente gerar a sinapse imunológica em conjunto com acessórios / adesão de moléculas, o que pode resultar na indução de factores inibidores ou supressor sobre tanto a célula T e célula que apresenta antigénios. No sistema de AAPC, estes factores podem ser regulada pela célula T, mas o cordão não irão expressar os ligandos cognatospara estes receptores.
Além disso, as células CD4 + NKT foram mostrados para suprimir as respostas anti-tumorais em ratinhos e seres humanos, por isso, é possível que a activação não selectiva de todas as células NK (por exemplo, estimulação global com α-GalCer) ou à activação do subconjunto errado pode resultar em indesejáveis imunológica resultados. Consequentemente, deve-se fenotipicamente e funcionalmente caracterizar a AAPC-expandido população de células NKT. Como mostrado na Figura 4, verificou-se que a estimulação com α-GalCer-carregado AAPC expressar anti-CD28 pode resultar células NKT produzem Th1, Th2 e citocinas do tipo Th17. Estudos em ratos relataram que o desafio com IL-33, uma citoquina recentemente identificada, resultou no aumento dos níveis circulantes de citocinas inflamatórias, tais como IL-5 e IL-13. O tratamento de células NKT com IL-33 aumentou a sua produção de citocinas 20. IL-33 é um ligando específico para ST2 e demonstrou-se que ca solúvel ST2n de blocos de IL-33 de sinalização. Assim, como um exemplo de uma possível aplicação, AAPC ST2 expressar pode ser gerado e utilizado para determinar se se pode inibir selectivamente a produção de citocinas do tipo Th2, enquanto a indução da secreção de citocinas Th1 pelas células NK. Também tem sido relatado que a injecção iv de Kb-expressando AAPC em ratinhos C57BL / 6 resultou em metástases do pulmão diminuiu de 21 tumores. Mais importante ainda, estes dados demonstram que o tráfego de AAPC para o pulmão e são capazes de activar células T efectoras subconjuntos. Portanto, pode gerar vários tipos de AAPC e examinar a interação entre antígeno subpopulações de células T específicas. Resumindo, estes estudos demonstram que CD1d-Ig AAPC base pode ser usada para substituir APC celular normal, e têm o potencial de melhorar as actuais abordagens clínicas para imunoterapia baseada em célula NKT-adoptiva.
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Os autores gostariam de agradecer a Priyanka Subrahmanyam para discussões úteis. Os autores não competindo interesse financeiro. Este trabalho foi financiado por doações do American Cancer Society, NIH / NCI K01 CA131487, CA162273 R21, R21 CA162277, e P30 Tumor Imunologia e Imunoterapia Programa para TJ Webb. O conteúdo é da exclusiva responsabilidade dos autores e não representam, necessariamente, a posição oficial do Instituto Nacional do Câncer ou o National Institutes of Health.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários (opcional) |
| Ficoll-Paque PLUS | GE Life Sciences | 17-1440 | |
| EasySep Human T Kit Enriquecimento celular | StemCell Technologies | 19051 | |
| Aloficocianina CD161 humano mAb | Pharmingen | 550968 | |
| EasySep Magnet | StemCell Technologies | 18002 | |
| Anti-ratinho IgG1 micropérolas | Miltenyi Biotec | 130-047-101 | |
| XI dímero solúvel recombinante dimérica Rato CD1d: IG Proteína de Fusão | BD Biosciences | 557599 | |
| Anti-CD28 mAb | Biolegend | 302914 | |
| M-450 pérolas Epoxi | Life Technologies | 150-11 | |
| Alpha-galactosilceramida (KRN7000) | Axxora, LLC | BML-SL232-0100 | |
| Meio RPMI 1640 | Sigma Aldrich | R 0883 | |
| Piruvato de sódio | Gibco | 11360-070 | |
| Não-aminoácidos essenciais | Gibco | 11140-050 | |
| Solução de vitamina | Gibco | 11120-052 | |
| 2-mercaptoetanol | Gibco | ||
| Ciprofloxacina | Bioquímicos Alexis | 380-288-G025 | |
| PE-Vα24Jα18 | Biolegend | 342904 | |
| PE-Vα24 (Clone C15) | Beckman Coulter | A66907 | |
| FITC-Vβ11 (Clone C21) | Beckman Coulter | A66905 | |
| PE-CD1d | Biolegend | 123510 | |
| PE anti-rato IgG1 | BD Biosciences | 556650 | |
| FITC anti-mouse IgG2a | Biolegend | 407105 | |
| DPBS, sem cálcio, magnésio nenhuma | Life Technologies | 14190250 | |
| Azida de sódio | Sigma Aldrich | S8032 | |
| Albumina de Soro Bovino | Americana Bioanalytical | AB00440-00100 | |
| EDTA | Sigma Aldrich | 431788 | |
| IL-2 (Proleukin) | BD Biosciences | 354043 | |
| O soro humano AB | Atlanta Biologicals | S40110 | |
| Rotator Tubo Labquake | Fisher Scientific | 13-687-10Q | |
| BD Falcon 5 ml de poliestireno de fundo redondo tubos | Fisher Scientific | 14-959-1A | |
| Wheaton frascos de vidro com tampa de Amostra | Fisher Scientific | Pequeno (03-343-6A) Grande (03-343-6E) |
Referências
- Fowlkes, B. J. A novel population of T-cell receptor αβ-bearing thymocytes which predominantly expresses a single Vβ gene family. Nature. 329, 251-254 (1987).
- Prigozy, T. I. Glycolipid antigen presentation by CD1d molecules. Science. 291, 664-667 (2001).
- Davodeau, F. Close phenotypic and functional similarities between human and murine αβ T cells expressing invariant TCR α-chains. J. Immunol. 158, 5603-5611 (1997).
- Exley, M., Garcia, J., Balk, S. P., Porcelli, S. Requirements for CD1d recognition by human invariant Vα24+ CD4-CD8- T cells. J. Exp. Med. 186, 109-120 (1997).
- Koseki, H. Dominant expression of a distinctive V14+ T-cell antigen receptor α chain in mice. Proc. Natl. Acad. Sci. U.S.A. 88, 7518-7522 (1991).
- Dellabona, P., Padovan, E., Casorati, G., Brockhaus, M., Lanzavecchia, A. An invariant Vα24-JαQ/Vβ11 T cell receptor is expressed in all individuals by clonally expanded CD4-8- T cells. J. Exp. Med. 180, 1171-1176 (1994).
- Porcelli, S. A., Modlin, R. L. The CD1 System: Antigen-presenting molecules for T cell recognition of lipids and glycolipids. Annu. Rev. Immunol. 17, 297-329 (1999).
- Harada, Y., et al. Expansion of alpha-galactosylceramide-stimulated Valpha24+ NKT cells cultured in the absence of animal materials. J. Immunother. 28, 314-321 (2005).
- Bella, S. D., et al. Altered maturation of peripheral blood dendritic cells in patients with breast cancer. Br. J. Cancer. 89, 1463-1472 (2003).
- Onishi, H., et al. Dysfunctional and Short-Lived Subsets in Monocyte-Derived Dendritic Cells from Patients with Advanced Cancer. Clinical Immunology. 105, 286-295 (2002).
- Shimizu, K., et al. Evaluation of the function of human invariant NKT cells from cancer patients using alpha-galactosylceramide-loaded murine dendritic cells. J. Immunol. 177, 3484-3492 (2006).
- Shiratsuchi, T., Schneck, J., Kawamura, A., Tsuji, M. Human CD1 dimeric proteins as indispensable tools for research on CD1-binding lipids and CD1-restricted T cells. Journal of immunological. 345, 49-59 (2009).
- Webb, T. J., Bieler, J. G., Schneck, J. P., Oelke, M. Ex vivo induction and expansion of natural killer T cells by CD1d1-Ig coated artificial antigen presenting cells. J. Immunol. Methods. 346, 38-44 (2009).
- Tham, E. L., Jensen, P. L., Mescher, M. F. Activation of antigen-specific T cells by artificial cell constructs having immobilized multimeric peptide-class I complexes and recombinant B7-Fc proteins. J. Immunol. Methods. 249, 111-119 (2001).
- Goldberg, J., Shrikant, P., Mescher, M. F. In vivo augmentation of tumor-specific CTL responses by class I/peptide antigen complexes on microspheres (large multivalent immunogen). J. Immunol. 170, 228-235 (2003).
- Dal Porto, J. A soluble divalent class I major histocompatibility complex molecule inhibits alloreactive T cells at nanomolar concentrations. Proc. Natl. Acad. Sci. U.S.A. 90, 6671-6675 (1993).
- Greten, T. F. Direct visualization of antigen-specific T cells: HTLV-1 Tax11-19-specific CD8+ T cells are activated in peripheral blood and accumulate in cerebrospinal fluid from HAM/TSP patients. PNAS. 95, 7568-7573 (1998).
- Oelke, M., et al. Ex vivo induction and expansion of antigen-specific cytotoxic T cells by HLA-Ig-coated artificial antigen-presenting cells. Nat. Med. 9, 619-625 (2003).
- Huang, M. M. S., Borszcz, P., Sidobre, S., Kronenberg, M., Kane, K. P. CD1d1 Displayed on Cell Size Beads Identifies and Enriches an NK Cell Population Negatively Regulated by CD1d1. J. Immunol. 172, 5304-5312 (2004).
- Bourgeois, E. The pro-Th2 cytokine IL-33 directly interacts with invariant NKT and NK cells to induce IFN-gamma production. Eur. J. Immunol. 39, 1046-1055 (2009).
- Ugel, S., et al. In vivo administration of artificial antigen-presenting cells activates low-avidity T cells for treatment of cancer. Cancer Res. 69, 9376-9384 (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados