Method Article
Fabricação e utilização Piggy-back Multibarrel Eletrodos para
Neste Artigo
Resumo
A iontoforese de agonistas e antagonistas neurais durante extracelular In vivo Gravações é uma maneira poderosa de manipular microambiente de um neurônio. Essas manipulações podem facilmente ser feito através de piggy-back multibarrel eletrodos. Aqui descrevemos como fabricá-los e usá-los durante as gravações auditivas.
Resumo
Em gravações in vivo de neurónios individuais permitem que um investigador para examinar as propriedades de queima de neurônios, por exemplo, em resposta a estímulos sensoriais. Neurônios normalmente recebem várias excitatórios e inibitórios entradas aferentes e / ou eferentes que se integram com o outro, e as finais propriedades de resposta medidos do neurônio são conduzidos pelas integrações neurais desses insumos. Para estudar o processamento da informação nos sistemas neural, é necessário compreender as várias entradas de um neurónio ou sistema neural, e as propriedades específicas destas entradas. Um método poderoso e tecnicamente relativamente simples para avaliar o papel funcional de determinados insumos que um neurônio dado está recebendo é dinâmica e reversível suprimir ou eliminar estas entradas, e medir as mudanças na saída do neurônio causados por essa manipulação. Isto pode ser conseguido por alteração farmacologicamente ambiente imediato do neurônio com piggy-back multibarrel electrodes. Estes eletrodos consistem de um eletrodo único barril de gravação e um eletrodo de drogas multibarrel que pode transportar até quatro diferentes agonistas ou antagonistas sinápticas. Os agentes farmacológicos pode ser aplicada por iontoforese, por vezes, desejados durante a experiência, permitindo tempo de entrega controlada e reconfiguração reversível das entradas sinápticas. Como manipulação, como farmacológica do microambiente representa um método poderoso e incomparável para testar hipóteses específicas sobre a função do circuito neural.
Aqui nós descrevemos como piggy-back eletrodos são fabricados, e como eles são utilizados durante experimentos in vivo. O sistema piggy-back permite que um investigador para combinar um eletrodo de registro único barril de qualquer propriedade arbitrária (resistência, tamanho da ponta etc, forma) com um eletrodo de drogas multibarrel. Esta é uma vantagem importante sobre os padrões de multi-eléctrodos, onde todos os barris têm mais ou menos as formas e propriedades semelhantes. Multibarrel electrodes foram introduzidos mais de 40 anos 1-3, e foram submetidos a uma série de melhorias no projeto 2,3 até o tipo piggy-back foi introduzido na década de 1980 4,5. Apresentamos aqui um conjunto de melhorias importantes na produção laboratorial de piggy-back eléctrodos que permitem a penetração profunda do cérebro intacto em preparações em animais in vivo, devido a um eixo de eléctrodo relativamente finas que causa o mínimo de danos. Além disso, estes eléctrodos são caracterizadas por as gravações de baixo ruído, e têm de barris de baixa resistência com drogas para iontoforese muito eficaz dos agentes farmacológicos desejados.
Protocolo
Puxe eletrodos de vidro
Puxe eletrodos de vidro- Puxar eléctrodo único barril. Use vidro único barril capilar com filamento e puxar a ponta para um diâmetro de cerca de 1-2 micrómetros, comprimento do eixo de 10-12 mm, e resistência do eléctrodo correspondente de cerca de 12 MOhm (variação 5-20 MOhms) conforme medido em 0,9% de solução de NaCl. Resistências eletrodo inferior resultaria em atividade mais fundo e, portanto, mais dificuldade em isolar a atividade unitária de neurônios individuais. Para empurrar este eletrodo, usar um horizontal ou vertical com um puxador de filamentos de aquecimento ou serpentinas de aquecimento.
- Puxar eléctrodo multibarrel. Devido ao diâmetro muito maior do vidro multibarrel e a necessidade de uma distribuição uniforme do calor em torno do multibarrel inteiro, um extractor poderoso com uma bobina maior diâmetro de aquecimento, não um filamento de aquecimento, se necessário. Uma pipeta multibarrel tem de ser introduzido no centro do filamento de aquecimento com no contacto com a serpentina de aquecimento. Note-se que, além das pipetas de 5 barril descrito aqui, pipetas 3 barril ou 7 barril são alternativas disponíveis comercialmente. Puxar de vidro até uma ponta de pipeta de cerca de 10 micrómetros de diâmetro total, ou menos. A ponta vai ser quebrado para o diâmetro correcto no passo seguinte, de modo que o tamanho exacto da ponta é menos crítico durante o processo de puxar do que a forma geral da ponta do eléctrodo, o qual deve ser longa e relativamente fino. Referem-se a imagem na Figura 1C para a forma desejada do eléctrodo ponta. Formas de eléctrodos curtos e grossos (Figura 1B) fará com que uma quantidade substancial de danos nos tecidos quando avança para dentro do cérebro, enquanto as formas de eléctrodo muito longos e finos (Figura 1A), irá dobrar e assim torná-la difícil de quebrar a extremidade do eléctrodo para a correcta diâmetro (ver passo 2).
Modificar Dicas Eletrodo
Modificar pontas dos eletrodos. Antes que os dois eléctrodos podem ser coladas umas às outras, Eles têm de ser modificados. O eixo do eléctrodo único necessita de ser dobrado antes de ser ligado ao multibarrel para garantir que o eixo do conjunto do eléctrodo piggy-back acabado é o mais fino possível. Além disso, a ponta do eléctrodo multibarrel tem de ser interrompida, a fim de assegurar a resistência baixa para iontoforese.- Dobre eixo de um eletrodo único barril por cerca de 20 graus. Use a chama menor bico de Bunsen possível. Típicas "pequenos" bicos de Bunsen de empresas de fornecimento padrão de laboratório criar tamanhos de chama que são grandes demais para esta aplicação. Para contornar este problema utilizar o queimador de Bunsen menor comercial e fixar uma agulha de seringa (calibre 18 ~) para o topo do queimador, e selar a ligação com cimento dental. Quando em funcionamento, a chama deve ser difícil de ver, de cerca de 5 mm ou menos de diâmetro, e cerca de 8 mm de altura. Qualquer movimento do ar na sala se apaga a chama, por isso é uma boa idéia para operar o gravador em umsala fechada, ou para utilizar escudos de vento. Mova o eletrodo único barril através da chama para dobrá-lo por cerca de 20 graus. Ter em vista que a chama do queimador de fusão do vidro para a zona de transição a cerca de 10 milímetros de distância entre a ponta do eléctrodo. Para evitar a fusão da extremidade do eléctrodo que sugerem que o eléctrodo ser mantida a cerca de 45 graus, a ponta voltada para baixo, e mover-se do eléctrodo através da chama de forma relativamente rápida.
- Quebre a ponta do eletrodo multibarrel. Para garantir o controle visual ao quebrar a ponta do eletrodo, use um microscópio com um objectivo mínimo de 10x e 10x oculares. A escala de medida inserida no ocular também serão necessários para medir tamanhos de ponta. Anexar um pedaço de plexiglass para o microscópio de modo que a extremidade do plexiglass pode ser visto em cerca de um terço a um meio do campo de visão do microscópio. No nosso caso, a peça de plexiglass é cerca de 25 x 70 mm e 5 mm de espessura e ligada por meio de um parafuso que pode ser fixada em um personalizadofeito fio em platina do microscópio. É importante ter um design que permite que o plexiglass mover independentemente da corrediça. Coloque o eletrodo multibarrel em uma cama de massa de modelar sobre uma lâmina de vidro, e inserir o slide contendo o eletrodo no suporte do microscópio do slide. Usando manipuladores do microscópio de xy, mova suavemente a ponta do eletrodo contra a peça de acrílico, e observar a quebra da ponta através das oculares do microscópio. Tentativa de limpa quebrar a ponta multibarrel para um diâmetro acumulado de cerca de 25-35 micrômetros. Descarte pipetas com diâmetros de ponta que se desprenderam muito grande, ou dicas com intervalos irregulares. Nós descartar aproximadamente 30% dos eléctrodos devido às nossas multibarrel pontas de formas indesejáveis.
Montar Piggy back-eletrodo
Montar piggy-back eletrodo.- Eléctrodos de posição. Remover pedaço plexiglass usado no passo 2.2 a partir de platina do microscópio. Fixe concluídamultibarrel eletrodo em massa de modelar sobre uma lâmina de vidro, a ponta apontando ligeiramente para cima. Apontando para cima, será importante para o passo 3.2, a colagem dos dois eléctrodos. Dicas que apontam-se fazer com que a cola para fugir da ponta, evitando a colagem das pontas dos eletrodos. Insira dobrado eléctrodo único barril em suporte de eléctrodo do micromanipulador feitos (Figura 2). Usando orientação visual em primeiro lugar e então a orientação de microscópica, abaixe o eletrodo único barril para o eletrodo multibarrel. O único eléctrodo deve ser reduzido directamente para dentro da ranhura que é formada pela disposição das 5 barris, com a sua ponta a ponta saliente da ponta multibarrel por cerca de 5-10 micrómetros. Ao abaixar o tambor único, observar de perto o ângulo que é formado entre os dois eléctrodos. Para obter o melhor resultado evitar quaisquer ângulos em que as pontas apontam afastados uns dos outros, mas sim tentar diminuir o único eléctrodo para o multi perfeitamente paralelos, ou mesmo com a sua pontatocando o multibarrel primeira, formando um arranjo muito ligeiro "cunha". Uma vez que a ponta do tambor só é muito flexível, que se curva quando o único eléctrodo é abaixado um pouco mais após a ponta ter atingido a superfície de topo do eléctrodo de barril múltiplas, formando uma ponta limpa composto que tem uma quantidade pequena de acção de mola embutido que ajuda a manter as pontas juntas. No entanto, se o ângulo entre o tambor e único eléctrodo multibarrel é demasiado íngreme (muito de uma cunha), a acção de mola vai ser muito alta e dobrar para baixo o arranjo de eléctrodo.
- Eixos cola eletrodos juntos. Cole as hastes dos dois eletrodos em conjunto usando cianoacrilato (super cola). Coloque uma pequena gota de cola para o lado pequeno de um palito plano e conjunto de eléctrodos de contato com a gota de cola. Comece na posição mais distal das dicas e mova lentamente palito com queda de cola ao longo eixos de eletrodos para as pontas dos eletrodos. Usando cola demais, ou a aplicação de cola too perto das pontas de eléctrodos irá resultar na colagem das aberturas dos eléctrodos, tornando o eléctrodo pelo menos parcialmente funcional.
- Estabilizar conjunto com cimento dental. Misture uma pequena quantidade de cimento dentário e acrílico dental em um prato de plástico descartável pequeno barco ou pesar, utilizando um palito plana. Espere até que o cimento se torna moldável e se aplica uma pequena quantidade para a junção entre os dois eléctrodos para estabilizar a articulação (material-de-rosa na Figura 3). Permitir que cerca de 15 minutos para secar.
- Retire e guarde eletrodo. Retire cuidadosamente o eletrodo concluída piggy-back a partir do primeiro titular micromanipulador, e depois separar da lâmina de vidro, e guarde em um recipiente à prova de poeira.
Preparar soluções Eletrodo de preenchimento
Preparar soluções eléctrodo de enchimento. Uma vez que a iontoforese requer moléculas carregadas, a maioria dos agentes têm de ser dissolvidos ou em um meio ácido ou alcalino (tipicamente umta pH de cerca de 3-4, ou um pH de cerca de 8-10, respectivamente). Um certo número de produtos químicos que são usados frequentemente em iontoforese são listados na Tabela 1. No caso dos agentes que não estão listados na tabela, determinar a partir do valor de pKa, se seria mais fácil de utilizar a molécula de ácido ou em um ambiente alcalino para manter a molécula carregada, e dissolvem-se em conformidade. Para melhores resultados, misture todas as soluções diariamente.Preencha e Preparar Eletrodos
Preencher e preparar eletrodos. Pouco antes, usando o eletrodo, de volta a encher cada barril com seu respectivo medicamento, usando fibra de carbono 28-34 agulhas de calibre ligados a seringas com filtros de seringa. Encha as quatro barris exteriores da configuração 5-barril com os fármacos de eleição, e o centro do tambor com NaCl 3M como um tambor de equilíbrio. Preencha o eletrodo de registro único barril com NaCl 3M também. Adicionando um corante para a solução de NaCl, tal como o vermelho ou verde fenol rápido irá tornar mais fácil visualizar a ponta do eléctrododurante a colocação do eléctrodo sobre a superfície do cérebro. Insira o eletrodo no porta-eletrodo da configuração de gravação e inserir todos os fios para os barris de vidro apropriados. Use fio isolado de prata a partir da qual cerca de 1 cm de isolamento foi removida na ponta. Não deve ser de 5 fios para o eléctrodo multibarrel (4 barris de drogas e um tambor de equilíbrio), mais o fio amplificador que necessita de ser inserido no eléctrodo barril de gravação única.Ligue módulos de bomba Iontoforese
Ligue módulos de bomba de iontoforese e testar todos os barris. A função de teste de eletrodo de cada módulo da bomba irá ajudar a determinar se o barril do eletrodo é funcional. Para prevenir fugas da droga a partir dos tambores quando não está em uso, uma tensão de retenção na polaridade oposta à carga molécula tem de ser aplicada.
Resultados
Neste experimento, o receptor de glicina hidrocloreto de estricnina antagonista foi iontoforeticamente aplicado. Bloqueio de inibição glicinérgica normalmente aumenta atirando nos neurônios. Figura 4 mostra dados de exemplo de um neurônio auditivo cujas respostas a estímulos sonoros sinusoidais de intensidade crescente entregue aos ouvidos do animal foram registrados. Este tipo de um experimento é referido como o neurónio de descarga função intensidade taxa vs. Sons mais altos resultaram em maiores taxas de Spike (curva preta). O atual iontoforese inicial utilizado durante este experimento foi de 15 nA. Depois que o atual foi ligado e as mudanças na função de intensidade taxa se estabilizou em seu nível novo (curva azul escuro), a corrente de ejeção foi progressivamente aumentada para 30, 45 e 60 nA (laranja, verde e luz curvas azuis, respectivamente). Em cada caso, as respostas do neurónio sobre a mesma gama de intensidades sonoras foram registados após as mudanças na discharge taxa intensidade funções em resposta à corrente de ejecção novo tinha estabilizado. A ejeção mais apropriado atual para usar neste exemplo foi de 45 a 60 nd nd porque esses níveis de corrente já não alterar de forma diferente as respostas do neurônio. Este resultado sugere que a 45 nA de corrente, todos os receptores de glicina de que neurónio já havia sido bloqueada por cloridrato de estricnina. Qualquer aumento adicional da ejeção estricnina atual e liberando ainda mais não resultou em uma mudança mais do neurônio descarga função taxa nível. Após a conclusão do protocolo, a corrente de ejeção foi desligado. A recuperação das respostas neurais de volta à linha de base foi obtida após cerca de 25 minutos (linha vermelha). Isso pode levar, dependendo do tipo e da quantidade de fármaco ejectado, entre alguns segundos e várias dezenas de minutos.
| Droga | Concentração | pH de uma solução | Solvente | Companhia | Gato. # | Retenção típico atual | Correntes típicas de ejeção |
| GABA | 500 mM | 3,5-4,0 | dH2O | Sigma | A-2129 | -15 NA | 5 nA a 100 nA |
| Glicina | 100 mM | 3,5-4,0 | dH2O | Sigma | G-7126 | -15 NA | 5 nA a 100 nA |
| Metiliodeto bicuculina | 10 mM | 3,0 | 0,165 M de NaCl em dH2O | Sigma | B-6889 | -15 NA | NA 5 a 60 nA |
| Cloridrato de estricnina | 10 mM | 3,0 | 0,165 M de NaCl em dH2O | Sigma | S-8753 | -15 NA | NA 5 a 80 nA |
| Ácido L-glutâmico | 500 mM | 8 | dH2O | Sigma | G-1251 | 30 nA | -10 A -150 nA nA |
| Ácido L-aspártico | 500 mM | 8 | dH2O | Sigma | A-8949 | 30 nA | -10 A -150 nA nA |
| Ácido caínico | 1 mM | 9 | dH2O | Sigma | K-0250 | 30 nA | -10nA a -100 nA |
Tabela 1. Medicamentos comumente usados, com pH de dissolução e concentração. A tabela lista os agonistas mais utilizados sinápticas e antagonistas utilizados com iontoforese. O ambiente de pH listados contas para a necessidade de polarizar t agentes stas, e as contas de concentração sugeridas para a variabilidade na eficácia entre diferentes medicamentos.
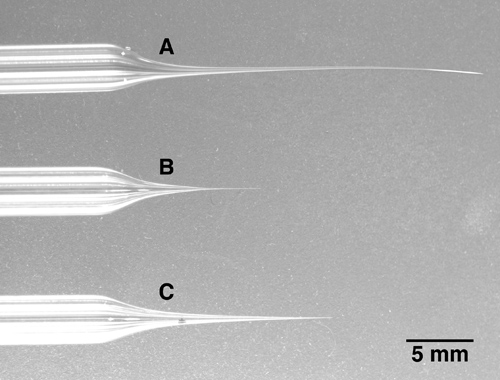
Figura 1. Três multibarrel pipetas com comprimentos diferentes de ponta A: A ponta. Deste eletrodo 5 barril foi puxado muito longo e fino. Note-se que a ponta é dobrada e muito macio. Este tipo de ponta é muito difícil de quebrar para o diâmetro desejado. B: A ponta do eletrodo é muito curto e atarracado. Quando avançou para zonas mais profundas do cérebro, este eléctrodo irá causar danos cerebrais desnecessário devido ao fato de que o eléctrodo se torna relativamente espessa apenas alguns milímetros depois da ponta. C: Um exemplo de um eléctrodo com uma ponta correctamente puxado. Apesar de ser longo e fino, a dica é ainda firme e pode ser facilmente quebrado com o diâmetro da ponta desejado.
gura 2 "src =" / files/ftp_upload/4358/4358fig2.jpg "/>
Figura 2. Desenho de montagem manipulador eletrodo. Manipulador O conjunto é utilizado em conjunto com um microscópio para montar os eletrodos piggy-back. Os itens marcados a cinzento são produtos comercialmente disponíveis e estão listados na Tabela 2. Itens marcados em azul foram personalizados usinado na loja da nossa instituição máquina. Elas são: 1) 1/4 de polegada em aço da placa de tamanho 43x26 centímetros com furos para a etapa 423 Newport perfurado em la de acordo com o padrão de furos proporcionado por Newport, 2) uma fase de inclinação que permite uma inclinação do conjunto em ângulos arbitrários, 3) um conector que monta o suporte do eletrodo para o estágio superior de translação.
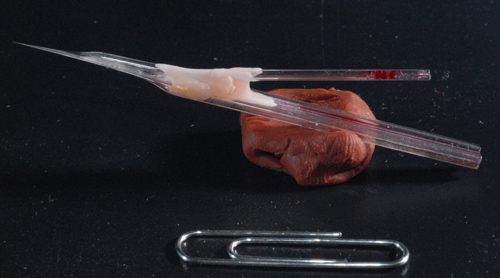
Figura 3. Foto de uma amostra de eletrodo piggy-back. Um eletrodo de 5 barril acabado reunidos com um único barril de gravação electrode. Observe eixo longo de cerca de 7 mm para permitir que uma gravação profundas do cérebro.
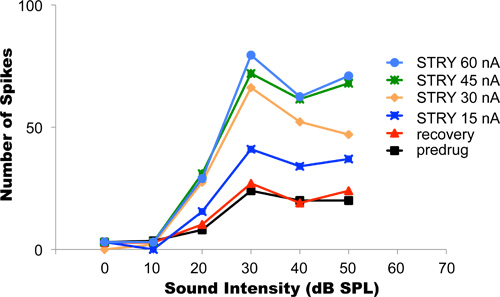
Figura 4. Titulação de correntes de ejeção. O gráfico mostra taxa de intensidade registrados funções de um neurônio auditivo único, orelhas do animal foram estimuladas com tons de várias intensidades. Sons mais altos tendem a provocar maiores taxas de queima. Antes da aplicação da droga, a função do neurônio taxa de intensidade apresentou as menores taxas de Spike (curva preta). Correntes de ejeção progressivamente maiores receptores bloqueado progressivamente mais glicina no neurônio, resultando em taxas de queima progressivamente maiores. A ejeção ideal atual neste neurônio era 45-60 nA. Com estas correntes de ejecção, o bloqueio completo de todos os receptores do neurônio glicina foi obtida. Após a conclusão do protocolo experimental, a iontoforese foi terminada e o neurónio foi permitidorecuperar. A recuperação completa foi alcançada quando a recuperação função taxa de intensidade correspondente a função inicial de recuperação pré-droga. Reproduzido com permissão da American Physiological Society, de Klug et al, 1995.
Discussão
Descrevemos uma técnica que permite a manipulação de um único neurônio microcircuito do in vivo, enquanto que, ao mesmo tempo que permite a gravação de respostas do neurônio durante a manipulação experimental. Circuitos neurais são manipulados através da aplicação iontophoretical sinápticos dos agonistas e antagonistas. A principal vantagem da iontoforese sobre pressão de ejecção é a de que a iontoforese não exige o movimento físico do fluido a partir do eléctrodo no tecido neural, e assim não há nenhuma preocupação de provocar danos nos tecidos por meio da pressão aplicada ou o volume de líquido. A principal limitação desta técnica é a falta de informação sobre a concentração de droga absoluta no tecido, e o volume de tecido afectado. No entanto, uma vez que as quantidades de agentes farmacológicos ejectadas com iontoforese são muito menores e muito mais controlável do que com precisão a pressão de ejecção, a recuperação a partir da aplicação da droga é tipicamente muito mais rapidamente umd muito mais completo. Microiontophoresis tem sido usado com sucesso em vários sistemas neuronais sensoriais, e outros, e é aplicada com êxito em mais áreas do cérebro, com pouco ou nenhum processamento intrínseca. A razão é que uma parte do agente farmacológico ejectado pode difundir a partir do local de aplicação para um neurónio vizinho e também manipular as propriedades de resposta dos neurónios vizinhos.
O fabrico separado de eléctrodos de tambor simples ou múltipla permite a combinação de eléctrodos com propriedades arbitrárias e não relacionados. Puxando barris de eléctrodos em conjunto e utilizando alguns para gravação e alguns para fins de iontoforese deve produzir pontas de eléctrodos com propriedades muito semelhantes, de tal modo que as pontas de eléctrodos ou seria demasiado grande para gravação única célula, ou demasiado pequena para a aplicação do fármaco. Além disso, ter a ponta único barril estender para além das pontas de eletrodos multibarrel por cerca de 20 micrômetros reduz o ruído nas gravações, umd elimina possíveis efeitos de confusão atual das correntes de retenção ou ejeção de disparo do neurônio 3.
Piggy-back multibarrel eléctrodos tenham sido previamente descrito com mais de 30 anos atrás, 4-6 e têm sido utilizados com muito sucesso para dissecar circuitos neurais 7-18 19-29. Assim, o método por si só não é nova ou original. No entanto, os detalhes particulares da preparação e utilização do eléctrodo ter sido modificado ao longo dos anos, e o conjunto de instruções descritas aqui tem provado ser especialmente fácil e bem sucedida, e não foi publicado em detalhe noutro local na literatura. Particularmente, a flexão da ponta do tambor único eléctrodo permite que a ponta final do eléctrodo piggy-back a ser relativamente fino (Figura 3) e, portanto, permite a gravação de núcleos profundos com danos mínimos para o cérebro, o saliente do tambor único eletrodos sobre o eletrodo multi-barril remove praticamente todas as moedast efeitos, que eram muitas vezes citada como uma desvantagem da técnica 3. Novos detalhes aqui apresentados como tendo a extremidade do eléctrodo que aponta para cima durante o processo de colagem e de repouso do cilindro único na ranhura do eléctrodo multibarrel irá garantir uma elevada taxa de sucesso na produção de eléctrodos piggy-back. A técnica é relativamente fácil e geralmente pode ser dominado por um novato dentro de alguns dias.
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
O trabalho foi financiado pelo R01 DC 011.582 (AK) e RO1 DC011555 (DJT).
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do item | Fabricante | Comentário | Gato. # |
| Bico de Bunsen | Disponível em: VWR | 17928-027 | |
| Dois componentes do cimento dental: "Cold cura" material odontológico | Co-oral-ite Dental Mfg Co | Disponível em: AM Systems, Inc | 525000 |
| Dois componentes do cimento dental: Prótese de material composto líquido de reticulação | Co-oral-ite Dental Mfg Co | Disponível em: AM Systems, Inc | 525000 |
| Cola líquida | Henkel | Disponível em: Loctite Super Cola | 01-06849 |
| Micro iontoforese-Unele: Neurophore BH-2 | Harvard Apparatus | Disponível a partir de: Harvard Apparatus | 65-0200 e 65-0203 |
| Fio de prata isolados | AM-Systems | Disponível em: AM-Systems | 785500 |
| Extrator Horizontal | Zeitz DMZ-Universal Extrator | Disponível em: AutoMate Científico | NA |
| Micro-Manipulador peças: suporte do eletrodo | WPI | Disponível em: WPI | M3301EH |
| Micro-Manipulador peças: estágio linear | Série 423 Newport | Disponível em: Newport | 423 |
| Micro-Manipulador peças: fase de rotação | Newport RSP-2 | Disponível em:Newport | RSP-2 |
| Micro-Manipulador peças: tradução z | Série 433 Newport | Disponível em: Newport | 433 |
| Micro-Manipulador peças: suporte de ângulo de 90 ° para montar e z xy eixo | Newport 360-90 | Disponível em: Newport | 360-90 |
| Micro-Manipulador peças: x tradução / linear fase | Série 423 Newport | Disponível em: Newport | 423 |
| Micro-Manipulador peças: y tradução / linear fase | Newport 423 | Disponível em: Série Newport | 423 |
| Microscópio | Leitz Laborlux 11 | ||
| Microscópio: objetivo | Leitz Wetzlar 10x, NA 0,25 | 519760 | |
| Microscópio: eypieces | Leitz Wetzlar, Periplan 10x/18 | 519748 | |
| Microscópio: estágio | Leitz Wetzlar | 513544 | |
| Multibarrel capilar | N / A | Disponível em: AM Systems, Inc | 612000 |
| Sinlge barril capilar (GC 150F-10) | Harvard Apparatus | Disponível a partir de: Harvard Apparatus | 30-0057 |
| Puxador vertical | Narishige modelo PE-2 | ||
| Personalizados elementos feitos do manipulador Micro-(marcado luz blue na Figura 1) | |||
| chapa de aço | |||
| base de inclinação | |||
| acessório para suporte do eletrodo | |||
Tabela 2. Fabricantes e números de itens de todos os equipamentos e materiais utilizados no procedimento. |
Referências
- Curtis, D. R. A method for assembly of "parallel" micro-pipettes. Electroencephalogr. Clin. Neurophysiol. 24, 587-589 (1968).
- Carette, B. A new method of manufacturing multi-barrelled micropipettes with projecting recording barrel. Electroencephalogr. Clin. Neurophysiol. 44, 248-250 (1978).
- Crossman, A. R., Walker, R. J., Woodruff, G. N. Problems associated with iontophoretic studies in the caudate nucleus and substantia nigra. Neuropharmacology. 13, 547-552 (1974).
- Havey, D. C., Caspary, D. M. A simple technique for constructing "piggy-back" multibarrel microelectrodes. Electroencephalogr. Clin. Neurophysiol. 48, 249-251 (1980).
- Verberne, A. J., Owens, N. C., Jackman, G. P. A simple and reliable method for construction of parallel multibarrel microelectrodes. Brain Res. Bull. 36, 107-108 (1995).
- Oliver, A. P. Technical contribution. A simple rapid method for preparing parallel micropipette electrodes. Electroencephalogr. Clin. Neurophysiol. 31, 284-286 (1971).
- Oswald, J. P., Klug, A., Park, T. J. Interaural intensity difference processing in auditory midbrain neurons: effects of a transient early inhibitory input. J. Neurosci. 19, 1149-1163 (1999).
- Park, T. J., Pollak, G. D. GABA shapes a topographic organization of response latency in the mustache bat's inferior colliculus. J. Neurosci. 13, 5172-5187 (1993).
- Park, T. J., Pollak, G. D. GABA shapes sensitivity to interaural intensity disparities in the mustache bat's inferior colliculus: implications for encoding sound location. J. Neurosci. 13, 2050-2067 (1993).
- Peterson, D. C., Nataraj, K., Wenstrup, J. Glycinergic inhibition creates a form of auditory spectral integration in nuclei of the lateral lemniscus. J. Neurophysiol. 102, 1004-1016 (2009).
- Ramsey, L. C. B., Sinha, S. R., Hurley, L. M. 5-HT1A and 5-HT1B receptors differentially modulate rate and timing of auditory responses in the mouse inferior colliculus. Eur. J. Neurosci. 32, 368-379 (2010).
- Wenstrup, J. J., Leroy, S. Spectral Integration in the Inferior Colliculus: Role of Glycinergic Inhibition in Response Facilitation. J. Neurosci. 21, RC124 (2001).
- Yang, L., Pollak, G. D. Features of ipsilaterally evoked inhibition in the dorsal nucleus of the lateral lemniscus. Hear. Res. 122, 125-141 (1998).
- Yang, L., Pollak, G. D. GABA and glycine have different effects on monaural response properties in the dorsal nucleus of the lateral lemniscus of the mustache bat. J. Neurophysiol. 71, 2014-2024 (1994).
- Yang, L., Pollak, G. D. The roles of GABAergic and glycinergic inhibition on binaural processing in the dorsal nucleus of the lateral lemniscus of the mustache bat. J. Neurophysiol. 71, 1999-2013 (1994).
- Yang, L., Pollak, G. D., Resler, C. GABAergic circuits sharpen tuning curves and modify response properties in the mustache bat inferior colliculus. J. Neurophysiol. 68, 1760-1774 (1992).
- Faingold, C. L., Gehlbach, G., Caspary, D. M. On the role of GABA as an inhibitory neurotransmitter in inferior colliculus neurons: iontophoretic studies. Brain Res. 500, 302-312 (1989).
- Faingold, C. L., Hoffmann, W. E., Caspary, D. M. Effects of excitant amino acids on acoustic responses of inferior colliculus neurons. Hear. Res. 40, 127-136 (1989).
- Hurley, L., Pollak, G. D. Serotonin shifts first-spike latencies of inferior colliculus neurons. J. Neurosci. 25, 7876-7886 (2005).
- Hurley, L., Pollak, G. D. Serotonin effects on frequency tuning of inferior colliculus neurons. J. Neurophysiol. 85, 828-842 (2001).
- Hurley, L. M., Pollak, G. D. Serotonin differentially modulates responses to tones and frequency-modulated sweeps in the inferior colliculus. J. Neurosci. 19, 8071-8082 (1999).
- Klug, A., Bauer, E. E., Pollak, G. D. Multiple components of ipsilaterally evoked inhibition in the inferior colliculus. J. Neurophysiol. 82, 593-610 (1999).
- Klug, A., Park, T. J., Pollak, G. D. Glycine and GABA influence binaural processing in the inferior colliculus of the mustache bat. J. Neurophysiol. 74, 1701-1713 (1995).
- Moore, M. J., Caspary, D. M. Strychnine blocks binaural inhibition in lateral superior olivary neurons. J. Neurosci. 3, 237-242 (1983).
- Nataraj, K., Wenstrup, J. J. Roles of inhibition in creating complex auditory responses in the inferior colliculus: facilitated combination-sensitive neurons. J. Neurophysiol. 93, 3294-3312 (2005).
- Fukui, I., Burger, R. M., Ohmori, H., Rubel, E. W. GABAergic inhibition sharpens the frequency tuning and enhances phase locking in chicken nucleus magnocellularis neurons. J. Neurosci. 30, 12075-12083 (2010).
- Burger, R., Pollak, G. D. Reversible inactivation of the dorsal nucleus of the lateral lemniscus reveals its role in the processing of multiple sound sources in the inferior colliculus of bats. J. Neurosci. 21, 4830-4843 (2001).
- Burger, R. M., Pollak, G. D. Analysis of the role of inhibition in shaping responses to sinusoidally amplitude-modulated signals in the inferior colliculus. J. Neurophysiol. 80, 1686-1701 (1998).
- Coleman, W. L., Fischl, M. J., Weimann, S. R., Burger, R. M. GABAergic and glycinergic inhibition modulate monaural auditory response properties in the avian superior olivary nucleus. J. Neurophysiol. 105, 2405-2420 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados