Method Article
Procedimentos cirúrgicos para um modelo de rato de Transplante de Fígado parcial ortotópico com reconstrução arterial hepática
Neste Artigo
Resumo
O transplante hepático em ratos é um modelo indispensável experimental para a pesquisa biomédica. Aqui apresentamos nossos procedimentos cirúrgicos para transplante ortotópico do fígado do rato com a reconstrução da artéria hepática utilizando um enxerto parcial de 50%.
Resumo
O transplante hepático (OLT) em ratos usando um enxerto total ou parcial é um modelo indispensável para a pesquisa experimental de transplante, como estudos sobre a preservação do enxerto e isquemia-reperfusão 1,2 lesão, respostas imunológicas 3,4, 5,6 hemodinâmica e pequeno para a dimensão síndrome 7. A OLT rato está entre os modelos animais mais difíceis em cirurgia experimental e exige técnicas de microcirurgia avançados que levam muito tempo para aprender. Por conseguinte, a utilização deste modelo tem sido limitada. Desde a confiabilidade e reprodutibilidade dos resultados são os principais componentes dos experimentos em que esses modelos animais complexos são usados, é essencial para os cirurgiões que estão envolvidos em OLT rato a ser treinados nos procedimentos de bem-padronizados e sofisticado para esse modelo.
Embora várias técnicas e modificações do OLT em ratos foram descritos 8 uma vez que o primeiro modelo descreviaed por Lee et al. 9 em 1973, a eliminação da reconstrução arterial hepática 10 e da introdução da técnica de anastomose cuff por Kamada et al. 11 foram um grande avanço neste modelo, uma vez que os procedimentos de reconstrução simplificada, em grande . No modelo de Kamada et al., O rearterialization hepática foi também eliminado. Desde ratos podem sobreviver sem fluxo arterial hepática após transplante de fígado, houve uma considerável controvérsia sobre o valor de arterialização hepática. Contudo, a superioridade fisiológica do modelo arterializado tem sido cada vez mais reconhecido, especialmente em termos de conservação do sistema biliar 8,12 e a integridade hepática 8,13,14.
Neste artigo, apresentamos detalhados procedimentos cirúrgicos para um modelo de rato de OLT com a reconstrução da artéria hepática utilizando um enxerto parcial de 50% após a ressecção hepática ex vivoção. Os procedimentos de reconstrução para cada navio e do ducto biliar são realizados pelos métodos seguintes: uma sutura de polipropileno 7-0 contínuo para a supra-infra e veia cava inferior, uma técnica de manga para a veia porta, e uma técnica de stent na artéria hepática e ducto biliar.
Protocolo
1. Técnicas básicas e procedimentos comuns
- Todos os procedimentos são realizados em condições limpas, mas não esterilizado.
- Uma vez que o abdómen do rato é aberto, todos os procedimentos são realizados sob um microscópio cirúrgico, com uma ampliação de 16x. Excepções são a ressecção hepática ex vivo, o qual é realizado a 10x, e os procedimentos seguintes, que são realizados em 25x: inserção de um stent no ducto biliar e da artéria hepática, e a reconstrução da artéria hepática, a veia cava infrahepatic (IHVC), e do ducto biliar.
- Cotonetes de algodão são usadas para manipulação delicada dos órgãos, dissecção romba dos tecidos, hemostase e compressão. Compressas de gaze (5 x 5 cm) embebido com uma solução de Ringer com lactato são utilizados para retrair o fígado ou intestinos, e para manter os órgãos húmido. O grampo Satinsky pode ser utilizado para a retracção de gaze cobertas de intestinos para a esquerda ou a cauda do rato para ampliar o campo cirúrgico em volta da IHVC.
- Todas as ligaduras são realizadas com um fio de seda 6-0 com excepção dos pedículos dos lobos hepáticos durante a ressecção hepática ex vivo, em que fios de seda 4-0 são utilizados. A ligadura pode ser puxado por um grampo de buldogue DeBakey ou outros instrumentos para fornecer a tensão adequada para o ponto ligado de modo que a segunda ligadura pode ser efectuada a uma distância da primeira, e a divisão entre os dois pontos de ligadura pode ser feita adequadamente.
- Todas as injecções intravenosas são realizadas através da veia peniana.
- Durante os procedimentos de reconstrução de veia cava supra-hepática (SHVC), a veia porta, da artéria hepática e do ducto biliar, uma pequena massa de argila à base de petróleo é utilizada para manter um anel de dedo de uma pinça vascular periférica ou uma pinça mosquito para os manter fixos em posição.
2. Preparação pré-cirúrgica
- Ratos Lewis macho, pesando entre 230 e 250 g são usados como dador e do receptor para o transplante de fígado. Os ratos são todosdevido livre acesso a água e comida até a indução da anestesia.
- Cuff para a veia porta (Figura 1): Preparar a braçadeira para a veia porta pelo corte de um cateter de calibre 14, com uma lâmina de escalpelo N ° 11 sob o microscópio. A braçadeira é constituída por um corpo e uma extensão, cada um com um comprimento de 2 mm. Fazer ranhuras circunferenciais na braçadeira de fixação na parede da braçadeira passo a passo circunferencialmente com uma pinça mosquito, de modo que um fio podem ser fixados firmemente no punho sem escorregar.
- Stents para a via biliar e a artéria hepática (Figura 1): Corte cateteres de calibre 24 com um bisturi ao microscópio para produzir chanfros em ambas as extremidades, os cateteres com um comprimento de 4 mm para a artéria hepática e de 5 mm para o ducto biliar .
3. Operação doador
O esquema da remoção do fígado do rato doador é mostrado na Figura 2. Este procedimento requer aproximadamentemadamente min 30-35.
- Anestesiar o rato com a inalação de 4% vol de isoflurano em 100% de oxigénio a uma velocidade de fluxo de 4 L / min para a indução da anestesia, e de 1,5% vol de 2 L / min para a manutenção. Injectar buprenorfina (0,1 mg / kg) por via subcutânea como analgésico. Coloque o rato em uma almofada de aquecimento, e corrigir os braços usando o sistema de retração magnético fixador (Figura 3A). Raspar a pele de toda a região abdominal do rato, e esterilizar a pele correspondente com uma solução de povidona-iodo.
- Abrir o abdômen de incisão na linha com extensões bilaterais. Coloque uma seringa de 5 ml, sob as costas do rato de modo que a SHVC é elevada ventralmente. Usando uma pinça mosquito, pinça e puxe o processo xifóide em direção à cabeça, e aplicar os afastadores subcostais para abrir o campo cirúrgico (Figura 3A).
- Dissecar o ligamento falciforme e ligamento triangular esquerda. Em seguida, ligadura da veia e dividir frênico esquerdo.
- Retragir os lobos mediano e lateral esquerda para cima com um cotonete gaze molhada. Utilizando uma pinça bipolar, coagular e dividir os vasos para-esofágica entre o lobo caudado lateral esquerdo e anterior.
- Mover os intestinos fora do abdómen para o lado esquerdo do rato, e cobrindo-os com um cotonete de gaze molhada. Retrair o lobo lateral direito para cima com um cotonete gaze molhada. Isolar o IHVC a partir do tecido retroperitoneal, e ligar a veia adrenal, que será mais tarde divididos imediatamente antes da remoção do enxerto.
- Para inserir um stent no ducto biliar (Figura 3b):
- Ligar o canal biliar no nível da ramificação da artéria gastroduodenal. Os tecidos moles em torno do ducto biliar deve ser preservado, tanto quanto possível, e a separação do ducto biliar a partir da artéria hepática, deve ser evitado para assegurar o fornecimento de sangue arterial suficiente para o canal biliar.
- Com retas tesoura micro, fazer uma pequena incisão na ânteroou a parede do ducto biliar proximal ao ponto ligado. Enquanto segura a parede anterior da incisão com pinça reta micro na mão esquerda, insira um stent no duto utilizando um fórceps curvos micro na mão direita, e prenda-o com um fio de seda 6-0. Uma das extremidades cortadas do fio no canal biliar é mantida a um comprimento de 4 mm, de modo que o segmento pode ser realizada durante a anastomose posterior.
- Libertar a veia porta das veias pyloric e esplênica pela ligação e dividindo-os.
- Ligadura e dividir a artéria gastroduodenal, então isolar a artéria hepática comum (ACS) da cabeça do pâncreas à sua raiz. Gire o fígado para a direita com cotonetes, e dissecar o ligamento em torno da volta do fígado e do esôfago.
- Após a conclusão da preparação para a excisão do fígado, remover os afastadores, os fórceps de mosquitos para o processo xifóide e a seringa de 5 ml, sob as costas do rato. Retorno do intestino para o abdominacavidade l.
- Injectar 500 UI de heparina-Natrium em 2 ml de solução salina normal, através da veia peniana. Cerca de 3 minutos mais tarde, redefinir a seringa de 5 ml, a pinça de mosquitos, e os afastadores. Ligar o CHA proximais à sua raiz. Manter uma das extremidades cortadas do fio ligado para o ACS comprimento.
- Depois de prender a IHVC próximo à veia renal direita com uma pinça mosquito, fixar a veia porta com uma braçadeira descartável navio micro abaixo do coto da veia esplênica. Incisão na parede anterior da veia portal, e inserir um cateter de calibre 18 na veia portal.
- Perfundir o fígado in situ com 60 mL de frio histidina-triptofano-cetoglutarato solução (HTK) a uma pressão hidrostática de 20 cm H 2 O. Imediatamente depois, cortar o diafragma e transecção da veia cava intratorácica, e cortar a parede anterior da abertura IHVC para permitir que a solução de perfusão para ser lavado para fora do fígado (Figura 3c).
- Prenda o IHVC com um divaso micro sposable braçadeira apenas abaixo do fígado. O fígado Excise dissecando o IHVC ligeiramente abaixo do ponto médio entre o fígado e a veia renal direita, a veia portal abaixo do coto da veia esplénica, o diafragma, os ligamentos remanescentes na parte de trás do fígado, a veia adrenal direita, e os ACS em sua raiz. Coloque o fígado excisado em solução HTK frio em um copo de metal montado numa caixa de plástico cheio de gelo picado.
4. Ex Preparação Enxerto vivo
Todos os procedimentos para o enxerto de fígado são realizados no copo de metal cheia com solução gelada HTK. A preparação do enxerto ex vivo requer aproximadamente 30 min.
- Para a fixação de um punho para a veia porta (Figura 4):
Prenda o tronco venoso portal com uma pinça Bulldog DeBakey. Colocar o grampo numa posição de ponte sobre o copo (Figura 4a, b). Coloque a veia porta através do manguito e braçadeiraa veia porta de novo em conjunto com o extensão do punho na posição das 12 horas (Figura 4c). Evert a parede da veia porta sobre a braçadeira para posicionar o coto da veia esplénica exterior da braçadeira na posição 07:00 (Figura 4d), e fixar a veia portal, com um fio de seda 6-0 (Figura 4e) . - Para inserir um stent na artéria hepática (Figura 5):
Corrigir o fígado, fixando ambas as bordas do diafragma por fórceps, e puxar os ACS em linha reta, mantendo o fio ligado ao Bulldog DeBakey braçadeira (Figura 5a). Com retas tesoura micro, fazer uma pequena incisão na parede anterior dos ACS. Com a mão esquerda, segure a parede anterior da incisão com pinça reta micro, e com a mão direita, insira um stent para os ACS usando uma pinça curvas micro. O stent é previamente lavada com heparina Natrium-solução (100 UI / ml) (Figura 5b-d). Secure o stent com um fio de seda 6-0, e manter uma das extremidades cortadas do fio com um comprimento de 4 mm. Lave o fígado através do cateter arterial com 5 ml de solução HTK frio. - Para a ressecção hepática de 50% (Figura 6):
- Prenda o lobo caudado posterior com uma pinça mosquito para corrigi-lo no lugar. Ressecção do lobo após a ligadura de seu pedículo com um fio de seda 4-0 (Figura 7a). Da mesma maneira, remover o lobo caudado anterior.
- Gire a caixa de plástico de 90 graus. Prender a extremidade direita do diafragma e a parte esquerda do lobo mediano. Fazer uma pequena incisão na borda superior da borda das porções bilaterais do lobo médio, e, em seguida, remover a parte esquerda após a ligação (Figura 7b). Remover o lobo lateral esquerdo após ligadura do pedículo com um fio de seda 4-0. Cauterizar a superfície do fígado ressecado cuidadosamente com uma pinça bipolar. Como resultado, a massa do fígado é reduzida por umpproximately 50% 15 (Figura 7c, d).
- Para plastia da SHVC (Figura 8):
Fixar a posição do fígado por aperto nas extremidades da membrana com uma pinça mosquito (Figura 8a). Aparar a parede anterior do SHVC através da remoção do diafragma correspondente. Anexar dois 7-0 suturas de polipropileno a partir do exterior para o interior em ambos os cantos, como ficar suturas para a anastomose posterior (Figura 8b). Em seguida, cortar a parede posterior da SHVC. - Armazenar o enxerto de fígado a 4 ° C em solução HTK em um banho de água fria.
5. Operação destinatário
O esquema de implantação do enxerto no rato receptor é mostrada na Figura 9. A operação requer destinatário 60-70 min, que inclui 10-11 min de tempo anepática e aproximadamente 23-24 min de tempo de aperto IHVC.
- Executar os mesmos procedimentos que no do façaou operação (3,1 a 3,4), excepto para a abertura do abdómen através de uma incisão na linha média, sem extensões bilaterais (Figura 10a).
- Coloque uma compressa de gaze molhada sobre o lado direito do duodeno e do intestino inteiro para obter um campo cirúrgico em volta da IHVC. Coloque os lobos lateral esquerdo e mediano na cavidade esquerda subfrênico, e recolher o lobo lateral direito para cima com um cotonete gaze molhada. Isolar o IHVC a partir do tecido retroperitoneal. Ligadura e dividir a veia adrenal direita (Figura 10b). Com algumas compressas de gaze e algodão molhado, rodar o fígado para a esquerda, e dissecar o ligamento em torno da parte de trás do fígado.
- Retorne o lobo lateral direito para a posição anatômica. Coloque uma compressa de gaze molhada para cobrir e retratar os lobos mediano e lateral esquerda para cima. Transecção do ducto biliar, logo abaixo do ramo do lobo caudado. Os tecidos moles em torno do ducto biliar deve ser preservado, tanto quanto possível. Mantenha uma das extremidades cortadas do dialer ligado para o canal biliar, a 4 mm de comprimento.
- Ligadura e dividir a artéria gastroduodenal e a artéria hepática adequada, a uma distância de 3 mm para a ramificação do ACS. Em seguida, fazer uma estrutura de Y-da artéria no final do ACS. Manter uma das extremidades cortadas do fio ligado para a artéria hepática própria, a 4 mm de comprimento. Girar o fígado para a direita com cotonetes de algodão, e dissecar o ligamento em torno da parte de trás do fígado a partir do lado esquerdo.
- Após a injecção intravenosa de 2 ml de solução de Ringer com lactato, o grampo IHVC com uma braçadeira de metal micro vaso logo acima da veia renal direita. Prender a veia porta ao nível da sua bifurcação no hilo do fígado por uma pinça de mosquitos do lado esquerdo do rato. Prender o SHVC juntamente com o diafragma do lado direito por um grampo vascular periférica, e fixar o anel de dedo da braçadeira em um pedaço de base de óleo de argila.
- Reduzir a anestesia com isoflurano a 0,4% vol, durante o tempo anepática (a duraçãode pinçamento da veia porta). Excisar o destinatário fígado nativo dissecando o SHVC, a veia portal, e o IHVC nos seguintes níveis: o SHVC, na fronteira entre o SHVC e o fígado, e a veia porta, logo acima da mandíbula da pinça de mosquitos, e o IHVC, ligeiramente abaixo do ponto médio entre o fígado e a veia renal direita (Figura 10c). Coloque o enxerto hepático ortotópico.
- Para a anastomose da SHVC por uma sutura contínua (Figura 11):
- Use uma pinça curvas micro na mão esquerda durante o procedimento de sutura para agarrar a parede do vaso ou segurar a agulha de sutura. Primeiro, coloque a sutura estadia na SHVC destinatário de dentro para fora, usando o polipropileno 7-0 anexado no canto direito do enxerto seguido de amarrar um nó (ou você pode amarrá-lo depois de todos os procedimentos de sutura estão completos). Em seguida, colocar o segundo estadia sutura da mesma maneira que no milho esquerdaer, o qual será o ponto de partida de uma sutura contínua. Para ampliar a anastomose, compreender e manter as suturas usando grampos DeBakey bulldog em ambos os cantos com tração suave superiolaterally (Figura 11a, b).
- Pierce a sutura no canto esquerdo através da parede do lado do enxerto a partir do exterior para o interior de perto para o exterior do nó, e suturar a linha posterior da SHVC intraluminalmente com 7-8 pontos para o canto direito (Figura 11c). Fazer os pontos primeiros cuidado para que os lumens dentro estão se enfrentaram. No canto superior direito, perfurar o polipropileno 7-0 através do recipiente no lado de enxerto para o exterior.
- Em seguida, suturar a linha anterior de fora, da direita para a esquerda, com cerca de 10 pontos (Figura 11d). Antes da conclusão da linha anterior, lave o interior com uma solução de Ringer com lactato para remover bolhas de ar. Faça o último ponto, na linha anterior o mais próximopossível a sutura estadia no canto esquerdo, e depois amarrá-los juntos.
- Para a reconstrução da veia portal por uma técnica de bainha (Figura 12):
- Recolha os lobos mediano e lateral esquerda para cima com um cotonete gaze molhada. Grampo da veia porta destinatário na sua confluência com a veia pilórica usando uma braçadeira descartável navio micro da direita. Fixar a pinça mosquito que grampos da veia porta no barro, e puxe a ponta da pinça em direção ao hilo do fígado (Figura 12a, b).
- Incisão na parede anterior da veia porta, logo abaixo do queixo do fórceps de mosquitos. Lavar o interior da veia portal destinatário e do balonete com solução de Ringer com lactato. Segure a parede anterior da incisão com pinça reta micro na mão esquerda e uma extensão do punho com uma pinça curvas micro na mão direita. Insira o manguito na veia porta destinatário profundamente, e prenda-o com umfio de seda 6-0 circunferencial (Figura 12c-f).
- Solte os grampos da veia porta e SHVC, e depois reperfundir o fígado. Remova a seringa de 5 ml a partir da parte traseira do rato, e aumentar a concentração de isoflurano a 0,8% vol.
- Para a reconstrução da artéria hepática por uma técnica de stent 16 (Figura 13):
- Primeiro, mantenha o fio da artéria hepática destinatário adequada por uma pinça mosquito do lado esquerdo, e puxe-o em direção ao hilo, fígado e, em seguida, apertar os ACS beneficiários do lado direito próximo ao pâncreas (Figura 13a).
- Com um fórceps micro rectas, fazer uma pequena incisão na bifurcação do Y-estrutura no final do ACS destinatário para fazer uma abertura em forma de funil. Segure o stent colocado nas CHA enxertos com um fórceps curvos micro. Depois de lavar cada lúmen com heparina Natrium-solução (100 UI / ml), deslizar a manga vascular dentro do reCHA cipient e prenda com um fio de seda 6-0. Amarrar uma extremidade desta linha na CHA destinatário e o segmento de 4 mm, nas CHA enxerto em conjunto para que os dois ACSs aproximar-se uns aos outros com tensão reduzida do local da anastomose (Figura 13b). Após isso, libertar o grampo.
- Para a anastomose da IHVC por uma sutura contínua (Figura 14):
Anastomose da mesma maneira como para o SHVC, mas utilizam mais pontos com mordida mais fina (figura 14a-d). Amarrando das suturas no último ponto pode ser eliminada, ou amarração pode ser realizada com um factor de crescimento para evitar a estenose anastomótica causada por amarrar com muita força. Após o despinçamento, aumentar a concentração de anestesia para 1,0% vol. Se a anastomose parece estenótica, dilatam a anastomose puxando as suturas de ancoragem bilaterais ou ampliando a linha anterior suavemente para expandir a anastomose. - Administrar 0,5 ml de 8,4% de bicarbonato de sódio solution com 1,0 ml de solução de Ringer com lactato por via intravenosa.
- Aplicar pequenos fragmentos de TachoSil para selar a superfície do fígado ressecado para prevenir hemorragias e extravasamento biliar.
- Para a reconstrução do ducto biliar por uma técnica de stent:
- Segurar o fio do ducto biliar destinatário por uma pinça de mosquitos do lado esquerdo. Fixar a pinça de mosquitos no barro, e puxe a ponta da pinça em direção ao hilo do fígado.
- Fazer uma pequena incisão no ducto biliar ao nível adequado de modo a que o canal biliar reconstruído não seria muito longa. Insira o stent colocado no ducto biliar enxerto no duto destinatário com muita atenção para evitar uma torção, e prenda-o com um fio de seda 6-0. Atar esta discussão sobre a conduta do destinatário e o segmento de 4 mm na conduta de enxerto em conjunto para que ambas as condutas de se aproximar um do outro, com tensão reduzida do local da anastomose.
- Após a conclusão dos procedimentos de reconstrução, injectar 1 ml de uma solução de glicose a 5% por via intravenosa (Figura 15).
- Confirme hemostasia adequada, e depois fechar a incisão abdominal por 4-0 suturas Vicryl em duas camadas.
6. O tratamento pós-operatório e acompanhamento
Imediatamente após a operação, tratamento do rato destinatário com uma injecção subcutânea de cefuroxima sódica (16 mg / kg) e buprenorfina (0,1 mg / kg), num total de 1,5 ml de solução salina normal. Permitir que o rato a recuperar durante 60 min numa gaiola de unidade de cuidados intensivos especial com ar aquecido (30-35 ° C) e uma fonte de oxigénio. Injectar buprenorfina (0,1 mg / kg) por via subcutânea, um analgésico a cada 12 horas, durante 3 dias. Depois mover o rato para uma jaula normal, e proporcionar o acesso ad libitum a água e alimento.
Resultados
Todos os ratos destinatário (n = 20) sobreviveram sem complicações aparentes até eutanásia planeada para amostragem de sangue, 1, 3, 24 e 168 horas (7 dias) após a reperfusão portal (n = 5 em cada ponto de tempo). As amostras de sangue foram coletadas da IHVC por uma punção direta com uma agulha de calibre 27. Seguindo a centrifugação a 5340 xg durante 10 min, as amostras de soro foram obtidas e analisadas para a alanina aminotransferase (ALT), que reflectem o grau de dano hepatocelular após transplante. O curso temporal das alterações nos níveis de ALT no soro é mostrado na Figura 16. Os níveis de ALT atingiu um pico às 24 horas (média ± desvio padrão: 212,6 ± 67,9 UI / L) e, em seguida, desceu para dentro dos limites normais em 168 hr (33,6 ± 6,8 UI / L).

Figura 1. Uma braçadeira para a veia porta (VP) de um 14 de calibre do cateter, e stents para a artéria hepática (AH) e ducto biliar (BD) de calibre 24 cateteres.
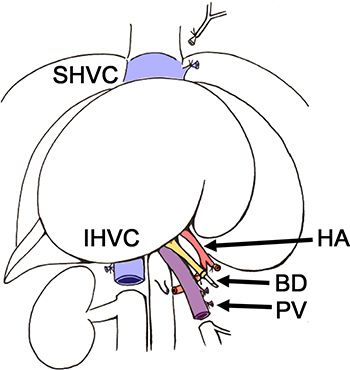
Figura 2. Esquema da retirada do fígado do animal doador BD, ducto biliar; HA., Artéria hepática; IHVC, infrahepatic veia cava; PV, veia porta; SHVC, supra-hepática da veia cava.

Figura 3. Operação doador. a. O rato é colocado sobre uma almofada de aquecimento com um sistema de retracção magnética fixador. O abdómen é aberto por uma incisão na linha média com extensões bilaterais. B. Inserção do stent dentro do canal biliar. C. Perfusão do fígado através da veia portal. As abreviaturas são explicared na Figura 2.

Figura 4. Fixação de um punho para a veia porta. a, b. DeBakey A braçadeira Bulldog que agarra o tronco venoso portal é colocado sobre o copo de metal. O copo está montado na caixa de plástico cheio de gelo picado. C. A veia porta é colocada através da braçadeira. D. A parede da veia portal é evertido sobre a manga com o coto da veia esplénica fora do manguito na 7 horas posição e uma extensão do punho na posição das 12 horas e.. A veia porta é fixada com um fio de seda 6-0 circunferencial no punho. As setas pretas indicam o coto da veia esplênica.
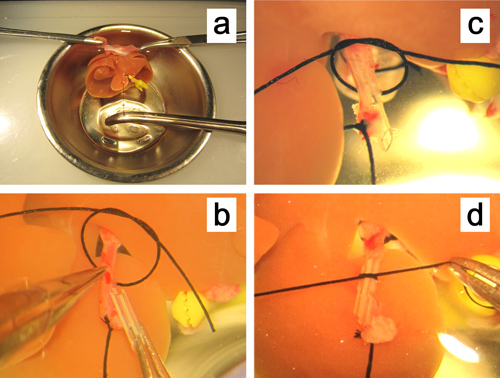
Figura 5. Ex vivoa inserção de um stent na artéria hepática. a. O fígado é fixado por aperto de ambas as bordas do diafragma, e a artéria hepática é puxada reta, segurando o fio ligado à artéria. b. A parede anterior da pequena incisão na artéria hepática é realizada com uma pinça rectas micro . c, d. O stent é inserido na artéria hepática e fixada com um fio de seda 6-0.

Figura 6. O esquema de ressecção hepática ex vivo de 50%. Lobos em cor cinza são removidos. ACL, anterior caudado do lobo; PCL, lobo caudado posterior; LLL, lobo lateral esquerda; LML, parte esquerda do lobo médio; parte, RML direito do lobo médio; SRL, lobo direito superior lateral; IRL, lobo inferior direito lateral.
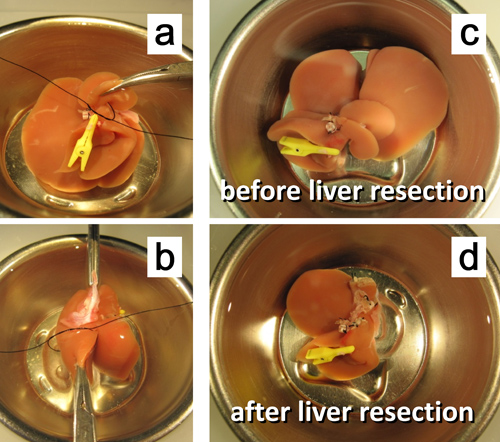
Figura 7. Ex vivo ressecção hepática de 50%. uma ligadura. ligadura do pedículo do lobo caudado posterior. b. do pedículo da porção esquerda do lobo mediano. c. O fígado antes da ressecção de 50%. d. O fígado após ressecção de 50%.
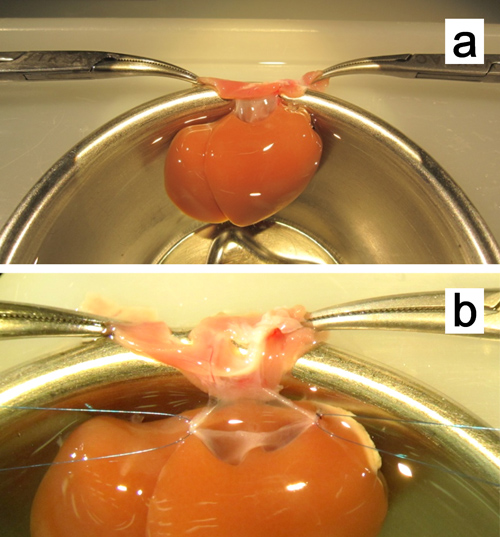
Figura 8. Ex vivo plastia da veia cava supra-hepática. a. O fígado é fixado por aperto as duas bordas do diafragma com a pinça de mosquitos. b. Estadia sutura com fio de polipropileno 7-0 estão ligados em ambos os cantos.

Figura 9. Esquema de implantação do enxerto no rato receptor. Os procedimentos de reconstrução são realizados para a supra-infra e veia cava (SHVC e IHVC) com um fio de sutura 7-0 contínua, a veia porta (VP), por uma técnica de manga, e a hepática artéria (HA) e das vias biliares (BD) por uma técnica de stent.
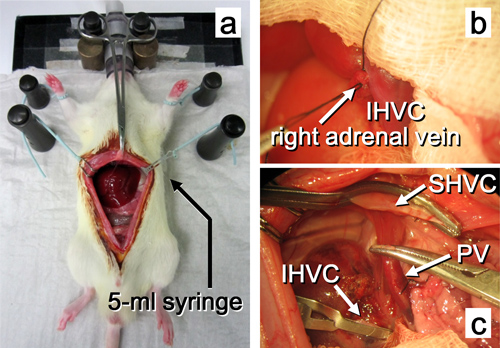
Figura 10. Operação beneficiário até à remoção do fígado nativo. um. O abdômen é aberto por uma incisão na linha. b. A veia adrenal direita é ligada. c. nativa O fígado é extirpado. As abreviaturas são explicados na figura 2.
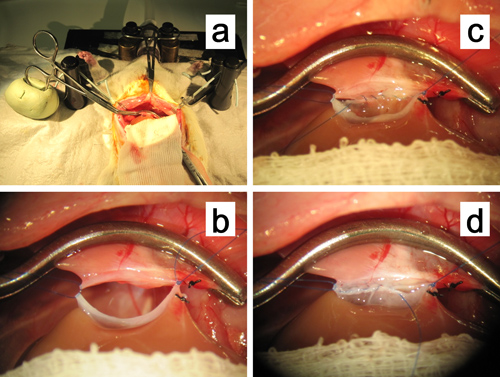
Figura 11. Anastomose da suprahehepáticas veia cava. a, b. O grampo vascular periférico para a veia cava supra-hepática é fixado em um pedaço de argila à base de óleo. As suturas de ancoragem em ambos os cantos são mantidos com leve tração superiolaterally para ampliar a anastomose. C. Fio intraluminal contínua da linha posterior em andamento. D. Sutura contínua da linha anterior em andamento.
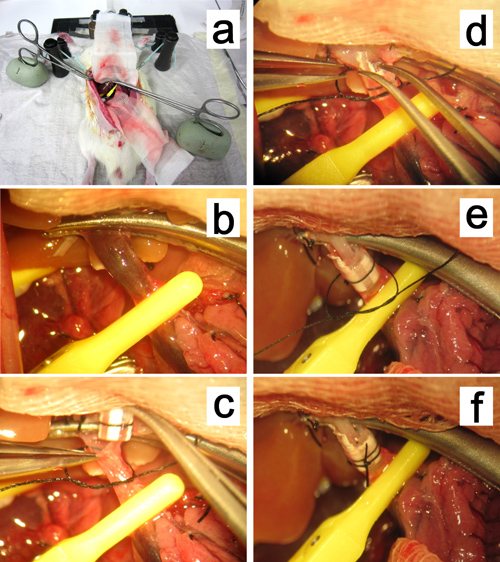
Figura 12. Reconstrução da veia portal. a, b. A pinça de aperto de mosquitos da veia portal é fixa em argila à base de óleo e puxado para o hilo do fígado. cf. Inserção da bainha para dentro da veia portal.

Figura 13. Reconstrução da artéria hepática. a, b. g> A inserção de um stent na artéria hepática receptor comum (CHA) a bifurcação da artéria hepática própria (PHA) e da artéria gastroduodenal (GDA).

Figura 14. Anastomose da veia cava infrahepatic. um Reperfusão. As suturas de ancoragem em ambos os cantos. b. sutura contínua da linha posterior. c. sutura contínua da linha anterior. d. infrahepatic da veia cava. As abreviaturas são explicados na figura 2.
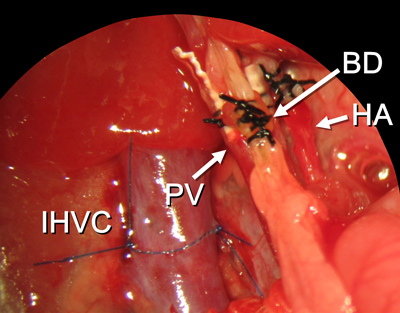
Figura 15. Todos os procedimentos de reconstrução terminar. As abreviaturas são explicados na figura 2.
"Figura 16" src = "files/ftp_upload/4376/4376fig16.jpg /" />
Figura 16 pós-operatória curso temporal das alterações de níveis séricos de alanina-aminotransferase (ALT) (n = 20, n = 5 em cada ponto de tempo).. Os dados são expressos como médias com barras de erro que indicam os desvios padrão. Os níveis de ALT atingiu um pico às 24 h (212,6 ± 67,9 UI / L) e, em seguida, desceu para dentro dos limites normais em 168 hr (33,6 ± 6,8 UI / L).
Discussão
O primeiro modelo de rato OLT foi relatado por Lee et al. Em 1973 9, em que todos os recipientes, incluindo a artéria hepática foram reconstruídos por um método costuradas a mão e o desvio portossistêmico extracorpórea foi utilizado. Este modelo foi tecnicamente complicado e difícil de realizar. O modelo seguinte foi um sem reconstrução da artéria hepática e da derivação extracorpórea, desenvolvido pelos mesmos autores 10 em 1975. Posteriormente, em 1979, Kamada et al. Introduziu a técnica de anastomose manguito para o modelo sem rearterialization hepática 11. Com estas modificações, OLT em ratos foi simplificada com um tempo anepática encurtado em operações ao receptor e tem sido amplamente utilizado como modelo experimental.
No entanto, tem havido uma considerável controvérsia uma vez que, em seguida, sobre o significado de arterialização hepática em ratos OLT 8 porque a arterialização foi uma tarefa exigente, mas did não afeta a sobrevivência após o transplante. Numerosos estudos sobre arterialização hepática utilizando técnicas de reconstrução várias foram relatadas 8, tal como uma anastomose do segmento de aorta 3,9,17-aórtico, uma técnica de anastomose cuff 18,19,20, uma técnica telescópica 5, uma técnica de stent 13, 16, e uma técnica de anastomose manga 12,21-23. Embora a técnica de OLT rato ainda não está padronizado hoje, o modelo arterializado tem sido cada vez mais favorecida em termos de sua superioridade fisiológica 8,12,13,14. Entre as técnicas acima mencionadas, uma técnica de stent que é simples e rápido de executar foi relatada por Lehmann et al. 16 em 2005. O estudo mostrou excelentes resultados: não foi observado grau de oclusão na artéria hepática reconstruído menos 8 h, 24 h, e 6 meses após a reperfusão. Por isso, adotou essa técnica para arterialização hepática.
Nós desempenhoma anastomose costurado à mão para a reconstrução do SHVC e IHVC. Este método fornece o local da anastomose, com uma óptima condição fisiológica, o que leva à redução da incidência de trombose 8, e é o melhor simulação microcirurgia e de formação para os cirurgiões. Além disso, a anastomose pode ser possível mesmo com cotos dos vasos pequenos. No que diz respeito a anastomose de IHVC, este método não requer um IHVC longo do lado de enxerto em comparação com a técnica de anastomose manguito. Portanto, quando a veia renal doador é dissecada para fazer o enxerto IHVC tempo, este método é aplicável para o transplante de um enxerto que precisa de uma pequena IHVC longo, tal como um enxerto de 30%, que é constituída por lóbulos laterais direito e caudado com um curto intrahepática veia cava sem SHVC 2.
Em relação às técnicas de ressecção hepática em ratos, até hoje vários métodos têm sido relatados, as duas principais técnicas são a técnica de ligadura clássica massae a técnica de vaso-orientado 24. Realizamos a técnica clássica para a ligadura ressecção hepática de 50% de 15, mas com um microscópio cirúrgico, para tornar o procedimento mais finas, e para evitar danos nos lobos remanescentes e estruturas.
Descrevemos os resultados representativos dos ratos receptores no nosso modelo, os ratos sobreviveram durante o período de observação de 7 dias sem complicações aparentes. O modelo pode ser modificado para fins diferentes de experiências, escolhendo as configurações diferentes, como o armazenamento frio prolongado, isquemia quente prolongado que inclui a doação após a morte cardíaca, ea utilização de enxertos menores de fígado ou enxertos de modelos experimentais de lesão hepática ou doenças.
Em nossa experiência, há três fatores-chave em todo os procedimentos que podem afetar a sobrevivência após o transplante, o parâmetro mais confiável para os resultados de OLT rato: a quantidade de perda de sangue, o tempo de operação, os eespecialmente tempo de pinçamento da veia porta e IHVC; ea adequação da reconstrução de cada navio, o que poderia resultar em trombose, estenose, ou sangramento. Em um período de treinamento deste modelo, a maioria das falhas provavelmente poderia estar relacionada a esses fatores. Neste artigo de vídeo, apresentamos passo-a-passo para os procedimentos cirúrgicos para o nosso modelo do rato de OLT parcial com reconstrução arterial hepática. Enquanto um modelo do rato de OLT é complicado e requer habilidades avançadas de microcirurgia, este artigo fornece uma abundância de informações práticas, que deve servir como um bom guia para a formação e aprendizagem deste modelo. Aprender este modelo eficaz é particularmente importante para a redução do período de aprendizagem, a redução do número de animais e dos custos necessários para a prática, e mais tarde reproduzir resultados fiáveis em experiências. Isto está em linha com o conceito 3R (substituição, redução e refinamento) dos experimentos com animais, o que foi postulado por Russell e Burch em1959 25.
Divulgações
Nós não temos nenhum conflito de interesses para divulgar. Os ratos estão alojados em específico patógeno-condições livre de acordo com as diretrizes da Federação de Associações de Laboratório de Ciência Animal (FELASA). Todos os experimentos foram realizados em conformidade com a lei federal alemão em matéria de protecção dos animais e "Guia para o Cuidado e Uso de Animais de Laboratório" (National Institutes of Health publicação No. 86-23, revisado 1985).
Agradecimentos
Os autores agradecem Pascal Paschenda e Mareike Schulz para a sua assistência técnica.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome | Companhia | Número de catálogo | Comentários |
| Microscópio cirúrgico | Leica | M651 | |
| Fonte de luz | Schott | KL1500LCD | |
| Cotonetes | NOBA Verbandmittel | 974202 | |
| Compressas de gaze (5x5 cm) | Fuhrmann | 10002 | |
| solução de iodo-povidona | Mundipharma | 6108022.00.01 | |
| À base de óleo de argila | Debika corporação | 090148 | |
| TachoSil | Takeda Pharmaceuticals International GmbH | EU/1/04/277/001-004 | Aplicado a superfície ressecada do fígado |
| Lâmina de bisturi n º 11 | Pfm médica | 200130011 | Preparação da braçadeira e stents |
| Calibre 14 cateter | B. Braun | 4268210S | Manguito para o PV |
| Calibre 18 cateter | B. Braun | 4268130S | Perfusão através PV |
| Calibre 24 cateter | B. Braun | 4269071S | Stent para BD e HA |
| Sutura de seda 4-0 | Resorba | H3F | Ressecção hepática |
| 6-0 seda | Resorba | H1F | |
| 7-0 Prolene (polipropileno) sutura | Ethicon | 8701H | SHVC e IHVC |
| Sutura Vicryl 4-0 | Ethicon | V304H | Fechamento abdominal |
| Seringa de 5 ml | Terumo | SS + T05ES1 | Fazer travesseiro |
| Almofada de aquecimento | Thermo | 190 x 260 mm | |
| Sistema de retração magnético fixador | Multa Ciência Tools Inc. | 18200-01 18200-02 18200-03 18200-12 | |
| Banho de água fria | Huber | 740.000X | Preservação do enxerto |
| Fórceps bipolar | Soring | MBC-200 | |
| Fórceps do mosquito | BONIMED | 451-476-03 | Dois pares utilizados |
| Adson micro fórceps | Dimeda | 10.176.12 | |
| Milhas curvacro fórceps | AESCULAP | FD281R | |
| Retas fórceps micro | Bonimed | 451-476-03 | |
| Curvas microtesoura | Medicon | 05.15.83 | |
| Retas microtesoura | AESCULAP | FD12 | Incisão fina |
| Tesoura | AESCULAP | BC211W | |
| Suporte da agulha micro | AESCULAP | FD241R | Reconstrução |
| Prefeito Hegar-titular da agulha | Mizuho Ikakogyo | 06-798-00 | Fechamento abdominal |
| DeBakey Bulldog braçadeira (em linha reta) | ULRICH | CV3054 | |
| DeBakey Bulldog braçadeira (curvo) | CODMAN | 37-1062 | |
| Satinsky braçadeira | Mizuhoika | 09-230-24 | |
| Grampo vascular periférica | Teleflex Medical | 353494 | Destinatário SHVC |
| Braçadeira navio Micro (descartável) | AROSurgical Instruments Corporation | TKM-1-60 g | PV, IHVC enxerto, e receptor HA |
| Braçadeira navio Micro (metal) | Multa Ciência Tools Inc. | 18052-01 | Destinatário IHVC |
| Solução de Ringer com lactato | Fresenius Kabi | 6150917.00.00 | |
| Solução salina normal | DeltaSelect | 1299.99.99 | |
| Solução HTK | Dr. Franz Köhler Chemie GmbH | 31268.00.00 | Solução de preservação |
| Heparina Natrium- | Ratiopharm | 5394.02.00 | 500 UI antes de perfusão do enxerto |
| Bicarbonato de sódio a 8,4% | Fresenius Kabi | 4399.97.99 | 0,5 ml após a reperfusão |
| Solução de glicose a 5% | B. Braun | 6714567.06.00 | 1,0 ml após a reperfusão |
| Cefuroxima de sódio | Fresenius Kabi | 38985.01.00 | Antibiótico, 16 mg / kg |
| Buprenorfina | Essex Pharma | 997.00.00 | Analgésico, 0,1 mg / kg |
| Gaiola de Unidade de Terapia Intensiva | Brinsea Products Ltd. | Vetario S10 | Cuidados pós-operatórios |
Referências
- Puhl, G., et al. Low viscosity histidine-tryptophan-ketoglutarate graft flush improves subsequent extended cold storage in University of Wisconsin solution in an extracorporeal rat liver perfusion and rat liver transplantation model. Liver Transpl. 12, 1841-1849 (2006).
- Yagi, S., et al. Improved Preservation and Microcirculation with POLYSOL After Partial Liver Transplantation in Rats. J Surg Res. 167, e375-e383 (2011).
- Engemann, R., Ulrichs, K., Thiede, A., Muller-Ruchholtz, W., Hamelmann, H. Value of a physiological liver transplant model in rats. Induction of specific graft tolerance in a fully allogeneic strain combination. Transplantation. 33, 566-568 (1982).
- Sumimoto, R., Shinomiya, T., Yamaguchi, A. Influence of hepatic arterial blood flow in rats with liver transplants. Examination of donor liver-derived serum class I MHC antigen in rats with liver transplants with or without hepatic arterial reconstruction. Transplantation. 51, 1138-1139 (1991).
- Chaland, P., et al. Orthotopic liver transplantation with hepatic artery anastomoses. Hemodynamics and response to hemorrhage in conscious rats. Transplantation. 49, 675-678 (1990).
- Imamura, H., Rocheleau, B., Cote, J., Huet, P. M. Long-term consequence of rat orthotopic liver transplantation with and without hepatic arterial reconstruction: a clinical, pathological, and hemodynamic study. Hepatology. 26, 198-205 (1997).
- Zhong, Z., Theruvath, T. P., Currin, R. T., Waldmeier, P. C., Lemasters, J. J. NIM811, a mitochondrial permeability transition inhibitor, prevents mitochondrial depolarization in small-for-size rat liver grafts. Am. J. Transplant. 7, 1103-1111 (2007).
- Spiegel, H. U., Palmes, D. Surgical techniques of orthotopic rat liver transplantation. J. Invest. Surg. 11, 83-96 (1998).
- Lee, S., Charters, A. C., Chandler, J. G., Orloff, M. J. A technique for orthotopic liver transplantation in the rat. Transplantation. 16, 664-669 (1973).
- Lee, S., Charters, A. C., Orloff, M. J. Simplified technic for orthotopic liver transplantation in the rat. Am. J. Surg. 130, 38-40 (1975).
- Kamada, N., Calne, R. Y. Orthotopic liver transplantation in the rat. Technique using cuff for portal vein anastomosis and biliary drainage. Transplantation. 28, 47-50 (1979).
- Howden, B., Jablonski, P., Grossman, H., Marshall, V. C. The importance of the hepatic artery in rat liver transplantation. Transplantation. 47, 428-431 (1989).
- Gao, W., Lemasters, J. J., Thurman, R. G. Development of a new method for hepatic rearterialization in rat orthotopic liver transplantation. Reduction of liver injury and improvement of surgical outcome by arterialization. Transplantation. 56, 19-24 (1993).
- Zhao, D., Zimmermann, A., Wheatley, A. M. Morphometry of the liver after liver transplantation in the rat: significance of an intact arterial supply. Hepatology. 17, 310-317 (1993).
- Omura, T., Ascher, N. L., Emond, J. C. Fifty-percent partial liver transplantation in the rat. Transplantation. 62, 292-293 (1996).
- Lehmann, T. G., Bunzendahl, H., Langrehr, J. M., Neuhaus, P. Arterial reconstruction in rat liver transplantation--development of a new tubing technique of the common hepatic artery. Transpl. Int. 18, 56-64 (2005).
- Reck, T., et al. Impact of arterialization on hepatic oxygen supply, tissue energy phosphates, and outcome after liver transplantation in the rat. Transplantation. 62, 582-587 (1996).
- Hasuike, Y., et al. A simple method for orthotopic liver transplantation with arterial reconstruction in rats. Transplantation. 45, 830-832 (1988).
- Steffen, R., Ferguson, D. M., Krom, R. A. A new method for orthotopic rat liver transplantation with arterial cuff anastomosis to the recipient common hepatic artery. Transplantation. 48, 166-168 (1989).
- Knoop, M., Bachmann, S., Keck, H., Steffen, R., Neuhaus, P. Experience with cuff rearterialization in 600 orthotopic liver grafts in the rat. Am. J. Surg. 167, 360-363 (1994).
- Hickman, R., Engelbrecht, G. H., Duminy, F. J. A technique for liver transplantation in the rat. Transplantation. 48, 1080 (1989).
- Liu, T., Freise, C. E., Ferrell, L., Ascher, N. L., Roberts, J. P. A modified vascular "sleeve" anastomosis for rearterialization in orthotopic liver transplantation in rats. Transplantation. 54, 179-180 (1992).
- Li, J., et al. Modified sleeve anastomosis for reconstruction of the hepatic artery in rat liver transplantation. Microsurgery. 22, 62-68 (2002).
- Martins, P. N., Theruvath, T. P., Neuhaus, P. Rodent models of partial hepatectomies. Liver Int. 28, 3-11 (2008).
- Russell, W. M. S., Burch, R. L. . The Principles of Humane Experimental Technique. , (1992).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados