Method Article
Não-invasivo de medição óptica do metabolismo cerebral e Hemodinâmica em Lactentes
Neste Artigo
Resumo
Nós combinamos domínio da freqüência medidas espectroscopia no infravermelho próximo de oxigenação cerebral hemoglobina com medidas de correlação difusas espectroscopia de índice de fluxo sangüíneo cerebral para estimar um índice de metabolismo do oxigênio. Nós testamos a utilidade desta medida como uma ferramenta de triagem de cabeceira para avaliar a saúde e desenvolvimento do cérebro do recém nascido.
Resumo
Lesão cerebral perinatal continua a ser uma importante causa de mortalidade e morbidade infantil, mas ainda não há uma ferramenta eficaz que pode cabeceira precisão tela para lesão cerebral, a evolução lesão, monitor ou avaliar a resposta à terapia. A energia usada pelos neurônios é derivado em grande parte do metabolismo oxidativo de tecidos, e hiperatividade neural e morte celular são refletidas por mudanças correspondentes no metabolismo cerebral de oxigênio (CMRO 2). Assim, as medidas de CMRO 2 são reflexo da viabilidade neuronal e fornecer informação de diagnóstico importante, tornando CMRO 2 um alvo ideal para a medição de cabeceira de saúde do cérebro.
Imagiologia cerebral técnicas como a tomografia por emissão de pósitrons (PET) e emissão de fóton único tomografia computadorizada medidas (SPECT) de rendimento de glicose cerebral e metabolismo do oxigênio, mas estas técnicas exigem a administração de radionucleotides, então eles são usados apenas nos casos mais graves.
De onda contínua de espectroscopia de infravermelho próximo (CWNIRS) prevê medidas de radiação não-invasivos e não-ionizante de saturação de oxigênio da hemoglobina (SO 2) como um substituto para o consumo de oxigênio cerebral. No entanto, SO 2 é menos do que o ideal como um substituto para o metabolismo cerebral de oxigênio, como é influenciado tanto pelo fornecimento de oxigênio e consumo. Além disso, as medições de SO 2 não são sensíveis o suficiente para detectar horas após a lesão cerebral 1,2 insulto, pois o consumo de oxigênio e entrega alcançar o equilíbrio depois de transientes agudos 3. Nós investigamos a possibilidade de utilização de NIRS mais sofisticados métodos ópticos para quantificar o metabolismo cerebral de oxigênio à beira do leito em recém-nascidos saudáveis e cérebro lesado. Mais especificamente, nós combinamos os NIRS domínio da freqüência (FDNIRS) medida de SO 2 com a espectroscopia de correlação difusa (DCS) medida de índice de fluxo de sangue (CBF i) yield um índice de CMRO 2 (CMRO 2i) 4,5.
Com os FDNIRS combinados / sistema DCS somos capazes de quantificar o metabolismo cerebral e hemodinâmica. Isto representa uma melhoria em relação CWNIRS para detectar a saúde do cérebro, o desenvolvimento do cérebro e resposta ao tratamento em recém-nascidos. Além disso, este método adere a todas as UTI Neonatal (UTIN) políticas de controle de infecção e políticas institucionais para a segurança do laser. Trabalho futuro vai procurar integrar os dois instrumentos para reduzir o tempo de aquisição à beira do leito e implementar feedback em tempo real sobre a qualidade dos dados para reduzir a taxa de rejeição de dados.
Introdução
O dispositivo FDNIRS é um sistema no domínio da frequência personalizada de ISS Inc. com dois conjuntos idênticos de 8 diodos laser emitindo em oito comprimentos de onda que variam 660-830 nm, e dois tubos fotomultiplicadores (PMT) detectores. Fontes e detectores são moduladas a 110 MHz e 110 MHz, acrescido de 5 kHz, respectivamente, para se conseguir a detecção heteródina 6. Cada diodo laser é ligado por 10 mseg em seqüência, para um tempo de aquisição 160 ms total por ciclo. Fontes e detectores são acoplados a fibra óptica e dispostos em uma linha em uma sonda óptica. A disposição das fibras na sonda é tal que se produz quatro diferentes fonte de detector-separações. Ao medir a luz transmitida (atenuação de amplitude de deslocamento de fase e) a distâncias diversas, é possível quantificar a absorção (mA) e espalhamento (mS ') coeficientes do tecido sob observação. A partir dos coeficientes de absorção em comprimentos de onda múltiplos, que, em seguida, estimar os valores absolutos das oxigenado (HBO) edesoxigenada (HBR) concentrações de hemoglobina 7, volume sanguíneo cerebral (CBV) e saturação de oxigênio da hemoglobina (SO 2).
O dispositivo DCS é uma casa - sistema integrado semelhante ao desenvolvido pelos drs. Arjun Yodh e Turgut Durduran da Universidade da Pensilvânia 8,9. O sistema DCS, que consiste de um sólido - laser de estado coerência, longo em 785 nm, quatro fóton-contagem fotodiodo avalanche (APD) detectores (EG & G Perkin Elmer SPCM-AQRH) apresentam baixa contagem de escuro (<50 contagens / s) e uma alta rendimento quântico (> 40% em 785 nm), e um canal de quatro, 256-bin multi-tau correlacionador, com resolução de 200 nseg. Com o DCS medimos o fluxo sanguíneo microvascular no córtex cerebral, quantificando as flutuações de intensidade de luz temporais multiplamente disperso que surge a partir de desvios Doppler produzido pelo movimento de células vermelhas do sangue. A técnica, semelhante ao laser de fluxometria de Doppler no sangue (isto é, eles são Fourier Transform análogos), mede uma função de autocorrelação das flutuações de intensidade de cada canal de detector calculado por um dispositivo de correlação digital, ao longo de um intervalo de tempo de atraso de 200 ns - 0,5 seg. O correlator calcula a intensidade temporais auto-correlação da luz re-emergindo a partir do tecido. Em seguida, ajuste da equação de difusão de correlação para a função de autocorrelação medido, adquirida sequencialmente, cerca de uma vez por segundo, para se obter o índice de fluxo de sangue (CBF i) 10,11. DCS medidas de mudanças no fluxo de sangue têm sido extensivamente validados 12,13. Ao combinar as medidas FDNIRS de SO 2 com as medidas DCS da CBF i, conseguimos uma estimativa do metabolismo cerebral de oxigênio (CMRO 2i).
Protocolo
1. Preparação para Medidas de cabeceira
- Os FDNIRS e os sistemas DCS são compactos e fáceis de seguir em um carro pequeno a cabeceira da criança no hospital (Figura 1).
- Depois de mover o carrinho com os dispositivos ao lado da cama, ligar os sistemas e conectar a sonda óptica para as FDNIRS e dispositivos DCS. Certifique-se que dois experimentadores estão presentes para todas as medições: uma para gerir os instrumentos e computador, e um para segurar a sonda.
- Escolher a sonda apropriada em função da idade pós-menstrual da criança (PMA). A sonda óptica com FDNIRS fonte-detector de separações cm 1, 1,5, 2 e 2,5 é utilizado para crianças de idade <37 semanas com PMA e com a sonda FDNIRS separações 1,5, 2, 2,5 e 3 cm é usado para lactentes mais velhos (Figura 2-A ). A escolha da fonte mais curtos detectores de separações é ditada pelo tamanho do bebê prematuro pequeno e curvatura cabeça maior. Ao utilizar um maior sonda com uma criança pré-termo, a relavamente menor tamanho da cabeça do bebê e sua curvatura significativa juntos impedir o contato efetivo entre a cabeça do bebê e todas as fontes e detectores. Por este motivo, a sonda com FDNIRS fonte-detector de separações cm 1, 1,5, 2 e 2,5 é apropriado para utilização com recém-nascidos prematuros. Nossa pesquisa verificou que os escolhidos fonte detector de separações são suficientes para medir as propriedades ópticas do córtex cerebral de 14 de tanto prematuro ou a termo. Fibras DCS fonte eo detector estão dispostos em uma linha paralela às fibras FDNIRS com a fonte eo detector distâncias de 1,5 (um detector) e 2 cm (três detectores) em ambas as sondas prematuros e de termo lactentes.
- Higienizar as sondas ópticas com um pano Sani-desinfecção e limpeza de introduzir a sonda e as fibras em uma luva de plástico de uso único de polipropileno.
2. FDNIRS ajustes de ganho e calibração
- Abra a interface do usuário FDNIRS gráfica (GUI) e selecione o arquivo de configurações do programabloco correspondente à sonda e calibragem a ser utilizado.
- Para ajustar os ganhos de detector, suavemente coloque a sonda em uma área de cabeça do sujeito sem cabelo (de preferência, o lado esquerdo da testa) e mantê-lo na posição mesmo sem a aplicação de qualquer pressão. Ligar fontes e detectores de tensão e ajuste PMT até que a amplitude de qualquer um dos lasers fonte atinge 20.000 contagens. 32.000 contagens é a digitalização máxima do análogo de placa de aquisição digital, e ganhos têm de ser ajustado abaixo desse limiar para evitar a saturação durante a aquisição de dados. Os ganhos devem ser definidas na área frontal porque esta região geralmente tem o menor absorção de luz a laser e é, portanto, mais propenso a saturação.
- Desligue as fontes e detectores e enviar a sonda para o bloco de calibração. Os lasers precisa ser desligado quando mover a sonda para segurança do olho, os detectores devem ser desligado porque PMT são muito sensíveis e exposição a qualquer luz brilhante increases ruído de fundo e pode danificar permanentemente los.
- Com a sonda de volta no bloco de calibração, utilize o filtro de densidade neutra (ND) se satura qualquer fonte de detectores de par. Os filtros ND diferentes podem ser selecionadas devido a ganhos de otimização em crianças com diferentes tons de pele Mantenha a sonda ainda por 16 segundos durante a execução do procedimento de calibração. Uma vez que não se movem fisicamente uma fonte para distâncias diferentes a partir de um único detector para conseguir um regime de multi-distância, mas em vez disso utilizar quatro combinações de duas fontes independentes, e dois detectores independentes, é necessário calibrar a potência diferente das duas fontes e os ganhos diferentes dos dois detectores. Através da medição de um bloco de calibragem conhecidas propriedades ópticas, estima-se a amplitude e os factores de correcção de fase necessários para recuperar os coeficientes de absorção e de difusão do bloco de calibração.
- Após a calibração, adquirir mais 16 seg de dados sobre o bloco e visualmente avaliar a adequação do diacalibração e com um in-house MATLAB GUI. A medida uA e uS 'devem coincidir com os coeficientes reais do bloco de calibração em todos os comprimentos de onda. Recalibrar se o ajuste é pobre.
- Se os ganhos detector precisa ser mudado, ou fibras de origem e detector precisa ser desconectado durante as medições, repita o procedimento de calibração do dispositivo FDNIRS.
- No fim da sessão de medição, adquirir outra sec 16 de dados no bloco de calibração para verificar se a calibração foi mantida durante as medições sobre o assunto. Se a calibragem não foi mantido, dê uma segunda calibração no final da medição e aplicam-se os dados obtidos.
3. DCS Configurações
- Abra o em casa DCS aquisição de dados GUI e carregar o arquivo de configuração correspondente à sonda óptica que está sendo usada.
- Antes de iniciar as medições, verifique se a potência do laser da fonte de DCS é apropriado para a exposição da pele medindo tele potência de laser da fonte de DCS com um medidor de energia e verificando o tamanho do ponto, com uma placa de visualização IR (o laser emite a 785 nm, o que não é visível). O DCS potência de laser é de ~ 60 mW e acoplado a uma fibra de diâmetro relativamente pequeno (400-600 um). Para atender aos padrões ANSI para a exposição da pele, a luz no sonda deve ser atenuada e difundida em uma grande área. Isto é conseguido através da cobertura da extremidade da fibra com um 3 mm de diâmetro branco folha de Teflon (Figura 2-A). O Teflon é dispersores e amplamente difunde o feixe de laser. Na cabeceira, assegurar que a potência do laser ao nível da sonda é inferior a 25 mW e o tamanho do ponto é maior do que 3 mm em diâmetro. Quanto aos FDNIRS, desligue sempre fontes e detectores de movimento, quando a sonda óptica.
- DCS é a detecção de fotões de contagem e não há ajustamento de ganho de APD, como é necessário para o dispositivo FDNIRS. Uma bandeira do software de aquisição indica se muita luz é detectada, caso em que a luz de acoplamento para IETsua fonte ou as fibras do detector tem de ser reduzida, rodando os conectores de fibra. Detecção de luz adequada está na gama de 200,000-4,000,000 fotões detectados (correspondente a -26 ~ 0 dB no monitor do computador). Evite luz interior excessiva para reduzir o ruído de fundo.
- A DCS não necessita de calibração para medir CBF i. O fluxo de sangue é proporcional ao tempo que demora a perder correlação. Um bloco sólido não é suficiente para verificar a qualidade do sinal, pois não há dispersão de partículas em movimento para causar cárie. Braço de um experimentador vez mostra decadência - o mais rápido o fluxo de sangue, mais íngreme a decadência.
4. Aquisição de Dados
- Enquanto FDNIRS e medições DCS pode ser feito rapidamente em seqüência, primeiro medir todos os locais com um dispositivo e, em seguida, repita a mesma progressão com o outro dispositivo, usando software de aquisição independente correspondente a cada um.
- Meça sete locais que cobrem frontal, temporal e PARIETáreas al, de acordo com um sistema de 10-20 (Fp1, Fpz, FP2, C3, C4, P3, P4), em sequência (Figura 2-B). Parte do cabelo ao longo da linha da fonte de detector, e colocar a sonda em que a região da cabeça.
- Ligue FDNIRS lasers e detectores e verificar a qualidade do sinal: a contagem de amplitude deve ser entre 2.000 e 20.000 e fase muda SNR <2 graus. Se estiver fora desses intervalos, reposicionar a sonda, assegurando cabelo é partido e todas as fontes e detectores estão em contacto com a pele.
- Aquisição de dados para 16 seg. Repita as medições até três vezes em cada local (Figura 2-C), partindo o cabelo e reposicionamento da sonda num local ligeiramente diferente para cada aquisição. Isto é feito para minimizar o efeito de não homogeneidades locais, tais como cabelo e superficiais grandes vasos e para fornecer os valores representativos de uma região, em vez de um único ponto.
- Ligue o laser e detectores de DCS e aquisição de dados para 10 seg. Mude a posição da sonda e repcomer as aquisições (como com as medidas FDNIRS).
- Desligue todos os lasers ao mover a sonda entre os locais. A coleta de dados em todos os sete locais nem sempre é possível. Descontinuar medição, se o sujeito se manifesta qualquer sinal de angústia ou de movimento. Repetir a aquisição, se possível. Eletrodos de EEG ou equipamento respiratório pode também impedir medições em alguns locais.
5. Medida de parâmetros sistêmicos
- Para o cálculo do CMRO 2i, dois parâmetros sistémicas, a oxigenação arterial (SaO 2) e hemoglobina no sangue (HGB), deve ser adquirida. HGB também é necessário para calcular CBV. Enquanto oximetria de pulso convencional prevê medidas de São dois, HGB é convencionalmente medida com um exame de sangue. Um oxímetro de pulso novo, desenvolvido pela Masimo Corporation, é capaz de medir HGB não invasiva, utilizando comprimentos de onda múltiplos. O dispositivo é aprovado pelo FDA para crianças> 3 kg, e permite uma medição rápida de cabeceiraure de ambos SaO2 e Hb.
- Registro SaO 2 e HGB usando um Masimo oxímetro de pulso (spot Pronto verificar o pulso co-oxímetro). Para estas medições, anexar um sensor de uso único adesivo para o dedão do pé do bebê. HGB será exibido no monitor dentro de alguns segundos.
- Quando não for possível utilizar o pulso Masimo co-oxímetro, medida SaO 2 com outros oxímetros de pulso aprovados pela FDA. HGB pode ser recuperado ou prontuários clínicos ou estimadas usando valores normativos.
6. Análise de Dados
- Abra um em casa pós-processamento de análise de dados GUI usando MATLAB. Este software não só calcula todos os parâmetros hemodinâmicos, mas também usa a redundância de dados automaticamente para avaliar a qualidade de medição e restringir os resultados.
- Automáticas critérios objetivos para o controle de qualidade consistem descartando dados para FDNIRS se: R2 <0,98 para o ajuste do modelo de dados experimentais, valor-p> 00,02 para o coeficiente de correlação do momento do produto de Pearson entre os oito coeficientes de absorção medidos e o ajuste da hemoglobina (Figura 3-A), p-valor> 0,02 para o ajustamento linear dos coeficientes de dispersão reduzida versus comprimento de onda (figura 3-B) 15. Se mais do que 33 por cento dos dados méritos devoluções, todo o conjunto é descartado. Para os DCS, os dados são descartados se: a cauda do ajuste de curva diferente de 1 por mais do que 0,02, a variação acumulada entre os três primeiros pontos da curva é maior do que 0,1, ou o valor médio dos três primeiros pontos é mais de 1,6 (Figura 4). Se mais do que 50 por cento das curvas são descartados, ou os valores de ajuste possuir um coeficiente de variação> 15 por cento, de todo o conjunto é descartado 15.
- Calcule absoluta HBO e concentrações HBR pelo ajuste dos coeficientes de absorção em todos os comprimentos de onda, usando os valores da literatura para Hb coeficientes de extinção e 16uma concentração de 75 por cento de água no tecido 17. Derivar concentração de hemoglobina total (HBT = HbO + HBR) e SO 2 (HBO / HBT) de concentrações HBO e HBr.
- Estimar o volume sanguíneo cerebral através da equação descrita no Ijichi et al 18. CBV = (HBT × MW Hb) / (HGB × D bt), onde Hb = 64.500 MW [g / mol] representa o peso molecular da Hb, e D bt = 1,05 g / ml é a densidade do tecido cerebral.
- Calcule CBF i ajustando as funções de autocorrelação medidos temporais para a equação de correlação de difusão. O enquadramento teórico para calcular CBF i é em Boas et al. E Boas e Yodh 10,11. Nas equações, utilizar coeficientes de absorção individuais medidos a partir FDNIRS e uma média dos coeficientes de espalhamento de todo o conjunto da população.
- Calcula-se o índice de consumo de oxigénio cerebral usando a medida de FDNIRS SO 2, e a medida do DCS CBFi com a seguinte equação: CMRO 2i = (HGB CBFi × × (SaO 2 - SO 2)) / (4 x MW Hb × β) 15, em que o factor 4 reflete as quatro moléculas de O 2 ligados uns aos hemoglobina e β é a contribuição percentual do compartimento venoso para a oxigenação da hemoglobina medição 19.
Resultados
Nos últimos cinco anos, têm demonstrado a viabilidade e utilidade clínica do método proposto. Em particular, demonstrámos CMRO 2 seja mais representativo da saúde do cérebro e do desenvolvimento de SO 2.
Em um estudo transversal, em mais de 50 bebês saudáveis, descobriram que, enquanto CBV é mais do que o dobro durante o primeiro ano de vida, SO 2 permanece constante 4 (Figura 5). Num estudo em 70 recém-nascidos saudáveis, também, que o SO 2 é constante em todas as regiões do cérebro enquanto CMRO 2i, CBV e CBF são mais elevadas nas regiões temporal e parietal do que na região frontal (Figura 6) 20, que é consistente com a captação de glicose PET achados 21. Em ambos os estudos, a constante SO 2, dentro de uma faixa de 60-70 por cento indica que a oferta de oxigênio se aproxima o consumo local, enquanto CBV, a CBF e CMRO 2 são more firmemente acoplado com o desenvolvimento neural.
Para verificar se CMRO 2i é uma ferramenta melhor triagem de SO 2 na detecção de lesão cerebral neonatal, medimos crianças que sofreram lesões cerebrais durante a fase aguda 5, e (em alguns poucos infantes) durante a fase crônica vários meses após a lesão. Resultados na Figura 7 mostram como SO 2 não é significativamente alterada por lesão cerebral em ambos os iniciais (1-15 dias após o insulto) e crônica (meses após a lesão) fases, enquanto CMRO 2i é significativamente diferente do que o normal durante as duas fases agudas e crônicas . Especificamente, CMRO 2i é elevada durante a fase aguda, devido a actividade convulsiva após lesão cerebral, e mais baixa do que o normal durante a fase crónica devido à perda neuronal.
Crianças com lesões de isquemia hipóxica são actualmente tratados com hipotermia terapêutica (TH) para o metabolismo inferior do cérebro e reduzir os danos após a ins hipóxicoUlt. A hipotermia terapêutica é mantido durante três dias e foram capazes de controlar 11 lactentes durante o tratamento (Figura 8). Descobrimos que CMRO 2i diminui significativamente a níveis abaixo do normal durante a TH, e esta diminuição parece estar relacionada com a resposta a terapia e os resultados do desenvolvimento. Estes resultados preliminares sugerem que o método FDNIRS-DCS pode ser capaz de orientar e otimizar a terapia hipotermia.
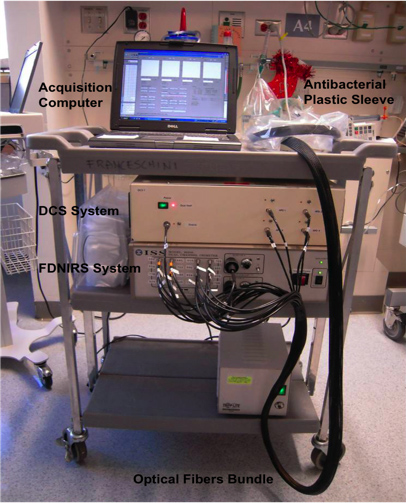
Figura 1. Imagem do carrinho com os FDNIRS e dispositivos DCS. Os dois instrumentos são compactos o suficiente para caber em um carro pequeno que pode ser movido para a cabeceira do bebê na UTIN.
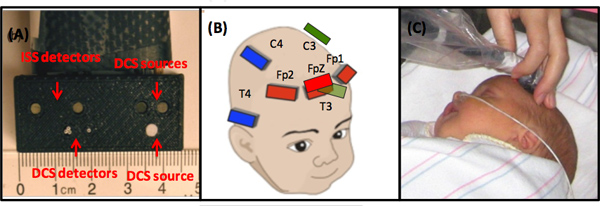
Figura 2. (A) configuração da sonda óptica. (B) O regime local de medição. (C) Uma foto de uma medição FDNIRS-DCS típico de uma criança.
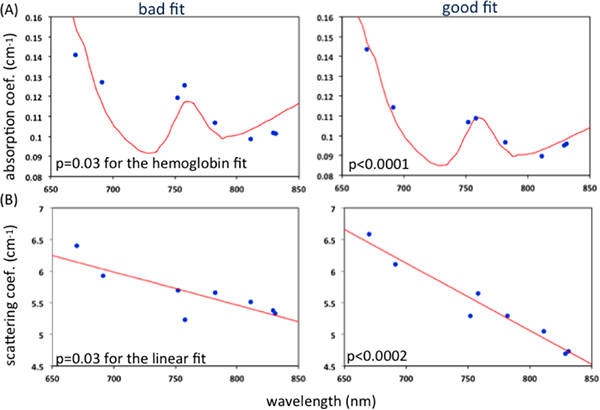
Figura 3. Exemplos representativos de bom ajuste e ruim de medida (A) e coeficientes de absorção da hemoglobina coeficientes de ajuste (B) dispersão eo ajuste linear. P-valor> 0,02 refere-se a um ajuste ruim. Clique aqui para ver maior figura .
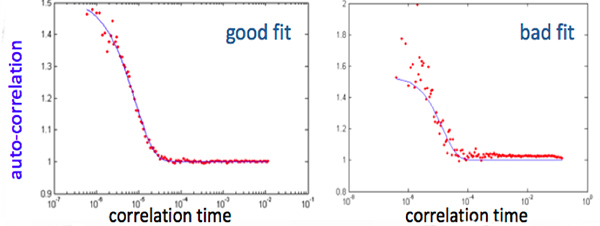
Figura 4. Um exemplo representativo de ajuste bom e mau de uma função de autocorrelação das flutuações de intensidade calculadopor um dispositivo de correlação em um intervalo de tempo de atraso de 200 ns - 0,5 seg. Na figura desajuste da cauda do ajuste de curva diferente de 1 em mais de 0,02 e a variação dos três primeiros pontos é mais do que 0,1. para ver figura maior .
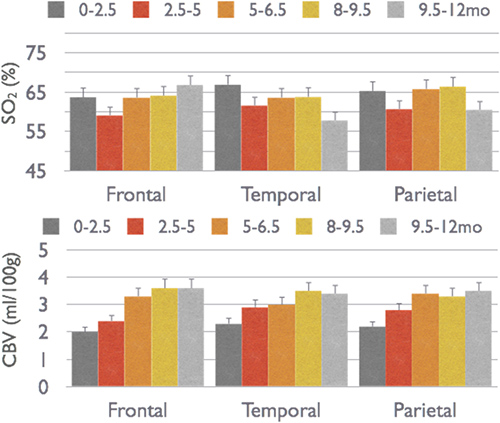
Figura 5. Mudanças na CBV e SO 2 em todo frontal, temporal e parietal regiões corticais em crianças desde o nascimento até um ano de idade.
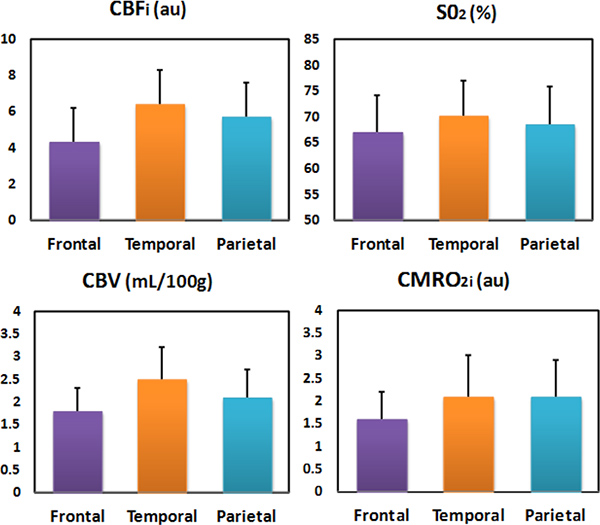
Figura 6. CBF, SO 2, CBV e CMRO 2i do frontal, teregiões mporal e parietal em 70 recém-nascidos saudáveis.

Figura 7. Exemplos de consumo de oxigénio anormal e normal, SO 2 após a lesão cerebral em recém-nascidos. Lesão cerebral é caracterizada por alterações na CMRO 2 com respeito ao normal enquanto que o SO 2 não é significativamente diferente do normal. Por favor, note que, nestas duas figuras, CMRO 2 foi calculada utilizando a relação Grubb, porque a medida DCS não estava disponível no momento dessas medidas.

Figura 8. rCMRO 2 de 11 crianças durante a hipotermia terapêutica vs controles pareados por idade saudáveis. Metabolismo do oxigênio é fortemente reduzido em todas as crianças com terapia de hipotermia.
Discussão
Nós demonstramos uma medição quantitativa da hemodinâmica cerebral e metabolismo com FDNIRS e DCS na população neonatal. A configuração da sonda é otimizado para medir córtex cerebral neonatal 14. Mudanças de fluxo de sangue medidos pela DCS têm sido extensivamente validados contra outras técnicas em estudos animais e humanos 22,23. Usando uma medida directa DCS do fluxo sanguíneo, que são capazes de reduzir a variância no cálculo da CMRO 2i 24. A variância de medidas repetidas também foi menor do que as mudanças entre as regiões cerebrais e com 20 anos de idade.
A partir dos nossos resultados anteriores, CBFi e CMRO 2i mostraram alterações significativas com PMA em recém-nascidos prematuros saudáveis. A medida de CMRO 2i é mais capaz de detectar danos cerebrais do que a medida de SO 2. Isto sugere que as medidas combinadas de parâmetros vasculares e metabólicos servir b como mais robustoiomarkers de saúde do cérebro neonatal e desenvolvimento do que a saturação de oxigênio sozinho. Melhorias técnicas incidirá sobre a integração de dois instrumentos para reduzir o tempo de aquisição de 35-40% por sessão ea implementação de feedback em tempo real sobre a qualidade dos dados para reduzir a frequência das medidas descartadas. No futuro próximo, este sistema pode ser entregue para os utilizadores finais clínicos como um monitor de cabeceira novel de oxigénio metabolismo cerebral anormal. Ao medir trajetórias de CMRO 2 ao longo do tempo também pode aumentar significado clínico e prever resultados. Esta ferramenta poderia, finalmente, fazer uma contribuição significativa para a melhoria da gestão de lesão cerebral neonatal.
Divulgações
Maria Angela Franceschini, seu marido David Boas, e Beniamino Barbieri (ISS Inc) detêm patentes sobre esta tecnologia.
Agradecimentos
Os autores agradecem a todas as famílias para a sua participação neste estudo e os enfermeiros, médicos e pessoal na UTI Neonatal, o Berçário de Cuidados Especiais, Neurologia Pediátrica, e as unidades de maternidade no Massachusetts General Hospital, Brigham e do Hospital da Mulher e Hospital Infantil de Boston por sua ajuda e apoio. Em particular, agradeço Linda J. Van Marter, Robert M. Insoft, Jonathan H. Cronin, Julianne Mazzawi, e Steven A. Ringer. Os autores também agradecem Marcia Kocienski-Filip, Yvonne Sheldon, Alpna Aggarwall, Maddy Artunguada e Genevieve Nave por sua ajuda durante as medições. Este projecto é apoiado pelo NIH R01-HD042908, R21-HD058725, P41-RR14075 e R43-HD071761. Marcia Kocienski-Filip e Yvonne Sheldon são suportados pelo Prêmio de Ciência Clínica Translational UL1RR025758 à Universidade de Harvard e do Brigham e do Hospital da Mulher, do Centro Nacional de Pesquisa de Recursos. O conteúdo é de responsabilidade exclusiva do authors e não representam necessariamente a posição oficial do Centro Nacional de Pesquisa de Recursos ou do National Institutes of Health.
Materiais
| Name | Company | Catalog Number | Comments |
| Equipamento | Companhia | Número de catálogo | Comentários (opcional) |
| Imagent | ISS | FDNIRS | |
| DCS laser de fibras | Thorlabs | FT400 | Componente DCS |
| DCS fibra detector | Thorlabs | 780HP | Componente DCS |
| DCS a laser | CrystaLaser | DL785-070-S | Componente DCS |
| DCS detector | Pacer International | SPCM-AQRH-14-FC | Componente DCS |
| DCS Correlator | Correlator.com | Flex05-8ch | Componente DCS |
| Pronto co-oxímetro | Masimo | HGB e SaO 2 do monitor | |
| NOVA | OPHIR | 7Z01500 | Laser medidor de energia |
| Sensor cartão | Newport | F-IRC1-S | IR espectador |
| Filtro de densidade neutra | Câmera fotográfica | NT54-453 |
Referências
- Zaramella, P., et al. Can tissue oxygenation index (TOI) and cotside neurophysiological variables predict outcome in depressed/asphyxiated newborn infants?. Early Hum. Dev. 83, 483-489 (2007).
- van Bel, F., Lemmers, P., Naulaers, G. Monitoring neonatal regional cerebral oxygen saturation in clinical practice: value and pitfalls. Neonatology. 94, 237-244 (2008).
- Boas, D. A., Franceschini, M. A. Haemoglobin oxygen saturation as a biomarker: the problem and a. 369, 4407-4424 (2011).
- Franceschini, M. A., et al. Assessment of infant brain development with frequency-domain near-infrared spectroscopy. Pediatr. Res. 61, 546-551 (2007).
- Grant, P. E., et al. Increased cerebral blood volume and oxygen consumption in neonatal brain injury. J. Cereb. Blood Flow Metab. 29, 1704-1713 (2009).
- Feddersen, B. A., Piston, D. W., Gratton, E. Digital parallel acquisition in frequency domain fluorimetry. Rev. Sci. Instrum. 60, 2929-2936 (1989).
- Fantini, S., et al. Frequency-domain multichannel optical detector for non-invasive tissue spectroscopy and oximetry. Opt. Eng. 34, 34-42 (1995).
- Cheung, C., Culver, J. P., Kasushi, T., Greenberg, J. H., Yodh, A. G. In vivo cerebrovascular measurement combining diffuse near-infrared absorption and correlation spectroscopies. Phys. Med. Biol. 46, 2053-2065 (2001).
- Durduran, T., et al. Diffuse optical measurement of blood flow, blood oxygenation, and metabolism in a human brain during sensorimotor cortex activation. Opt. Lett. 29, 1766-1768 (2004).
- Boas, D. A., Campbell, L. E., Yodh, A. G. Scattering and imaging with diffusing temporal field correlations. Phys. Rev. Lett. 75, 1855-1859 (1995).
- Boas, D. A., Yodh, A. G. Spatially varying dynamical properties of turbid media probed with diffusing temporal light correlation. J. Opt. Soc. Am. A. 14, 192-215 (1997).
- Buckley, E. M., et al. Validation of diffuse correlation spectroscopic measurement of cerebral blood flow using phase-encoded velocity mapping magnetic resonance imaging. J. Biomed. Opt. 17, 037007 (2012).
- Irwin, D., et al. Influences of tissue absorption and scattering on diffuse correlation spectroscopy blood flow measurements. Biomedical Optics Express. 2, 1969-1985 (2011).
- Dehaes, M., et al. Assessment of the frequency-domain multi-distance method to evaluate the brain optical properties: Monte Carlo simulations from neonate to adult. Biomed. Opt. Exp. 2, 552-567 (2011).
- Roche-Labarbe, N., et al. Noninvasive optical measures of CBV, StO2, CBF index, and rCMRO2 in human premature neonates' brains in the first six weeks of life. Hum. Brain Mapp. 31, 341-352 (2010).
- Wray, S., Cope, M., Delpy, D. T., Wyatt, J. S., Reynolds, E. O. Characterization of the near infrared absorption spectra of cytochrome aa3 and haemoglobin for the non-invasive monitoring of cerebral oxygenation. Biochim. Biophys. Acta. 933, 184-192 (1988).
- Wolthuis, R., et al. Determination of water concentration in brain tissue by Raman spectroscopy. Anal. Chem. 73, 3915-3920 (2001).
- Ijichi, S., et al. Developmental changes of optical properties in neonates determined by near-infrared time-resolved spectroscopy. Pediatr. Res. 58, 568-573 (2005).
- Watzman, H. M., et al. Arterial and venous contributions to near-infrared cerebral oximetry. Anesthesiology. 93, 947 (2000).
- Lin, P. Y., et al. Regional and hemispheric asymmetries of cerebral hemodynamic and oxygen metabolism in newborns. Cereb. Cortex. , (2012).
- Chugani, H. T. A critical period of brain development: studies of cerebral glucose utilization with PET. Prev. Med. 27, 184-188 (1998).
- Carp, S. A., Dai, G. P., Boas, D. A., Franceschini, M. A., Kim, Y. R. Validation of diffuse correlation spectroscopy measurements of rodent cerebral blood flow with simultaneous arterial spin labeling MRI; towards MRI-optical continuous cerebral metabolic monitoring. Biomed. Opt. Exp. 1, 553-565 (2010).
- Durduran, T., et al. Optical measurement of cerebral hemodynamics and oxygen metabolism in neonates with congenital heart defects. J. Biomed. Opt. 15, 037004 (2010).
- Roche-Labarbe, N., et al. Near infrared spectroscopy assessment of cerebral oxygen metabolism in the developing premature brain. J. Cereb. Blood Flow Metab. 32, 481-488 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados