É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Captura selectivo de 5-hydroxymethylcytosine a partir de DNA genómico
Neste Artigo
Resumo
Descrita é um processo de rotulagem em duas etapas usando β-glicosiltransferase (β-GT) para transferir uma azida de glucose para 5 HMC, seguido por química do clique para transferir de um ligante de biotina para o enriquecimento fácil e densidade independente. Este método de marcação eficiente e específico permite o enriquecimento de 5 HMC com fundo extremamente baixo e de alto rendimento de mapeamento epigenômico via sequenciamento de última geração.
Resumo
5-metilcitosina (5-mC) constitui ~ 2-8% das citosinas totais no DNA genómico humano e um impacto de uma ampla gama de funções biológicas, incluindo a expressão de genes, a manutenção da integridade do genoma, a impressão parental, inactivação do cromossoma X, a regulação dos desenvolvimento, envelhecimento, cancro e 1. Recentemente, na presença de um oxidado 5-mC, 5-hydroxymethylcytosine (5 HMC), foi descoberto em células de mamíferos, em particular no estaminais embrionárias (ES) e células neuronais 2-4. 5 HMC é gerado por oxidação de 5-mC catalisada por TET família de ferro (II) / α-cetoglutarato-dependente dioxigenases 2, 3. 5 HMC é proposto para ser envolvido na manutenção de células estaminais embrionárias (MES), a hematopoiese normal e doenças malignas, e o desenvolvimento do zigoto 2, 5-10. Para melhor compreender a função da 5-HMC, um sistema de sequenciação fiável e simples é essencial. Seqüenciamento bissulfito tradicional não pode distinguir 5 HMC de 5-MC 11 12.
Aqui descrevemos um procedimento em duas etapas simples para rotulagem química seletiva de 5-HMC. No passo de rotulagem em primeiro lugar, 5 HMC em ADN genómico é marcado com um catalisada 6-azida-glucose por β-GT, uma glicosiltransferase de bacteriófago T4, de uma maneira que transmite a 6-azida-glucose a 5 HMC do cofactor modificado, UDP-6-N3-Glc (6-N3UDPG). No segundo passo, biotinilação, de um ligante de biotina de dissulfureto é ligado ao grupo azida por química do clique. Ambos os passos são altamente específicos e eficiente, levando à completa marcação, independentemente da abundância de 5 HMC em regiões genómicas e dando de fundo extremamente baixos. Seguindo a biotinilação de 5 HMC, os fragmentos de 5 HMC contendo ADN são então selectivamente capturadautilizando contas de estreptavidina de um modo independente de densidade. Os fragmentos resultantes de 5 HMC enriquecidas de DNA pode ser utilizado para as análises a jusante, incluindo a última geração de sequenciação.
Nossa marcação selectiva e protocolo de captura confere alta sensibilidade, aplicável a qualquer fonte de DNA genômico com variáveis / diverso 5 HMC-abundâncias. Embora o objetivo principal deste protocolo é a sua aplicação a jusante (ou seja., Sequenciamento de última geração para mapear a distribuição de 5 HMC no genoma), é compatível com molécula única, em tempo real SMRT (DNA) de seqüenciamento, que é capaz de fornecer uma única base de sequenciação de resolução de 5 HMC.
Protocolo
1. A fragmentação de ADN genómico
Fragmento de ADN genómico utilizando sonicação de uma gama de tamanhos desejada adequada para a plataforma de sequenciamento do genoma. (Nós normalmente sonicar a ~ 300 pb.) Verificar a distribuição do tamanho do ADN genómico fragmentado em 1% de gel de agarose (Figura 1).
2. Preparação de ADN
Determinar as quantidades de ADN a partir baseadas na abundância de 5 HMC em ADN genómico. Desde 5-HMC níveis variam significativamente em diferentes tipos de tecidos, quantidades de DNA a partir dependem dos níveis de 5-HMC das amostras. Por favor, consulte a Tabela 1 para exemplos.
3. β-GT reacção catalisada (reacção de transferência de Glicose)
- Misturar por pipetagem da mistura, como detalhado na Tabela 2 e incuba-se em um banho de água a 37 ° C durante 1 h.
- Após a incubação, limpar-se a mistura reaccional com remoção Kit QIAquick Nucleotide, utilizando 10 jig de DNA porcoluna. Eluir com 30 ul de água por coluna e combinar.
4. Reação Biotinilação (Clique Química)
- Adicionar DBCO-SS-PEG3-biotina conjugado de solução de trabalho (1 mM) na solução de ADN eluído (do passo 3) para uma concentração final de 150 uM (ou seja, 5 uL de solução de trabalho por 30 ul de solução de ADN).
- Misturar por pipetagem, e incubar em banho de água a 37 ° C durante 2 horas.
- Limpe a reação com QIAquick Removal Kit Nucleotide. O volume de eluição total ideal é de 100 uL.
- Quantificar a quantidade de DNA recuperado usando microlitro espectrofotômetro escala (por exemplo., NanoDrop).
5. Captura de 5 HMC contendo DNA
- Lave 50 ul de Dynabeads MyOne Estreptavidina C1 3 vezes com 1 ml de 1X tampão B & W de acordo com as instruções do fabricante. Separa-se as pérolas com um suporte magnético.
- Adicionar um volume igual de 2X tampão B & W para o D recuperado biotiniladoNA (100 ul) às pérolas lavadas.
- Incubar durante 15 min à temperatura ambiente com rotação suave num agitador rotativo.
- Separa-se as pérolas com um suporte magnético e lavar as pérolas três vezes com 1 ml de 1X tampão B & W.
- Eluir o DNA através da incubação as pérolas em 100 ul de DTT mM preparada de fresco 50 durante 2 h à temperatura ambiente, com rotação suave num agitador rotativo.
- Separa-se as pérolas com um suporte magnético. Aspirar o eluente e uma carga para Micro Bio-Spin 6 Coluna de acordo com a instrução de fabrico para remover o DTT. O ADN alvo é a solução agora.
- Purifica-se o DNA eluído a partir do passo anterior, Qiagen Purification Kit MinElute PCR DNA e elui-se em 10 ul de tampão EB. Quantificar DNA usando Fluorometer Qubit ou NanoDrop se a concentração é superior a 20 ng / ul. O DNA está pronto para jusante preparação biblioteca genômica sequenciação.
6. Resultados representativos
Se a qualidade de of DNA genómico é elevada, o rendimento de recuperação típicos após a β-GT e reacções de biotinilação são ~ 60-70%. No entanto, a eficiência da captação variar significativamente com os tipos de tecidos diferentes, dependendo dos níveis de 5-HMC das amostras. Normalmente, a eficiência da captação de DNA genómico cérebro é ~% 4-9, e, em alguns casos extremos, a eficiência pode atingir até 12%. No caso de células ES, a eficiência da captação média é de aproximadamente 2-4%, em contraste com a ~ 0,5% para as células estaminais neurais. A menor eficiência visto até agora foi para o DNA genômico de células cancerosas. Todos DNA enriquecido está pronto para o padrão da próxima geração de protocolos de preparação de bibliotecas. Além disso, o ADN capturado pode também ser usado como molde para a PCR em tempo real para detectar o enriquecimento de alguns fragmentos em comparação com o ADN de entrada, se os iniciadores relacionados estão disponíveis.
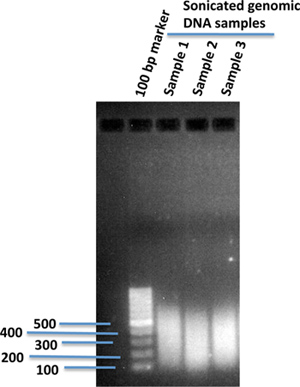
Figura 1. Sonicados fragmentos genómicos humanos de DNA em1% de gel de agarose. De 10 ug de DNA genómico isolado a partir de células humanas do iPS em 120 ul de tampão TE 1X foi sonicada usando um dispositivo de ultra-sons (Covaris). Após sonicação, 2 ul do DNA sonicado foi carregada num gel de agarose a 1% utilizando 100 pb do marcador de DNA para comparar os tamanhos dos fragmentos de DNA sonicados.
| Componente | Volume | Concentração Final |
| Água | _ Ul | |
| 10 X tampão de reacção β-GT | 2 ul | 1 X |
| Até 10 ug de ADN genómico | _ Ul | Até 500 ng / uL |
| UDP-N-6, 3-Glc (3 mM) | 0,67 ul | 100 uM |
| β-GT (40 uM) | 1 ul | 2 uM |
| Volume total | 20 ul |
i) Para o DNA genômico de tecidos (conteúdo 5 HMC alta> 0,1%)
| Componente | Volume | Concentração Final |
| Água | _ Ul | |
| 10 X tampão de reacção β-GT | 10 ul | 1 X |
| Até 20 ug de ADN genómico | _ Ul | Até 500 ng / uL |
| UDP-6-N3-Glc (3 mM) | Ul 1,33 | 100 uM |
| β-GT (40 uM) | 2 ul | 2 uM |
| Volume total | 40 ul |
ii) Para o ADN genómico de células estaminais (mediana 5 HMC conteúdo ~ 0,05%)
| Componente | Volume | Concentração Final |
| Água | _ Ul | |
| 10 X tampão de reacção β-GT | 10 ul | 1 X |
| Até 50 ug de ADN genómico | _ Ul | Até 500 ng / uL |
| UDP-6-N3-Glc (3 mM) | 3,33 ul | 100 uM |
| β-GT (40 uM) | 5 ul | 2 uM |
| Volume total | 100 ul |
iii) Para o câncer de DNA genômico de células (conteúdo 5 HMC baixo ~ 0,01%)
Tabela 1. Exemplos de quantidades de ADN de entrada e de reacções de etiquetagem utilizando as amostras com diferentes níveis de HMC-5 através do método selectivo química rotulagem.
| Amostra | 5 HMC nível | ADN de partida (mg) | A recuperação após a etiquetagem (entrada de esferas) (ig) | Rendimento de recuperação | Pull-down DNA (ng) | Puxe para baixo rendimento |
| Cerebelo do rato adulto | 0,4% | 10 | 7,5 | 75% | 236 | 3,1% |
| Pós-natal do rato 7 dias cerebelo | 0,1% | 11 | 9 | 82% | 140 | 1,6% |
| Rato de células ES E14 | 0,05% | 60 | 42 | 70% | 350 | 0,8% |
Tabela 2. Resultados representativos a partir de tecidos e células do cérebro de rato ES.
Discussão
5-hydroxymethylcytosine (5 HMC) é uma modificação do presente recentemente identificado epigenética em quantidades substanciais em certos tipos de células de mamíferos. O método aqui apresentado é para determinar a distribuição de todo o genoma de 5 HMC. Usamos bacteriófago T4 β-glicosiltransferase para transferir uma porção glucose engenharia contendo um grupo azida para o grupo hidroxilo de 5 HMC. O grupo azida pode ser quimicamente modificados com biotina para a detecção, o enriquecimento por afinidad...
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Este estudo foi financiado em parte pelo Instituto Nacional de Saúde (GM071440 a CH e NS051630/MH076090/MH078972 para PJ).
Materiais
| Name | Company | Catalog Number | Comments |
| Nome | Companhia | Catalogo | Comentário |
| Reagentes | |||
| O cloreto de sódio 5 M (NaCl) | Promega | V4221 | |
| PH 8,0 0,5 M de ácido etilenodiaminotetracético (EDTA) | Promega | V4231 | |
| 1M Trizma base (Tris) pH 7,5 | Invitrogen | 15567-027) | |
| HEPES 1M, pH 7,4 | Invitrogen | 15630 | |
| Cloreto de magnésio (MgCl2) 1M | Ambion | AM9530g | |
| Dimetil-sulfóxido (DMSO) | Sigma | D8418 | |
| Tween 20 | Fisher biorreagentes | BP337-100 | |
| DBCO-SS-PEG3-biotina conjugado | Clique em Ferramentas Química | A112P3 | |
| 1,4-Ditiotreitol, ultrapura (TDT) suprapuro | Invitrogen | 15508-013 | |
| QIAquick Removal Kit Nucleotide | Qiagen | 28304 | |
| Micro Bio-Spin 6 Coluna | Bio-Rad | 732-6222 | |
| Dynabeads MyOne | Invitrogen | 650-01 | |
| Estreptavidina C1 | |||
| Qiagen MinElute PCR Purification Kit | Qiagen | 28004 | |
| UltraPure Agarose | Invitrogen | 16500500 | |
| UDP-6-N 3-glucose | Motivo ativa | 55013 | |
| Enzima | |||
| β-glicosiltransferase (β-GT) | New England Biolab | M0357 | |
| Equipamento | |||
| Dispositivo sonicação | Covaris | ||
| Centrífuga de mesa | |||
| Banho de água | Fisher Scientific | ||
| Aparelho de gel de corrida | Bio-Rad | ||
| NanoDrop1000 | Thermo Scientific | ||
| Labquake Tubo Shaker | Barnstead | ||
| Labquake Tubo Shaker | Thermolyne | ||
| Suporte de Separação Magnética | Promega | Z5342 | |
| Qubit 2,0 Fluorometer | Invitrogen | ||
| Configuração de reagente 10 X Reacção β-GT tampão (500 mM de HEPES pH 7,9, 250 mM de MgCl 2) 2 X de ligação e de lavagem (B & W) de tampão (10 mM Tris pH 7,5, EDTA 1 mM, NaCl 2 M, Tween a 0,02% 20) . |
Referências
- Jaenisch, R., Bird, A. Epigenetic regulation of gene expression: how the genome integrates intrinsic and environmental signals. Nat. Genet. , 245-254 (2003).
- Ito, S. Role of Tet proteins in 5mC to 5hmC conversion, ES-cell self-renewal and inner cell mass specification. Nature. 466, 1129-1133 (2010).
- Tahiliani, M. Conversion of 5-methylcytosine to 5-hydroxymethylcytosine in mammalian DNA by MLL partner TET1. Science. 324, 930-935 (2009).
- Kriaucionis, S., Heintz, N. The nuclear DNA base 5-hydroxymethylcytosine is present in Purkinje neurons and the brain. Science. 324, 929-930 (2009).
- Ko, M. Impaired hydroxylation of 5-methylcytosine in myeloid cancers with mutant TET2. Nature. 468, 839-843 (2010).
- Koh, K. P. Tet1 and tet2 regulate 5-hydroxymethylcytosine production and cell lineage specification in mouse embryonic stem cells. Cell Stem Cell. 8, 200-213 (2011).
- Iqbal, K., Jin, S. G., Pfeifer, G. P., Szabo, P. E. Reprogramming of the paternal genome upon fertilization involves genome-wide oxidation of 5-methylcytosine. Proceedings of the National Academy of Sciences of the United States of America. 108, 3642-3647 (2011).
- Wossidlo, M. 5-Hydroxymethylcytosine in the mammalian zygote is linked with epigenetic reprogramming. Nat. Commun. 2, 241 (2011).
- Gu, T. P. The role of Tet3 DNA dioxygenase in epigenetic reprogramming by oocytes. Nature. 477, 606-610 (2011).
- Dawlaty, M. M. Tet1 is dispensable for maintaining pluripotency and its loss is compatible with embryonic and postnatal development. Cell Stem Cell. 9, 166-175 (2011).
- Huang, Y. The behaviour of 5-hydroxymethylcytosine in bisulfite sequencing. PLoS One. 5, e8888 (2010).
- Song, C. X. Selective chemical labeling reveals the genome-wide distribution of 5-hydroxymethylcytosine. Nat. Biotechnol. 29, 68-72 (2011).
- Pastor, W. A. Genome-wide mapping of 5-hydroxymethylcytosine in embryonic stem cells. Nature. 473, 394-397 (2011).
- Matarese, F., Pau, C. a. r. r. i. l. l. o. -. d. e. S. a. n. t. a., E, ., Stunnenberg, H. G. 5-Hydroxymethylcytosine: a new kid on the epigenetic block. Mol. Syst. Biol. 7, 562 (2011).
- Szwagierczak, A., Bultmann, S., Schmidt, C. S., Spada, F., Leonhardt, H. Sensitive enzymatic quantification of 5-hydroxymethylcytosine in genomic DNA. Nucleic Acids Res. 38, 181 (2010).
- Terragni, J., Bitinaite, J., Zheng, Y., Pradhan, S. Biochemical characterization of recombinant β-glucosyltransferase and analysis of global 5-hydroxymethylcytosine in unique genomes. Biochemistry. , (2012).
- Rusmintratip, V., Sowers, L. C. An unexpectedly high excision capacity for mispaired 5-hydroxymethyluracil in human cell extracts. Proc. Natl. Acad. Sci. U.S.A. 97, 14183-14187 (2000).
- Globisch, D. Tissue distribution of 5-hydroxymethylcytosine and search for active demethylation intermediates. PLoS One. 5, e15367 (2010).
- Yildirim, O. Mbd3/NURD Complex Regulates Expression of 5-Hydroxymethylcytosine Marked Genes in Embryonic Stem Cells. Cell. 147, 1498-1510 (2011).
- Szulwach, K. E. Integrating 5-hydroxymethylcytosine into the epigenomic landscape of human embryonic stem cells. PLoS Genet. 7, e1002154 (2011).
- Szulwach, K. E. 5-hmC-mediated epigenetic dynamics during postnatal neurodevelopment and aging. Nat. Neurosci. 14, 1607-1616 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados