Method Article
Geração de topicamente transgênicas Rats por
Neste Artigo
Resumo
Genes podem ser manipulados durante o desenvolvimento do córtex ou do hipocampo do rato via in utero eletroporação (IUE) em E16, para permitir modificações rápidas e direcionadas na conectividade neuronal para estudos posteriores do comportamento ou neuropatologia em animais adultos. Pós-natal em imagem in vivo para o controle do sucesso IUE é realizada por bioluminescência de ativar luciferase cotransfectados.
Resumo
No útero electroporação (IUE) é uma técnica que permite a modificação genética das células do cérebro para investigar o desenvolvimento neuronal. Até agora, o uso de IUE para investigar o comportamento ou neuropatologia no cérebro adulto tem sido limitada por métodos insuficientes para o controlo do sucesso da transfecção IUE por técnicas não invasivas em animais após o nascimento.
Para o presente estudo, os ratos E16 foram utilizados para IUE. Após a injecção intraventricular de ácidos nucleicos para os embriões, o posicionamento dos eléctrodos de pinça é crítico para o direccionamento tanto do córtex ou do hipocampo em desenvolvimento.
Ventricular co-injecção e de electroporação de um gene de luciferase permitiu a monitorização das células transfectadas postnatally após injecção intraperitoneal luciferina no cão anestesiado P7 vivo por in vivo a bioluminescência, utilizando um dispositivo de IVIS Espectro com software de quantificação 3D. Disc1 no córtex do rato levou à hipersensibilidade anfetamina. GFP cotransfectados pode ser detectado em neurônios por post mortem microscopia de fluorescência em criosecções indicando a expressão do gene presente em ≥ 6 meses após o nascimento.
Conclui-se que a imagem de bioluminescência pós-natal permite avaliar o sucesso de transfections transitórios com IUE em ratos. As investigações sobre a influência de manipulações genéticas tópicos durante neurodevelopment no cérebro adulto e sua conectividade está muito facilitada. Para muitas questões científicas, esta técnica pode complementar ou mesmo substituir o uso de ratos transgênicos e fornecer uma nova tecnologia para a neurociência comportamental.
Introdução
O desenvolvimento da eletroporação in utero método (IUE), que permite a modulação da expressão gênica no cérebro em desenvolvimento, tem sido um break-through, uma vez que permitiu estudar neurodesenvolvimento com relativa facilidade. 1-7 Alterações nos níveis de um gene alvo na expressão uma região específica do cérebro durante o desenvolvimento embrionário e / ou perinatal em roedores foram demonstrados criticamente influência proliferação neuronal, migração, arborização e conectividade. 8-10
A esquizofrenia é uma doença mental complexa, com sintomas agudos e crônicos que tem sido relacionados com anormalidades do desenvolvimento neurológico 11, 12 e, portanto, muitos dos genes candidatos identificados para a esquizofrenia são investigados os efeitos potenciais sobre a modulação do neurodesenvolvimento, como por exemplo para a interrompeu-in-esquizofrenia -1 (Disc1) gene 13-15.
O desenvolvimento do cérebro é regued por fatores genéticos e suas interações com o meio ambiente que desempenham papéis em, pré-períodos de desenvolvimento peri e pós-natal. Um importante factor de risco genético para várias desordens comportamentais é Disc1 os 16 genes. DISC1 knockdown leva a defeitos de migração em ratinhos 13, 17, e a manipulação de expressão Disc1 no córtex desenvolvimento por IUE foi mostrado para impactar o comportamento de ratinhos adultos 18.
Manipulando a expressão genética do cérebro por IUE tem várias vantagens em relação à geração 19 de linhagens de animais transgênicos. Em primeiro lugar, a expressão de genes dentro das áreas de interesse é alcançado dentro de semanas ou meses, em vez de várias gerações de criação de linhas de roedores transgênicos. Em segundo lugar, os mecanismos compensatórios durante o desenvolvimento precoce, que pode protegê fenótipos em animais de engenharia de 20 germinativas são evitados. Em terceiro lugar, apenas por meio de direccionamento numa população de células específico ou área específica do cérebro, migratiem ou diferenças de proliferação pode ser comparado diretamente com o não-mutante ou controlar lado contralateral se electroporations unilaterais são escolhidos. Por outro lado, IUE não tem a precisão de cre / lox-sincronismo induzido accionado o promotor de expressão e apenas uma sub-população de células de uma determinada zona é orientada conduzindo a uma espécie de mosaico da expressão genética padrão.
Para muitas aplicações experimentais em roedores adultos, a transfecção transiente de um número limitado de células, em uma região do cérebro, pode ser suficiente, ou mesmo desejado, de modo que a maior vantagem da estabilidade da linha germinativa, roedores transgénicos é negligenciável. Na verdade, IUE é útil para investigar se algumas células anormalmente desenvolvidos podem afectar toda uma rede de células ou circuitos. Outra vantagem pode ser a capacidade de demonstrar os efeitos das células-autônoma não de um gene, devido à natureza mosaico do hit. Além disso, a geração de ratos transgênicos e knockout ainda está em sua infância e do usode IUE nesta espécie para estudar as consequências do desenvolvimento do cérebro aberrantes é de alta de juros.
Até o momento, o maior obstáculo de usar IUE para investigar as conseqüências de intervenção nos animais como adultos é a falta de sucesso de monitoramento eletroporação. Até agora, a GFP co-transfectadas neurónios fluorescentes nas crias de ratos recém-nascidos vivos não podiam ser detectadas com um microscópio de fluorescência binocular adequado ou com a imagem de fluorescência do IVIS Spectrum.
Para superar este obstáculo, nós co-transfectadas de um gene repórter de luciferase e realizada bioluminescência imagens ao vivo de filhotes por três dimensões (3D) a quantificação da área do cérebro IUE.
Como um exemplo para demonstrar a aplicabilidade deste método num ensaio funcional depois testando a manipulação genética do neurodesenvolvimento, uma co-injecção de plasmídeos contendo Disc1 humano, luciferase e GFP no ventrículo lateral de embriões de rato 3 seguido por electroporação com um eléctrodo de pinça foi realizada. Embora os sinais de fluorescência não pôde ser detectado na fase pós-natal in vivo, um sinal de bioluminescência sólido derivado do metabolismo luciferina pelo gene da luciferase de co-transfectado foi detectado até cinco semanas após o nascimento. 3D-medidas da área do cérebro quantificação permitiu electroporados pelo qual foram identificados filhotes com eletroporação insuficiente ou equivocada desde o início, assim, permitindo a atribuição de animais IUE (gene de interesse e mexidos controle) para os grupos experimentais com áreas cerebrais eletroporados combinados de baixa variabilidade . A utilização de ratos adultos em IUE paradigmas comportamentais foi demonstrada como um exemplo da utilidade deste protocolo.
Protocolo
Todos os experimentos com animais foram autorizados pela Landesministerium responsável für Natur, Umwelt und Verbraucherschutz (LANUV NRW; 87-51.05.2010.A301), de acordo com a legislação nacional e europeia.
1. In utero Eletroporação
Este método foi descrito pormenorizadamente na JOVE para o rato por Walantus et al. 3, bem como Rice et al. 4 e é aqui resumida brevemente. Um tamanho de ninhada de 6-8 filhotes rende um bom resultado. Deve haver, pelo menos, dois embriões não electroporadas, a fim de aumentar a taxa de sobrevivência global (ver abaixo).
- Preparar DNA-mistura que contém 1,5 mg / mL de meta-Plasmid (shRNA: pENTR-U6; Invitrogen, Eugene, OR / Disc1 superexpressão: pCAX 21), 0,5 mg / mL de luciferase contendo plasmídeo (pCAX), 0,5 ug / uL GFP contendo plasmídeo (pCAGGS 22) em 1x PBS solução manchado blu luze com Fast Green Dye.
- Prepare agulhas de injeção de capilares de vidro com uma agulha Pipeta Extrator. E esterilizar instrumentos cirúrgicos ou em autoclave ou a incubação com um desinfetante à base de álcool (kodan Tinktur forte).
- Administrar uma dose pré-operatória de buprenorfina (0,05 mg / kg) 15 minutos antes da cirurgia para uma rata grávida 16 dias após a fertilização (E16). Então anestesiar os animais numa câmara de isoflurano.
- Após a anestesia, coloque o rato em decúbito dorsal sobre uma mesa de operação 37 ° C-aquecido com máscara de respiração ligado ao aparelho de anestesia, usando configuração de oxigênio em 0,4 L / min e isoflurano em 1,8%.
- Depois de raspar o abdômen, desinfetar a área depilada três vezes com kodan Tinktur Forte (um desinfetante à base de álcool).
- Cubra o rato com panos estéreis, expondo apenas o campo de operação raspada.
- Execute in utero eletroporação.
- Corte o abdômen com uma Tesourasr ao longo da linha alba (~ 2cm).
- Expor os cornos uterinos cuidadosamente com um anel de fórceps.
- Tome cuidado para manter a parede do útero molhado com aquecido PBS estéril durante toda a cirurgia.
- Injectar solução de ADN com uma agulha de vidro fino para um dos ventrículos laterais de embriões.
- Coloque o eletrodo 7 milímetros ao redor da cabeça do embrião. Para bater uma população de células de camadas corticais superiores, realizar a IUE em E16 23 e posicionar o eletrodo positivo no hemisfério acima do ventrículo injetado com uma ligeira dorsal / lateral, tendência. Para atingir as células do hipocampo de alterar a colocação do eléctrodo positivo para o lado oposto do que o ventrículo lateral, injectados com a direcção ligeiramente dorsal (Figura 1).
- Realize eletroporação por cinco a 50 pulsos ms a 55 V com 950 breaks ms com uma onda de pulso electroporador quadrado.
- Poupar o primeiro embrião no final vaginal de cada trompa do útero, a fim de aumentar a tele as chances de sobrevivência de todos os embriões.
- Coloque os chifres do útero de volta para o rato mãe.
- Stich da parede abdominal com uma Vicryl material absorvível sutura cirúrgica.
- Fechar a pele com o material de sutura de Vicryl ou com grampos de sutura.
- Coloque o rato mãe de volta para a gaiola e mantê-lo quente por 2-3 horas.
- Segure os ratos sozinho em sua gaiola na sala de instalações para animais e ração à vontade. Eles dão à luz entre E22-24.
- Manter os filhotes de ratos com sua mãe por três semanas e depois separá-los por gênero.
2. Bioluminescência Imagens ao vivo da reação enzimática da luciferase
Este método é utilizado para analisar a posição das células transfectadas no útero. Co-electroporados cDNA firefly luciferase é traduzido em luciferase ativo, que após metabolização de D-luciferina para oxiluciferina, emite um fóton (Figura 2 ). A luminescência resultante pode ser detectado no cérebro de ratos jovens positivos electroporadas em um espectro IVIS-se com a idade de cerca de 35 dias após o parto (Figura 4).
No presente estudo, o ensaio de luciferase e a bioluminescência de imagem foi realizado a partir de P7. Este ponto de tempo foi escolhido para permitir que a mãe e os filhotes para recuperar do stress do nascimento. Quando inicialmente trabalhando com os filhotes no P0, a sobrevivência das crias foi severamente afetado em que os filhotes foram encontrados mortos ou comido pela mãe.
Inicialmente, os filhotes de rato com a electroporação de sucesso são identificados por uma imagem 2D-bioluminescência com um tempo de exposição de três minutos. Posteriormente, os filhotes positivos são utilizados para a criação de imagens 3D, a fim de especificar a localização da área electroporados.
- Dilui-se o sal de sódio D-luciferina em PBS a uma concentração de 15 mg / ml e esterilizar por filtração através de um filtro de seringa estéril.
- Pesar os filhotes.
- Leve o filhote em um lado com o abdômen em cima e esticar o abdômen ligeiramente. Injectar 10 mL / g de peso corporal de solução de luciferina intraperitoneal. Para os mais velhos e mais ágeis, pré-anestesiar os filhotes com isoflurano na câmara de indução antes de injetar a luciferina.
- Ligue o influxo isoflurano da XGI-8 Gas Anestesia Sistema dentro do IVIS Spectrum com 3% de isoflurano.
- Coloque o focinho do animal para os cones do nariz de vidro do sistema de anestesia.
- Mantenha o animal em uma posição propensa até que esteja em anestesia profunda (2-3 min). Em seguida, reduzir o influxo de isoflurano a 1,5%.
- Escolha uma medição 2D-bioluminescência para selecionar filhotes positivos de toda a ninhada. Use as seguintes configurações
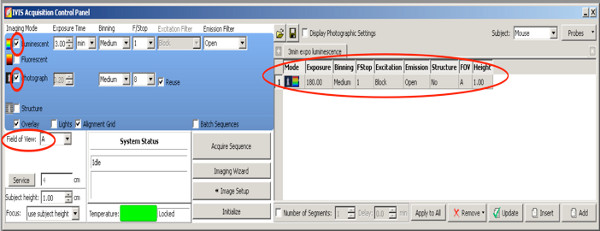
Clique aqui para ver maior figura .- Defina um checkmark na fotografia com binning médio e F / Stop em 8, a câmera tira uma foto de cima após o início da medição.
- Definir filtro de excitação: block.
- Definir filtro de Emissão: aberto.
- Definir Binning para médio.
- Defina F / Stop em 1.
- Definir o nível de Estágio A.
- Definir luminescência tempo de exposição a 180 seg.
- Para a criação de imagens 3D, a fim de melhor quantificar a área electroporados dos filhotes positivos, use as seguintes configurações DLIT para luciferase de vaga-lume.
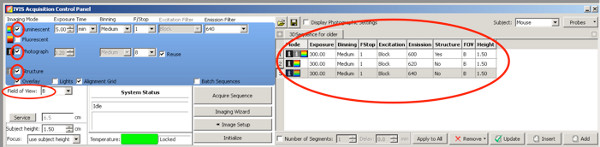
Clique aqui para ver maior figura .- Definir uma marca de seleção na fotografia, a câmera tira uma foto de cima após o início da medição.
- Definir uma marca de verificação na estrutura, a superfície do animal é digitalizado pela IVIS antes da medição da bioluminescência.
- Use após filtros de emissão e configurações de tempo de exposição até a idade de duas semanas;
Filtro de emissão de 1: 590 nm, tempo de exposição de 300 seg
Filtro de emissão 2: 600 nm, tempo de exposição de 240 seg
Filtro de emissão 3: 620 nm, tempo de exposição de 180 seg
Filtro de emissão de 4: 640 nm, tempo de exposição de 120 seg
Para os ratos com mais de P20
Filtro de emissão de 1: 600 nm, tempo de exposição de 300 seg
Filtro de emissão 2: 620 nm, tempo de exposição de 300 seg
Filtro de emissão 3: 640 nm, tempo de exposição de 300 seg
Clique aqui para ver maior figura .
Devido à diminuição da intensidade do sinal em animais velhos, o tempo de exposição é ampliada para os três melhores filtros de emissão. - Definir o nível de Estágio B
- Definir Binning para médio.
- Defina F / Stop em 1
- Após a medição, mar k os ratos por um código Earhole para diferenciá-los uns dos outros e combiná-los com as fotos de imagem IVIS Vivo
- No final do procedimento de medição, desligar isoflurano afluxo e manter o rato sobre a placa aquecida durante alguns minutos, antes de voltar para a sua jaula.
3. Análise de Imagens bioluminescência
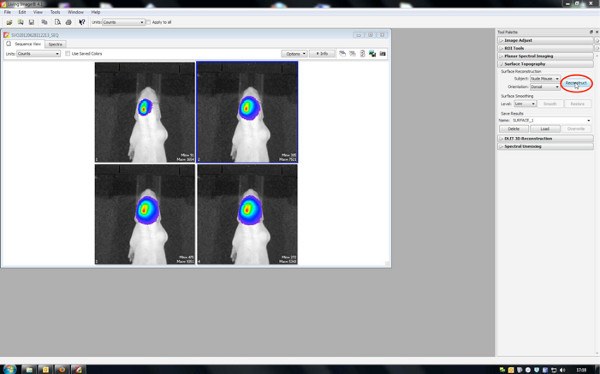
A geração de imagens em 3D, os filmes em 3D e a quantificação do volume da fonte de sinal é feita pelo software de estar imagem pré-instalado no IVIS Spectrum.
- Geração de imagens em 3D
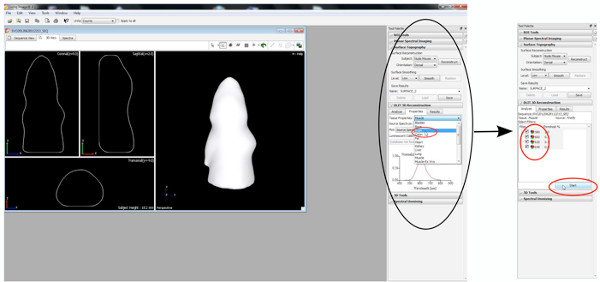
- Primeiro, reconstruir a topografia da superfície, portanto, definir o limite entre 20-30%.
Clique aqui para ver maior figura .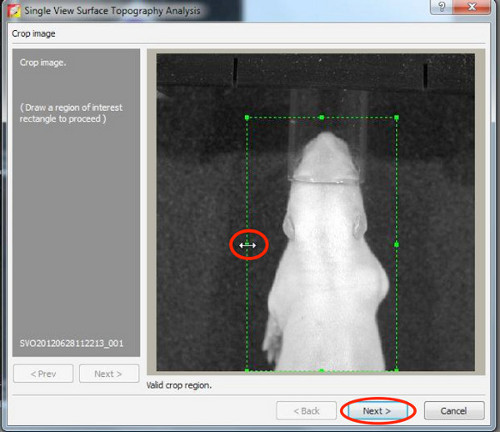
een 6 "src =" / files/ftp_upload/50146/50146screen6.jpg "/> - Comece DLIT reconstrução 3D com um limite de imagem de 10% para cada comprimento de onda.
Clique aqui para ver maior figura .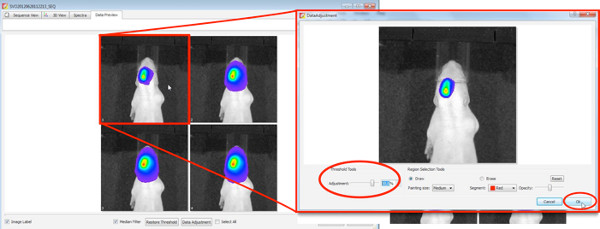
Clique aqui para ver maior figura .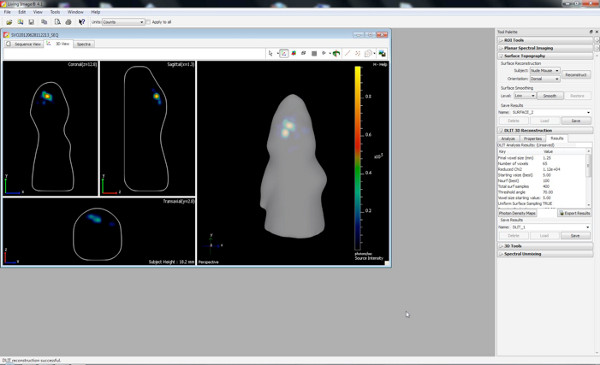
Clique aqui para ver maior figura . - Crie filmes em 3D usando o botão animado dentro da barra de ferramentas 3D.
- Escolha diferentes orientações da imagem em 3D, bem como visualizações de zoom como quadros-chave e pressione o 'Record & #39; botão, registrando a passagem de uma posição / orientação para o outro.
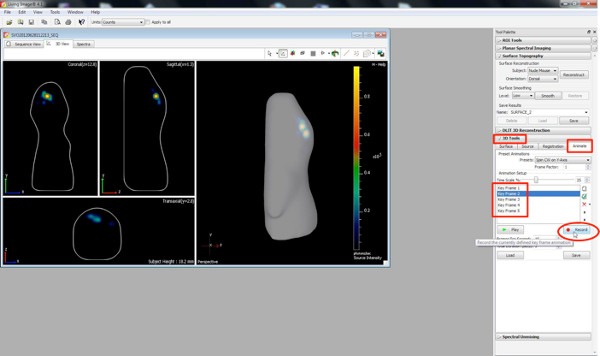
Clique aqui para ver maior figura .
- Primeiro, reconstruir a topografia da superfície, portanto, definir o limite entre 20-30%.
4. Teste Comportamental
Teste comportamental foi realizado a fim de determinar se as manipulações do gene IUE mediadas no rato pode iniciar efeitos de longo prazo que persistem na idade adulta. No presente caso, o efeito do transiente, unilateral comprimento total DISC1 humano cortical superexpressão após IUE foi investigada por meio de testes de locomoção em um campo aberto (OF), com e sem uma dose baixa de anfetamina, como um teste específico para dopamina relacionada comportamento 24. Num procedimento semelhante realizada por Niwa et al. Em ratinhos IUE usando knockdown Disc1, ratinhos IUE mas não controlos mostraram hipersensibilidadea anfetamina 18.
Os ratos que foram no útero electroporated com um overexpressing vetor DISC1 foram realizados em condições de laboratório, com luz 12 horas sete horas - sete horas e foram alimentados ad libitum. Aos 3 meses de idade, os ratos foram submetidos a testes de comportamento.
Para quantificar a locomoção como uma leitura dos efeitos da anfetamina, um campo aberto de um sistema de atividade Tru digitalização situado em uma câmara de som e de luz isolado foi usado. Este sistema mede o tempo de duração e distância os movimentos de animais, tempo e distância passados na margem ou no centro do campo aberto, bem como a criação de comportamento 25.
- No primeiro dia, depois de testar a injecção de soro fisiológico
- Pesar os animais.
- Injectar por via intraperitoneal 1 ul / g de peso corporal de uma solução salina (PBS 1x).
- Logo após a injeção, colocar o animal para o campo aberto e iniciar a medição do sistema TruScan. Record para 15 min umad subdividir dados em 3 x 5 min partes.
- Coloque o animal de volta para sua gaiola.
- Segundo dia, teste na injeção de anfetamina
- Pesar os animais.
- Injectar por via intraperitoneal 1 ul / g de peso corporal de uma solução a anfetamina 0,5 mg / ml.
- Logo após a injeção de colocar o animal para o campo aberto e iniciar a medição do sistema TruScan. Recorde durante 15 min e subdividir dados em 3 x 5 min partes.
- Devolver o animal para sua gaiola.
- Analisar locomoção e criação de comportamento gerado pelo software de digitalização Tru específico. Crie gráficos com GraphPad (Prisma) e calcular estatísticas pelo software SPSS Statistics.
Resultados
A Figura 3 mostra viver medições de imagem de três filhotes de ratos em P7 após a injeção de 150 mg luciferina / kg de peso corporal. As diferenças de intensidade do sinal, indicando a variabilidade na eficiência da IUE são visíveis. Bioluminescência sinais fortes foram registados até P36 (Figura 4). Na Figura 5, a capacidade de definir cortical (Figuras 5A e 5C) e hipocampo (Figuras 5B e 5D), eletroporação de imagem de bioluminescência estão representados. A correlação entre o sinal de bioluminescência (Figura 7A), com o seu sinal de fluorescência após a remoção do crânio (Figura 7B) e as células electroporadas-GFP correspondentes no cérebro cryosectioned (Figura 8) ao P14 estão ilustrados nas Figuras 6-8. De nota, não houve detecção de um sinal de fluorescência em ratos vivos em qualquer ponto de tempo.
tenda "> in vivo bioluminescência imagiologia permite discriminação aproximado de diferentes áreas do cérebro electroporadas por 2D (Figuras 5A e 5B), que é melhorada com o programa de software DLIT IVIS Espectro de gerar imagens 3D (Figuras 5C e 5D). Nos exemplos mostrados , electroporação do córtex pré-frontal e hipocampo podem ser distinguidos. Deve notar-se que, enquanto que aponta para electroporar o hipocampo, algumas células progenitoras para o córtex deitada dorsal do hipocampo pode também ser atingido (Figura 7).Rats unilateralmente no útero eletroporados com pCAX vetor para o córtex e, posteriormente, com superexpressão completo DISC1 humano comprimento foram investigados tanto espontânea e hiperatividade induzida por anfetamina como adultos. Rats eletroporados com pCAX-DISC1 foram hipersensíveis a uma dose baixa de anfetamina. Estes ratos movido significativamente more após o tratamento do que as anfetaminas após a injecção de soro fisiológico, enquanto os animais de controlo não o fez (Figura 10).
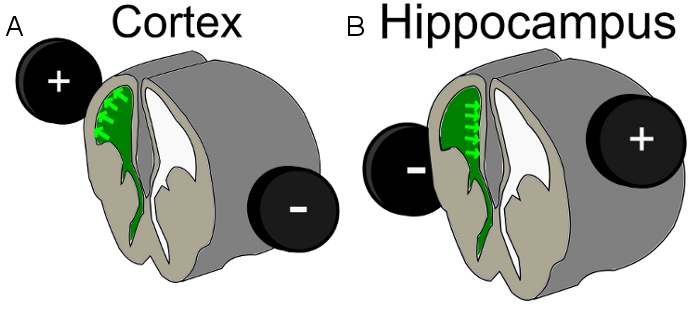
Figura 1. Esquema da posição do eletrodo para A) eletroporação e B córtex) eletroporação hipocampo; verde = DNA injetado-Mix dentro do ventrículo.
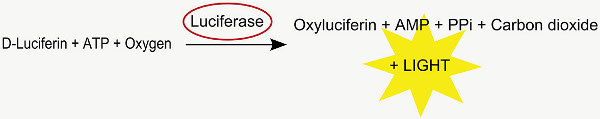
Figura 2. Reacção da luciferase.
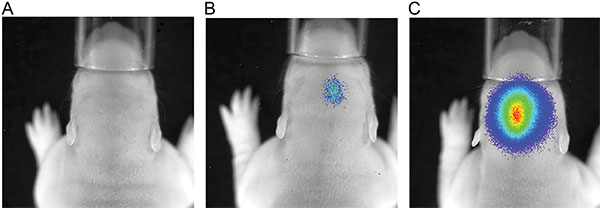
Figura 3. A medição de luminescência do P7 ratos após injecção de 150 mg / kg de peso corporal luciferina; tempo de exposição de 180 seg; A) ratos com nenhum sinal de luminescência, B) de rato com um sinal de bioluminescência fraca, C rato) com um sinal de luminescência forte.
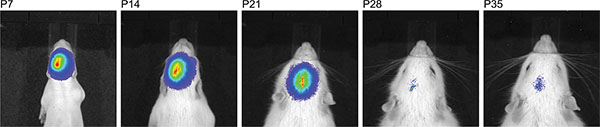
Figura 4. A linha do tempo da medição de bioluminescência consecutivas do mesmo rato após injecção de 150 mg / kg de luciferina demonstrando uma grande janela de tempo em que o sucesso IUE pode ser detectada.
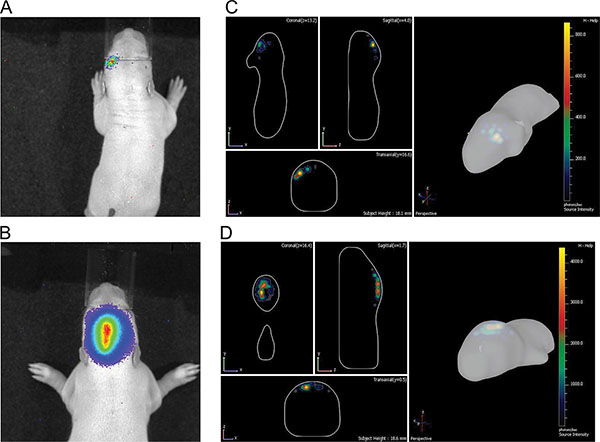
. Figura 5 Ilustração de diferenças entre eletroporação cortical e hipocampal no P7 A) e B) as imagens 2D;. C) e D) as imagens em 3D; A) e C) do córtex; B) e D) do hipocampo.files/ftp_upload/50146/50146fig5highres.jpg "> Clique aqui para ver maior figura.
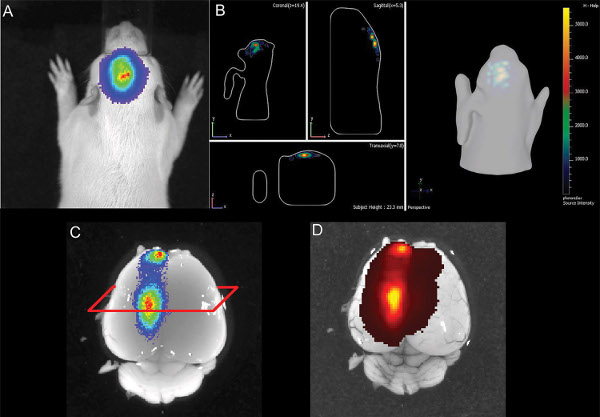
Figura 6. Ilustração de E16 eletroporação do hipocampo de um filhote de rato em P14 A) 2D imagem de bioluminescência B) ilustração 3D da bioluminescência sinal C) dissecado cérebro com sinal de bioluminescência D) cérebro com GFP sinal epi-fluorescência. Clique aqui para ver maior figura .
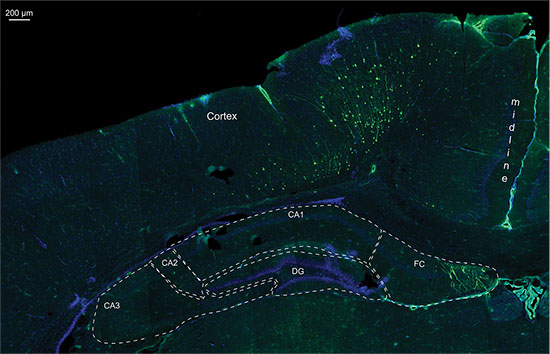
Figura 7. Detalhe de uma imagem de fluorescência de uma seção crio 20 mM do mesmo P14 cérebro de rato electroporados com GFP contendo plasmídeo e luciferasevetor, coloração núcleos com DAPI; CA1-3 = Cornu Ammonis 1-3; DG = giro denteado; FC = Fasciolarum cinereum.
Video 1. Animação em 3D de um hipocampo electroporados rato em P14.
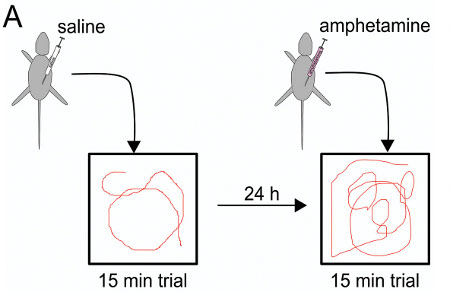
Figura 8. Esquema de ensaio anfetamina: a injeção de solução salina primeiro dia, antes de 15 min o julgamento, 24 horas mais tarde anfetamina injeção antes do teste na câmara de campo aberto.
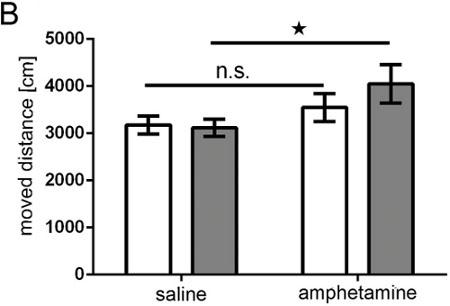
Figura 9. Teste de anfetamina. Gráfico de barras mostrando distância percorrida (em cm) do animal gravado por um sistema TrueScan mais de 15 min barras brancas = grupo controle;. Barras cinza = grupo superexpressão DISC1; grupo controle n = 10; DISC1 grupo superexpressão n = 11; ANOVA: geno * Tratamento p = 0,043; T-Test para salina tempo total vs ns = não significativo anfetaminas Pcontrol = 0,172, pDISC1 = 0,001.
Discussão
O nosso estudo mostra que IUE é adequado para gerar ratos adultos com os neurónios que expressam um transgene em uma área selectivo do cérebro e que, como resultado desta intervenção, estes animais apresentam mudanças de comportamento, indicando a funcionalidade da manipulação realizada. Neste estudo, por exemplo, os ratos que sobrexpressam Disc1 unilateralmente em uma pequena parte do córtex pré-frontal mostraram hipersensibilidade direcção anfetamina (Figura 9).
Seleção de ratos para o sucesso eletroporação in vivo por bioluminescência imagem foi eficiente no controle da variabilidade inerente de transfecção de células IUE e foi aplicado para gerar grupos com uma área homogênea IUE de baixa variabilidade inter-sujeitos para investigações posteriores.
Neste estudo, não fomos capazes de selecionar filhotes electroporados da ninhada por detecção de fluorescência induzida por GFP co-electroporados no animal recém-nascido, mesmo thourg, ao mesmo tempo e no mesmo animal um sinal de bioluminescência da luciferase igualmente co-electroporado poderia ser detectado após a injecção de luciferina (Figura 6), e o GFP expressando neurónios estavam ainda presentes no cérebro com uma idade de seis meses. Conclui-se que, no rato, a reacção da luciferase / luciferina é bem adequada para diferenciar animais com cérebros electroporadas sucesso (Figura 3).
O controlo quantitativo de sucesso IUE relaciona-se com a intensidade do sinal de bioluminescência que é medida pela contagem de fotões dentro do mesmo tempo de exposição (Figura 3) e corresponde à actividade enzimática de luciferase co-expressa. Sinais de bioluminescência pequenas são detectáveis por 100-200 contagens de fótons, e, em um esplendor de ~ 1x10 4 fótons / seg / cm 2 / show esterradiano 1.000-2.000 as células marcadas com GFP na histologia no 6 meses de idade cérebro de rato. A maior disp sinalDefiniu um brilho de até ~ 5x10 6 fótons / seg / cm 2 / esterradiano e ~ 64.000 contagens.
Na estirpe de ratos Sprague Dawley utilizado, observou-se um enfraquecimento do sinal de bioluminescência longitudinalmente com o aumento da idade e do sinal desapareceu para além da idade de P35 (Figura 4). Neste momento, nós não sabemos se quer o transitório, expressão baseada em vetor plasmídeo de luciferase diminui, ou se o sinal de bioluminescência enfraquece devido ao aumento da massa cerebral, ou ambas são as causas para o sinal desaparecer. Para o presente ensaio funcional em ratos adultos, a selecção para os estudos de comportamento foi feita apenas com base na localização do sinal, mas não pela intensidade do sinal da bioluminescência.
Apesar de a monitorização da bioluminescência quantitativa 3D permitiram a diferenciação entre as diferentes áreas de electroporação (Figura 5), o seu rigor foi limitada para as células localizadas na profundidade dimension do cérebro. Figura 6 mostra um exemplo de uma electroporação do hipocampo onde a medição da bioluminescência no 2D e a imagem 3D indicado um bom posicionamento da electroporação. No cérebro post mortem dissecados, um sinal de GFP foi detectado por fluorescência mais ou menos na mesma posição que o sinal de bioluminescência, indicando correcto direccionamento do hipocampo. Mas mostra histologia que também as células do córtex dorsal do hipocampo foram alvo (Figura 7). Isso indica que o ensaio de bioluminescência é uma ferramenta útil para detectar, filhotes IUE positivos e também para ter uma idéia da área electroporados, mas, em última instância, a imagem não pode substituir histologia post mortem a exatamente localizar células-alvo de forma positiva.
Nossa demonstração indica promessa para a aplicação da tecnologia de IUE para gerar manipulações sutis alvo de regiões cerebrais corticais ou do hipocampo para simular aberrações em cmigração ortical ou outros defeitos do desenvolvimento neurológico que podem influenciar o animal adulto. Enquanto electroporação bilateral 26 tem a vantagem de um possível efeito maior sobre o comportamento, há também mais a mortalidade dos embriões. Eletroporação unilateral foi escolhido a fim de comparar os dois hemisférios com um como um controle interno, bem como para mostrar que, mesmo manipulando IUE em um unilateral, pequena região é suficiente para mudar o comportamento. Mudanças induzidas pelo IUE na conectividade entre os neurônios ou arquitetura pode, assim, ser induzido sem evocar uma lesão eo jogo necessário da região para-ser-IUE-manipulado com o teste comportamental apropriada depende da questão científica.
Resolução de problemas
Tamanho da ninhada reduzida Há várias sugestões sobre o aumento da sobrevivência dos filhotes IUE. Em primeiro lugar, a utilização de capilares de vidro muito finas durante a electroporação, a fim de minimizar o tecido Lesion é recomendada. Em segundo lugar, não electroporate o primeiro embrião no final vaginal de cada trompa do útero: a morte do primogênito embrião aumenta as chances de um aborto de todos os outros embriões. Em terceiro lugar, após o nascimento, ratas mães muitas vezes matar parte de sua descendência devido ao estresse perinatal. A fim de reduzir o estresse adicional, não comece com a imagem ao vivo logo após o nascimento, mas esperar por sete dias.
Detecção de fluorescência da GFP-dos filhotes
Em uma semana após o nascimento, nenhum sinal de fluorescência ou usando fluorescência binocular ao vivo imagens microscópicas ou imagens de fluorescência com o IVIS Spectrum (modos de epifluorescência e transfluorescence, pois GFP excitação / emissão: 465/520 nm e 500/540 nm). É possível que ambos, a transmissão limitada de curto comprimento de onda de excitação e emissão de luz através do tecido como o crânio e o fundo alto autofluorescência da pele prevenir utilizando fluorescência sob a desccondições ribed no rato. Como mostrado na Figura 6, o sinal de luciferase no animal vivo também pode ser detectada no cérebro dissecado (sem crânio) e há, também um sinal de fluorescência é detectável (Figura 6D).
Diferenciação de bioluminescência em áreas do cérebro espaçados
Mesmo na figura 3D a localização da área de bioluminescência não pode ser previsto a 100%. Especialmente as células sobre ou abaixo da área prevista também pode ser acidentalmente direccionada e transfectadas. A posição exacta tem de ser controlado por post-mortem (fluorescência) histologia (ver Figura 7).
Divulgações
Os autores deste estudo não têm interesse financeiro neste estudo e não foram patrocinados pela indústria para este estudo. Taxas de acesso aberto foram contribuídas por PerkinElmer Inc. publicação post.
Agradecimentos
Os autores agradecem Tracy Young-Pearse e Atsushi Kamiya para a prestação de plasmídeos.
Este trabalho foi financiado pela Neuron-ERANET Discover para OU e CK (BMBF 01EW1003), DFG (Ko 1679/3-1; GRK1033) para CK, e (DE 792/2-4) para MASS
Materiais
| Name | Company | Catalog Number | Comments | ||||||||||||||||||||||||||||
| Reagent name | |||||||||||||||||||||||||||||||
| Dulbecco's Phosphate-Buffered Saline (PBS) | Invitrogen | 14190-250 | without calcium, without magnesium | ||||||||||||||||||||||||||||
| D-luciferin, sodium salt | SynChem OHG, Germany | BC218 | CAS number: 103404-75-7 substrate for firefly-luciferase | ||||||||||||||||||||||||||||
| Fast Green FCF | Sigma Aldrich, USA | F7258-25G | CAS: 2353-45-9 | ||||||||||||||||||||||||||||
| D-Amphetamine | Sigma Aldrich, USA | A 5880 | CAS: 51-63-8 | ||||||||||||||||||||||||||||
| kodan Tinktur forte | Schülke Mayr GmbH, Germany | 104 005 | |||||||||||||||||||||||||||||
| Material / product | |||||||||||||||||||||||||||||||
| Glass capillaries | Sutter Instrument | Novato, California, USA | borosilicate glass O.D.:1 mm, I.D.: 0.78 mm | ||||||||||||||||||||||||||||
| Needle Pipette Puller | David Kopf Instruments | Tujunga, California, USA | |||||||||||||||||||||||||||||
| Tweezer electrode | Nepa Gene CO., LTD. | Shioyaki, Ichikawa, Chiba, Japan | 7 mm in diameter platinum disc electrodes (CUY650P7) | ||||||||||||||||||||||||||||
| Surgical Scissors - sharp | Fine Science Tools | Heidelberg, Germany | Straight, 12 cm (14002-12) | ||||||||||||||||||||||||||||
| Ring Forceps | Fine Science Tools | Heidelberg, Germany | 2.2 mm ID, 3 mm OD (11021-12) | ||||||||||||||||||||||||||||
| Square wave pulse electroporator (CUY21SC) | Nepa Gene CO., LTD. | Shioyaki, Ichikawa, Chiba, Japan | (CUY21SC) | ||||||||||||||||||||||||||||
| Vicryl surgical suture material | Ethicon | Norderstedt, Germany | 3-0; 2 Ph. Eur; | ||||||||||||||||||||||||||||
| Wound Clip Applicator | Fine Science Tools | Heidelberg, Germany | Reflex 9 mm (12032-09) | ||||||||||||||||||||||||||||
| Syringe filter | VWR | Darmstadt, Germany | 0.45 μm cellulose acetate | ||||||||||||||||||||||||||||
| IVIS Spectrum | Caliper Life Science / PerkinElmer | Waltham, MassachusettsUSA | |||||||||||||||||||||||||||||
| XGI-8 Gas Anesthesia System | PerkinElmer | Waltham, Massachuset tsUSA | |||||||||||||||||||||||||||||
| Open-field | Coulbourn Instruments | Allentown, USA | (40 x 40 x 39 cm) | ||||||||||||||||||||||||||||
| Tru Scan activity system | Coulbourn Instruments | Allentown, USA | |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
Referências
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Developmental Biology. 240, 237-246 (2001).
- Fukuchi-Shimogori, T., Grove, E. A. Neocortex patterning by the secreted signaling molecule FGF8. Science. 294, 1071-1074 (2001).
- Walantus, W., Elias, L., Kriegstein, A. In Utero Intraventricular Injection and Electroporation of E16 Rat Embryos. J. Vis. Exp. (6), e236 (2007).
- Rice, H., Suth, S., Cavanaugh, W., Bai, J., Young-Pearse, T. L. In utero Electroporation followed by Primary Neuronal Culture for Studying Gene Function in Subset of Cortical Neurons. J. Vis. Exp. (44), e2103 (2010).
- Takahashi, M. Manipulating gene expressions by electroporation in the developing brain of mammalian embryos. Differentiation. 70, 155 (2002).
- Tabata, H., Nakajima, K. Efficient in utero gene transfer system to the developing mouse brain using electroporation: visualization of neuronal migration in the developing cortex. Neuroscience. 103, 865-872 (2001).
- Nakahira, E., Yuasa, S. Neuronal generation, migration, and differentiation in the mouse hippocampal primoridium as revealed by enhanced green fluorescent protein gene transfer by means of in utero electroporation. J Comp Neurol. 483, 329-340 (2005).
- Young-Pearse, T. L., et al. A critical function for beta-amyloid precursor protein in neuronal migration revealed by in utero RNA interference. The Journal of Neuroscience : the Official Journal of the Society for Neuroscience. 27, 14459-14469 (2007).
- Niwa, M., et al. Knockdown of DISC1 by in utero gene transfer disturbs postnatal dopaminergic maturation in the frontal cortex and leads to adult behavioral deficits. Neuron. 65, 480-489 (2010).
- Sapir, T., et al. Accurate balance of the polarity kinase MARK2/Par-1 is required for proper cortical neuronal migration. The Journal of Neuroscience : the Official Journal of the Society for Neuroscience. 28, 5710-5720 (2008).
- Weinberger, D. R. From neuropathology to neurodevelopment. Lancet. 346, 552-557 (1995).
- Murray, R. M., Lewis, S. W. Is schizophrenia a neurodevelopmental disorder?. British Medical Journal. 295, 681-682 (1987).
- Kamiya, A., et al. A schizophrenia-associated mutation of DISC1 perturbs cerebral cortex development. Nat Cell Biol. 7, 1167-1178 (2005).
- Miyoshi, K., et al. Disrupted-In-Schizophrenia 1, a candidate gene for schizophrenia, participates in neurite outgrowth. Mol Psychiatry. 8, 685-694 (2003).
- Mao, Y., et al. Disrupted in schizophrenia 1 regulates neuronal progenitor proliferation via modulation of GSK3beta/beta-catenin signaling. Cell. 136, 1017-1031 (2009).
- Millar, J. K., et al. Disruption of two novel genes by a translocation co-segregating with schizophrenia. Hum Mol Genet. 9, 1415-1423 (2000).
- Steinecke, A., Gampe, C., Valkova, C., Kaether, C., Bolz, J. Disrupted-in-Schizophrenia 1 (DISC1) is necessary for the correct migration of cortical interneurons. The Journal of Neuroscience : the Official Journal of the Society for Neuroscience. 32, 738-745 (2012).
- Niwa, M., et al. Knockdown of DISC1 by in utero gene transfer disturbs postnatal dopaminergic maturation in the frontal cortex and leads to adult behavioral deficits. Neuron. 65, 480-489 (2010).
- Taniguchi, Y., Young-Pearse, T., Sawa, A., Kamiya, A. In utero electroporation as a tool for genetic manipulation in vivo to study psychiatric disorders: from genes to circuits and behaviors. The Neuroscientist : a Review Journal Bringing Neurobiology, Neurology and Psychiatry 18. , 169-179 (2012).
- Bai, J., et al. RNAi reveals doublecortin is required for radial migration in rat neocortex. Nat Neurosci. 6, 1277-1283 (2003).
- Osumi, N., Inoue, T. Gene transfer into cultured mammalian embryos by electroporation. Methods. 24, 35-42 (2001).
- Momose, T., et al. Efficient targeting of gene expression in chick embryos by microelectroporation. Development, Growth & Differentiation. 41, 335-344 (1999).
- LoTurco, J., Manent, J. B., Sidiqi, F. New and improved tools for in utero electroporation studies of developing cerebral cortex. Cereb Cortex. 19, 120-125 (2009).
- Featherstone, R. E., Kapur, S., Fletcher, P. J. The amphetamine-induced sensitized state as a model of schizophrenia. Progress in Neuro-psychopharmacology & Biological Psychiatry. 31, 1556-1571 (2007).
- Pum, M., Carey, R. J., Huston, J. P., Muller, C. P. Dissociating effects of cocaine and d-amphetamine on dopamine and serotonin in the perirhinal, entorhinal, and prefrontal cortex of freely moving rats. Psychopharmacology. 193, 375-390 (2007).
- dal Maschio, M., et al. High-performance and site-directed in utero electroporation by a triple-electrode probe. Nature Communications. 3, 960 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados