Method Article
Introdução à membrana apoiada sólida baseada Eletrofisiologia
Neste Artigo
Resumo
Aqui apresentamos um método eletrofisiológico com base em membranas suportados sólidos com foco em suas aplicações para a caracterização de transportadores de membrana electrogénico.
Resumo
O método electrofisiológico apresentamos baseia-se numa membrana de suporte sólido (MES), composto por uma camada octadecanethiol quimicamente em um chip sensor revestido de ouro e uma monocamada de fosfatidilcolina em cima. Este conjunto está montado num sistema cuvete contendo o eléctrodo de referência, um fio de prata clorada.
Após a adsorção de fragmentos de membrana ou proteolipossomos contendo a proteína de membrana de interesse, uma troca rápida solução é utilizada para induzir a actividade de transporte da proteína de membrana. Nos únicos dois soluções protocolo de troca de soluções, um não-ativação e uma solução de ativação, são necessários. O fluxo é controlada por meio de ar pressurizado e um sistema de válvulas e tubos dentro de uma gaiola de Faraday.
A cinética da actividade de transporte eletrogênica é obtido por meio de acoplamento capacitivo entre o MES e os proteolipossomas ou fragmentos de membrana. O método, por conseguinte, produz apenas transient correntes. A corrente de pico representa a actividade de transporte parado. O tempo de correntes transportadoras dependentes pode ser reconstruído pela análise do circuito.
Este método é especialmente adequado para os transportadores procarióticas ou eucarióticas transportadores de membranas intracelulares, que não podem ser investigados por sujeição do emplastro, ou os métodos de fixação de tensão.
Introdução
Aqui demonstramos uma nova abordagem eletrofisiológica baseado em uma membrana em suporte sólido (SSM) para a caracterização de proteínas de membrana electrogénico.
O suporte sólido é constituído por uma fina camada de ouro sobre uma lâmina de vidro, o chip sensor. A superfície de ouro hidrófilo é utilizado para ligar o grupo tiol de um reagente alcanethiol. Depois, de um selfassembly monolyer fosfatidilcolina completa a formação do MES.
Para medir reacções eletrogênica de proteínas da membrana, proteolipossomas ou fragmentos de membrana são adsorvidos ao MES (Figura 1). A proteína de membrana e contendo o MES então formar um sistema de membrana acoplado capacitivamente. Portanto, a taxa de translocação na membrana que contém a proteína pode ser detectada por meio do acoplamento capacitivo SSM. Este método produz apenas correntes transitórias. A corrente de pico representa a actividade de transporte parado. O tempo depende do transportador currents pode ser reconstruído pela análise do circuito.
O chip do sensor é montado em um sistema cuvete (Figura 2). A cuvete tem um volume de cuvete cilíndrica de 17 ul (volume de líquido com o-ring montado). Um pino de mola de contato cria o contato para o amplificador. Um conector de saída é aparafusada à parte superior da parte principal e carrega o eléctrodo de referência, um fio de prata clorada.
A cuvete é montado em uma gaiola de Faraday. Ele é ligado a uma passagem de fluido, que é utilizado para induzir a actividade de transporte da proteína da membrana em resposta a uma solução de troca rápida (Figura 3). Nos únicos dois soluções protocolo de troca de soluções, um não-ativação e uma solução de ativação, são necessários. O fluxo é controlado por ar pressurizado através de um software de controle de válvula de um computador ou de interruptores manuais sobre uma caixa de interface.
Protocolo
1. Criação de um aparelho para Eletrofisiologia baseado SSM
Os pormenores são apresentados em duas das nossas publicações técnicas, que também contêm desenhos e fotografias dos nossos cuvetes esquemáticos e configurar 1, 2. Configurações de taxas de soluções diferentes e protocolos de fluxo também são discutidos em nosso trabalho o método 2.
A seguir, adicione algumas melhorias recentes e detalhes técnicos que são de relevância direta para a apresentação de vídeo.
Válvula de controle e aquisição de dados
A caixa de interface contém um / interface comercial digital USB saída analógica de entrada (NI USB 6009 da National Instruments) e os controladores de válvulas. Ele controla o fluxo da solução e é responsável pela aquisição de dados. As válvulas são normalmente conduzidos com 12 V. No entanto, para uma rápida troca das válvulas pode ser conduzido com uma tensão de até 18 V. No vídeo, usamos uma fonte de alimentação de 12 V.
O driver da placa de circuito da válvula pode operar quatro válvulas. Foi fabricado pela oficina do Instituto Max Planck de Biofísica. As válvulas podem ser controlados por computador ou manualmente através de interruptores no painel frontal. O último é conveniente para os procedimentos de limpeza--e rubor. Durante a medição, a caixa de interface é controlado por computador usando uma válvula de controle e software de aquisição de dados (2 surfe R software, IonGate Biosciences).
2. Preparativos
Nesta seção, são mencionados os diferentes protocolos para a preparação de um experimento de eletrofisiologia baseado SSM.
2.1 Fazendo a solução de lípido para a formação do SSM
- Misturar 25 ul octadecilamina (5 mg / ml em clorofórmio) e 375 Diphytanoylphosphatidylcholine ul (20 mg / ml em clorofórmio) num frasco Glas.
- Usando um evaporador rotativo e o fluxo de gás de azoto contínua, evapora-se o clorofórmio paracerca de 30 min.
- Remover o lípido a partir das paredes do tubo de vidro, com agitação, 500 mL de n-decano. A concentração final de lípido de 15 mg / ml, com 1:60 (w / w) octadecilamina.
- Transferir a solução para o frasco de armazenamento de vidro. Armazene a solução de lípido, a -20 ° C.
2.2 Cloração do eletrodo de referência
Os eléctrodos de referência tem que ser clorada em intervalos regulares, devido à abrasão.
- Remover o resto da camada silverchloride idade, utilizando uma lixa fina antes do processo de cloração.
- Coloque o fio de prata juntamente com um eléctrodo de platina em uma solução de ácido clorídrico a 1 e clorar durante 15 min a 0,5 mA. Depois de completar a cloração, o fio de prata muda sua cor para um cinza escuro homogênea.
2.3 Preparação da Ponte de gel de poliacrilamida
- Prepara-se uma solução contendo 100 mM de KPi, pH = 7, KCl a 100 mM e 6% Acrylamid.
- Adicionar 0,3% de APS (10%) e por 0,6% TEMED e logo misturar a solução com uma pipeta.
- Imediatamente após a mistura a solução, utilizar uma pipeta de injectar 30 jil da mistura para dentro do recipiente vazio em gel de ponte. É importante para evitar as bolhas de ar durante a injecção.
- Durante um tempo de incubação de 20 min o gel polimerize.
- Após a polimerização da ponte gel é armazenado em solução (100 mM de KPi pH 7, 100 mM de KCl). Para prolongar a vida útil da ponte de gel, a solução é armazenada a 4 ° C.
2.4 Preparação das soluções de medição
Devido à forte interação dos solutos com o SSM, artefatos elétricos são gerados quando as soluções de composição diferente são trocados. Portanto, a preparação das soluções é um passo crítico. Tome as seguintes precauções durante o processo de preparação da solução para minimizar taxas de artefatos de solução.
- Adicione não activação e a activação de um lote de soluções, ajustar o pH e força iónica.
- Fundo de alta sal ajuda a reduzir taxas de artefatos de solução.
- Dividir a solução em lotes em dois volumes.
- Adicionar o composto activador para a solução de activação. Utilização de um composto na solução de compensação não-activador para manter a osmolaridade e a força iónica de ambas as soluções tão semelhantes quanto possível.
- Se as soluções são armazenadas a 4 ° C, certifique-se que todas as soluções atinja a temperatura ambiente antes de iniciar uma medição, porque mesmo pequenas diferenças de temperatura pode produzir artefatos.
3. A Experiência Eletrofisiologia baseado SSM
Aqui apresentamos um protocolo típico de um experimento eletrofisiológico baseado SSM.
3.1 Preparando o Setup SSM
Enquanto a configuração SSM não está em uso, os tubos estão cheios com um 30% de etanolSolução / água para evitar o crescimento bacteriano.
- Lavar o sistema com água pura para remover o etanol a partir do tubo, antes da montagem da cuvete. Substituir os recipientes de etanol com recipientes de água. Utilização de alta pressão (0,6 a 1,0 bar) limpar o sistema com 20-30 ml de água.
- Repetir o processo de limpeza utilizando um tampão KPi 100 mM a pH 7,6 ou uma solução não-activação.
- Certifique-se de que não existem bolhas de ar permanecem no sistema fluido.
3.2 Montagem da cuba
- Anexar um o-ring para o eletrodo de referência
- Atravesse a ponte gel da solução de armazenamento e conecte o eletrodo de referência.
- Prefill o conector de saída com um tampão de não-ativação, insira um o-ring e ligar a ponte gel para completar a montagem do eletrodo de referência. Tome especial cuidado para que não há bolhas de ar na junção da ponte de gel e da solução via de fluxo de saída.
- Preassemble a parte principal do cuvette adicionando o pino de contacto de mola (ligação ao amplificador), o tubo de entrada (ligação à válvula do terminal), o anel de vedação (selagem para o SSM) e os parafusos.
- Usando uma pinça, tomar o chip sensor para fora da solução de armazenamento (10 mM octadecanethiol em etanol).
- Com uma pipeta, lave a solução restante com aprox. 5 ml de etanol puro.
- Seca-se o eléctrodo sob azoto gasoso.
- Colocar o chip sensor com precisão sobre a parte de base da tina de modo a que o orifício de entrada da parte principal da cuvete é dirigida para a área activa do sensor circular.
- Adicionar 1 ml de solução de lípido para a área activa do sensor chip. Certifique-se de que a camada de ouro é totalmente coberto pelo lipídico.
- Imediatamente após a adição da solução lipídica, fechar a cuba, acrescentando a parte principal pré-montada.
- Antes de montar o cadinho na gaiola Faraday, certifique-se que todas as superfícies estejam completamente secas.
- Connect o amplificador para o pino de mola de contacto e o tubo de entrada para o terminal de válvulas. Em seguida, fixar a cuba com os parafusos dentro da gaiola de Faraday.
- Parafuso do conector de saída para a parte superior da tina. Finalmente ligar o tubo de saída para o conector de saída e o gerador de tensão para o eléctrodo de referência.
- Imediatamente após a montagem da cuba lavar o sistema com tampão em 0,6 bar. Isto leva à formação de AGE espontânea.
3.3 parâmetros de membrana de medição
Para verificar a qualidade do SSM, capacitância e condutância são medidos utilizando o gerador de função.
- Usando o gerador de funções, aplicar tensão de 100 mV DC para medir a condutância.
- Calcule a condutância: A decadência atual mostra o carregamento do capacitor membrana. Depois que o capacitor está totalmente carregado os rendimentos atuais de medição da condutância da membrana usando a lei de Ohm. Por razões de simplicidade, utilizar a current 1 segundo após a voltagem é aplicada para calcular a condutância G = I / U.
- Aplique uma tensão alternada triangular de 50 mV pico a pico de amplitude e uma freqüência de 0,5 Hz para medir a capacitância.
- Calcular a capacitância: A amplitude da corrente de onda quadrada resultante representa as correntes de carga do capacitor. A capacidade C é igual à carga transferida Q = IΔt dividido por? U = 100 mV. (? U é o dobro da tensão aplicada de 50 mV, porque é a diferença actual inclinação positiva de menos negativo da tensão triangular.)
- Monitorar os parâmetros elétricos da membrana repetidamente a cada 10 min aprox. 30 a 40 min, até que sejam atingidos valores constantes. Lave com tampão entre KPi a alta pressão na gama de cerca de 0,6 a 1 bar.
- Estimar a qualidade do SSM: parâmetros óptimos estão na gama de 0,1 a 0,2 ns e 2 a 3,5 nF. A alta condutância acima de 0,8 nS capacitância e baixa abaixo de 1 nF indicaque o MES não estiver correctamente formada. A alta capacidade acima de 4 nF pode implicar que a zona ativa não está completamente coberto pela SSM.
- Se os parâmetros não estão no intervalo óptimo, a membrana deve ser descartado e outro SSM preparado, utilizando um chip de eléctrodo recentemente preparada.
3.4 Verificação de taxas de artefatos de solução
Depois que os parâmetros de membrana foram verificados, os buffers de medição devem ser testados para taxas de artefatos de solução.
- Inserir os respectivos recipientes de solução para o sistema de fluidos.
- Retirar as bolhas de ar do sistema de fluido, utilizando-se as válvulas manuais.
- Usando o software de aquisição de dados escolheu o protocolo de fluxo que deseja usar em sua experiência.
- Regule a pressão a 0,6 bar e iniciar a medição.
- Além dos artefatos de comutação de válvulas mecânicas, o ideal é não correntes artefato deve ser medido ou eles devem ser muito smaller do que os sinais de transporte de proteína esperadas. Se as taxas de artefatos de solução são observadas, tentar otimizar as composições de buffer e / ou o procedimento de preparação, antes de continuar o experimento.
3.5 Adição da amostra proteica
Normalmente proteolipossomos ou fragmentos de membrana são armazenadas congeladas a -80 ° C. Para obter uma medição é necessária uma aliquota de cerca de 30 ul.
- Lavar o SSM com solução não-ativação.
- Descongelar a amostra de proteína em gelo.
- Três ciclos de sonicação de 10 seg são alternados com intervalos de arrefecimento de 10 seg em gelo. Proteolipossomos são sonicadas usando um sonicador de banho. Para fragmentos de membrana num sonicador ponta (50 W, 30 kHz, 1 mm de diâmetro sonotrodo, intensidade de 20%, ciclo de 0,5) é utilizado. Após a última etapa de sonicação não colocar a amostra de volta no gelo, mas injetá-lo imediatamente para a tina.
- Desparafuse a tomada de conector junto com o eletrodo de referência assembly.
- Usando uma pipeta, aspirar 30 ul da amostra de proteína e montar a ponta da pipeta para o furo de saída.
- Abrir a válvula manual na via não-activador para o contentor de lixo e os proteolipossomas injectar para dentro do volume da cuvete. Tenha cuidado para não injetar ar no volume de cuba com o sensor.
- Antes de retirar a ponta da pipeta, fechar a válvula manual para evitar mais fluxo de solução.
- Permitir que os proteolipossomas para adsorver o SSM para um tempo de incubação de 1 a 2 horas. É também possível a incubar durante a noite.
3.6 Procedimento geral de uma experiência baseada SSM
- Aquecer os buffers de medição de tempo, se forem armazenados a 4 ° C. Todos os tampões de medição têm de estar à temperatura ambiente antes de iniciar a medição para evitar artefactos.
- Ao mudar soluções, primeiro limpe os tubos no interior dos recipientes de soluções com um tecido não de difusão, em seguida, inserir as novas garrafas.
- Antes de iniciar a medição, utilizar as válvulas manuais para remover as bolhas de ar, o que poderia ter evoluído a partir do processo de transformação.
- Ajuste a pressão antes de iniciar uma medição. Rotineiramente usar uma pressão de 0,6 bar, que a página da válvula e o tubo específico configuração produz uma taxa de fluxo de aproximadamente 1,0 ml / seg.
- As primeiras medições pode ser realizado em linha reta um após o outro e deve ser rejeitado até que o pico de corrente continua constante. Se as soluções de pH diferem em um tempo de incubação de pelo menos 3 minutos é necessário para ajustar o pH interno dos proteolipossomas antes do início da medição.
- Agora, o set up está pronto para a medição. Para reduzir o ruído de pelo menos três medições devem ser feitas e uma média.
3.7 Medidas de controle
Um resumo de um sinal durante uma série de medições pode ocorrer devido à degradação da proteína ou de uma perda de adsorção. Cada experimento SSM deve include um controle resumo. Isto é feito através de medições repetidas, com soluções idênticas. O controlo degradado mínimo significa uma medida no início e outro no final da experiência, utilizando a mesma solução.
Recomendamos fazer o controle resumo sob condições em que se espera a maior amplitude de pico no experimento. Isto faz com que seja mais fácil de quantificar a degradação do sinal.
O resumo do sinal pode ser quantificada por comparação das amplitudes de pico dos dois controles aperto. O valor percentual resultante pode ser utilizada para corrigir os sinais medidos, assumindo uma dependência do tempo linear degradado.
3.8 controles Artefato
Se possível, tente validar seus resultados através da inibição da proteína de interesse após o experimento. Sinais restantes são provavelmente taxas de artefatos de solução. Os sinais então tem que ser corrigido para os artefatos medidos.
3,9 Após a experiência
- Lavar o sistema com 20-30 ml de água pura e 20-30 ml de 30% de etanol / água. A solução etanólica evita o crescimento bacteriano, quando o sistema não está em uso.
- Após este procedimento de limpeza, liberar a pressão do sistema e desligar todos os instrumentos.
- Remover a cuvete da gaiola de Faraday e desmontá-lo. Todas as partes da cuvete pode ser limpo com água e etanol puro, se necessário, usando um sonicador de banho.
- Colocar o sensor chip numa proveta glas com etanol puro. Sonicar a proveta de cerca de 1 a 2 minutos usando um sonicador de banho.
- Seca-se o chip do sensor sob azoto gasoso.
- Armazenar o chip sensor de distância da luz, em uma solução etanólica 10 mM de Octadecanthiol. Após um tempo de incubação de cerca de 30 min o chip sensor está pronto para reutilização.
Resultados
Até agora, electrofisiologia baseado MES foi utilizado para caracterizar mais do que 20 transportadores, principalmente de origem procariota, por exemplo, MELB 3, 4 e nhaa PutP 5 (resumido em 6). Mas também a partir de transportadores eucarióticas membranas intracelulares, por exemplo, ClC7 7, bem como canais de iões, por exemplo, o receptor de acetilcolina nicotínico 8 têm sido investigados.
Aqui apresentamos como exemplo as medidas do açúcar / H + cotransporter Lacy de Escherichia coli utilizando proteolipossomos com pelo menos 85% do lado direito para fora orientada Lacy em um LPR de 5 9, 10. Nós nos concentramos sobre as principais etapas que levam a um modelo cinético mínima desta proteína de transporte.
1. Caracterização eletrofisiológica de wildtype Lacy
O primeiro passo é uma caracterização geral da reacção eletrogênica medindo diferentes valores de pH ( > Figura 4), as concentrações de substratos (Figura 5) e os substratos. Para validar a técnica, K M e valores de pK dado na literatura foram reproduzidas.
A dependência do pH Lacy mostra dois diferentes reações electrogénico. A corrente aumenta capacitivamente acoplados entre pH 5 e pH 8,5, mas também muda a sua forma. Em condições alcalinas transporte estado estacionário é observada, enquanto que para pH ácido valoriza apenas uma reação rápida electrogénico permanece. Para distinguir os sinais de estado estacionário a partir das reacções rápidas eletrogênica que utilizaram a análise de circuito para reconstruir as correntes transportadoras (Figura 6).
A pH 7, o sinal bifásica torna-se monofásica. Isto também indica que existem dois tipos diferentes de reacções eletrogênica. Estimada a partir da carga transferida (integral dos sinais), as duas reacções têm cerca de 6% e 94% do total de electrogenicity o ciclo de transporte.
ove_step "> 2. Atribuição das reações electrogénicoPara atribuir as duas reações electrogénico para determinadas etapas do ciclo de reação de Lacy, a variante Lacy E325A foi medido (Figura 7). Esta variante só mostra a lactose troca, mas é deficiente para todos os modos de transporte activos, devido à inibição da libertação de protões. O sinal de E325A Lacy representa um transitório rápido e é constante para todos os valores de pH medidos. A forma e amplitude do sinal é semelhante ao sinal de tipo selvagem laçado sob condições ácidas. Além disso, observamos uma pequena fase negativa após o declínio da corrente de pico, que é característico para rápidas correntes transitórias medidos em sistemas capacitively acoplados. Porque lactose ligação e liberação não é electrogénico, o transitório rápido deve correlacionar com uma transição conformacional electrogénico seguindo lactose vinculativo.
Sabe-se que o passo de protões é a taxa de libertação limiting para o volume de negócios laçado no modo de transporte orientado lactose gradiente de concentração. Neste caso, espera-se um aumento da taxa de transporte com pH alcalino, pois a liberação de prótons é favorecido. Este é o caso para o transporte no estado estacionário sinal de wildtype Lacy correlacionados. Além disso, pôde ser demonstrado por medições de gradiente de pH que apenas o pH interno influencia o transporte de estado estacionário de Lacy (não publicado). Portanto, a grande reacção electrogénica poderá ser atribuída à etapa de libertação de protões.
3. Medidas para análise cinética
Após a identificação das reações electrogénico e fora as taxas de transporte foram determinadas usando um Setup SSM com uma alta resolução temporal de cerca de 4,5 ms. Isto só é possível sob condições, quando uma reacção domina o sinal. Neste caso, as constantes de velocidade podem ser derivados a partir das correntes transitórias em consideração a resolução de tempo dos sinais utilizando um processo iterativo de mínimos quadrados algoritmo de convolução (Figura 8). As constantes de velocidade determinadas, bem como o modelo cinético mínima proposta (Figura 9), finalmente, foram usadas para a simulação da cinética do transportador. As curvas de reproduzir os dados simulados SSM comprova que adicionalmente o modelo de cinética.

Figura 1. Adsorção de geometria proteolipossomos no SSM. SSM é formado num chip sensor, uma lâmina de vidro revestida de ouro estruturada. Para medir reacções eletrogênica de proteínas da membrana, proteolipossomas ou fragmentos de membrana são adsorvidos ao MES. As duas membranas formam um sistema acoplado capacitivamente. Isto é porque apenas correntes transitórias são detectados.
tp_upload/50230/50230fig2highres.jpg "/>
Figura 2. O SSM tina carrega o chip sensor eo eletrodo de referência. The chip sensor é colocado entre a base tina ea cabeça cuvete. O eléctrodo de referência é isolado a partir da via de fluxo através de uma ponte de sal em gel de poliacrilamida.
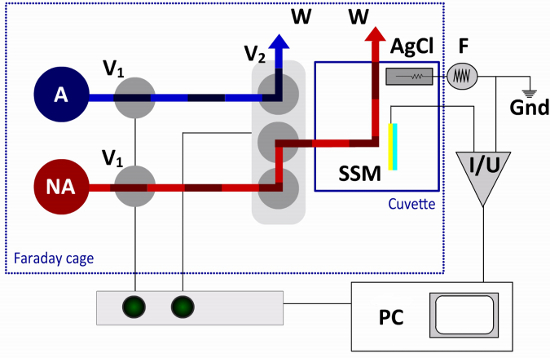
Figura 3. Passagem de fluido e circuito eléctrico da instalação SSM. No protocolo única troca de solução é necessário não apenas um activador (NA) e de um activador (A) solução. O fluxo é controlado por duas válvulas de duas vias (V1) e uma válvula terminal de (V2). Os interruptores de válvulas terminais entre as soluções não-activadores e de activação, dirigindo uma das soluções para a cuvete e a outra solução para um recipiente de resíduos (W). O chip do sensor (MES) é ligado ao amplificador (I / L), enquanto que o eléctrodo de referência (AgCl) está ligado ao gerador de função (F), no circuito eléctrico externo. Um computador (PC) e uma caixa de interface são utilizados para o funcionamento da válvula e aquisição de dados.
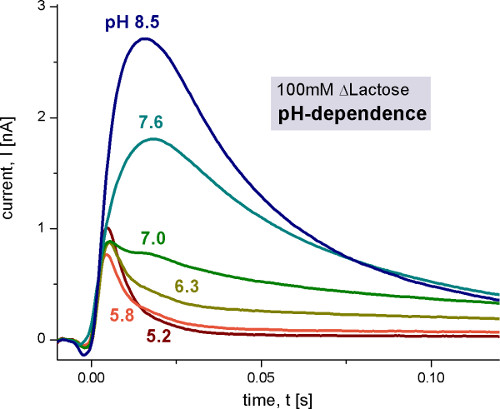
Figura 4. Correntes transitórias medidos com proteolipossomas laçado de tipo selvagem após 100 mM lactose saltos de concentração em diferentes valores de pH. A solução de activação não continha 100 mM de glucose, enquanto a solução de activação continha 100 mM de lactose. Todas as soluções foram preparadas em tampão de fosfato de potássio 100 mM com o pH indicado com 1 mM de DTT. Para mais informações sobre as condições de medição neste e nos seguintes números, consulte a 9 e 10.
ftp_upload/50230/50230fig5highres.jpg "/>
Figura 5. Médios correntes de pico normalizada medida com proteolipossomos Lacy do tipo selvagem após saltos concentração de lactose em diferentes concentrações e valores de pH. Os valores de K M são obtidos a partir dos ajustes hiperbólicos.
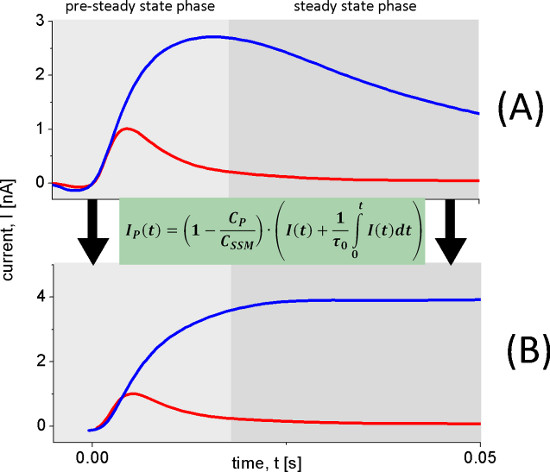
Figura 6. Reconstrução de correntes transportadoras. As correntes transitórias (A) usado para reconstruir as correntes transportadoras (B) foram medidos com proteolipossomos Lacy do tipo selvagem depois de 100 mm lactose saltos de concentração em pH 8.5 (traço azul) e pH 5,2 (traço vermelho). A pH 8,5 volume contínuo é observada a pH 5,2, enquanto ocorre uma reacção eletrogênica rápido. Isto é claramente observada na corrente reconstituídas (B).
files/ftp_upload/50230/50230fig7.jpg "alt =" Figura 7 "fo: content-width =" 4 polegadas "fo: src =" / files/ftp_upload/50230/50230fig7highres.jpg "/>
Figura 7. Corrente transitória medida com E325A proteolipossomos Lacy depois de um salto de 100 mM lactose concentração em pH 5.2. Esta variante Lacy é inibida na etapa de liberação de prótons do ciclo de transporte e, portanto, o transporte deficiente. O pequeno componente negativa observada é característica para rápidas correntes transitórias medidos em sistemas acoplados capacitivamente e é provocada pela descarga da capacitância da membrana depois de um reacção eletrogênica rápido. O tempo π0 constante é determinada pelas capacitâncias e condutância do sistema (Figura 1).
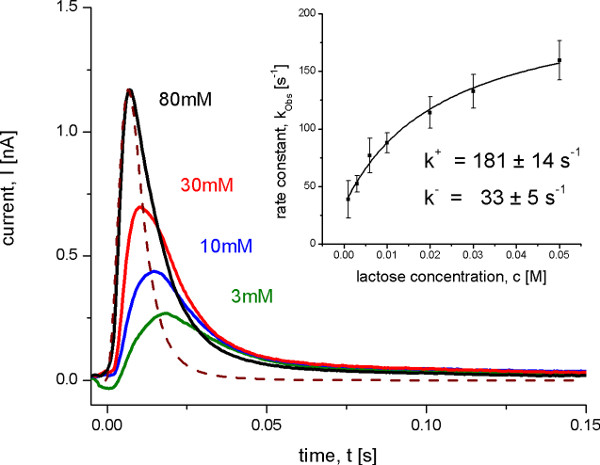
Figura 8. Correntes transitórias medidos com proteolipossomos Lacy do tipo selvagem after diferentes lactose saltos de concentração em pH 5.2. Sob essas condições não de transporte de estado estacionário é observada, mas uma transição conformacional electrogénico sobre lactose vinculativo. A linha tracejada mostra a função de transferência que representa o tempo de resolução do sistema. A inserção mostra a determinação do ligar e desligar constantes de velocidade a partir da taxa constante Kobs observadas com um ajuste hiperbólico aos dados. A constante de velocidade observada foi determinada a partir das correntes transientes com um algoritmo de desconvolução pelo método dos mínimos quadrados 10.
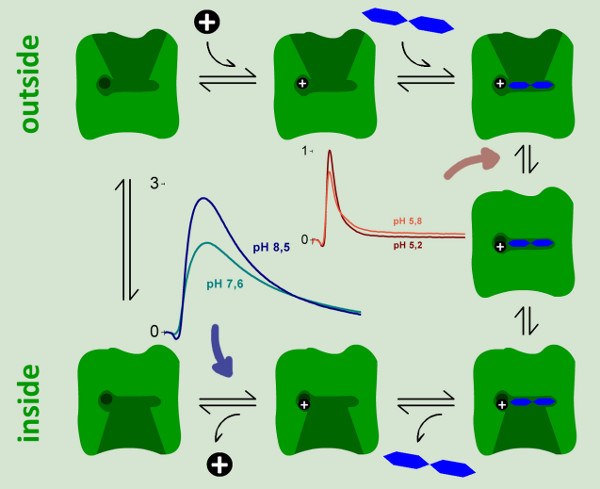
Figura 9. Um modelo cinético para o ciclo de reacção de Lacy. Dois passos eletrogênica puderam ser identificados e caracterizados por meio de medições de SSM. Uma reacção fortemente eletrogênica representando ~ 94% do deslocamento total de carga na reacçãociclo é observado apenas em valores de pH neutro e básico. Pode ser atribuída à etapa de libertação de protões (seta azul). Um passo fracamente eletrogênica é observada a pH ácido, quando da rotação contínua do tipo selvagem laçado é inibida. Atribuímos esta reacção a uma transição conformacional eletrogênica sobre a lactose de ligação, o que representa 6% do deslocamento total de carga no ciclo de reacção.
Discussão
1. Vantagens de electrofisiologia SSM baseado em comparação com os métodos convencionais
Eletrofisiologia baseado SSM provou-se como uma valiosa ferramenta da caixa de ferramentas eletrofisiológico. É especialmente útil em casos onde convenção electrofisiologia, nomeadamente patch clamp e métodos de fixação de tensão, não podem ser aplicadas: Para além de algumas excepções raras transportadores bacterianos não pode ser investigada através de fixador de tensão ou métodos de patch clamp devido à pequena dimensão das bactérias e porque eles são difíceis de expressar em células de mamífero ou oócitos. Mas também transportadores fisiologicamente relevantes de mamífero podem ser investigadas. Neste caso eletrofisiologia baseado SSM é atraente para os transportadores de membranas intracelulares e para aplicações de seleção na descoberta da droga por causa de sua robustez e seu potencial para automação.
SSM-basedUsing eletrofisiologia, o tempo caracterização resolvido convencional de transporters é um desafio. Uma vez que o volume de negócios de transportadores é baixo um "gigante remendo" ou a configuração de um 'todo célula é necessária, que tem uma resolução de tempo inerentemente baixo em um experimento de troca de solução. A complicação pode ser superado usando liberação substrato fotolítica. No entanto, apenas um número limitado de substratos são apropriados para esta abordagem. Aqui, a troca rápida solução no SSM oferece a oportunidade única de realizar estudos eletrofisiológicos com uma resolução temporal alta, usando substratos arbitrárias.
2. Limitações e as etapas críticas
Em contraste com as técnicas de fixação de membranas e fixador de tensão, electrofisiologia baseado SSM não pode ser usado para aplicar um potencial. Caracterização transportador é, portanto, limitado aos modos de transporte que não se baseiam em um potencial de membrana.
Em geral, com base em electrofisiologia SSM não tem nenhuma limitação em relação ao tipo do transportador (electrogénica). Mas cl tensãoampères ou patch métodos de fixação pode ter vantagens, se os componentes intracelulares, como proteínas de ligação são necessários para a funcionalidade da proteína.
Limitações podem surgir, se troca solução cria grandes correntes artefato. Isto acontece quando o substrato interage fortemente com o SSM, como no caso de compostos lipofílicos. Controlos artefacto podem ser utilizadas para corrigir os sinais medidos. Além disso fundo elevado teor de sal em todas as soluções tampão de medição pode ser utilizado para reduzir os artefactos. Mas em casos, onde o tamanho do artefacto é comparável ao sinal de proteína, que é quase impossível isolar o sinal relacionado com proteína a partir do artefacto. Felizmente, os altos artefatos são incomuns em uma troca solução otimizada.
Existem algumas etapas que são fundamentais para a realização bem sucedida de um experimento de eletrofisiologia baseado SSM. A preparação da amostra de proteína é a parte mais importante. Se forem utilizados proteolipossomos, verifique se os reconstuição processo produz uma amostra reprodutível limpo de um LPR suficiente e que o transportador é orientado de maneira correta. A LPR pode ser verificado por congelamento fratura microscopia eletrônica e orientação por um experimento ELISA se os anticorpos estão disponíveis.
Utilize apenas um SSM que mostra os parâmetros ideais para incubação da amostra de proteína. A injecção da proteína é um passo crítico. A sonicação é essencial e as bolhas de ar deve ser evitada durante a injecção. Após incubação, as amostras são medidas em si crítica, porque as bolhas de ar irá remover a amostra de proteína adsorvida a partir do chip do sensor. Portanto, sempre remover as bolhas de ar depois de mudar soluções. No entanto, um sinal de degradação pode ocorrer. Para corrigir uma eventual degradação do sinal, que é essencial para realizar os controlos degradados durante a experiência.
3. Sistemas especializados
O SSM-Setup pode ser modificado de acordo com sua aplicação. Além disso taqui são completamente diferentes, configurações altamente especializados disponíveis.
Existe a possibilidade de medir os sinais de proteínas sob condições assimétricas, por exemplo, sob um gradiente de pH. Para estabelecer composições assimétricas tampão dentro e fora das proteolipossomos uma terceira solução, a solução de descanso, tem de ser introduzida e isso requer uma configuração de troca de casal. Aqui é necessário um adicional de válvula de três vias alternar entre as soluções não-ativação e de descanso.
Para aumentar a resolução de tempo do sistema foi desenvolvida uma via de fluxo alternativo sem a válvula terminal, mas usando um diferente tipo de cuvete. Aqui, a junção de activação e uma solução não-activação está localizado no interior da cuvete, com 3 mm em frente do MES. Esta configuração é adequada para a análise cinética dos processos de transporte rápido. Pode ser demonstrado que uma resolução de tempo tão baixo como 2 ms é possível.
F comercialully sistemas automáticos estão disponíveis visando um rendimento significativamente maior para a triagem de drogas. A unidade móvel reúne soluções e injecta-los sobre a superfície do sensor em placas de 96 poços num formato de placa de microtitulação padrão.
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Agradecemos J. Garcia-Celma, eu Smirnova e R. Kaback para as contribuições para as medições Lacy e E. Bamberg de apoio e discussões úteis.
Materiais
| Name | Company | Catalog Number | Comments |
| Materials | |||
| Waterbath Sonicator | Bandelin | RK 52 H | |
| Tip Sonicator | Hielscher Ultrasonics GmbH | UP50H | |
| 2-way valve | NResearch, West Caldwell, USA | NR225T011 | |
| Terminal valve | NResearch, West Caldwell, USA | NR225T031 | |
| Manometer | Greisinger electronics | GDH 14 AN | |
| Faraday cage | Max Planck Institute of Biophysics | ||
| Cuvette | Max Planck Institute of Biophysics | ||
| 100 ml solution containers | Kartell | 1623 | |
| O-rings | Seal Science Inc. | ||
| Oscilloscope | Tektronix | TDS 1002 | |
| Reference electrode | Max Planck Institute of Biophysics | ||
| Function generator | Max Planck Institute of Biophysics | ||
| Tubings | SAINT-GOBAIN Performance Plastics | AAC00006 | |
| Sensor chip | Fraunhofer Institut für Schicht und Oberflächentechnik | ||
| Interface box | Max Planck Institute of Biophysics | ||
| Amplifier | Keithley | 427 | |
| Manual cog | Vygon GmbH | 876 | |
| USB analog-to-digital converter | National Instruments | 6009 | |
| Regeants | |||
| 1,2‑Diphytanoyl-sn-glycero-3-Phosphatidylcholine | Avanti Polar Lipids, Inc. | 850356 | |
| Acrylamide/Bis-acrylamide | Sigma Aldrich | A3574 | |
| Ammonium persulfate | Sigma Aldrich | A3678 | |
| D-(+)-Glucose | Sigma Aldrich | G8270 | |
| Dithiothreitol | Sigma Aldrich | 43819 | |
| Ethanol absolut | VWR AnalaR NORMAPUR | 603-002-00-5 | |
| Natural E. coli lipids polar extract | Avanti Polar Lipids, Inc. | 100600 | for LacY reconstitution |
| n-Decane | Sigma Aldrich | D901 | |
| Octadecanethiol | Sigma Aldrich | O1858 | |
| Octadecylamine | Sigma Aldrich | 74750 | |
| Potassium chloride | Merck | 1049360500 | |
| Potassium phosphate dibasic | Sigma Aldrich | P3786 | |
| Potassium phosphate monobasic | Sigma Aldrich | P9791 | |
| Tetramethylethylenediamine | BIO RAD | 1610801 | |
| α-Lactose monohydrate | Sigma Aldrich | L8783 | |
Referências
- Seifert, K., Fendler, K., Bamberg, E. Charge transport by ion translocating membrane proteins on solid supported membranes. Biophys. J. 64, 384-391 (1993).
- Schulz, P., Garcia-Celma, J. J., Fendler, K. SSM-based electrophysiology. Methods. 46, 97-103 (2008).
- Garcia-Celma, J. J., et al. Rapid activation of the melibiose permease MelB immobilized on a solid-supported membrane. Langmuir. 24, 8119-8126 (2008).
- Mager, T., Rimon, A., Padan, E., Fendler, K. Transport mechanism and pH regulation of the Na+/H+ antiporter NhaA from Escherichia coli: an electrophysiological study. J. Biol. Chem. 286, 23570-23581 (2011).
- Zhou, A., et al. Charge translocation during cosubstrate binding in the Na+/proline transporter of E.coli. J. Mol. Biol. 343, 931-942 (2004).
- Ganea, C., Fendler, K. Bacterial transporters: charge translocation and mechanism. Biochim. Biophys. Acta. 1787, 706-713 (2009).
- Schulz, P., Werner, J., Stauber, T., Henriksen, K., Fendler, K. The G215R mutation in the Cl-/H+-antiporter ClC-7 found in ADO II osteopetrosis does not abolish function but causes a severe trafficking defect. PLoS ONE. 5, e12585(2010).
- Schulz, P., Dueck, B., Mourot, A., Hatahet, L., Fendler, K. Measuring ion channels on solid supported membranes. Biophys. J. 97, 388-396 (2009).
- Garcia-Celma, J. J., Smirnova, I. N., Kaback, H. R., Fendler, K. Electrophysiological characterization of LacY. Proc. Natl. Acad. Sci. U.S.A. 106, 7373-7378 (2009).
- Garcia-Celma, J. J., Ploch, J., Smirnova, I., Kaback, H. R., Fendler, K. Delineating electrogenic reactions during lactose/H+ symport. Biochemistry. 49, 6115-6121 (2010).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados