É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Protocolo Relativo Avaliação hidrodinâmica de Tri-folheto polímero Válvulas
Neste Artigo
Resumo
Tem havido um interesse renovado no desenvolvimento de válvulas de polímeros. Aqui, os objetivos são demonstrar a viabilidade de modificação de um duplicador de pulso comercial para acomodar geometrias tri-folheto e definir um protocolo para apresentar polímero dados hidrodinâmicos de válvulas em relação aos dados de válvulas nativas e protéticas, recolhidos em condições quase idênticas.
Resumo
Limitações de válvulas atualmente disponíveis protéticos, xenotransplantes e homoenxertos levaram um ressurgimento recente da evolução da área de tri-folheto próteses valvares polímero. No entanto, a identificação de um protocolo para a avaliação inicial da funcionalidade da válvula hidrodinâmica polímero é importante, durante as fases iniciais do processo de concepção. Características em sistemas in vitro duplicador de pulsos não são configurados para acomodar materiais tri folheto flexíveis e, além disso, a avaliação da funcionalidade da válvula de polímero tem de ser feito num contexto em relação a válvulas cardíacas e próteses nativos sob condições de teste idênticas, para que a variabilidade nas medições de diferentes instrumentos podem ser evitados. Deste modo, foi realizada a avaliação da hidrodinâmica i) nativa (n = 4, o diâmetro médio, D = 20 mm), ii) bi-folheto mecânica (n = 2, D = 23 mm) e iii) polímero de válvulas (n = 5, D = 22 mm) através da utilização de um sistema de duplicação de impulso disponível comercialmente (ViVitro LabsInc, Victoria, BC) que foi modificado para acomodar geometrias de válvula tri folheto. Válvulas de silicone Tri-folheto desenvolvidos na Universidade da Flórida, constituíram o grupo válvula de polímero. Uma mistura na proporção de 35:65 de glicerina para a água foi utilizada para imitar as propriedades físicas do sangue. Caudal instantâneo foi medido na interface do ventrículo esquerdo, e as unidades da aorta, enquanto a pressão foi registada nas posições ventriculares e da aorta. Foi utilizado Bi-folheto e dados de válvulas nativas da literatura para validar o fluxo e leituras de pressão. As seguintes métricas hidrodinâmicas foram relatados: frente a queda de pressão do fluxo, da raiz da aorta taxa média de praça em frente do fluxo, o fechamento da aorta, o vazamento eo volume regurgitante, fechamento transaórtica, vazamento, e as perdas totais de energia. Os resultados representativos indicam que as métricas hidrodinâmicos dos três grupos de válvulas pode ser obtido com sucesso pela incorporação de um conjunto de custom-built em um sistema duplicador de pulsos disponíveis comercialmente e subsequently, em comparação objetiva fornecer insights sobre aspectos funcionais do projeto da válvula de polímero.
Introdução
Doença valvular cardíaca muitas vezes resulta de calcificação valvar degenerativa 1, febre reumática 2, endocardite 3,4 ou defeitos congênitos. Quando a lesão de válvula, provocando estenose e / ou prolapso da válvula de refluxo e não pode ser reparado cirurgicamente, a válvula nativa é geralmente substituído por uma válvula protética. Atualmente opções disponíveis incluem válvulas mecânicas (válvulas gaiola de esfera, válvulas de disco basculante, etc.), Homoenxerto e válvulas bioprostéticas (suínos e bovinos válvulas). As válvulas mecânicas são frequentemente recomendadas para pacientes mais jovens com base na sua durabilidade, mas o paciente é obrigado a permanecer em terapia anticoagulante, para a prevenção de complicações trombóticas 5. Próteses valvares homoenxerto e biológicos têm sido escolhas eficazes para evitar a terapia de sangue mais fino, no entanto, estas válvulas têm risco elevado de fibrose, calcificação, degeneração e complicações imunogênicas levando à insuficiência da válvula 6. Válvulas da engenharia de tecidos estão sendo investigados como uma tecnologia emergente 7-9, mas ainda há muito a ser descoberto. Válvulas alternativos duráveis, biocompatíveis, protéticos são necessários para melhorar a qualidade de vida dos pacientes com doença da válvula cardíaca. Mais uma vez, este projeto válvula poderia substituir a prótese biológica utilizados em tecnologia de válvula transcateter, com abordagens transcateter mostrando o potencial de transformar o tratamento de pacientes selecionados com doença valvular cardíaca 10.
Como dito pelos padrões atuais, um substituto de válvula cardíaca bem sucedida deve ter as seguintes características de desempenho: "1) permite avançar com fluxo aceitável diferença pequena queda média pressão, 2) impede o fluxo retrógrado com aceitavelmente pequena regurgitação, 3) resiste a embolização; 4) resiste hemólise; 5) resiste à formação de trombos, 6) é biocompatível, 7) é compatível com as técnicas de diagnóstico in vivo e 8) e pode ser entregue no alvo implantávelpopulação; 9) permanece fixo, uma vez colocado, 10) tem um nível de ruído aceitável; 11) tem a função reprodutível; 12) mantém a sua funcionalidade para uma vida razoável, de acordo com sua classe genérica; 13) mantém a sua funcionalidade e esterilidade para uma prateleira razoável vida antes da implantação. "11. Alguns dos defeitos de próteses de válvulas existentes podem, potencialmente, ser superada por uma válvula de polímero. polímeros biocompatíveis, têm sido considerados os melhores candidatos com base em bioestabilidade, anti-hidrólise, anti-oxidação, e propriedades mecânicas vantajosas, tais como alta resistência e viscoelasticidade. Em particular, os polímeros elastoméricos podem prever deformação do material semelhante a dinâmica da válvula nativas. Elastómeros pode ser adaptado para imitar as propriedades dos tecidos moles, e eles podem ser os únicos materiais artificiais disponíveis que são bio-tolerantes e que possa resistir ao acoplamento, in vivo, as tensões de fluido induzida por tensão e de flexão, no entanto, mover-se de maneira semelhante ao saudável,movimento da válvula nativa. Além disso, os elastómeros podem ser produzidos em massa numa variedade de tamanhos, armazenados com facilidade, são esperados para serem dispositivos de baixo custo e pode ser estruturalmente reforçada com reforço fibroso.
O conceito de utilização de materiais poliméricos para montar uma válvula de tri-folheto não é novo e tem sido objecto de várias investigações de investigação ao longo dos últimos 50 anos, 12, os quais foram abandonados, em grande parte devido à válvula de durabilidade limitada. Contudo, com o advento de novas metodologias de fabrico 13,14, o reforço de materiais poliméricos 15,16 e integração potencialmente sem costura de substitutos de válvulas de polímero com tecnologia de válvula transcateter, recentemente tem havido um interesse renovado e actividade no desenvolvimento de válvulas de polímero como um potencialmente alternativa viável para válvulas comerciais actualmente disponíveis. Neste contexto, um protocolo para permitir testes destas válvulas para avaliar a funcionalidade de hidrodinâmica é a primeira etapano processo de avaliação, ainda sistemas de simulador de pulso disponíveis comercialmente geralmente não estão equipados para acomodar os modelos de válvulas de tri-folheto e conter um espaçamento anelar para inserir válvulas cardíacas comercialmente disponíveis (por exemplo, disco de inclinação, as válvulas cardíacas mecânicas bi-folheto). Em segundo lugar, as válvulas de polímero são uma tecnologia emergente cujo hidrodinâmica só pode ser avaliada em um contexto familiar. Apesar da pressão da válvula do coração nativo e dados de fluxo está disponível, é importante para a realização de testes de válvulas nativas aórtica porcina, que são biologicamente compatíveis com válvulas humanos, utilizando o mesmo simulador pulsátil que é utilizado para avaliar as válvulas de polímero de modo a contabilizar diferenças de medição que podem estar dependentes do sistema. Assim, o objetivo deste estudo foi demonstrar como um simulador de pulso disponível comercialmente pode ser equipado com um conjunto de construções para acomodar válvulas tri-folheto e avaliar sistematicamente polímero válvula métricas hidrodinâmicas em um cont relativaext, em comparação com colegas mecânicos e nativo de válvula cardíaca suínos. No nosso caso, as válvulas de polímero de silicone tri-folheto novos anteriormente desenvolvido na Universidade da Flórida 13 formaram o grupo de válvula de polímero.
Protocolo
1. Preparação
- Projetar e fabricar uma montagem para acomodar uma geometria válvula tri-folheto. Isto, pelo menos, conter um suporte de válvula de sutura-nos folhetos da válvula e de um tubo para alojar o suporte da válvula e acessórios circundantes para fixar o conjunto para o sistema de duplicação de pulso. No nosso caso, utilizamos um sistema comercialmente disponível duplicador de pulso disponíveis a partir ViVitro Labs Inc. (Victoria, BC). Válvula de suporte de cartão, bem como configurações de pré e pós-montagem estão representadas na Figura 1.
- O ciclo inteiro terá de ser preparado antes do uso. Isto envolve dois passos: i) a limpeza do sistema de circuito completo utilizando uma solução de sabão e de água, incluindo a substituição de todos os tubos degradados antes de usar e ii) calibração dos instrumentos conectados ao circuito, ou seja, a bomba que está sendo utilizado, a sonda de fluxo, e os transdutores de pressão (geralmente medido em locais atrial, da aorta e do ventrículo). Calibração pode inicializaçãoei ra me ser realizada utilizando uma solução salina de 1% e deve ser repetido antes de sangue usando uma solução de glicerina-analógico.
2. Nativo da Válvula Aórtica Dissection
- Obter quatro corações de suínos frescas com a aorta intacta de um matadouro (Institutional Animal Care e do Comitê Use aprovação (IACUC) pode ser necessária) USDA aprovado. No nosso caso, o nosso protocolo de dissecação foi aprovado pelo IACUC na Universidade Internacional da Flórida (Protocolo Número de Aprovação: 11-020). Lavar o coração com água desionizada e colocá-las num recipiente cheio com o fosfato antimicótica / antibiótica e esterilizada de 1% e solução tamponada de transporte salino (PBS) em gelo para o laboratório de ensaio de hidrodinâmica.
- Coloque os corações em uma panela dissecação e remova cuidadosamente o pericárdio. Posicione o coração de tal forma que o lado ventral é voltado para você. Inspecione visualmente e identificar as quatro câmaras do coração e localizar o arco aórtico na aorta intacta.
- Separe o coração em twO metades cortando transversalmente na horizontal a cerca de 0,75 em baixo do anel, ou seja, na junção entre a aorta e o ventrículo esquerdo. Isolar cuidadosamente aorta intacta ainda ligado ao segmento de tecido ventricular esquerda.
- Examinar a válvula aórtica localizado na raiz da aorta, a região entre a aorta ascendente e o anel inferior, garantindo que não há danos ou quaisquer sinais de calcificação.
- Dividir a aorta a ~ 1 em cima do anel e separar o segmento de tecido ventricular esquerda inferior do anel para isolar a válvula da aorta (Figura 2a).
3. Polímero e processo de Sutura valva nativa
- Coloque a válvula cardíaca interior do suporte da válvula de tal modo que a base de cada válvula está alinhada com a base do suporte do poste. Fixe a válvula no lugar em cada posto temporariamente com um clipe de papel, mas tenha cuidado para não danificar as comissuras ou cúspides.
- Inserir a sutura noagulha. Comece a sutura na parte inferior do suporte da válvula, passando a agulha através do primeiro furo, a partir do exterior para o interior tal que a agulha pode ser facilmente removido a partir do fundo. Em uma forma de looping, comece a sutura da válvula verticalmente até os lugares do suporte da válvula.
- Progresso com a sutura (Figura 2b) ao longo da circunferência do titular e seguro com sutura adicional em torno das pontas das mensagens titular. Os grampos de papel (Figura 2c) pode ser removida quando a válvula é completamente segura por meio de sutura para os três postos de trabalho e na periferia do suporte da válvula (Figuras 2d e 2e).
4. Avaliação hidrodinâmica
Nota: O protocolo irá variar dependendo do sistema duplicador de pulso específico que está sendo usado. Todas as informações caontained usado aqui, o ViVitro pulso duplicador Sysytem (ViVitro Labs, Inc., Vancouver, BC).
- Va Bi-folhetolve
- Ajustar a taxa de coração do sistema duplicador de pulsos para 70 batimentos / min.
- Seleccionar uma forma de onda de fluxo de propulsão da bomba (no caso do sistema ViVitro o S35 onda foi escolhida para todos os testes hidrodinâmicos). A forma de onda específico utilizado nas nossas experiências é ilustrada por Lim et ai. (2001) 17.
- Ligue o amplificador e bomba de pistão. Aquecer por 15 min.
- Lugar válvula bi-folheto (Figura 2f) em posição aórtica.
- Smear graxa de vácuo em todos os cruzamentos do dispositivo onde poderia ocorrer vazamentos.
- Despeje a glicerina / líquido salino no compartimento fibrilação. Note-se que o sistema de duplicação pulsátil é executado em 2 L de líquido com: 35% / 0,7 L e 65% de glicerina / 1,3 L de solução salina. A solução salina é preparado usando o sal comum bem dissolvido em água desionizada a uma concentração de 9 mg / ml (peso / volume).
- Ligue o transdutor de fluxo que tenha sido colocado na posição aórtica.
- Calibrar ªe bomba.
- Continuar com a calibração do transdutor de fluxo, seguido pelos transdutores de pressão. Da mesma forma que a bomba, basta seguir as instruções dadas pelo software ViVitest (ViVitro Labs Inc.) para cada fluxo e pressão sob a aba calibrar.
- Uma vez que a calibração estiver concluída, inicie a bomba em baixa rpm até que o líquido preenche o compartimento da aorta. Verifique se há vazamentos. Use graxa de vácuo adicional, se necessário.
- Vire as duas torneiras de corte (transdutores aórticas e ventriculares) para a posição aberta.
- Aumentar a rpm da bomba até o volume sistólico chega a 80 ml / batida.
- Permitir que o sistema funcione por 10 minutos até que o fluxo se estabilizou. Fluxo de estabilização pode ser verificada através da observação do fluxo e da pressão de onda exibida na tela. Baixa à variação nenhum entre os ciclos é um bom indicador de estabilização do sistema.
- No software ViVitest selecionar o modo de adquirir.
- Clique em coletar 10 ciclos.
- De modo a analisar, clamber na mesa e salve o arquivo. Também salvar uma imagem da onda usando a opção foto-snap em ViVitest.
- Valvas nativas e Polymer
- Para válvulas de polímeros e animal, siga os mesmos passos 3.1.1 - 3.1.3 das instruções da válvula bi-folheto.
- Coloque o suporte da válvula com a válvula suturado no interior do tubo de vidro da montagem feitos. Sandwich o tubo com as peças superior e inferior e seguras no local com parafusos laterais e nozes.
- Montagem lugar entre a câmara de suporte da válvula aórtica e da aorta de origem.
- Continue com os passos 3.1.5 - 3.1.16 de instruções da válvula de bi-folheto.
5. Pós-Processamento
- Formas de onda de fluxo e pressão
- Calcule a média dos dados obtidos para cada uma das formas de onda recolhido, ou seja, a pressão da aorta (PA), a pressão do ventrículo esquerdo (VP), e taxa de fluxo (Q).
- Para cada grupo de válvula (polímero, porcino nválvula aórtica ative e bi-folheto), traçar a correspondente AP, VP e Q contra as relações de tempo na mesma trama.
- Para a AP, sobrepor, a válvula aórtica normal, nativo 18, e bi-protética do folheto da válvula 19 parcelas a partir da literatura para fins de validação.
- Métricas hidrodinâmicas
- Para cada válvula testada, as seguintes métricas hidrodinâmicas devem ser computadas: a) queda Encaminhar fluxo de pressão e pressão transvalvar máximo (TVP), b) raiz da aorta mean square (RMS) taxa de fluxo para a frente, c) o fluxo direto da aorta, fechamento, vazamento eo volume regurgitante total d) válvula área final do orifício (EOA), e) transaórtica frente de fluxo, fechamento, vazamentos e perdas totais de energia.
- Frente a queda de pressão do fluxo é calculado a partir das leituras TVP e podem ser classificados em três intervalos de tempo, P: intervalo que começa e termina com 0 TVP, F: intervalo com fluxo direto e H: intervalo começando com 0 TVP e terminando com 0 fluxo. Máximo TVP é a magradiente de pressão ximum registrado através da válvula a partir das leituras de pressão ventricular e aórtica.
- O atacante vazão RMS (Q rms) fornece uma métrica útil para quantificar a magnitude da taxa de fluxo para a frente como se segue:

Onde 'n' é o número total de pontos no tempo coletado, 'Q i' é a medição da taxa de fluxo instantânea coletados em ordem 'i'. - Volumes da aorta para a frente, de fechamento e vazamento são calculados com base nos seguintes intervalos de tempo, Forward: início do fluxo para a frente através da válvula (t o), ao final do fluxo direto (t 1); Encerramento: a partir de t 1 até a instância de fecho de válvula (T 2); vazamento: a partir de t 2 até ao final do ciclo cardíaco (t 3). O volume total de regurgitação é simplesmente a soma de closção e os volumes de vazamento.
- O EOA com base nas propriedades do sangue podem ser calculados para os intervalos de 3, P, F e H do TVP significativo durante cada um destes períodos de 20:
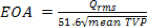
- As perdas de energia são definidos da seguinte forma 21:
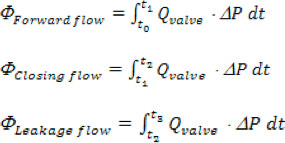
- Para cada válvula testada, as seguintes métricas hidrodinâmicas devem ser computadas: a) queda Encaminhar fluxo de pressão e pressão transvalvar máximo (TVP), b) raiz da aorta mean square (RMS) taxa de fluxo para a frente, c) o fluxo direto da aorta, fechamento, vazamento eo volume regurgitante total d) válvula área final do orifício (EOA), e) transaórtica frente de fluxo, fechamento, vazamentos e perdas totais de energia.
Resultados
Fluxo representativo e ondas de pressão são mostrados nas Figuras 3, 4 e 5. As parcelas foram em média sobre o tamanho da amostra de válvulas para cada grupo testado, que foi, n = 5, 4 e 2 válvulas de polímero, porcina nativa e grupos bi-folheto, respectivamente. As métricas hidrodinâmicas médios e o erro padrão da média para estas amostras são apresentados na Tabela 1.
Discussão
Neste estudo, foi demonstrado a utilidade da modificação de um aparelho duplicador pulsátil comercialmente disponível para acomodar geometrias de válvula tri folheto de modo que o teste hidrodinâmico de um polímero e as válvulas nativas porcino pode ser executada. Especificamente, no nosso caso, o sistema foi modificado de um coração esquerdo ViVitro e sistema de simulador sistémica (Figura 1a), controlado através do sistema de aquisição de dados ViViTest (ViVitro Systems, Inc, Victoria, B...
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
A doação de sementes da Universidade da Flórida - Faculdade de Medicina é reconhecido agradecimento. Estudos de pós-graduação (Manuel Salinas) foram apoiadas através de oportunidades de minoritários em programas de investigação biomédica - iniciativa de pesquisa para o aprimoramento científico (MBRS-RISE) comunhão: NIH / NIGMS R25 GM061347. O apoio financeiro da Fundação Wallace H. Coulter através Florida International University, Departamento de Engenharia Biomédica é também reconhecido agradecimento. Finalmente, os autores agradecem aos seguintes alunos para a sua assistência durante as várias etapas do processo experimental: Kamau cais, Malaquias Suttle, Kendall Armstrong e Alfonso Abraham.
Materiais
| Name | Company | Catalog Number | Comments |
| Pump | ViVitro Labs | http://vivitrolabs.com/products/superpump/ | |
| Flow Meter and Probe | Carolina Medical | Model 501D | http://www.carolinamedicalelectronics.com/documents/FM501.pdf |
| Pressure Transducer | ViVitro Labs | HCM018 | |
| ViVitro Pressure Measuring Assembly | ViVitro Labs | 6186 | |
| Valve holder | WB Engineering | Designed by Florida International University. Manufactured by WB Engineering | |
| Pulse Duplicator | ViVitro Labs | PD2010 | http://vivitrolabs.com/wp-content/uploads/Pulse-Duplicator-Accessories1.pdf |
| Pulse Duplicator Data Acquisition and Control System, including ViViTest Software | ViVitro Labs | PDA2010 | http://vivitrolabs.com/products/software-daq |
| Porcine Hearts and Native Aortic Valves | Mary's Ranch Inc | ||
| Bi-leaflet Mechanical Valves | Saint Jude Medical | http://www.sjm.com/ | |
| High Vacuum Grease | Dow Corning Corporation | http://www1.dowcorning.com/DataFiles/090007b281afed0e.pdf | |
| Glycerin | McMaster-Carr | 3190K293 | 99% Natural 5 gal |
| Phosphate Buffered Saline (PBS) | Fisher Scientific | MT21031CV | 100 ml/heart |
| Antimycotic/Antibiotic Solution | Fisher Scientific | SV3007901 | 1 ml in 100 ml of PBS/heart; 20 ml for ViVitro System |
| NaCl | Sigma-Aldrich | S3014-500G | 9 g/L of deionized water |
| Deionized Water | EMD Millipore Chemicals | Millipore Deionized Purification System. 1.3 L for ViVitro System, 200 ml for heart valve dissection process |
Referências
- Rajamannan, N. M., et al. Calcific aortic valve disease: not simply a degenerative process: A review and agenda for research from the National Heart and Lung and Blood Institute Aortic Stenosis Working Group. Executive summary: Calcific aortic valve disease-2011 update. Circulation. 124, 1783-1791 (2011).
- Marijon, E., Mirabel, M., Celermajer, D. S., Jouven, X. Rheumatic heart disease. Lancet. 379, 953-964 (2012).
- Karaci, A. R., et al. Surgical treatment of infective valve endocarditis in children with congenital heart disease. J. Card. Surg. 27, 93-98 (2012).
- Knirsch, W., Nadal, D. Infective endocarditis in congenital heart disease. Eur. J. Pediatr. 170, 1111-1127 (2011).
- Korossis, S. A., Fisher, J., Ingham, E. Cardiac valve replacement: a bioengineering approach. Biomed. Mater. Eng. 10, 83-124 (2000).
- Ghanbari, H., et al. Polymeric heart valves: new materials, emerging hopes. Trends Biotechnol. 27, 359-367 (2009).
- Mol, A., Smits, A. I., Bouten, C. V., Baaijens, F. P. Tissue engineering of heart valves: advances and current challenges. Expert Rev. Med. Devices. 6, 259-275 (2009).
- Ramaswamy, S., et al. The role of organ level conditioning on the promotion of engineered heart valve tissue development in using mesenchymal stem cells. Biomaterials. 31, 1114-1125 (2010).
- Sacks, M. S., Schoen, F. J., Mayer, J. E. Bioengineering challenges for heart valve tissue engineering. Annu. Rev. Biomed. Eng. 11, 289-313 (2009).
- Zamorano, J. L., et al. EAE/ASE recommendations for the use of echocardiography in new transcatheter interventions for valvular heart disease. J. Am. Soc. Echocardiogr. 24, 937-965 (2011).
- ANSI/AAMI/ISO. Cardiovascular Implants - Cardiac Valve Prostheses. Assoc. Adv. Med. Instrum. 71, (2005).
- Gallocher, S. L. . Durability Assessment of Polymer Trileaflet Heart Valves PhD thesis. , 313 (2007).
- Carroll, R., Boggs, T., Yamaguchi, H., Al-Mously, F., DeGroff, C., Tran-Son-Tay, R. Blood Cell Adhesion on Polymeric Heart Valves. , (2012).
- Pierre, K. K., Salinas, M., Carroll, R., Landaburo, K., Yamaguchi, H., DeGroff, C., Al-Mousily, F., Bleiweis, M., Ramaswamy, S. Hydrodynamic Evaluation of a Novel Tri-Leaflet Silicone Heart Valve Prosthesis. , (2012).
- Cacciola, G., Peters, G. W., Schreurs, P. J. A three-dimensional mechanical analysis of a stentless fibre-reinforced aortic valve prosthesis. J. Biomech. 33, 521-530 (2000).
- De Hart, J., Cacciola, G., Schreurs, P. J., Peters, G. W. A three-dimensional analysis of a fibre-reinforced aortic valve prosthesis. J. Biomech. 31, 629-638 (1998).
- Lim, W. L., Chew, Y. T., Chew, T. C., Low, H. T. Pulsatile flow studies of a porcine bioprosthetic aortic valve in vitro: PIV measurements and shear-induced blood damage. J. Biomech. 34, 1417-1427 (2001).
- Gutierrez, C., Blanchard, D. G. Diastolic heart failure: challenges of diagnosis and treatment. Am. Fam. Physician. 69, 2609-2616 (2004).
- Shi, Y., Yeo, T. J., Zhao, Y., Hwang, N. H. Particle image velocimetry study of pulsatile flow in bi-leaflet mechanical heart valves with image compensation method. J. Biol. Phys. 32, 531-551 (2006).
- Chandran, K. B., Yoganathan, A. P., Rittgers, S. E. . Biofluid Mechanics: The Human Circulation. , 277-314 (2007).
- Akins, C. W., Travis, B., Yoganathan, A. P. Energy loss for evaluating heart valve performance. J. Thorac. Cardiovasc. Surg. 136, 820-833 (2008).
- Fung, Y. C. . Biomechanics: Circulation. , (1997).
- Keener, J., Sneyd, J. . Mathematical Physiology, II: Systems Physiology. , (1998).
- Quick, C. M., Berger, D. S., Noordergraaf, A. Apparent arterial compliance. Am. J. Physiol. 274, H1393-H1403 (1998).
- Wang, Q., Jaramillo, F., Kato, Y., Pinchuk, L., Schoephoerster, R. T. Hydrodynamic Evaluation of a Minimally Invasive Heart Valve in an Isolated Aortic Root Using a Modified In Vitro Model. J. Med. Devices. 3, 011002.1-011002.6 (2009).
- Baldwin, J. T., Campbell, A., Luck, C., Ogilvie, W., Sauter, J. Fluid dynamics of the CarboMedics kinetic bileaflet prosthetic heart valve. Eur. J. Cardiothorac. Surg. 11, 287-292 (1997).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados