É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Medindo intracelular de Ca
Neste Artigo
Resumo
Intracelular de Ca 2 + Dinâmica são muito importantes na fisiologia do esperma e Ca 2 + Sensíveis corantes fluorescentes constituem uma ferramenta versátil para estudá-los. Experiências da população (fluorometria e parou fluorometria fluxo) e experimentos com células individuais (citometria de fluxo e de imagem única célula) são usados para rastrear espaço-temporal [Ca 2 +] Alterações nas células de espermatozóides humanos.
Resumo
Os espermatozóides são células reprodutoras masculinas, especialmente concebidos para alcançar, reconhecer e fundir-se com o ovo. Para executar essas tarefas, os espermatozóides precisam estar preparados para enfrentar um ambiente em constante mudança e superar várias barreiras físicas. Sendo na sua essência transcriptionally e translação em silêncio, estas células móveis dependem profundamente sobre diversos mecanismos de sinalização para orientar-se e nadar de forma dirigida, e de lidar com difíceis condições ambientais durante a sua jornada para encontrar o óvulo. Em particular, o Ca 2 + sinalização mediada é essencial para várias funções do esperma: activação de motilidade, capacitação (um processo complexo, que se prepara de esperma para a reacção do acrossoma), e a reacção do acrossoma (um evento exocitótica que permite a fusão espermatozóide-ovo). A utilização de corantes fluorescentes para controlar flutuações intracelulares deste ião é de extraordinária importância, devido à sua facilidade de aplicação, a sensibilidade, e versatilidade de detexão. Usando um único protocolo corante de carregamento de nós utilizamos quatro técnicas fluorométricos diferentes para monitorar esperma Ca 2 + dinâmica. Cada técnica fornece informações distintas que permite a resolução espacial e / ou temporal, gerando dados, tanto a nível da população de células de uma única célula e.
Introdução
Ca2 + é um segundo mensageiro universal das vias de transdução de sinal em células eucarióticas. Intracelular de Ca2 + (Ca2 + i) participa na regulação de vários processos fisiológicos fundamentais tanto em células excitáveis e não excitáveis. A importância e da universalidade da Ca2 + como segundo mensageiro durante eventos de transdução de sinal é obtido a partir da sua versatilidade espácio-temporal, na transmissão de informação no interior da célula. Enquanto Ca2 + não podem ser sintetizados de novo ou degradada no interior da célula, a sua concentração intracelular ([Ca 2 +] i) é mantida dentro de limites muito restritos por diferentes mecanismos celulares que tampão continuamente, sequestram, compartimentar, e / ou acumular Ca2 +. As alterações na concentração do ião pode ocorrer em regiões altamente localizadas dentro da célula 1, e decifrar tais flutuações é essencial para a obtenção de umeper compreensão de (1) a sua função no mecanismo de sinalização (2), o seu significado fisiológico, e (3) mecanismos gerais de sinalização celular. Ca 2 + sinalização mediada é de particular importância na fisiologia esperma 2. A motilidade espermática é uma das funções mais importantes para o sucesso de fertilização, e, de fato, vários defeitos motilidade dos espermatozóides pode causar esterilidade 3-5. A importância de Ca 2 + em circulação flagelar tem sido reconhecida 6, no entanto, o mecanismo de como Ca 2 + controla a forma específica de flagelar flexão não é totalmente compreendido.
Antes da fusão com o ovo, os espermatozóides devem sofrer capacitação, um processo complexo que depende de residência de esperma dentro do trato genital feminino. Durante a capacitação, arquitetura lipídica da membrana de esperma e de organização são modificados, principalmente como um resultado da remoção do colesterol a partir da membrana plasmática. Além disso, várias proteínas são tirosina-fósforoylated 7. Importante, durante capacitação há um aumento do pH intracelular (pH I) e na [Ca 2 +] i, e o potencial de membrana em algumas espécies hiperpolariza 2. Capacitação só ocorre em uma subpopulação de espermatozóides (20-40%), e os mecanismos envolvidos em todas estas alterações celulares estão longe de ser clara. É geralmente aceite que apenas uma sub-população de esperma capacitada sofrer a reacção do acrossoma (AR), quando exposto a indutores fisiológicas. A AR é também um evento de Ca 2 +-regulada necessária para a fertilização em todas as espécies que possuem um acrossoma (organela especializada, com membranas externas e internas). Durante este processo, os fusíveis da membrana acrossomal exteriores com a membrana plasmática do espermatozóide, libertando enzimas hidrolíticas que permitem que a célula de esperma para penetrar na matriz de glico-proteico que rodeia o óvulo (zona pelúcida, ou ZP). A AR também expõe uma nova superfície de células de esperma, que interage com fusogénicoa membrana plasmática do ovo para que a fusão final de ambos os gâmetas. Existem vários ligandos celulares que induzem o AR, progesterona a ser uma das mais estudadas entre eles.
Neste trabalho, apresentamos quatro diferentes técnicas que envolvem o uso de um corante fluorescente Ca 2 + sensível para medir [Ca 2 +] i alterações no esperma humano provocado pela progesterona (com exceção de citometria de fluxo, no qual medimos a [Ca 2 + ] i induzida aumentam durante o processo de capacitação in vitro). Neste caso específico utilizou-Fluo-3 AM (Life Technologies, Grand Island, NY), um corante de membrana permeável com um K d = 325 nm. In vitro foi monitorada alterações de fluorescência como uma função do tempo com três das metodologias, e com a quarta técnica medimos valores de fluorescência a um único ponto no tempo. Estas diferentes abordagens se complementam, uma vez que eles fornecem completamente res espaciais e temporaislução em ambos os níveis de população de células de uma única célula e.
População celular ou Experimentos em massa
Técnicas de massa são amplamente utilizados, não só porque os instrumentos que requerem estão facilmente disponíveis, mas também porque são simples e bem estabelecido, e para permitir o cálculo da média da informação a partir de medições feitas em milhões de células numa única experiência.
Técnica n º 1. Fluorometria convencional
Esta técnica monitoriza as alterações na fluorescência como uma função do tempo, as experiências são realizadas em cuvetes de vidro, com volumes de amostra variam de 200 a 1000 ul. A mistura adequada de reagentes adicionados requer agitação magnética, e por conseguinte a resolução temporal obtida é da ordem de segundos. O intervalo de concentração típica de células das amostras analisadas é de 10 5 -10 8 células / ml.
Técnica n º 2. Parado Fluorometria Fluxo
Ta técnica também monitoriza as alterações na fluorescência como uma função de tempo, mas os reagentes são misturados rapidamente (através de pressão) numa cuvete de gravação que contém um volume de amostra muito pequena (variando 25-100 ul). Portanto, a homogeneização dos reagentes é instantânea, permitindo uma resolução temporal maior, na ordem de milissegundos. Análise da fluorescência vs tempo vestígios resultantes são adequados para a determinação da taxa de reacção, a elucidação da complexidade do mecanismo de reacção, obtendo-se informações sobre a vida curta intermediários da reacção, etc A gama de concentração de células comum das amostras analisadas é de 10 5 a 10 7 células / mL.
Experiências de uma única célula
Experimentos Granel relatar o comportamento médio de um grande número de células, no entanto, uma população podem frequentemente exibem propriedades que são heterogéneos negligenciado durante este tipo de medições. Técnicas de células individuais são então usadas para complementar thinformações e obtidos com as experiências da população de células.
Técnica # 3. Citometria de Fluxo
Apesar da importância da informação resultante a partir de medições de célula única, que é importante para analisar um grande número de células, a fim de impedir que a extrapolação errónea de propriedades específicas de células de uma população inteira. Por esta razão, as técnicas de alto rendimento são favorecidos e o método mais popular é a citometria de fluxo, em que 10.000 células por condição, são convencionalmente analisados. Este método permite uma análise multi-paramétricos de populações heterogêneas, uma vez que categoriza as células de acordo com seu tamanho (dispersão frontal (FSC)), granularidade (dispersão lateral (SSC)) e intensidade de fluorescência (rotulagem específico com um anticorpo, marcador de viabilidade, etc) , fornecendo assim informação sobre a distribuição dos parâmetros para um grupo de células. A citometria de fluxo fornece informações instantâneas ao invés de dependente do tempo 8. Para a frente e de lado valores dispersão arE também útil para a selecção de um portão que inclui células, mas discrimina os detritos celulares, a poeira, etc, para medições de fluorescência, fluorescência de controlos negativos e positivos devem também ser incluídos. Se mais de um canal de fluorescência é usada, um processo conhecido como a compensação deve ser realizada (ver detalhes http://www.bdbiosciences.com/resources/protocols/setting_compensation.jsp ). Compensação permite a sobreposição espectral discriminação entre fluoróforos. A citometria de fluxo também permite a discriminação de células mortas, geralmente por meio de coloração com iodeto de propídio.
Técnica n º 4. Única célula de imagem
Microscopia é outro método comum para estudar o comportamento de célula única, que é bem adequado para estudos dependentes do tempo e também fornece uma resolução espacial. A principal desvantagem é que a análise de alto rendimento é de apenas incipiente no momento presente 9.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Neste artigo relatamos o uso das quatro técnicas acima mencionadas para medir [Ca 2 +] i alterações nas células de esperma humano. Utilizou-progesterona para desencadear uma resposta de Ca 2 +, como é bem estabelecido que este esteróide produz um transiente [Ca 2 +] i aumentar em espermatozóides. Particularmente, no esperma humano, progesterona ativa diretamente a um canal de Ca2 + (isto é CatSper) exclusivamente expressa na membrana plasmática das células de esperma 10,11. Nós também medido em repouso [Ca 2 +] i antes e depois de capacitação dado que também é amplamente aceite que um aumento na [Ca 2 +] i ocorre durante a capacitação. Para técnicas que requerem um controlo positivo utilizou-se um ionóforo de Ca 2 +, ionomicina, para induzir a Ca 2 + a captação máxima na célula, e, assim, a resposta de fluorescência máxima, para o valor mínimo de fluorescência, utilizou-se Mn 2 + para extinguir a fluorescência.
1. Preparação de amostras de esperma pelo Método Swim-up (veja a Figura 1)
Utilize apenas ejaculado amostras (obtidos por masturbação), cujas características cumprir os parâmetros estabelecidos pela mais recente edição da Saúde Organização Mundial de manual de laboratório (disponível em http://whqlibdoc.who.int/publications/2010/9789241547789_eng.pdf ) para o exame e processamento de sêmen humano.
- Obter a amostra de esperma dentro de um recipiente estéril e coloque-o (com tampa solta) dentro de uma incubadora a 37 ° C e 5% de CO 2/95% de ar durante 30 min. Esta etapa é para a amostra de liquefação.
- Colocar alíquotas de 500 ul da amostra de sémen liquefeito no fundo de tubos de ensaio de vidro limpo (1,0 x 7,5 cm). Aproximadamente oito tubos de ensaio são necessários para uma amostra de tamanho médio (4 mL).
- Cuidadosamente camada de 1 ml de F-10 meio de Ham (su. pplemented com 2 mM de CaCl 2 e 5 mg / ml de albumina de soro bovino para promover a capacitação in vitro) no topo de cada alíquota de sémen (Ver Figura 1) NOTA: Toque a parede do tubo com a ponta da micropipeta, e dispensar suavemente o meio acima da amostra. É crucial para fazê-lo lentamente enquanto a mistura de ambas as camadas (amostra e meio) devem ser evitados.
- Inclinar-se cuidadosamente os tubos a um ângulo de 30 ° aproximadamente. Isto irá aumentar a área de superfície entre os dois líquidos, aumentando assim o deslocamento (aquático) de células humanas a partir da amostra ao meio durante a incubação.
- Colocar o conjunto de tubos de ensaio inclinado dentro de uma incubadora a 37 ° C e 5% de CO 2 / ar a 95% durante 1 hora.
- Usando uma micropipeta remova cuidadosamente a 700 mL superior do F-10 meio de HAM (agora contendo espermatozóides móveis) de cada tubo e piscina de todas as amostras coletadas em um único tubo limpo de vidro (1,0 x 7,5 cm, para volumes maiores, usar a 15 mlTubo Falcon), evitando a formação de bolhas. Coloque 10 ml de amostra colectiva no vidro plano óptico de Makler Contando base da câmara, e em seguida, coloque a tampa de vidro (uma vez que a tampa está no lugar, evitar levantar ou cobrindo novamente para manter a propagação uniforme da amostra de esperma). Certifique-se de evitar a formação de bolhas no interior da câmara, pois isso resultaria em uma contagem de células impreciso.
- Observar sob um microscópio composto (recomenda-se a utilização de uma objectiva de 20X). A tampa de vidro da câmara de contagem Makler tem um grande quadrado composto de 100 quadrados menores (ou seja, de 10 em 10 grid). Contar as células em qualquer faixa de 10 quadrados. Este número representa a sua concentração em milhões de células / ml. Repita a contagem em duas tiras de 10 quadrados adicionais, e calcular a média de três contagens NOTA:. Se uma câmara de contagem Makler (que foi especialmente concebido para contar as células de esperma) não está disponível, qualquer câmara de hemocitómetro podem ser utilizados.
- Ajuste fina da amostraconcentração de l para 1x10 7 células / ml em suplementado F-10 de Ham médio. Quando necessário, incubar a amostra a 37 ° C e 5% de CO 2/95% de ar durante 5 horas para promover a capacitação.
2. Corante fluorescente carregamento para Ca 2 + Medições
Existem vários corantes fluorescentes disponíveis para medir intracelular de Ca 2 +, o mais adequado deve ser escolhido de acordo com o seu K d, e seus comprimentos de onda de emissão e de excitação (para medições qualitativas e quantitativas, comprimentos de onda de emissão e de excitação simples e duplas, respectivamente, devem ser utilizado) mais informações). Para o presente pedido qualitativa foi utilizada Fluo-3 AM, um corante de células-permeável com um K d = 325 nm e emissão única e comprimentos de onda de excitação de 506/526 nm, respectivamente 12.
- Preparar 50 ml de um 1 mM de Fluo-03:00 solução estoque dissolvendo o conteúdo de um frasco de 50 ug de corante (PM = 1130 g / mol) em 44 mL de DMSO anidro.
- Usando um microtubo de 1,5 ml misturar o volume pretendido de suspensão de esperma (veja quantidade necessária para cada técnica específica a seguir) com uma suficiente mM Fluo-03:00 solução mãe para se obter uma concentração final de 2 jaM Fluo-3 AM (ou seja, 1 ul de estoque Fluo-3 AM é adicionado para cada 500 mL de suspensão de espermatozóides).
- Incubar durante 30 min a 37 ° C e protegida da luz.
- Centrifuga-se o tubo a 750 xg durante 5 min usando uma microcentrífuga, aspirar e descartar o sobrenadante e ressuspender o sedimento em um volume apropriado (veja concentração requerida para cada técnica específica a seguir) de Esperma Humano Médio (HSM; mM: 120 NaCl, 15 NaHCO3 , 4 KCl, 1,8 de CaCl2, 1 MgCl2, 10 HEPES, 10 lactato de Na, 5 D-glucose, piruvato de Na 1, pH = 7,4) NOTA: A formação de uma nuvem, em vez de uma pastilha indica que as células são em bom estado.
- As células são agora carregados com o corante, eles permanecem viáveis (mantida a 37 ° C e protegida da luz) durante cerca de duas horas, e podem ser usadas em qualquer uma das seguintes técnicas.
3. Técnica n º 1. Fluorometria convencional (Informações média de uma população de células Large)
Equipamento: Para nossa população esperma [Ca 2 +] i medições que usam um SLM Aminco espectrofluorímetro operado por software Olis (Bogart, GA, EUA), com controle de agitador magnético (SIM Aminco) e acoplado a um LED azul (Luxeon Estrela LXHL- LB3C, de LUMILEDS) e 465-505 nm filtro passa-banda (Chroma Technology Corp) para Fluo-03:00 excitação. O diodo emissor de luz é controlada por uma fonte de alimentação personalizada embutido (700 mA). Emissão de luz é medida através da definição do comprimento de onda de emissão (λ Em) a 525 nm em monocromador do espectrofluorímetro.
- Coloque 570 ml de HSM e 30 ul de suspensão de células de esperma (previamente carregado com Fluo-3 AM e ressuspensas em HSM obter 8 1x10 células / ml) num tubo de vidro de fundo plano (ID 8 x 50 mm). Colocar uma barra de agitação magnética no interior do tubo e inserir o tubo para dentro da câmara de leitura do espectrofluorímetro (pré-aquecido a 37 ° C), agita-se a amostra durante todo o tempo de aquisição.
- Iniciar o experimento usando o software do equipamento (software Olis neste caso) e proceder à aquisição de valores de fluorescência em uma freqüência de 0,5 Hz durante 300 segundos. Aplicar os compostos do teste desejados por injecção de um volume apropriado de uma solução de estoque (100X geralmente mais concentrada do que a concentração final desejada), utilizando uma micro-seringa Hamilton como se segue:
- Adquirir fluorescência basal durante 30 seg.
- Adicionar 4 mm de progesterona (Pg).
- Ao adicionar 20 seg 100 uM ionomicina (como um controlo positivo, para se obter o valor máximo de fluorescência).
- Executar um controlo negativo, repetindo os passos 3.1 a 3.2.3, mas em vez disso a adição de Pg só o solvente utilizado para dissolver o HSM (com 0,01% de DMSO anidro).
- Exportar os valores de intensidade de fluorescência para matérias Microsoft Excel e normalizam-utilizando a seguinte equação: (F/F0) - 1. Em que F é a intensidade de fluorescência medida em qualquer momento (t), e F0 é a fluorescência basal média feita durante o processo inicial de 30 s. Traça-se a série total de (F/F0) - valores em função do tempo 1 (Figura 2A). Medir a diferença entre os valores de intensidade de fluorescência antes e depois da adição dos compostos de ensaio (Af), pondo-os num gráfico de barras e processar os dados da aplicação dos métodos de análise estatística apropriados (Figura 2B).
4. Técnica n º 2. Parado Flow Fluorometria (Informações com alta resolução temporal de uma população de células Large)
Equipamento: intracelular [Ca 2 +] mudanças são medidos com alta resolução temporal utilizando um SFM-20 parou de fluxo misturador acoplado a um rápido sistema óptico MOS-200 cinética, tanto de instrumentos científicos Biológica (Grenoble, França). Todos os dados são analisados com o software de Bio-Kine32 da mesma empresa.
- Definir as condições apropriadas no equipamento, a fonte de iluminação deve ser ligado pelo menos 15 minutos antes do início do experimento, ajustar excitação e emissão filtros, ajustar o fotomultiplicador para um valor de tensão dentro do intervalo estabelecido pelo fabricante de fluxo interrompido, e definir a temperatura do banho a 37 ° C.
- Encher uma das seringas do instrumento com 1 ml de células de Fluo-3-AM esperma carregados (1X10 7 células / ml), e a segunda seringa com 1 ml do composto a ser testado, ou HSM (controlo negativo),10 pM de ionomicina (controlo positivo) ou de 10 uM dissolvida em Pg HSM Nota:. Neste passo, é crucial para evitar a formação de bolhas durante o desenho, os líquidos nas seringas.
- Levante os dois pistões instrumento até tocar com a ponta dos êmbolos das seringas.
- Ajuste a velocidade de fluxo para o valor mínimo que proporcionará uma resposta mensurável, a fim de minimizar os danos celulares. O caudal usamos no sistema SFM-20 é de 1 ml / 13 seg.
- Definir a frequência (neste caso, 10 ms) e o tempo total de amostragem (neste caso, 50 seg.)
- Desencadear a mistura de reagentes NOTA:. Enquanto um único gatilho de cada vez pode ser feita manualmente, de um conjunto de gatilhos consecutivos automáticos podem ser pré-programada, bem.
- O traço de fluorescência raw (unidades arbitrárias) em função do tempo é exibido na tela do computador.
- A mistura dos reagentes, por si só irá gerar um traço que não é uma linha recta. Assim, a fim de obter o real [Ca2 +] mudança derivado de um estímulo, o rastreio de controlo obtidas a partir de células de mistura com meio (controlo negativo), deve ser subtraído de cada um dos traços experimentais. Analisar os dados, conforme necessário; alguns parâmetros cinéticos também podem ser obtidas com o software de aquisição de Bio-Kine32. Vestígios brutos sem subtracção são mostrados na Figura 1 Suplementar para comparação.
- Para alterar o reagente no teste composto de seringa, limpe-o bem com água destilada. Em seguida, encher a seringa até o volume máximo, com água destilada, colocá-la no êmbolo correspondente do fluorímetro de fluxo parado e empurra a água através do mecanismo interno (a água de lavagem tem de ser dirigida para o recipiente de resíduos). Repetir esta etapa mais duas vezes.
- Repita os passos de 4,2-4,9, a segunda seringa de enchimento com o seguinte composto de teste desejada.
- No final da experiência, todo o equipamento de lavagem com água destilada, esvaziando completamente a água domangueiras internas.
5. Técnica # 3. Citometria de Fluxo (Informações celular individuais obtidos a partir de um grande número de células)
Equipamento: Esta técnica permite a medição simultânea de vários parâmetros num momento no tempo, mas, ao contrário das técnicas anteriores, não se medir as alterações ao longo do tempo, mas sim que fornece os valores de parâmetros no tempo de medição. Portanto, em vez de adicionar Pg para desencadear a resposta, neste caso, medimos intracelular de Ca 2 + em células de esperma, antes e após a indução de capacitação. Usamos um Cytometer FACSCanto (Becton Dickinson) e os dados foram analisados com o software FlowJo (Árvore Estrela 9.3.3).
- Preparar as amostras experimentais em tubos citómetro colocando 500 mL da suspensão de células (4x10 6 células / ml) por tubo em cada condição a ser testado (neste caso, dez condições, ver Tabela 1). Coletar dados de fluorescência from 10.000 eventos por amostra.
- Para configurar um experimento usar o software do equipamento para:
- Criar um novo: pasta, experiência, modelo e número de tubos.
- Selecione as configurações apropriadas para citómetro Fluo-3 AM (usar FITC-fluoresceína isotiocianato-filter) e PI (use PI-iodeto de propídio-filtro).
- Executar os tubos de controle não coradas 1 e 2 no citômetro. Colete FSC e SSC dados para verificar se as configurações de limite são apropriadas e para criar a porta correspondente, a fim de discriminar os restos de células.
- Para criar controles de compensação, execute os seguintes amostras de controle, a coleta de dados máximas de fluorescência (PI e canais FITC) (Nota: Esta tarefa é geralmente realizada por técnico do equipamento) e auto:
- Células não coradas (tubos 1 e 2).
- As células carregadas com Fluo-3 AM (2 | iM) (tubos 3 e 4).
- As células mortas (espermatozóides suspenso em 0,1% de Triton X-100 em HSM durante 10 min à temperatura ambiente)coradas com PI (1,2 uM PI, isto é, 0,25 mL de PI 2,4 mM é adicionado a 500 ul de suspensão de esperma), durante 30 min a 37 ° C, protegidos da luz (tubos 5 e 6).- Ver dados gravados e selecione a porta para as populações desejados.
- Ajuste o portão e selecione "Aplicar" a todos os controles de compensação.
- Selecione experiência> Configuração de compensação> calcular a compensação.
- Renomeie a configuração de compensação e de ligação e economize.
- Executar todos os tubos experimentais (neste caso, os tubos de 7-10). No final, exportar todos os dados para o software disponível para análise (veja o passo 5.6).
- Analisar os resultados de cada experimento utilizando o software do equipamento, o software FlowJo disponíveis comercialmente ou software livre Cytobank ( http://www.cytobank.org/ ).
6. Técnica n º 4. Única célula de imagem (Informações Single Cell com alta resolução espacial)
Equipamento:. Custom-built imagem set-up Nosso de imagens set-up é composto por um invertido Nikon Diaphot 300 microscópio equipado com um controlador de temperatura (Medical System Corp, Greenvale, NY), a Nikon PlanApo 60X (1,4 NA imersão em óleo) objetivo. Iluminação de fluorescência é fornecido por um Luxeon V Estrela Lambertian Cyan LED part # LXHL-LE5C (Lumileds Lighting LLC, San Jose, CA) ligado a uma caixa de controle estroboscópico custom-built. O LED foi montado em uma montagem FlashCube40 com espelho dicróico M40-DC400 (Rapp Opto Eletrônica, Hamburgo, Alemanha) (larguras de banda: excitação 450-490 nm, dicróicas espelho 505 nm e emissão de 520-560 nm). LED de saída foi sincronizado com a exposição Out sinal de uma câmera CCD pressão fresco através da caixa de controle para produzir um único raio de 2 ms duração por exposição individual. O tempo de exposição da câmera foi configurado equivalente à duração do flash (2 ms). As imagens são recolhidas a cada 250 ms (ou pode ser ajustada de acordo com aa resolução temporal desejado) utilizando um software de QI (Andor Bioimaging, Wilmington, NC).
- Prepara lamelas circulares (diâmetro = 25 mm) pela aplicação de uma gota de 5 ul da solução de poli-L-lisina (0,01% w / v) no centro. Deixe descansar por pelo menos 1 hora (pode secar). Usando uma garrafa de esguicho lavar a área tratada com água antes da utilização. Este procedimento permitirá que os espermatozóides a aderir ao lamínula de sua cabeça, enquanto o seu flagelo ainda pode se mover.
- Preparar os compostos a serem testados pela dissolução em HSM de acordo com a Tabela 2. Os compostos são adicionados sequencialmente, na mesma câmara de gravação, tendo o cuidado de adicionar sempre o mesmo volume, e para ajustar a concentração da solução de reserva, tendo em consideração a diluição que terá quando misturado com o volume já presentes na câmara (como indicado na Tabela 2). Mantenha todas as soluções de ensaio em um banho a 37 ° C até serem utilizados.
- Montar a lamínula dentro da recording câmara e coloque 10 ml de Fluo-3 células AM-carregados (1 x 10 7 células / ml) no centro. Cubra as células com 200 mL de pré-aquecido HSM.
- Coloque a câmara na fase do microscópio pré-aquecido a 37 ° C, ver as células (utilizando contraste de fase) e seleccionar uma área para a imagem latente. É importante selecionar uma área onde a densidade de células é apropriado (ver Figura 5A); muitas células fazer uma análise difícil, devido aos sinais sobrepostos NOTA: As células devem ser firmemente ligado ao lamínula por sua cabeça, mas exibindo movimento flagelar, o que confirma. viabilidade.
- Adquirir imagens de fluorescência no modo de viver para ajustar o foco eo brilho.
- Iniciar o experimento, ativando o software de aquisição de imagens de séries temporais (QI neste caso). Normalmente quatro imagens são adquiridas por segundo, com iluminação de 2 ms por imagem.
- Use uma micropipeta para adicionar cuidadosamente (gota a gota), o composto de ensaio (Pg, neste caso), continue image aquisição conforme requerido e executar duas adições sequenciais de controlo para a mesma câmara de: (1) 20 mM ionomicina para se obter o máximo de fluorescência e (2), 5 mM de MnCl2 para obter a fluorescência mínima. Alternativamente, os compostos podem ser adicionados usando uma câmara de perfusão, que oferece as vantagens de permitir a remoção do estímulo e a capacidade para uniforme banhar as células com o composto. Ao mesmo tempo, ele não tem as desvantagens de requerer maiores quantidades de solução, e de fazer o controlo da temperatura mais problemático.
- Repita a aquisição de uma nova câmara com cada composto teste desejado.
- Realizar análise de imagem on-line usando o software do equipamento, ou offline usando o Software de QI ou imagem J gratuito. Desenhe as regiões de interesse (ROI) em torno de cada célula (ou parte de células) e também selecionar uma área livre de células (por subtração de fundo automática pelo software). Uma série de intensidade de fluorescência de tempo é então obtida para cada ROI e estes dados de may ser exportados para o Microsoft Excel para análise posterior. Nós normalizar os valores de intensidade de fluorescência, utilizando a seguinte equação: (F/F0) - 1. Em que F é a intensidade de fluorescência medida em qualquer momento (t) e F0 é a fluorescência média feita durante o processo inicial de 30 s. Traça-se a série total de (F/F0) - 1 versus tempo (Figura 5B). Os valores também pode ser normalizada utilizando o valor da fluorescência obtido após a adição de ionomicina como 100%.
- Análise de Imagem pode, alternativamente, ser realizada através da Imagem J Software livre.
Técnica n º 1. Fluorometria convencional
A progesterona é um dos indutores e AR conhecido, tal como esperado, não provocam um transiente [Ca 2 +] i aumentar no esperma humano (mostrado na Figura 2). A adição de um ionóforo de cálcio (ionomicina) faz com que o máximo de [Ca 2 +] i aumento, que não retorna aos níveis basais.
Técnica n º 2. Stampo Fluorometria Fluxo
A progesterona induzido por [Ca 2 +] i foi medido aumento como antes (fluorometria convencional), mas desta vez com a maior resolução temporal, e neste caso a frequência de aquisição foi de 0,1 Hz. Como mostrado na Figura 3, ambos progesterona (transitória, linha vermelha) e ionomicina (, linha azul sustentada) causaram uma muito rápida [Ca 2 +] i aumente. A ausência de um atraso no aumento de progesterona induzida [Ca 2 +] i é consistente com trabalhos anteriores que sugerem que a progesterona ativa diretamente o Ca 2 + canal CatSper, sem intermediário sinalização 10,14.
Técnica # 3. Citometria de Fluxo
[Ca 2 +] i foi medido em capacitados e não capacitados esperma humano. Como relatado anteriormente, em 15 de rato, esperma bovino 16 e 17 de esperma humano, também observamos um aumento [Ca 2 +] i, em comparação com capacitada esperma humano não-capacitado. Baldi et al. (1991) 17 relataram mais basal de [Ca 2 +] i, em que capacitada no esperma humano não-capacitada utilizando fluorimetria convencional. Neste trabalho utilizamos a citometria de fluxo para medir [Ca 2 +] i antes e após a capacitação in vitro. A citometria de fluxo nos permite ver que a distribuição dos valores de fluorescência para o esperma capacitada (Figura 4D, azul traço) é deslocado para valores mais elevados em comparação com o esperma não capacitada (Figura 4D, em traço vermelho). Os valores da fluorescência de cada célula individual pode ser observado nos gráficos de pontos bidimensionais mostrado na Figura 4G; importante, o sinal resultante a partir de células mortas (cerca de 15%) pode ser eliminado (Figura 4G, quadrantes superiores).
Técnica n º 4. Única célula de imagem
A progesterona induzd [Ca 2 +] i alteração foi medida em células de esperma individuais. Além progesterona provoca um incremento na [Ca 2 +] i tanto na cabeça do espermatozóide e do flagelo. Tal como observado em experiências de população, a análise revelou uma única célula transitória e um aumento sustentado para a progesterona e ionomicina, respectivamente.
Access restricted. Please log in or start a trial to view this content.
Resultados
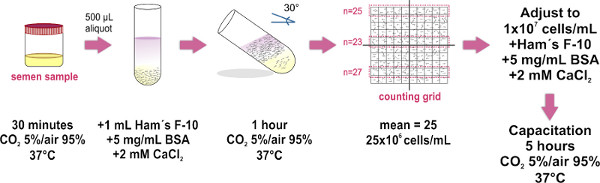
Figura 1. Diagrama esquemático do protocolo experimental para a preparação de amostras de espermatozóides pelo método aquático. Os principais passos para a separação de espermatozóides móveis e para ajustamento da sua concentração são ilustrados. O último passo de incubação é realizado apenas quando a c...
Access restricted. Please log in or start a trial to view this content.
Discussão
Sinalização intracelular é vital para a maioria das atividades celulares; Ca2 + é um mensageiro ubíquo que acompanha células de mamífero ao longo de toda a sua vida útil, a partir da sua origem no momento da fertilização, ao fim do seu ciclo de vida. Em resposta a diferentes estímulos, [Ca 2 +] i aumenta, oscila e diminui com a codificação espaço-temporal e, consequentemente, diversos processos são ativados, modulados ou denunciado por Ca 2 + mensagens codificadas. Ca
Access restricted. Please log in or start a trial to view this content.
Divulgações
Não temos nada a divulgar.
Agradecimentos
Os autores agradecem a José Luis De la Vega, Erika Melchy e Dr. Takuya Nishigaki para assistência técnica. Este trabalho foi apoiado pelo Consejo Nacional de Ciencia y Tecnología (CONACyT-México) (99.333 e 128.566 para CT); Dirección General de Asuntos del Pessoal Académico / Universidad Nacional Autónoma de México (IN202212-3 para CT).
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| Ham's F-10 | Sigma-Aldrich | N-6013 | |
| Bovine Serum Albumin | Sigma-Aldrich | A-7906 | |
| Calcium Chloride Dihydrate approx. 99% | Sigma-Aldrich | C-3881 | |
| Makler Counting Chamber | SEFI Medical Insruments LTD | SEF-MAKL | |
| Fluo-3 AM | Invitrogen | F-1242 | 20 vials/50 μg each |
| Ionomycin | Alomone | I-700 | |
| Progesterone | Sigma-Aldrich | P0130 | |
| Sodium chloride | Sigma-Aldrich | S-9888 | Reagents for human sperm medium (HSM) |
| Potassium chloride | Sigma-Aldrich | P-3911 | Reagents for human sperm medium (HSM) |
| Sodium bicarbonate | JT Baker | 3506 | Reagents for human sperm medium (HSM) |
| Magnesium chloride | Sigma-Aldrich | M-2670 | Reagents for human sperm medium (HSM) |
| Calcium chloride anhydrous | Sigma-Aldrich | C-1016 | Reagents for human sperm medium (HSM) |
| HEPES | Sigma-Aldrich | H-3125 | Reagents for human sperm medium (HSM) |
| D-Glucose | JT Baker | 1906-01 | Reagents for human sperm medium (HSM) |
| Sodium pyruvate | Sigma-Aldrich | P-2256 | Reagents for human sperm medium (HSM) |
| Sodium L-lactate (aprox. 99%) | Sigma-Aldrich | L- 7022 | Reagents for human sperm medium (HSM) |
| Propidium Iodide | Invitrogen | L-7011 | Component B |
| Triton X-100 (t-Octylphenoxypolyethoxyethanol) | Sigma- Aldrich | X-100 | 2.4 mM solution in water |
| Round coverslip | VWR | 48380 080 | 25 mm diameter |
| Poly-L-lysine solution | Sigma-Aldrich | P8920 | |
| Manganese chloride | Sigma-Aldrich | M-3634 | |
| Attofluor; Cell Chamber, for microscopy | Life technologies | A-7816 | |
| Dimethyl Sulphoxide | Sigma-Aldrich | D2650 | 5x5 ml |
Referências
- Bouschet, T., Henley, J. M. Calcium as an extracellular signalling molecule: perspectives on the Calcium Sensing Receptor in the brain. Comptes Rendus Biologies. 328, 691-700 (2005).
- Darszon, A., Nishigaki, T., Beltran, C., Trevino, C. L. Calcium channels in the development, maturation, and function of spermatozoa. Physiol. Rev. 91, 1305-1355 (2011).
- Esposito, G., et al. Mice deficient for soluble adenylyl cyclase are infertile because of a severe sperm-motility defect. Proc. Natl. Acad. Sci. U.S.A. 101, 2993-2998 (2004).
- Avenarius, M. R., et al. Human male infertility caused by mutations in the CATSPER1 channel protein. American Journal of Human Genetics. 84, 505-510 (2009).
- Carlson, A. E., et al. Pharmacological targeting of native CatSper channels reveals a required role in maintenance of sperm hyperactivation. PLoS ONE. 4, e6844(2009).
- Brokaw, C. J. Calcium and flagellar response during the chemotaxis of bracken spermatozoids. J. Cell. Physiol. 83, 151-158 (1974).
- Visconti, P. E., et al. Capacitation of mouse spermatozoa. II. Protein tyrosine phosphorylation and capacitation are regulated by a cAMP-dependent pathway. Development. 121, 1139-1150 (1995).
- Svahn, H. A., van den Berg, A. Single cells or large populations. Lab on a chip. 7, 544-546 (2007).
- Pepperkok, R., Ellenberg, J. High-throughput fluorescence microscopy for systems biology. Nat. Rev. Mol. Cell Biol. 7, 690-696 (2006).
- Strunker, T., et al. The CatSper channel mediates progesterone-induced Ca2+ influx in human sperm. Nature. 471, 382-386 (2011).
- Lishko, P., et al. The Control of Male Fertility by Spermatozoan Ion Channels. Annu. Rev. Physiol. , (2011).
- Kao, J. P., Harootunian, A. T., Tsien, R. Y. Photochemically generated cytosolic calcium pulses and their detection by fluo-3. J. Biol. Chem. 264, 8179-8184 (1989).
- Kilic, F., et al. Caged progesterone: a new tool for studying rapid nongenomic actions of progesterone. Journal of the American Chemical Society. 131, 4027-4030 (2009).
- Lishko, P. V., Botchkina, I. L., Kirichok, Y. Progesterone activates the principal Ca2+ channel of human sperm. Nature. 471, 387-391 (2011).
- Xia, J., Ren, D. The BSA-induced Ca2+ influx during sperm capacitation is CATSPER channel-dependent. Reprod. Biol. Endocrinol. 7, 119(2009).
- Galantino-Homer, H. L., Florman, H. M., Storey, B. T., Dobrinski, I., Kopf, G. S. Bovine sperm capacitation: assessment of phosphodiesterase activity and intracellular alkalinization on capacitation-associated protein tyrosine phosphorylation. Mol. Reprod. Dev. 67, 487-500 (2004).
- Baldi, E., et al. Intracellular calcium accumulation and responsiveness to progesterone in capacitating human spermatozoa. J. Androl. 12, 323-330 (1991).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados