Method Article
Imagem e Reconstrução 3D de Estruturas cerebrovasculares em Embryonic Zebrafish
Neste Artigo
Resumo
Imagem do desenvolvimento vascular cerebral em zebrafish larval é descrito. Técnicas para facilitar a imagens 3D e modificar o desenvolvimento vascular cerebral utilizando tratamentos químicos também são fornecidos.
Resumo
Zebrafish são uma ferramenta poderosa para estudar a biologia do desenvolvimento e patologia in vivo. O tamanho pequeno e transparência relativa de embriões de peixes-zebra tornam particularmente úteis para o exame visual dos processos, tais como o coração e o desenvolvimento vascular. Em vários estudos recentes peixes-zebra transgénicos que expressam GFP em células endoteliais vasculares foram utilizados para a imagem e analisar as redes vasculares complexos no cérebro e na retina, utilizando microscopia confocal. As descrições são fornecidos para preparar, tratar e imagem embriões de peixes-zebra que expressam reforçada proteína verde fluorescente (EGFP), e depois gerar renderings 3D abrangentes do sistema vascular cerebral. Protocolos incluem o tratamento de embriões, imagiologia confocal, e protocolos de fixação que preservam EGFP fluorescência. Além disso, dicas úteis sobre como obter imagens de estruturas vasculares cerebrais, tais como a remoção do olho sem tecido neural nas proximidades prejudicial de alta qualidade são fornecidos. Armadilhas potenciaiscom imagem confocal são discutidas, junto com os passos necessários para gerar reconstruções 3D a partir de pilhas de imagens confocal usando livremente disponível software de código aberto.
Introdução
Peixe-zebra fornecer um sistema poderoso para estudar a biologia do desenvolvimento, e da transparência relativa dos seus embriões é passível de estudos imagiológicos 1. O peixe-zebra foi agora utilizado como modelo para o desenvolvimento dos vertebrados durante décadas. Teleósteos, incluindo peixe-zebra, possuem um sistema vascular vertebrados simplificada que não tem homólogo razoável em invertebrados. O sangue é bombeado a partir da câmara anterior de uma de duas câmaras do coração através das guelras, onde é oxigenado. O sangue das brânquias converge na aorta dorsal e passa por artérias que se ramificam em vasos cada vez menores, eventualmente atingindo capilares em tecidos de órgãos. Dentro capilares oxigênio é liberado e dióxido de carbono é absorvido. No lado venoso dos capilares sangue flui para veias cada vez maiores e finalmente é arrastado para a câmara posterior do coração, onde o ciclo repete-se.
Um peixe-zebra adulto pode colocar 200 ou mais ovos de cada vez, e once fertilizados, eles desenvolvem rapidamente 2. Dentro de um dia, o eixo do corpo é bem desenvolvida, incluindo os músculos que movem o contrato e embrião em torno de dentro da membrana coriônica. De 2-7 dias pós-fertilização (dpf) a maioria dos sistemas do corpo se desenvolver, incluindo olhos e um sistema nervoso central que possa coordenar nadando em direção a comida ou abrigo da luz brilhante. Até 7 embriões dpf são suficientemente pequenas para permitir a visualização em microscopia. Linhagens transgênicas que expressam proteínas fluorescentes podem ser visualizados com microscopia confocal ou fluorescência. Imagem confocal pode ser emparelhado com software open-source 3 para criar desenhos em 3D de estruturas vasculares completos em embriões de peixe-zebra que fornecem uma perspectiva de biologia de sistemas de desenvolvimento vascular. Estudos relacionados com mudanças na complexidade vascular e cerebrovascular serão beneficiados com este protocolo, uma vez que permite uma análise de nível de sistemas de redes vasculares 4,5. Uma compilação de métodos e recursos são fornecerd para permitir a adoção fácil e destas técnicas para estudos que exigem imagens de estruturas vasculares em peixes-zebra embrionários. A eficiência de custo do peixe-zebra como modelo animal está combinando com as tecnologias de imagem emergentes para fornecer novas plataformas que permitam avaliar os efeitos angiogênicos de vias moleculares no desenvolvimento de vertebrados e homeostase.
Protocolo
1. Zebrafish Pecuária, Geração Embryo e Tratamento
- Realizar os seguintes protocolos de peixe-zebra, sob a orientação de um cuidado com os animais e uso comitê institucional (IACUC) e dentro das diretrizes de cuidados de animais do NIH ou outros órgãos / diretrizes regulamentares.
- Estirpes de peixe-zebra que expressam proteínas fluorescentes em tecidos específicos, células ou órgãos estão disponíveis a partir do Centro de Recursos Internacional de peixe-zebra (Zirc). Por exemplo, Tg (KDR: EGPF) s843 expressam GFP em células endoteliais vasculares, 6, os quais podem ser usados para produzir estruturas vasculares 3D completa como mostrado neste protocolo. Outras linhas de zebrafish transgênicos estão disponíveis a partir Zirc.
- Casa peixe-zebra adulto em um sistema de aquicultura apropriado que monitora pH, salinidade, temperatura, oxigênio dissolvido, luz e outros fatores ambientais 7. O peixe-zebra mostrado aqui foram alojados em um sistema Aquaneering Inc. (San Diego, CA) a 28,5 ° C, com uma lig 14 horasciclo escuro ht/10 hora. Alimente adulto zebrafish uma dieta equilibrada de camarão de água salgada e NRD 4/6 Alimentos para peixe (Brine Shrimp direta, Ogden, Utah).
- Adulto masculino e feminino de peixe-zebra em idade reprodutiva devem ser alojados separadamente para aumentar acasalamento bem-sucedido.
- Estimular a postura e fertilização, colocando fêmeas (2-4) e machos (4-6) juntos em um recipiente de acasalamento que tem um fundo de malha com buracos grandes o suficiente para os ovos a cair completamente, mas pequeno demais para os adultos de peixe-zebra para passar . Configure acasalamentos na noite anterior; ovos são colocados perto do amanhecer, normalmente, enquanto o ciclo de luz diurna aumenta lentamente na intensidade (madrugada). Entrada para os ovos na parte inferior do recipiente de acasalamento a cada 15-30 minutos.
- Coleta de ovos usando uma peneira de malha e limpo com tampão E3 (mM NaCl 5, KCl 0,17 mM, 0,33 mM de CaCl2, 0,33 mM MgSO 4). Transferir os ovos para 100 mm de placas de cultura de cheios com tampão de armazenamento e E3 em uma incubadora de 28 ° C.
- Para estudar os produtos químicos que alteram a cerebrovascular ramificação adicionar concentrações químicas desejadas. Por exemplo ramificação neovasular pode ser induzida com inibidor γ-secretase (GSI IX/DAPT/N- [N-(3,5-Difluorophenacetyl-L-alanil)]-S-éster phenylglycinet-butil) solubilizado em DMSO 4, a partir de 24 fertilização horas após (hpf). Pelo que os embriões de ponto de tempo ainda estão dentro do córion, e muitos produtos químicos podem passar por ela 8. Se uma condição de tratamento tem neurais ou motoras efeitos que podem prejudicar a capacidade de embriões para se libertar do córion, em seguida, os embriões devem ser de-chorionated entre 24 e 48 hpf, o que pode ser feito com o auxílio de pinças de pronase 2. Embriões mostrados nas imagens fornecidas foram dechorionated agarrando suavemente o córion com duas pinças afiadas e rasgá-lo aberto.
- Se necessário / desejado, a formação de pigmento pode ser inibida através da adição de 0,003% de N-feniltioureia (PTU) para o tampão de E3 em 24 hpf.
2. Confocal de Cerebrovascular StructUres em Fixed embriões Zebrafish
- Sacrifício embriões em 250 mg / L tricaina metanossulfonato, e, em seguida, fixar-lhes por imersão em 2-4% de paraformaldeído durante a noite a 4 ° C. Os recipientes com embriões fluorescentes devem ser embrulhados em papel alumínio. Uma vez fixo, embriões devem ser armazenadas em PBS a 4 ° C até ser fotografada - EGFP intensidade de fluorescência se torna menos resolvido depois de cerca de uma semana, mas a morfologia (como visto em campo brilhante) é preservada por muito mais tempo.
- Prepare-se para montar o embrião removendo primeiro um olho usando uma agulha de tungstênio afiadas. Cortar o tecido em torno de ligar o primeiro olho depois cortar os músculos, e finalmente cortar o nervo óptico para deslocar o olho. (Nota: Se remover imagiologia ambos os lados é desejada ambos os olhos.)
- Uma vez que o olho é removida da montagem, o embrião de uma lamela com uma gota de 3% de metilcelulose. Orientar o embrião de modo que o lado com o olho removido é virada para a lamela e é o mais próximo do vidro quanto possível. Cubra todo o embrião com metillcellulose para evitar a dessecação durante o exame.
- Imagem do embrião montado imediatamente usando um microscópio confocal invertido equipado com uma alta qualidade objectiva de 20x Plano Apo (abertura numérica = 0,75 ou melhor). Esta configuração é preferível a um microscópio invertido que não exigiria ensanduichando o embrião entre dois planos de vidro, e pressionando o embrião contra o tampo de vidro.
- Colete fatias ópticas em 1 mícron incrementos usando um ajuste de abertura médio ou grande. Passos maiores de 2,5 mM podem também ser usados, mas pode ser mais difícil de determinar a ordem espacial dos objectos mais pequenos. As pequenas aberturas produzir detalhes mais nítidos, mas os exames mais necessários podem descorar EGFP e também limitar a profundidade das imagens no embrião que pode ser alcançado. Um microscópio confocal permite a imagem a meio caminho através de um embrião.
- Se imagens de todo o peixe é desejada, remover os dois olhos no início (ver nota no passo 3.2), gire o embrião após imaging de um lado e repetir os passos 2,3-2,5 para o lado oposto.
3. Reconstrução 3D de Embryonic Zebrafish Cerebrovasculature
- Use a distribuição Fiji 3 de open source ImageJ (http://fiji.sc), que é otimizado para desenhos em 3D, de forma gratuita, e compatível com PC, computadores Mac e Linux.
- Importar pilhas confocal para Fiji, indo para Plugins> loci> BioFormats Importador 9 em seguida, selecione o arquivo confocal, por exemplo name.ids para pilhas Nikon (Figura 2A). Selecione Exibir pilha com o modo hyperstack, Cor: tons de cinza, verifique autoscale, verifique canais divididos.
- Essas seleções abrirá quatro painéis de canais separados; para EGFP apenas um será necessário, geralmente a terceira para baixo. Feche os outros três painéis (vermelho, azul e alfa) deixando a imagem de 16 bits com um nome longo seguido por C = 1 (Figura 2A).
- Ajuste o limiar de digitalização que a imagem usando o rolo tab ao longo do fundo para encontrar uma fatia que tem a região ou estrutura de interesse, em seguida, vá em Image> Adjust> Threshold (Figura 2C).
- No painel que vem para cima, deslize a barra superior (nível de preto) para a esquerda, de modo que a estrutura pode ser visto muito bem sobre o fundo, e deixar a lâmina inferior (nível de branco) onde é (Figura 2D). Selecione B & W, selecione Fundo escuro. Não selecione Threshold calcular para cada imagem, a menos que diferentes ajustes são necessários para cada fatia, selecione Fundo preto. Este processo cria uma nova imagem de 8-bit.
- ATENÇÃO: Limite não pode ser desfeita ou salvos em ImageJ, então a pilha confocal terá de ser recarregado cada vez que é necessária uma mudança. Anote os números e tentar diferentes configurações até que o resultado desejado seja alcançado.
- Ir para Plugins> 3D Visualizador> Threshold 0, fator 1 (melhor) ou 2 (bom) Reamostragem, desmarque as caixas de cores vermelho e azul para fazer uma saída 3D verde - caso contrário, will produzir uma prestação branco - selecione Aplicar (não automático) (Figura 2E).
- Girar, girar e ampliar a imagem em 3D usando o mouse e os controles do teclado (Figura 2F).
- Salve as imagens estáticas em qualquer ponto usando a opção de captura no menu. O tamanho da caixa de imagem na tela determina dimensões de pixel da imagem produzida por isso, se uma imagem de alta resolução é desejado fazer a caixa maior, arrastando o canto inferior direito.
- Crie um filme fiação 3D, selecione Exibir> Gravar rotação graus 360 (Figura 2G). Padrões de rotação para 2 graus por passo, mas pode ser alterado para 5 graus, por exemplo, que criará tamanhos de arquivo muito menores, mas pode adicionar jerkiness para a animação.
- Salve o arquivo em um dos vários formatos disponíveis para visualização posterior com players de mídia, fazer o upload para a Internet, ou usar em apresentações do PowerPoint. O open source media player, VLC ( http :/ / www.videolan.org / vlc / index.html), é gratuito e manipula esses vídeos muito bem.
Resultados
Reconstrução 3D de estruturas vasculares fornece uma perspectiva global e visualmente interessante de desenvolvimento do peixe-zebra. Métodos Figuras 1 e 2 mostram como eles normalmente feito. Figura 3 mostra vários ângulos de estruturas vasculares num 6 dpf embrião do peixe-zebra que expressa GFP em células endoteliais. Com uma cor verde ou branco sólido que pode ser difícil de avaliar a intensidade de sinal; pseudo-coloração fornecer intensidade de imagem a partir de uma tabela de look-up e permite uma melhor percepção de profundidade quando as estruturas se sobrepõem. Um exemplo de um pseudo-colorida imagem 3D da vasculatura num 6 dpf peixe-zebra é fornecida na Figura 4. Imagiologia de fluorescência de embriões vivos podem ser usados para estudar as características fisiológicas que incluem olho e movimento do corpo, e a actividade cardíaca. Figuras 3 e 4 mostra os resultados representativos obtidos com estes métodos, utilizando a linha de peixes-zebra transgénicos descrito. Resolução de imagem depende das características de microscópio, mas o brilho do sinal de EGFP é suficiente para uma boa qualidade de imagem, com a maioria dos sistemas comerciais. Reconstrução e prestação de representações 3D é consistente e opções dentro deste software open-source fornecer consistentemente bons resultados.
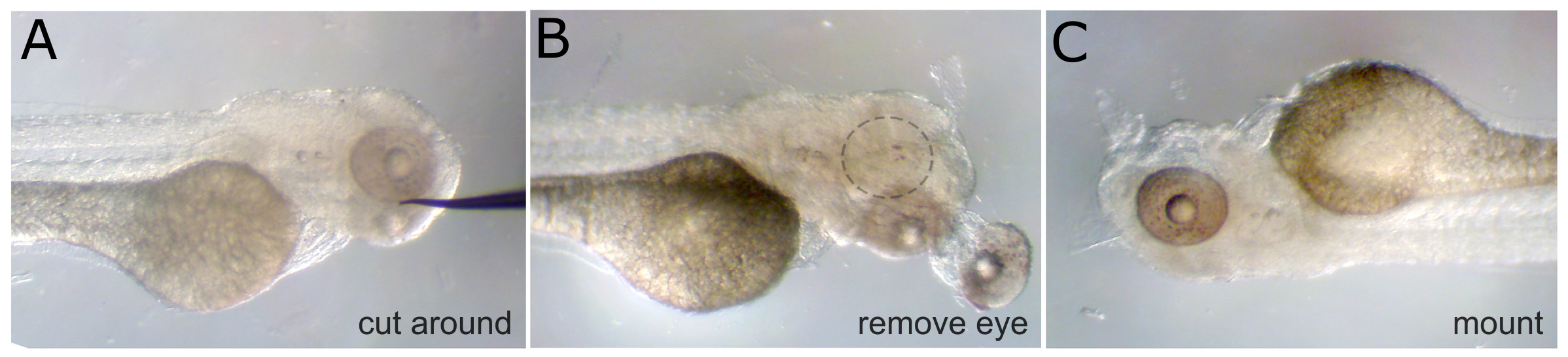
Remoção Figura 1. Dos olhos. A) Um embrião fixa 3 dpf com uma necessidade de tungsténio posicionado ao lado do olho. O tecido é cortado em torno do olho a partir desta posição. B) O olho é cai e os músculos subjacentes e oculares são cortadas do nervo óptico. A órbita vazia é indicado com círculo tracejado. C) O mesmo embrião é entregue e montado com metil-celulose, com o olho intacto voltado para cima. hres.jpg "target =" _blank "> Clique aqui para ver uma versão maior desta figura.
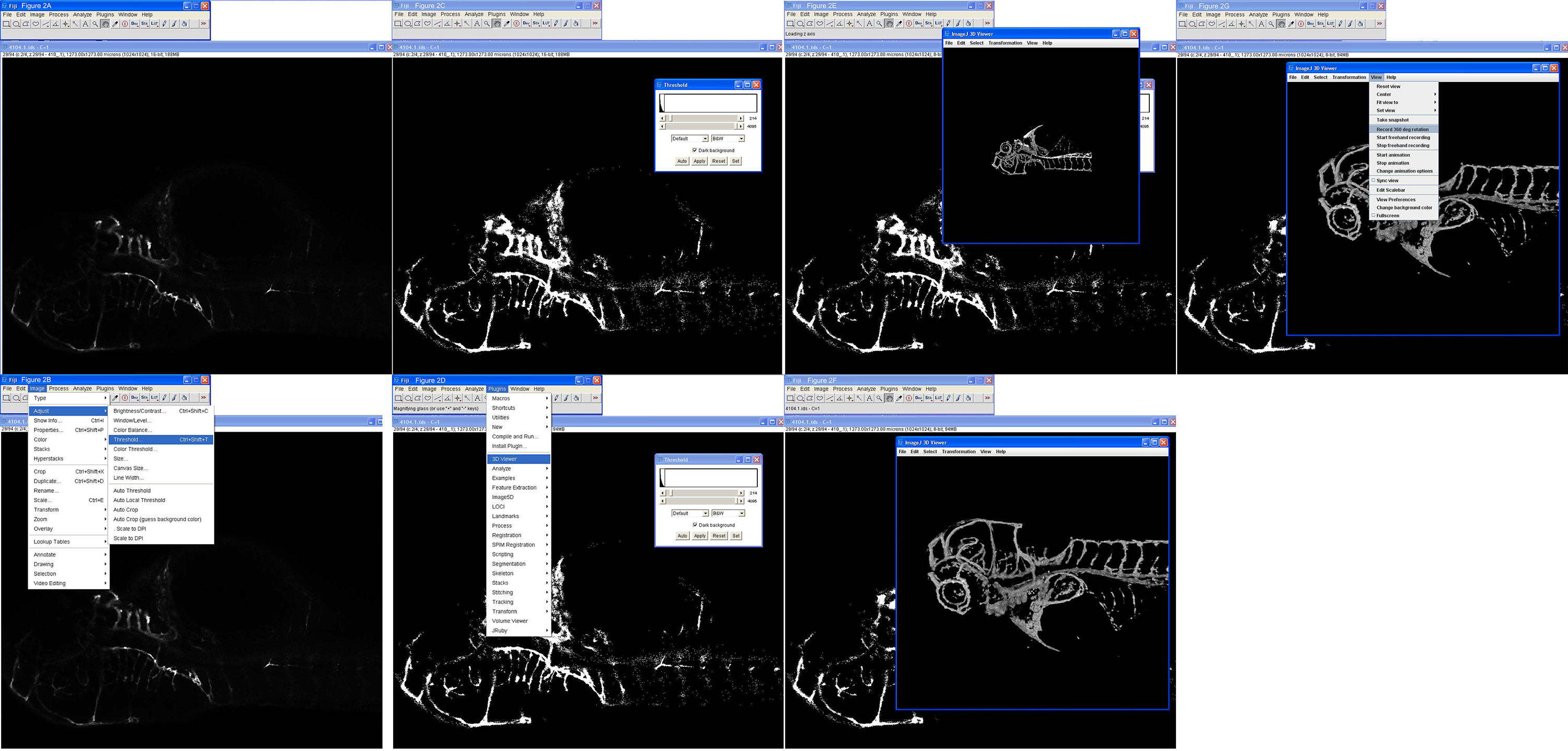
Figura 2. Passo-a-passo de reconstrução 3D de uma pilha de imagens confocal. A) Abra o arquivo (4104.1.ids) carregado dentro Fiji usando Plugins> LOCI> Bioformat selecionar. B) Depois de encontrar uma fatia com a região de interesse, de ajuste de limite é selecionada como mostrado. C) Threshold é ajustado para 214 usando o topo deslizante e aplicar é selecionado. espectador D) 3D é chamado como mostrado. E) A reconstrução 3D é mostrado de um peixe-zebra com o olho intacto, para orientação. F) A imagem foi ampliada e girado. G) Um filme de rotação de 360 graus é feita como mostrado. res.jpg "target =" _blank "> Clique aqui para ver uma versão maior desta figura.
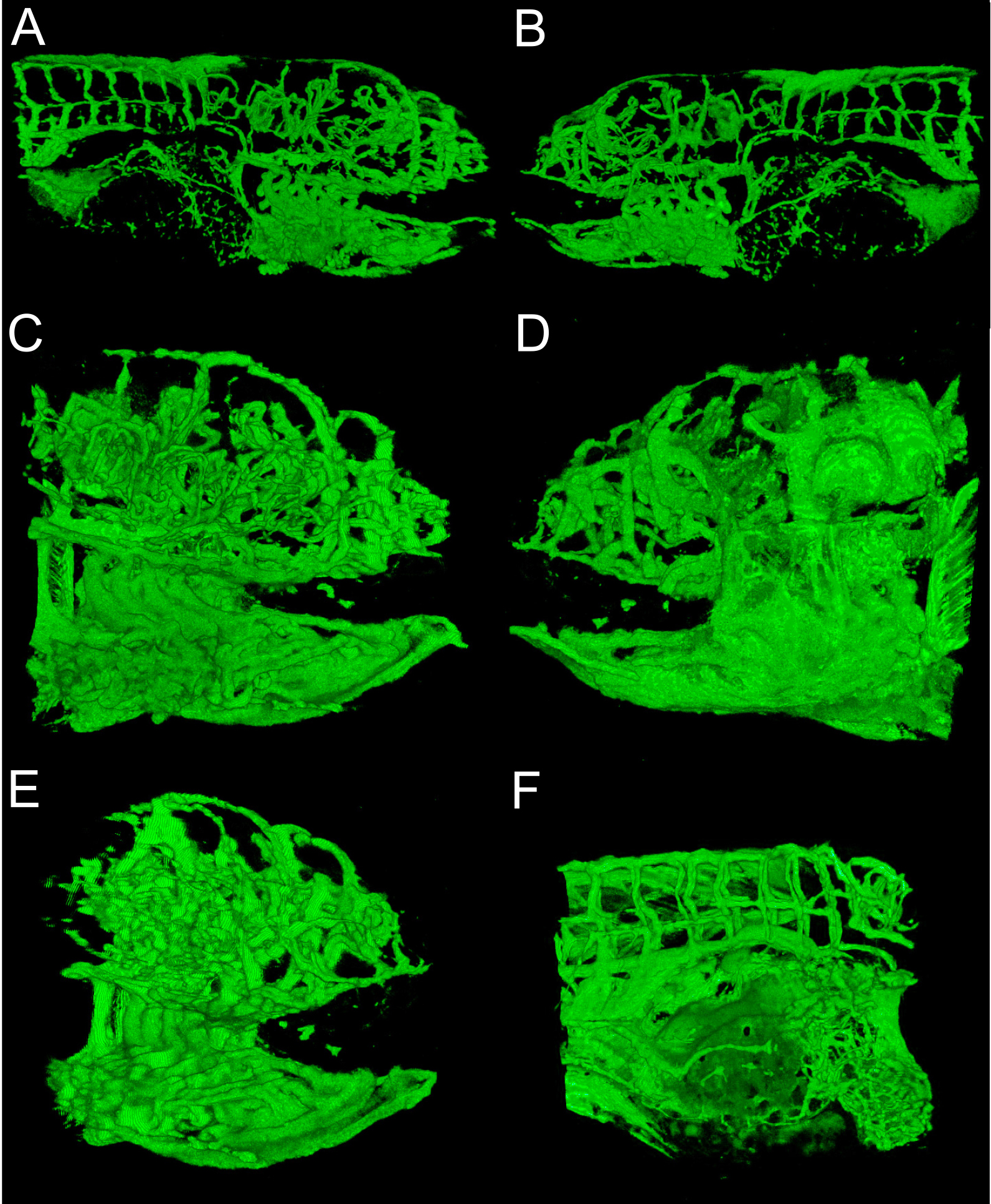
Figura 3. Perspectivas de reconstrução 3D. A) perspectiva Medial de 6 dpf embrião fotografada com 10x objetivo, a boca fica do lado direito, e não brânquias dentro da boca. B) lateral do mesmo embrião, nota fin é um laço no meio. C) O mesmo embrião fotografada com 20x objetiva, perspectiva medial, resolução de emalhar nota. D) perspectiva lateral 20x de imagem objetiva. A barbatana é na margem direita do painel. E) vista ântero-medial de 20x de imagem objetiva, guelras de notas dentro da boca F) Abdômen do mesmo embrião fotografada com um objetivo de 20x, a cabeça para a direita.. Nota vasculatura no saco vitelino no canto inferior direito.jove.com/files/ftp_upload/50417/50417fig3highres.jpg "target =" _blank "> Clique aqui para ver uma versão maior desta figura.
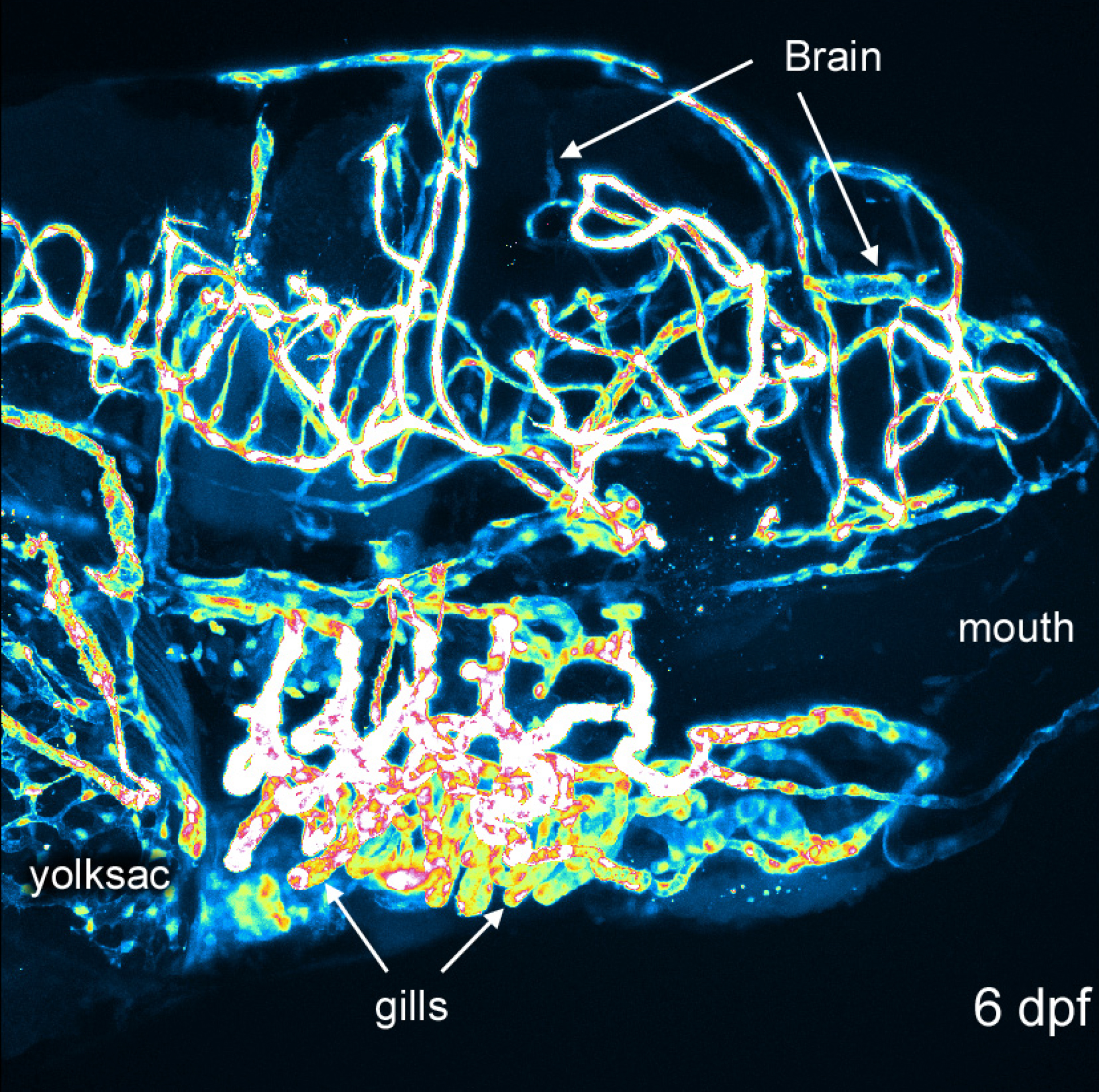
Figura 4. Diferenças de intensidade em 6 dpf embrião. Imagem de uma reconstrução 6 dpf usando um look-up-table pseudo para a intensidade do sinal. Boca, cérebro, brânquias e saco vitelino são rotulados para orientação. Clique aqui para ver uma versão maior desta figura.
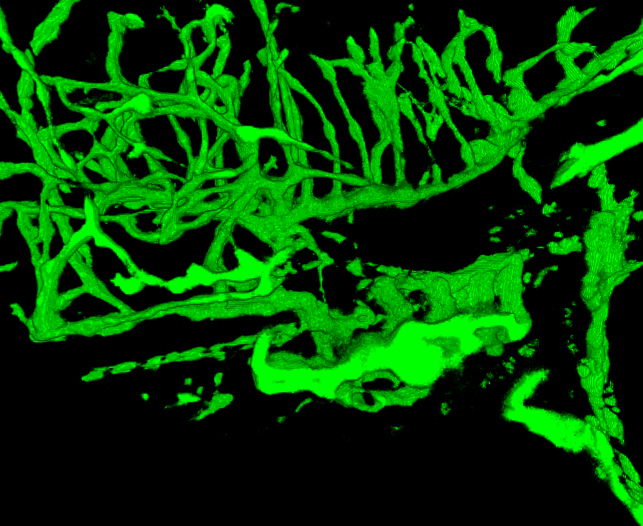
Figura 5. Filme do sistema vascular reconstruída em um peixe-zebra 4 dpf. O peixe foi fotografada em 2,5 mM. As imagens foramde imagiologia metade do embrião. Comparar estruturas vasculares com estruturas em um peixe-zebra tratado GSI fornecidos na Figura 6. Nota a menor densidade de vasos sanguíneos na cabeça e guelras maiores. (Veja o "Zfish_spin.avi" arquivo suplementar em Downloads)
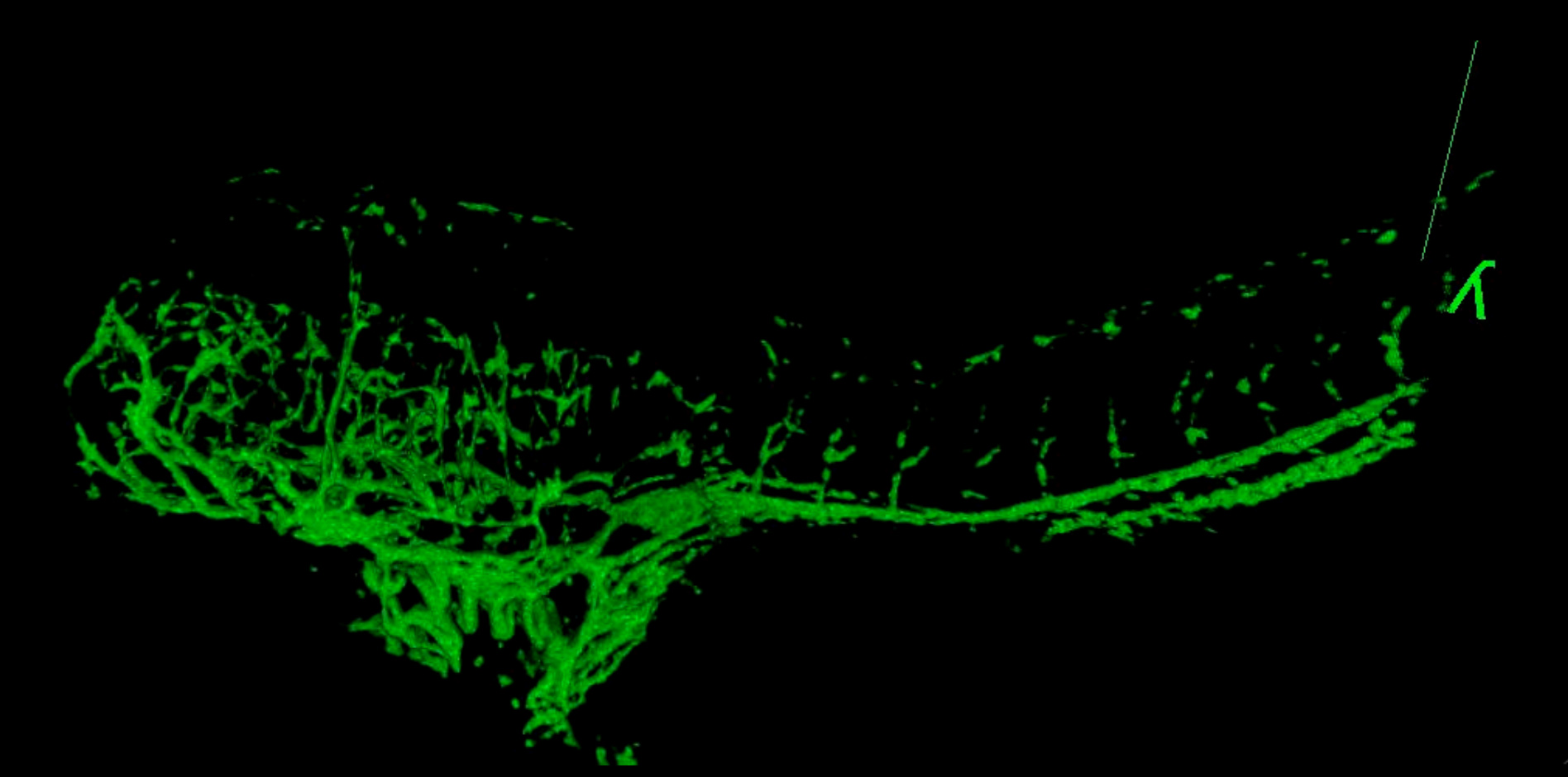
Figura 6. Filme 3D de sistema vascular em um embrião tratado GSI a 4 dpf. O peixe foi fotografada em 2,5 mM através de lateral para a linha média. Comparar estruturas vasculares com o controlo de 4 dpf peixe mostrado na Figura 5. A parte traseira arqueada e tamanho menor são típicos em embriões tratados com este produto químico. (Veja o "GSI-treated_4dpf_fish.avi" arquivo suplementar em Downloads)
Discussão
Os métodos descritos aqui fornecer uma base para os estudos visuais do sistema vascular no desenvolvimento do peixe-zebra. Os espécimes vivos pode ser usado para avaliar os parâmetros fisiológicos, como freqüência cardíaca e volume de ejeção cardíaca, enquanto as amostras fixas podem ser usados para confocal de alta resolução de imagem. Drosophila e C. elegans permitir a imagiologia de todo o corpo, mas de peixe-zebra são animais vertebrados e fornecer um modelo útil para tecidos de vertebrados, incluindo um sistema vascular forrado de célula endotelial. Estes estudos podem incorporar linhagens transgênicas significativas e recursos genômicos da comunidade de pesquisa do peixe-zebra. Reconstrução 3D e renderização de imagens confocal de peixe-zebra embrionária, como descrito aqui, permitir uma abordagem de biologia de sistemas de ramificação vascular e densidade de vasos sanguíneos que não é possível com modelos animais maiores, como ratos e camundongos. Além disso, como amniotas zebrafish desenvolver em um ambiente modificável (tampão E3), onde se pode facilmente adicionar chemicals que inibem enzimas específicas ou outros processos que afetam o desenvolvimento vascular. A concentração eo tempo de entrega química pode ser alterada, permitindo que o pesquisador condições de tratamento para afinar.
1. Modificações e solução de problemas
Modificações a este sistema pode incorporar linhas de peixes-zebra transgénicos que expressam proteínas fluorescentes EGFP ou outros numa variedade de tecidos, órgãos ou de padrões específicos da região 10. Além disso, a análise de alterações neovasculares da retina de peixe-zebra foi recentemente publicado em 5. Problemas com pigmentação em embriões de peixe-zebra mais velhas e adultos pode ser compensada pelo cruzamento com linhagens transgênicas que não produzem pigmentos escala ou pigmentar da retina. Problemas com fluorescência reduzida tipicamente resultam de condições inadequadas de fixação. Paraformaldeído (4%) durante 1 dia é óptimo, mas fixadores mais fortes, tais como o glutaraldeído, tetróxido de ósmio ou álcool, podedestruir EGFP fluorescência. Após a fixação, os embriões devem ser mantidos em PBS a 4 ° C e sempre protegida da luz solar directa.
2. Limitações desta técnica
A qualidade e resolução de desenhos em 3D produzidos com este protocolo dependem da qualidade das imagens geradas. A penetração de luz através destes embriões se limita ao plano médio-sagital utilizando um microscópio confocal padrão. Este aspecto da imagem limita a profundidade da imagem em embriões mais velhas e adultos, mas os sistemas de microscopia multi-fotão mais avançados permitem a imagem em maiores profundidades.
3. Significado no que diz respeito aos métodos existentes
Este protocolo proporciona uma abordagem para a análise de redes dos vasos sanguíneos em um nível de sistemas que podem incorporar um animal inteiro. Representações anteriores de tais dados, muitas vezes invocada série de imagens dispostas em conjunto, mas a renderização 3D proporciona uma melhor resolução da relação espacialções envolvidas.
4. Aplicações futuras
Novos desenvolvimentos na imagem e processamento de tecidos irá proporcionar muitas novas aplicações para esses métodos que podem incluir fazendo embriões mais velhas ou adultos transparente 11-14. Maior transparência permitirá aumentar significativamente a penetração nos tecidos por lasers confocal e multi-fotão. Além disso, como a velocidade de câmeras e tubos fotomultiplicadores aumentá-lo em breve poderá ser possível a produção de desenhos em 3D de peixes em tempo real, proporcionando uma 4 ª dimensão de análise.
5. Passos críticos
Um passo crítico neste protocolo é a preparação para a imagem latente, que inclui a fixação adequada. Imagem deve ser feito o mais cedo possível após a fixação com os objetivos de alta qualidade que têm as melhores aberturas numéricas disponíveis. A resolução depende do sistema de imagem usado, os sistemas de tão alta qualidade são geralmente melhor. Gerando desenhos em 3D é a memória intensivapara assim mais novos, computadores high-end, com uma grande quantidade de memória e bons processadores gráficos são recomendados.
O sistema de biologia visuais aqui descrita foi optimizado para peixes-zebra transgénicos que expressam GFP em células endoteliais vasculares, embora estes métodos pode ser adaptado a embriões transgénicos que expressam a GFP, ou outras proteínas fluorescentes, em populações de neurónios, músculos, glândulas ou qualquer número de outras células. A principal vantagem em trabalhar com este sistema é a possibilidade de estudar o que está acontecendo em todo o embrião, a qualquer momento durante este período de desenvolvimento, em animais fixos e / ou ao vivo.
Divulgações
Não há nada a divulgar.
Agradecimentos
Os autores agradecem os membros passados e presentes dos nossos laboratórios que ajudaram a desenvolver essas técnicas. Financiamento parcial fornecido ao DE por um subsídio do Instituto Califórnia de Medicina Regenerativa / CIRM (RN1-00538).
Materiais
| Name | Company | Catalog Number | Comments |
| N – Phenylthiourea | Alfa Aesar, catalog #41972 | 0.2 M in E3 buffer, kept at 4 °C | |
| E3 buffer | Sigma | 5 mM NaCl, 0.17 mM KCl, 0.33 mM CaCl2, 0.33 mM MgSO4 | |
| Confocal microscope | Nikon | D-EclipseC1 on a Nikon TE-2000U | |
| Glass bottom dishes | Mat-Tek | ||
| GSI IX/DAPT | N-[N-(3,5-Difluorophenacetyl-L-alanyl)]-S-phenylglycinet-butyl ester EMD Biosciences | ||
| 24 well plates | Becton-Dickinson, cat# 351147 | BD Falcon | |
| Transfer pipettes | VWR, cat #414004-001 | VWR disposable transfer pipettes | |
| Methyl-cellulose | Alfa Aesar, cat#43146 | 3% in E3 buffer | |
| NRD 4/6 Fish food | Brine Shrimp Direct | Dried | |
| Brine shrimp | Brine Shrimp Direct | Live | |
| Tungsten wire | Small Parts # TW-016-60 | 0.016” OD | |
| Tricaine | VWR # 101107-950 | Tricaine methanesulfonate 250 mg/L in E3 buffer |
Referências
- Staudt, D., Stainier, D. Uncovering the molecular and cellular mechanisms of heart development using the zebrafish. Annu Rev Genet. 46, 397-418 (2012).
- Westerfield, M. The Zebrafish Book. , University of Oregon Press. (2007).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9, 676-682 (2012).
- Cameron, D. J., et al. Alzheimer's-related peptide amyloid-β plays a conserved role in angiogenesis. PLoS ONE. 7, (2012).
- Cunvong, K., Huffmire, D., Ethell, D. W., Cameron, D. J. Amyloid-β increases capillary bed density in the adult zebrafish retina. Invest Ophthalmol Vis Sci. 54, 1516-1521 (2013).
- Jin, S. W., Beis, D., Mitchell, T., Chen, J. N., Stainier, D. Y. Cellular and molecular analyses of vascular tube and lumen formation in zebrafish. Development. 132, 5199-5209 (2005).
- Lawrence, C. The husbandry of zebrafish (Danio rerio): a review. Aquaculture. 269, 1-20 (2007).
- Hagedorn, M., Kleinhans, F. W., Artemov, D., Pilatus, U. Characterization of a major permeability barrier in the zebrafish embryo. Biol Reprod. 59, 1240-1250 (1998).
- Schmid, B., Schindelin, J., Cardona, A., Longair, M., Heisenberg, M. A high-level 3D visualization API for Java and ImageJ. BMC Bioinformatics. 11, 274(2010).
- Opitz, R., et al. Transgenic zebrafish illuminate the dynamics of thyroid morphogenesis and its relationship to cardiovascular development. Dev Biol. 372, 203-216 (2012).
- Gleave, J. A., et al. Neuroanatomical phenotyping of the mouse brain with three-dimensional autofluorescence imaging. Physiol Genomics. 44, 778-785 (2012).
- Chung, K., et al. Structural and molecular interrogation of intact biological systems. Nature. 497, 332-337 (2013).
- Markaki, Y., Smeets, D., Cremer, M., Schermelleh, L. Fluorescence in situ hybridization applications for super-resolution 3D structured illumination microscopy. Methods Mol Biol. 950, 43-64 (2013).
- Walter, T. J., Sparks, E. E., Huppert, S. S. 3-dimensional resin casting and imaging of mouse portal vein or intrahepatic bile duct system. J Vis Exp. 68, e4272(2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados