É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Derivando o Curso momento do desembaraço glutamato com uma Análise de Deconvolução das correntes Transporter astrocitárias
Neste Artigo
Resumo
Nós descrevemos um método analítico para estimar o tempo de vida de glutamato em membranas astrocitários de registros eletrofisiológicos de correntes transportador de glutamato em astrócitos.
Resumo
A maior densidade de transportadores de glutamato no cérebro é encontrada em astrócitos. O glutamato transportadores acoplar o movimento de glutamato através da membrana com o co-transporte de Na + e 3 1 de H + e a contra-transporte de K + 1. A corrente estequiométrica gerado pelo processo de transporte pode ser monitorizado com gravações de célula inteira de patch-clamp de astrócitos. O curso de tempo da corrente registada é moldada por o curso de tempo do perfil de concentração de glutamato que astrócitos são expostas, a cinética de transportadores de glutamato, e as propriedades das membranas passivas electrotonic astrocíticos. Aqui, descrevemos os métodos experimentais e analíticos que podem ser utilizados para registar as correntes do transportador de glutamato em astrócitos e isolar o curso de tempo de recarga glutamato de todos os outros factores que moldam a forma de onda das correntes de transportador astrocíticos. Os métodos descritos aqui podem ser usados para estimar o tempo de vida of flash-uncaged e glutamato sinapticamente lançado em membranas astrocitários em qualquer região do sistema nervoso central durante a saúde ea doença.
Introdução
Os astrócitos são um dos tipos de célula mais abundante no cérebro com uma morfologia em forma de estrela e as saliências de membranas finas que se estendem ao longo do neuropil e alcançar vizinha contactos sinápticos 1,2. Membrana celular dos astrócitos é densamente embalado com moléculas transportador de glutamato 3. Sob condições fisiológicas, os transportadores de glutamato rapidamente ligar glutamato no lado extracelular da membrana e transferi-lo para o citoplasma da célula. Ao fazer isso, os transportadores mantêm a concentração basal baixa de glutamato no espaço extracelular 4. Transportadores de glutamato em finas processos astrocitários adjacentes sinapses excitatórias são idealmente posicionado para ligar glutamato liberado durante eventos sinápticos, pois difunde para longe da fenda sináptica. Ao fazer isso, os transportadores também limitar spillover glutamato para peri e regiões extra-sinápticos e em sinapses vizinhas, reduzindo a propagação espacial do sinal excitatórios no cérebro 5-7.
Transporte do glutamato é um processo eletrogênica estequiometricamente acoplado ao movimento de 3 Na + e H + 1 ao longo do seu gradiente electroquimico e ao contra-transporte de K + 1 8. Transporte de glutamato está associado (mas não estequiometricamente acoplado a) uma condutância aniônica permeável ao SCN - (tiocianato)> NO 3 - (nitrato) ≈ ClO 4 - (perclorato)> I -> Br -> Cl -> F -, não a CH 3 SO 3 - (metano-sulfonato), C 6 H 11 O 7 - (gluconato) 9-11. Ambas as correntes (estequiométrica e não-estequiométrico) podem ser gravados pela obtenção de gravações de patch-clamp de célula inteira de astrócitos, identificados visualmente sob iluminação Dodt ou infra-vermelho contraste de interferência diferencial (IR-DIC), em Agudode e fatias de cérebro 12. O componente estequiométrica da corrente associado com o transporte do glutamato através da membrana pode ser isolado utilizando CH 3 SO 3 - ou C 6 H 11 O 7 - soluções intracelulares base e pode ser evocada por glutamato flash uncaging em astrócitos 13,14, ou ativando a liberação de glutamato de sinapses vizinhas, tanto eletricamente 12 ou com um controle optogenetic alvo.
O decurso de tempo do componente estequiométrica do transportador de corrente é formada por toda a vida do perfil de concentração de glutamato na astrocíticos membranas (isto é, passe glutamato), a cinética de transportadores de glutamato, as propriedades de astrócitos membrana passiva, e durante estimulações sinápticos, pela sincronia de liberação de glutamato através das sinapses ativadas 13. Aqui vamos descrever em detalhes: (1) uma aprox experimentaloach para isolar o componente estequiométrica de correntes de transportador de glutamato a partir de células inteiras gravações de patch-clamp de astrócitos de rato utilizando fatias de hipocampo agudas como por exemplo a preparação experimental, (2) uma abordagem analítica para derivar o tempo de curso do apuramento glutamato destas gravações 13, 14. Estes métodos podem ser usados para registar e analisar as correntes do transportador de glutamato a partir de astrócitos em qualquer região do sistema nervoso central.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. Slice Preparação
- Prepare uma solução de 500 ml de corte / armazenamento contendo (em mM): 119 NaCl, 2,5 KCl, 0,5 de CaCl2, 1,3 MgSO4 · 7H 2 O, 4 MgCl2, 26,2 NaHCO3, 1 NaH 2 PO 4, e 22 de glucose, 320 mOsm, pH 7,4
- Usar um copo de 250 ml para preparar uma câmara de imersão para as fatias, encher com 200 ml de solução de cortar / armazenamento, aquecê-lo num banho de água a 34 ° C e borbulhar com 95% de O2, 5% de CO 2.
- Manter a solução remanescente que corta / armazenamento numa garrafa de vidro a 4 ° C.
- Utilização de um adesivo de cianoacrilato para anexar um pequeno bloco de agar (6%, preparado em ACSF) no suporte de amostras vibratome e armazená-lo a 4 ° C.
- 30 min antes de iniciar o corte, coloque o frasco de vidro contendo a solução de armazenamento / corte em um balde com gelo e borbulhar com 95% de O2, 5% de CO 2.
Observação: A velocidade e precisão são fundamentais para as etapas descritas a seguir dissecação.
- Anestesiar o rato (P14-21, C57BL / 6) com halotano / isoflurano (isoflurano foi relatado para aumentar a captação de glutamato astrocítica 15), decapitá-lo e mergulhar a cabeça em um copo de 50 ml contendo solução oxigenado / storage, o frio de cortar.
- Realizar a dissecação do cérebro em um bloco de gelo envolto com toalhas de papel e armazenadas a -20 ° C.
- É um bisturi para fazer uma incisão na pele sagital médio no lado dorsal da cabeça, da extremidade frontal ao caudal, e expor o crânio.
- Coloque a lâmina de corte inferior de um pequeno par de tesouras cirúrgicas no buraco occipital e fazer dois cortes, para a esquerda e do lado direito (45 °).
- Cortar o crânio ao longo da linha média sagital, a partir da cauda para a extremidade dianteira.
- Remover o cérebro com uma espátula e mergulhá-lo em oxigenado, frio corte / storage solução quediante.
- Com um bisturi, fazer cinco cortes para: (1) remover os bulbos olfatórios e do córtex frontal, (2) retirar o cerebelo, (3) retirar a esquerda e (4) lobos temporais direito; (5) separar os dois hemisférios cerebrais com um corte sagital médio.
- Dab as duas partes do cérebro com toalhas de papel para remover qualquer solução em excesso.
- Cole a superfície lateral de cada secção do cérebro para a placa de base vibratome frio do lado dorsal do cérebro deve estar voltada para a lâmina vibratome, o lado ventral do cérebro deve estar em contacto com o bloco de agar, para longe da lâmina vibratome.
Nota: para obter as fatias mais alta qualidade, é importante que as duas partes do cérebro estão firmemente colado à placa de base vibratome. Para fazer isso, o uso de um adesivo de cianoacrilato que não é demasiado líquido e que não seque demasiado depressa. - Fixe a placa de base vibratome para a câmara de dissecação, definir o dia fatiaickness a 250 mM e ajustar a largura da lâmina de execução. Prossiga com a corte.
Nota: se tudo está correctamente orientado, o vibratome deve ser cortando fatias a partir da parassagitais dorsal e ventral, para a partir da média para o lado lateral do cérebro. - Uma vez que a lâmina tenha passado através do córtex e hipocampo, usar um bisturi para cortar o córtex / hipocampo do mesencéfalo e colocar cada fatia na câmara de imersão a 34 ° C.
- Descarte o primeiro par de fatias. Tipicamente, 12 fatias (250 um de espessura) pode ser obtido a partir de um cérebro de rato P14-21.
- Manter as fatias a 34 ° C durante 30 minutos e deixar arrefecer até à temperatura ambiente durante 30 min antes de as utilizar para as gravações electrofisiologia.
2. Identificação astrócitos e gravações
- Prepara-se uma solução interna contendo (em mM): 120 KCH 3 SO 3, 10 EGTA, 20 HEPES, 2 MgATP, 0,2 NaGTP,5 QX-314Br, e 5 de NaCl, 290 mOsm, pH 7,2.
- Prepara-se uma solução de gravação extracelular contendo (em mM): 119 NaCl, 2,5 KCl, 2,5 de CaCl2, 1,3 MgSO4 · 7H 2 O, 1 MgCl2, 26,2 NaHCO3, 1 NaHPO 4 e 22 de glucose, 300 mOsm, pH 7,4 , saturado com 95% O2, 5% de CO 2.
- Adicionar os seguintes fármacos para a solução de gravação extracelular, para bloquear a activação de GluA, Glun, mGluRII, mGluRIII, GABA A, o GABA B, e os receptores de adenosina A1 (em mM): 10 2,3-Dioxo-6-nitro-1, 2,3,4-tetra-hidrobenzo [ƒ] quinoxalina-7-sulfonamida sal dissódico (NBQX), 10 (RS) -3 - (2-carboxypiperazin-4-il)-propil-1-fosfónico (CPP), (2S )-2-amino-2-[(1S, 2S)-2-carboxycycloprop-1-il] -3 - (Xanth-9-il) propanóico sal dissódico do ácido (LY341495), 100 (R, S)-α- metilserina-O-fosfato (DIP), 100 picrotoxina, 5 3 - [[(3,4-diclorofenil) metil] amino] propil] dietoximetil) fosfínico (CGP52432), 18-ciclopentil-1 ,3-dipropilxantina (DPCPX).
- Ajustar a temperatura da solução extracelular na câmara de gravação, as temperaturas típicas situam-se entre 34-36 ° C.
- Prepare-se eletrodos de patch-clamp de borosilicato capilares de vidro (R ≈ 2,5 mohms) usando um dual-fase, vidro micro-pipeta extrator.
- Pegue uma das fatias e coloque-o na câmara de gravação. Segurá-lo com uma harpa de metal feito com fio de platina e cordas de nylon.
- Inspecione visualmente as fatias sob Dodt iluminação ou IR-DIC. Os astrócitos podem ser identificados pelo seu órgão de células pequenas (Ø = 10 mm) e núcleo proeminente (Figura 1).
- Para estímulos sinápticos, coloque um eletrodo de aço inoxidável bipolar, ~ 100 mm de distância do astrócitos que pretende corrigir.
- Corrigir o astrócitos e quebrar na configuração de célula inteira pela aplicação de uma sucção muito gentil.
Nota: Os astrócitos normalmente têm baixa resistanc entradae (~ 10 M), o potencial de membrana em repouso hyperpolarized (~ -90 mV), e nenhuma atividade de fuzilamento. Os astrócitos são mantidos em seu potencial de membrana em repouso durante todo o experimento em modo de tensão-clamp (ou seja, a corrente de retenção deve ler 0 aa). Antes de cada estimulação, um passo de 10 ms hiperpolarizante tensão (-3 mV) é usado para monitorizar a resistência em série e de entrada do astrócito. - Descartar as gravações se as alterações da resistência da série> 20% ou, se o potencial de membrana se torna despolarizada astrócitos. O potencial da membrana de astrócitos pode ser medido diretamente, passando de tensão-clamp para o modo atual-clamp. Como alternativa, enquanto em modo voltage-clamp, o potencial de membrana pode ser controlada pela leitura do valor do potencial de realização que resulta em 0 pA corrente de retenção.
- Se forem empregados estímulos sinápticos, os estímulos alternados individuais e pares (por exemplo, 100 ms de intervalo), a cada 10-20 seg.
- Para UV experim fotóliseentos, ligar uma lâmpada de Xe uncaging à porta do microscópio de epifluorescência, e adicionar o composto enjaulados à solução extracelular. Transportador de corrente de 100 pA ~ amplitude pode ser obtido quando flash uncaging 100 uM MNI-L-glutamato em todo o campo de visão (Ø = 662,5 mM quando utilizando uma objectiva de 40X 14). Estímulos alternados com o caminho da luz aberta e bloqueada, cada 10-20 seg.
- Evocar transientes glutamato e correntes transportador de registo, em condições de controlo e na presença de uma concentração sub-saturante do glutamato transportador antagonista de D, L-treo-β-Benzyloxyaspartic ácido de amplo espectro (TBOA, 10 uM), para reduzir a amplitude da corrente transportador para, pelo menos, 30% do seu valor de controlo (ver secções 4, 5), ou na presença de uma elevada concentração de TBOA (50-100 uM), para bloquear as correntes do transportador completamente e isolar o sustentada K +-corrente (ver secção 3) .
3. PharmacIsolamento ological do sustentado K +-corrente
- Grave astrocíticos correntes em condições de controlo e na presença de um nível elevado, a concentração saturante de TBOA (50-100 uM).
- Média de pelo menos 20 varrimentos em TBOA (50-100 uM).
- Coloque os traços médios obtidos em 3.2 com a função:
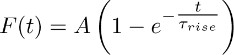
Nota: o componente TBOA insensível (isto é, aquele que é registada na presença de TBOA (50 - 100 um)) representa a constante K +-corrente. O decurso de tempo é aproximada pela função monoexponencial descrito acima. - Repita este ajuste em diferentes astrócitos e obter um valor médio de Τ origem (ou seja, o tempo médio de aumento sustentado do K +-corrente (ver seção 5)).
4. Eusolation da Parcela Facilitado das correntes Transporter sinapticamente-ativada (fSTCs)
- Média de pelo menos 20 varrimentos obtidos com estímulos emparelhados, em condições de controlo e em TBOA (10 mM) (Figura 2a esquerda).
- Média de um número idêntico de varrimentos obtidos com correntes individuais, em condições de controlo e em TBOA (10 mM) (Figura 2a meio).
- Compare a amplitude da resposta média atual para o degrau de tensão mV -3 nos quatro traços médios (controle de pulso único, controle pareado-leguminosas, TBOA pulso único, TBOA emparelhado-pulsos).
- Se a amplitude da resposta de corrente é a mesma em todos os quatro traços, prosseguir para o passo 4.7.
- Se a amplitude da resposta média de corrente é diferente em qualquer uma das quatro traços, verificar que todos os traços individuais eram adequadas para serem incluídas em média.
- Se a amplitude da corrente média é diferente em qualquer uma das quatro traços, mas todos emvestígios dividual são apropriados para serem incluídos na média, verificar que, em cada traço do tamanho das escalas FSTC linearmente com o tamanho da resposta da corrente do passo de teste de tensão. Se este for o caso, dimensionar todos os vestígios com relação um ao outro de modo que as respostas actuais para o passo de tensão do teste são todos iguais em amplitude.
Nota: as condições de gravação descrito aqui (ie intracelular CH 3 SO 3 - ou C 6 H 11 O 7 -), estímulos sinápticas de axônios excitatórios geram correntes astrocitárias formas de onda complexas constituídas por uma corrente rápida elevação transitória estequiométrica interior e uma lenta -crescente, sustentada dentro K +-K + atual refletindo re-equilíbrio no espaço extracelular seguindo propagação do potencial de ação ao longo de axônios vizinhos. É fundamental remover esta sustentada K +-corrente, como qualquer corrente residual conduziria a umsuperestimar de vida glutamato. - Subtrair o traço médio obtido com estímulos individuais do traço médio obtido com estímulos emparelhados (Figura 2a direita). Este passo permite que a estequiométrica e isolando o sustentada K +-corrente evocada pelo segundo estímulo.
- Deslocar o rastreio média obtida com estímulos por um único intervalo de tempo que coincide com o intervalo inter-pulso utilizada para entregar-pulsos emparelhados (isto é, 100 ms) (Figura 2b).
- Subtrair o tempo mudou resposta média obtida com estímulos individuais a partir da resposta média para o segundo estímulo obtido em 4.7 (Figura 2c). Este passo facilitado isola a porção da corrente evocada pelo transportador segundo estímulo (o FSTC).
- Na maioria dos casos, o passo anterior o remove inteiramente sustentado K +-corrente. Se for este o caso, o isolamento da FSTC está completa e pode proceed com a análise de deconvolução e tirar o curso de tempo de desembaraço glutamato de astrócitos. Em alguns casos, no entanto, uma pequena sustentado K +-corrente ainda está presente (Figura 2d), e é necessária uma análise mais aprofundada (ver seção 5).
Nota: lembre-se que a análise descrita em 4,7-4,10 deve ser realizada sobre os traços médios obtidos em condições de controle e em TBOA (10 mM).
5. Subtração do zdustained K Residual + corrente de fSTCs
- Medir a amplitude do sustentado K +-corrente remanescente após realizar a análise descrita na seção 4.
- Escala da amplitude da função monoexponencial descrito no ponto 3.3, a amplitude do K +-sustentada residual corrente medida no ponto 5.1 (Figura 2d esquerda e do meio). Para fazer isso, na equação 3.3, definir o termo A é igual à amplitude do sustentada K +-me actualasured em 5,1 e o termo Τ elevação é igual ao valor médio de Τ aumento estimado em 3.4.
- Subtrair a função monoexponencial resultante da K + FSTC e sustentada de corrente obtidos em 4,10 (Figura 2d direita). Este passo completa o isolamento do FSTC.
6. Isolamento de Currents Transporter Flash-ativadas (FTCs)
- Média de pelo menos 20 varrimentos obtidos com o percurso da luz aberta, em condições de controlo e em TBOA (10 uM).
- Média de um número idêntico de varrimentos obtido com o percurso da luz fechado, em condições de controlo e em TBOA (10 uM).
- Compare a amplitude da resposta atual para o degrau de tensão mV -3 nos quatro traços médios (controle de pulso único, controle pareado-leguminosas, TBOA pulso único, TBOA emparelhado-pulsos).
- Se a amplitude da resposta de corrente é a mesma em todos os quatro traços, prosseguir para o passo 6.7.
- Se a amplitude da resposta média de corrente é diferente em qualquer uma das quatro traços, verificar que todos os traços individuais eram adequadas para serem incluídas em média.
- Se a amplitude da corrente média é diferente em qualquer uma das quatro traços, mas todos os traços individuais são adequados para serem incluídos na média, verificar que, em cada traço com o percurso da luz abrir o tamanho da escala da FTC linearmente com o tamanho a resposta actual para o passo de tensão do teste. Se este for o caso, dimensionar todos os vestígios com relação um ao outro de modo que as respostas actuais para o passo de tensão do teste são todos iguais em amplitude.
Nota: nas condições de gravação descrito aqui (ie intracelular CH 3 SO 3 - ou C 6 H 11 O 7 -), os estímulos de flash gerar correntes astrocitários consistindo apenas da rápida elevação transitória corrente interna estequiométrica. - Subtrair o traço média obtida com a luz path bloqueado a partir da média de rastreio obtidos com o percurso da luz aberta. Este passo permite a remoção o artefacto de estímulo e isolando os FTCs.
Nota: a análise descrita em 6.7, deve ser realizada sobre os vestígios médios obtidos em condições de controlo e em TBOA (10 uM).
7. Análise Deconvolution
- Ajustar a corrente transportador (FSTC ou FTC) registrados em condições de controle (Figura 3A, à esquerda) e em TBOA (10 mM) (Figura 3a direita) e isolado como descrito nas seções 4-6, com a função multi-exponencial:

- Criar uma função instantaneamente crescente que decai mono-exponencial de acordo com a função:
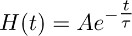
eque descreve melhor a fase de decaimento da corrente registada na TBOA transportador (10 mM) (Figura 3b).
Nota: a função descrita no ponto 7.2 (isto é, H (t)) representa o curso de tempo de recarga glutamato de astrócitos na presença de TBOA (10 uM). - Deconvolve a função monoexponencial obtido no ponto 7.2 (Figura 3b e 3c do meio) a partir do ajuste da corrente registada na TBOA transportador (10 uM), obtido no ponto 7.1 (Figura 3a direita c esquerda).
Nota: deconvolução é uma operação matemática incluída em muitos pacotes de software de análise, como (por exemplo, Matlab, Python). Em IgorPro, o código de programação que tipicamente utilizada para executar este tipo de análise, a operação de desconvolução, podem ser eficazmente calculadas como descrito abaixo, usando transformações rápida de Fourier discreta. Em primeiro lugar, utilizar a operação de FFT para calcular o discrete transformada rápida de Fourier da função monoexponencial obtidos em 7.2 e do ajuste da corrente registada no transportador TBOA obtido em 7.1. Em seguida, utilizar a operação de IFFT para calcular a discreta inversa transformada de Fourier rápida do rácio das duas funções de FFT. A função resultante I (t) pode ser descrito como se segue: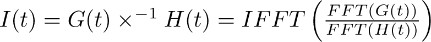
O passo descrito em 7.3 permite a derivação do filtro do transportador de corrente em TBOA (10 mM) (Figura 3c direita). O filtro representa os factores de distorção que convertem o tempo de vida de glutamato em membranas astrocíticos na corrente transportador isolado nos pontos 4-6 (ou seja, o FSTC ou FTC). - Deconvolve o filtro (Figura 3c direita, a Figura 3d meio) a partir do ajuste da corrente de transportador, em condições de controlo (Figura 3a esquerda, Figura 3d esquerda).
Nota: Esta etapa permite derivar o curso do tempo de desembaraço glutamato de astrócitos em condições de controle (Figura 3d direita). A hipótese subjacente a este passo de desconvolução é que o perfil temporal do filtro permanece inalterada em condições de controlo e em TBOA (10 uM). - Para obter uma estimativa quantitativa do curso do tempo global de apuramento glutamato, calcular o baricentro () da forma de onda obtida na etapa 7.4. Isto é feito por meio do cálculo como:
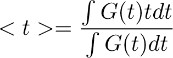
onde G (t) é a forma de onda obtida na etapa 7.1. Na equação acima descrita, o termo t corresponde à janela de tempo durante o qual é calculado o integral.
Nota: quando o método foi estabelecida pela primeira vez, foi calculado sobre as janelas de tempo que ficaram sem restrições 13. Esta abordagem pode ser usada, desde que a janela de integração é definido para ser maior do que a duração do alívio do glutamato e os decaimentos de forma de onda de apuramento completamente volta à linha de base. Se este não for o caso, no entanto, este método de estimativa encontra algumas limitações. Por exemplo, se a forma de onda de recarga não decai exactamente volta à linha de base, em seguida, aumenta com a largura da janela de integração. Para evitar qualquer fonte potencial de imprecisão na estimativa de , agora calcular-lo sobre uma janela de tempo correspondente a 10% do pico da corrente de transportador, antes e após o seu início 14. A última abordagem melhora a consistência com que é medido através de células. Isto vem a calhar, especialmente quando se analisa pequenos efeitos dos tratamentos farmacológicos no curso do tempo de folga.
Access restricted. Please log in or start a trial to view this content.
Resultados
O êxito da abordagem analítica descrita aqui criticamente dependente da obtenção de registos electrofisiolicos de alta qualidade a partir de correntes de transportador astrócitos em qualquer região do sistema nervoso central. Em fatias do hipocampo do rato agudas, os astrócitos podem ser prontamente identificados em Dodt iluminação ou IR-DIC, pois o corpo de célula pequena (Ø = 10 mm) e núcleo proeminente (Figura 1). A sua morfologia distinta em forma de estrela podem ser apreciados com epif...
Access restricted. Please log in or start a trial to view this content.
Discussão
Descrevemos aqui uma abordagem experimental para obter registos electrofisiolicos de astrócitos, um protocolo de análise para isolar as correntes do transportador de glutamato em astrócitos e um método matemático para derivar o curso de tempo de depuração a partir das correntes do transportador de glutamato astrocíticos.
O sucesso da análise baseia-se na capacidade de obter alta qualidade gravações de patch clamp de astrócitos e na precisão dos algoritmos de montagem utilizadas ...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores declaram que não há conflito de interesse.
Agradecimentos
Este trabalho foi apoiado pelo Instituto Nacional de Doenças Neurológicas e programa de pesquisa intramuros Curso (NS002986). AS escreveu o manuscrito e implementada a análise de deconvolução. JSD desenvolveu a versão inicial da análise de deconvolução e comentou sobre o texto.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| CGP52432 | Tocris | 1246 | |
| (R,S)-CPP | Tocris | 173 | |
| DPCPX | Tocris | 439 | |
| LY341495 disodium salt | Tocris | 4062 | |
| MSOP | Tocris | 803 | |
| NBQX disodium salt | Tocris | 1044 | |
| D,L-TBOA | Tocis | 1223 | |
| Picrotoxin | Sigma | P1675 | |
| MNI-L-glutamate | Tocris | 1490 | |
| Alexa 594 | Life Technologies | A10438 | Optional |
| Matrix electrodes | Frederick Haer Company | MX21AES(JD3) | |
| Borosilicate glass capillaries | World Precision Instruments | PG10165-4 | |
| Dual-stage glass micro-pipette puller | Narishige | PC-10 | |
| Loctite 404 instant adhesive | Ted Pella | 46551 | |
| Xe lamp | Rapp OptoElectronic | FlashMic | |
| Igor Pro 6 | Wavemetrics |
Referências
- Ventura, R., Harris, K. M. Three-dimensional relationships between hippocampal synapses and astrocytes. J. Neurosci. 19, 6897-6906 (1999).
- Witcher, M. R., Kirov, S. A., Harris, K. M. Plasticity of perisynaptic astroglia during synaptogenesis in the mature rat hippocampus. Glia. 55, 13-23 (2007).
- Danbolt, N. C. Glutamate uptake. Prog. Neurobiol. 65, 1-105 (2001).
- Herman, M. A., Jahr, C. E. Extracellular glutamate concentration in hippocampal slice. J. Neurosci. 27, 9736-9741 (2007).
- Arnth-Jensen, N., Jabaudon, D., Scanziani, M. Cooperation between independent hippocampal synapses is controlled by glutamate uptake. Nat. Neurosci. 5, 325-331 (2002).
- Barbour, B. An evaluation of synapse independence. J. Neurosci. 21, 7969-7984 (2001).
- Rusakov, D. A., Kullmann, D. M. Extrasynaptic glutamate diffusion in the hippocampus: ultrastructural constraints, uptake, and receptor activation. J. Neurosci. 18, 3158-3170 (1998).
- Zerangue, N., Kavanaugh, M. P. Flux coupling in a neuronal glutamate transporter. Nature. 383, 634-637 (1038).
- Eliasof, S., Jahr, C. E. Retinal glial cell glutamate transporter is coupled to an anionic conductance. Proc. Natl. Acad. Sci. U.S.A. 93, 4153-4158 (1996).
- Wadiche, J. I., Amara, S. G., Kavanaugh, M. P. Ion fluxes associated with excitatory amino acid transport. Neuron. 15, 721-728 (1995).
- Wadiche, J. I., Kavanaugh, M. P. Macroscopic and microscopic properties of a cloned glutamate transporter/chloride channel. J. Neurosci. 18, 7650-7661 (1998).
- Bergles, D. E., Jahr, C. E. Synaptic activation of glutamate transporters in hippocampal astrocytes. Neuron. 19, 1297-1308 (1997).
- Diamond, J. S. Deriving the glutamate clearance time course from transporter currents in CA1 hippocampal astrocytes: transmitter uptake gets faster during development. J. Neurosci. 25, 2906-2916 (2005).
- Scimemi, A., Tian, H. Neuronal transporters regulate glutamate clearance, NMDA receptor activation, and synaptic plasticity in the hippocampus. J. Neurosci. 29, 14581-14595 (2009).
- Zuo, Z. Isoflurane enhances glutamate uptake via glutamate transporters in rat glial cells. Neuroreport. 12, 1077-1080 (2001).
- Barbour, B., Brew, H., Attwell, D. Electrogenic uptake of glutamate and aspartate into glial cells isolated from the salamander (Ambystoma) retina. J. Physiol. 436, 169-193 (1991).
- Bergles, D. E., Tzingounis, A. V., Jahr, C. E. Comparison of coupled and uncoupled currents during glutamate uptake by GLT-1 transporters. J. Neurosci. 22, 10153-10162 (2002).
- Diamond, J. S., Jahr, C. E. Synaptically released glutamate does not overwhelm transporters on hippocampal astrocytes during high-frequency stimulation. J. Neurophysiol. 83, 2835-2843 (2000).
- Benediktsson, A. M., et al. Neuronal activity regulates glutamate transporter dynamics in developing astrocytes. Glia. 60, 175-188 (2012).
- Hires, S. A., Zhu, Y., Tsien, R. Y. Optical measurement of synaptic glutamate spillover and reuptake by linker optimized glutamate-sensitive fluorescent reporters. Proc. Natl. Acad. Sci. U.S.A. 105, 4411-4416 (2008).
- Scimemi, A., Meabon, J., Woltjer, R. L., Sullivan, J. M., Diamond, J. S., Cook, D. G. Amyloidβ1-42 slows clearance of synaptically-released glutamate by mislocalizing astrocytic GLT-1. J. Neurosci. 33, 5312-5318 (2013).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados