É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
O Sistema Swimmeret de lagosta: Um Guia Prático para a dissecção da medula nervosa e extracelulares Recordings do padrão motor
Neste Artigo
Resumo
Here we describe the dissection of the crayfish abdominal nerve cord. We also demonstrate an electrophysiological technique to record fictive locomotion from swimmeret motor neurons.
Resumo
Aqui demonstramos a dissecção do cordão nervoso abdominal lagostim. A preparação compreende os dois últimos gânglio torácico (T4, T5) e a cadeia de gânglios abdominal (A1 a A6). Esta cadeia de gânglios inclui a parte do sistema nervoso central (SNC) que leva a locomoção coordenada dos pleópodos (pleópodes): o sistema swimmeret. Ele é conhecido por mais de cinco décadas em que lagostas cada swimmeret é impulsionado por seu próprio padrão do kernel gerando independente que gera atividade rítmica alternando 1-3. Os neurônios motores que inervam a musculatura de cada swimmeret compreendem dois anatômica e funcionalmente distintas populações 4. Uma delas é responsável pela retração (curso de potência, PS) do swimmeret. O outro impulsiona o protraction (curso de retorno, RS) da swimmeret. Os neurónios motores do sistema swimmeret são capazes de produzir espontaneamente um padrão fictício do motor, que é idêntico ao padrão gravado in vivo 1.
O objetivo deste relatório é a introdução de um sistema modelo interessante e conveniente para o estudo de redes de geração de ritmo e coordenação dos microcircuitos independentes para cursos práticos de laboratório dos alunos. O protocolo fornecido inclui instruções passo-a-passo para a dissecação de cordão nervoso abdominal do lagostim, prendendo da cadeia isolado de gânglios, desheathing gânglios e registrando o swimmerets padrão motor fictício extracelular do sistema nervoso isolado.
Além disso, podemos monitorar a atividade dos neurônios swimmeret gravadas intracelular de dendritos. Aqui também descrever brevemente essas técnicas e dar alguns exemplos. Além disso, a morfologia de neurónios swimmeret pode ser avaliada utilizando várias técnicas de coloração. Aqui nós fornecemos exemplos de intracelular (por iontoforese) Dye preenchido neurônios e aterros de pools de neurônios motores swimmeret. No nosso laboratóriousamos esta preparação para estudar as funções básicas de locomoção fictício, o efeito de retorno sensorial sobre a actividade do sistema nervoso central, e a coordenação entre microcircuitos a um nível celular.
Introdução
Os swimmerets de lagostins servem a uma função no controle da postura e bater ritmicamente quando os animais nadar para a frente, ventilar suas tocas ou fêmeas arejar seus ovos 5, 6. Os swimmerets do lagostim sinal, Pacifastacus leniusculus, ocorrem em pares do segundo para o quinto segmento abdominal, com um membro de cada lado do abdômen 7. O sistema nervoso central produz por si própria o alinhador rítmica do motor que acciona o movimento swimmeret no animal intacto, bem como na preparação de nervo isolado cabo. Quando não há feedback sensorial ou descendente de entrada presente o padrão motor rítmica é chamado locomoção fictício 1, 2. No sistema swimmeret este padrão motor não diferem em qualquer parâmetro da actividade dos pleópodes medidos no animal intacto.
O movimento de cada swimmeret é accionado por um microcircuito que está localizado dentro e restrita a um corresponding hemiganglion 1 - 3. Em cada microcircuito há um núcleo de geração de padrões que compreende cinco identificados interneurons não spiking. Eles podem ser funcionalmente caracterizada como sendo ou Inibidor de Power Stroke (IPS) ou inibidor de Retorno Curso (IRS) 8. Estes IPS e interneurônios IRS não são osciladores endógenos, em vez da sua actividade alternada é impulsionado por inibição recíproca 9. Porque estes interneurônios inibem os neurônios motores swimmeret diretamente, o movimento alternado PS-RS é gerado 10. Locomoção no entanto, não requerem apenas a geração de actividade, mas também a coordenação das diferentes microcircuitos independentes. No sistema swimmeret essa coordenação é estabelecida pelo microcircuito coordenação que assegura que os membros estão ativos em horários corretos. Este microcircuito é construído por três neurônios identificados em cada segmento 11-15.
Este protocolo prevê the primeira vez um passo-a-passo para isolar a dissecção de gânglios da cadeia (T4 para A6, Figura 1). Mostramos como fixar o cordão nervoso abdominal isolada e desheathe cada gânglio. Neste isolado de preparação do sistema nervoso, os neurônios responsáveis pelo movimento swimmeret estão prontos para uso em experimentos eletrofisiológicos e morfológicos. A segunda parte deste protocolo demonstra as principais características do padrão motor swimmeret. Isto inclui um guia passo-a-passo para registro extracelular a atividade dos neurônios motores swimmeret. Os axônios dos neurônios motores RS projetar através do ramo anterior do nervo N1, enquanto axônios dos neurônios motores PS projeto por meio do ramo posterior do mesmo nervo (Figura 1) 4. Por isso a sua atividade pode ser gravado a partir destes ramos com eletrodos diferenciais pinos.

Figura 1: Isolado sistema nervoso de gânglio torácico 4 (T4) ao gânglio abdominal 6 (A6) e um diagrama esquemático de que T4:. Gânglio torácico 4; T5: gânglio torácico 5; A1, A2 ... A6 gânglio abdominal 1, gânglio abdominal 2 ... gânglio abdominal 6; N1: nervo N1; N2: nervo N2; N3: nervo N3; PS: power-acidente vascular cerebral; RS: return-acidente vascular cerebral. Abreviaturas direcionais: A = anterior; P = posterior.
Este procedimento de dissecção e a técnica eletrofisiológica demonstrado são convenientes para estudantes de graduação e podem complementar de estudantes de cursos práticos em fisiologia. A cadeia isolada de gânglios foi usado em uma série de experiências para estudar a função do sistema nervoso, a coordenação, ou modulação de microcircuitos swimmeret 6, bem como o controlo neuronal do comportamento adaptativo na locomoção 16, 17. O sistema de lagostas swimmeret proporciona assim uma enorme quantidade de ensino interessante ou tchovendo oportunidades que todos começam com a dissecção do cordão nervoso ventral de lagostins e gravação extracelular do padrão motor fictício.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Este procedimento de dissecção está em conformidade com a Directiva do Conselho das Comunidades Europeias do dia 22 de Setembro 2010 (2010/63 / UE).
1. Preparação
- Obter lagostas, Pacifastacus leniusculus (Dana), de ambos os sexos ≥8 cm de tamanho. Certifique-se de que os animais são vitais e abdome e dos membros abdominais estão intactos.
- Tome cuidado para inspecionar a carapaça e que esta cutícula é dura e rígida. Pré- e pós-muda animais têm uma carapaça macio e não são adequados para experiências porque durante o processo de muda mudar vários parâmetros (por exemplo, diminuição da actividade locomotora).
- Montar todas as ferramentas e os materiais utilizados durante a dissecção, prendendo e desheathing do cordão nervoso mostrado na Figura 2 e enumerados nos suplementos fornecidos.

Figura 2: Materiais e ferramentas utilizadas para a dissecção, prendendo e desheathing do cordão nervoso.
(1) balde grande cheio de gelo; (2) solução salina lagostas; (3) dispensador de solução salina; (4) microscópio de dissecação; (5) prato dissecção; (6) uma tesoura forte; (7) fórceps (8) tesoura primavera; (9) placa de Petri forradas com Sylgard claro; (10) dos pinos de fixação; (11) fonte de luz fria.
2. Dissecção Gross
- Anestesiar animais em gelo durante 15-20 min. Realizar a primeira parte da dissecção bruto a uma bancada de laboratório perto da pia, pois inclui uma etapa exsanguination ea amostra precisa ser lavado regularmente com lagostas salina durante o procedimento.
- Segure lado ventral animais e usar uma tesoura para cortar ambos os fortes garras em suas bases perto do tórax (Figura 3-1). Remover uropod esquerda e direita (Figura 3-2).
- Coloque o animal lado ventral-se no prato forrado com dissecção Sylgard preto. Elevate cefalotórax através da inserção de gelo por baixo e prender o abdômen no telson (Figura 4A).
- Encha o distribuidor de solução salina com ~ 60 ml de solução salina gelada lagostas. Perfundir lagostim com soro fisiológico frio através da abertura de garra (Figura 4B). O excesso de solução salina irá drenar através dos cortes nos uropods. Cubra lagostim com gelo durante exsanguination
- Decapitar o animal com um único corte transversal apenas posterior para os olhos do animal utilizando uma tesoura forte (Figura 5A). Remova todas as pernas que andam perto das articulações de base, como indicado na Figura 5B.
- Isolar o abdômen com os últimos segmentos torácicos a partir do resto do cefalotórax. Adicione um primeiro corte ao nível das segundas pernas de passeio (segmento torácico 3) inserindo a extremidade da tesoura para dentro da abertura da segunda perna curta e de corte para o lado oposto. (Figura 6A-1).
- Estender este primeiro corte para ambos os lados através de tele cefalotorácica (Figura 6A-2).
- Virar o animal aberto para fazer alguns dos órgãos internos visíveis. Empurrar o proeminente glândula digestivo (Figura 6B-3) para a parte anterior da amostra e usar uma pinça para remover os órgãos reprodutores a partir da cavidade abdominal.
- Retire a parte anterior do cefalotórax (Figura 6C). Use cortes laterais para remover as partes laterais da carapaça, que cobrem as guelras, em ambos os lados do tórax remanescente (Figura 6D-4). Retire as brânquias e enxaguar a amostra com solução salina fria.
- Continuar a dissecação com um corte através de todo o comprimento da placa esternal, como indicado na Figura 6E-5. Faça este corte nas posições laterais máximas entre Pleuron e swimmerets (Figura 6E marcações vermelhas). Proceder do outro lado com um mesmo corte. Lavar a amostra com solução salina fria.
- Realizar a dissecção restante sob uma dissection microscópio. Coloque abdômen lado ventral do lagostim-se no prato forrado com dissecção Sylgard preto e cheio de lagostas salina para que ele cobre o espécime.
NOTA: Os passos seguintes (2,12-4,8) contêm instruções de direção que se aplicam aos experimentadores destros. Nos passos seguintes (2,12-6,8) é importante para substituir lagostas salina em intervalos regulares, a cada 20-30 min com solução salina fria, para manter o sistema nervoso saudável. - Fixe a amostra com os pinos de insetos posteriormente no telson e anteriormente com os restos da carapaça. Coloque a amostra de modo a que os pontos Telson para a esquerda e é paralela à borda da mesa.
- Use uma pinça grossa na mão esquerda para pegar através de uma abertura perna curta (Figura 7A) e puxe o modelo open (Figura 7B seta branca). Identificar os grandes dorsais duas fibras musculares flexor (Figura 7b-1 e C-1) e cortar seu ventralbase, como mostrado na Figura 7B.
- Identificar a artéria esternal (Figura 7C-2), que desce a partir dorsal (coração) para ventral, no segmento torácico 4 th. Esta artéria situa-se acima do cordão nervoso (Figura 7C-3), antes de projectos no âmbito do cordão nervoso, formando a artéria ventral.
- Transecto artéria esternal. Como demonstrado na Figura 7C, levantar a artéria primeiro, usando uma lâmina da tesoura, e apenas cortada quando o cordão nervoso localizada ventralmente é visível.
- Corrigir os músculos flexores dorsal anterior (para o lado direito). Isto deve ser feito na posição máxima esticado com pinos que eles não vão bloquear a visão ea amostra permanece esticado. Quando as fibras musculares dorsal são fixadas (Figura 8-1), o primeiro gânglio abdominal, A1 e A2, com nervos associados N1, N2 e N3 são visíveis (Figura 8).
- Use uma pinça na mão esquerda para pegar a especificaçãoimen em uma abertura de pernas para caminhada. Durante todo o seguinte dissecção passos puxe delicadamente para manter o modelo aberto.
- Transecto os nervos N3 na posição mais distante do cordão nervoso. (Figura 8-3).
- Cortar os flexores perto do apodeme ventral, conforme mostrado na Figura 8-4. Tome cuidado para não danificar o cabo dos nervos ou o N2 nervos.
- Repita os passos 2.18 e 2.19 para o N3 nervos e os músculos flexores do restante gânglios abdominal A2 a A5.
- Na última gânglio abdominal, A6, cortar os flexores do apodeme dorsal e ventral do espécime deve ter a aparência, como mostrado na Figura 9.
- Corte a placa posterior do esterno para os nervos da A6 (Figura 9-1) e manter a parte ventral (Figura 9-2). Descarte a parte dorsal com músculos flexores (Figura 9-3). Fixar a placa esternal anteriormente com pinos através das aberturas das pernas de passeio,e posteriormente para A6.
3. Belas Dissection
- Coloque a amostra sob o microscópio com a parte anterior direcionada para fora e na parte posterior em direção da borda das mesas.
- Use uma pinça, como mostrado na Figura 10A para remover as partes mais anterior da esternos cefalotorácico.
NOTA: Os gânglios torácicos e nervos associados estão parcialmente cobertas pela musculatura da perna e esternos cefalotorácico. O esternos cefalotorácico formar um esqueleto que separa as cavidades localizadas lateralmente das pernas caminhada um do outro e da cavidade medial em que o cordão nervoso ventral reside. - Cortar os músculos entre as estruturas restantes exoesqueléticas conforme indicado na Figura 10B -1 e B2. Use uma pinça para agarrar e levantar a extremidade anterior do cordão nervoso ventral (Figura 10C).
NOTA: O cabo de nervo é danificado durante o processo, para evitar pegar a NERVe cabo várias vezes. - Cortar os nervos torácicos lateralmente ao levantar o nervo espinhal (Figura 10C-3). Manter estes nervos ao comprimento adequado para fixação. Retire a parte espremido da cadeia de gânglios, que foi pego com uma pinça, cortando-se todo o tecido anterior ao T4 (Figura 10C-4).
- Coloque a amostra com a parte anterior para a esquerda e se concentrar em A1. Corte o N1 e N2 nervos de A1 em um comprimento adequado (max. 1 cm) para fixar-los para fora.
- Concentre-se em A2 e identificar os nervos N1, N2, N3 e deste segmento (Figura 11). Os nervos N1 do gânglio abdominal A2-A5 residir entre dois dobramentos cuticulares esternal em cada segmento (Figura 11A-1) e são cobertos por musculatura. Faça um corte ao longo da infolding cuticular esternal posterior. Iniciar na borda lateral do abdómen e avançar no sentido da linha média como mostrado na Figura 11A.
- Se o N1 alvo ainda é covevermelha com o tecido, como mostrado na Figura 11B (seta vermelha), atravessam o feixe muscular, mas este tempo anterior para ambos os invaginações cuticulares esternal e o nervo N1 (Figura 11B-2).
- Cortar N1 nervo como distalmente quanto possível (Figura 11C-3). Nerve N1 é totalmente visível e do ramo anterior e posterior podem ser identificados (Figura 11C).
- Vá para a N1 nervo contralateral e primeiro corte os músculos ao longo da infolding cuticular esternal posterior, começando medial, próximo ao gânglio (Figura 11D). Se o nervo ainda é coberto por tecido, cortar transversalmente o feixe muscular, mas este tempo anterior para ambos os invaginações cuticulares esternal e o nervo N1, semelhante à Figura 11B-2. Corte o N1 nervo como distal possível.
- Corte o nervos N2 deste gânglio para um comprimento adequado (aprox. 0,5 centímetros) para fixação.
- Repita os passos 3,7-3,11 para os nervos de A3-A5.
- Corte o nerves de gânglio A6 como distal possível (Figura 12a). Use uma pinça para agarrar múltiplos nervos de A6 para levantar este gânglio e começar a isolar a cadeia de gânglios da placa esternal.
- Ao levantar o cordão nervoso, puxe-o suavemente na direção anterior, como demonstrado na Figura 12B (seta branca). Como os gânglios individuais são levantadas, remover a artéria ventral que pode ser ligado ao lado ventral do nervo espinhal (Figura 12C). Continue esta seqüência (suavemente) Puxe cortar, até o cordão nervoso está completamente isolado.
- Transfira a corrente isolada de gânglios de uma placa de Petri forradas com Sylgard claro e preenchido com solução salina lagostas (Figura 12D).
4. Fixar o cordão nervoso em placa de Petri
NOTA: Use pequenos pinos cortados a partir de fio de aço inoxidável (ver suplementos) para prender o cabo dos nervos. Toque apenas a terminação nervosa com a pinça e não fazer squeezum e os conectivos ou gânglios.
- Pin a cadeia de gânglios em uma linha reta, ao aplicar alongamento suave.
- Arrume o cordão nervoso na placa de Petri com o lado dorsal virada para cima (Figura 13, linha preta). O lado ventral do gânglio pode ser identificada pela sua convexidade; lado dorsal é plana. Pin os nervos torácicos para os lados. Continue com os nervos da A6, esticando o cordão nervoso ao longo do seu eixo longitudinal.
- Pin para os nervos de A1 em um ângulo de 90 ° em relação ao cordão nervoso.
- Avance para o pino A2 e N2 nervos num ângulo de 35-45 ° em relação ao cordão nervoso (Figura 1A).
- Separe os nervos N1 em seus ramos anterior e posterior antes de fixar como demonstrado na Figura 14. Use dois pares de uma pinça fina para pegar com um par de fórceps o anterior e com a outra o ramo posterior do nervo N1. Tome cuidado para escolher apenas o fim mais distals dos ramos nervosos. Agora puxe-os cuidadosamente separados.
- Pin o ramo anterior do nervo N1 a um ângulo de 90 ° relativamente ao cabo de nervo (Figura 1A). Pin o ramo posterior do nervo N1 entre o ramo N1 anterior eo nervo N2.
- Repita o 4,4-4,6 passos para os nervos dos gânglios A3-A5. Enquanto fixando o trecho cordão nervoso que em longitudinal, bem como as direções transversais.
5. Desheathing os gânglios
- Coloque a preparação de uma tal maneira que as mãos do experimentador estão sempre em repouso sobre um plano estável para evitar agitação. A fim de desheath os gânglios iluminar o cordão nervoso a partir de baixo.
- Concentre-se em qualquer gânglio A1 abdominal para A5. Use tesoura mola finos para fazer um pequeno corte lateral através da bainha gânglio, posterior ao gânglio e entre os nervos N2 e N3 (Figura 15A seta vermelha).
- Pegue a bainha gânglio usando muito ffórceps ine e cortar transversalmente através da bainha acima dos conectivos, como indicado na Figura 15A-1. Tome cuidado para não apertar ou cortar o cordão nervoso com a tesoura.
- Ainda segurando e levantando a bainha gânglio com uma pinça continuar a cortá-lo ao longo das bordas laterais do gânglio (Figura 15B-2 e -3). Remover a bainha. Alternativamente fixá-lo para ambos os lados dos conectores de tal modo que ele é fixado, mas o cordão nervoso não é espremido.
- Repita os passos de 5,2-5,4 para todos os gânglios abdominal A1 a A5.
- Desheathe gânglios torácica e o gânglio A6 de uma forma semelhante. A fim de desheathe A6 anterior início ao gânglio e prosseguir em direção posterior. Pin a bainha gânglio de A6 até o fim posterior da cadeia de gânglios.
6. Extracelular Recordings de Neurônios Motores
- Reúna todas as ferramentas e materiais utilizados para gravações extracelulares mostrados in Figura 16B e listados nos suplementos. Uma visão geral sobre a configuração de gravação é mostrado na Figura 16A. Comece todos os equipamentos eletrônicos utilizados neste experimento (Figura 16C), para que os amplificadores podem aquecer-se durante pelo menos 30 minutos antes da gravação. Ligue o computador e iniciar o software de gravação.
- Coloque a cadeia de gânglios na mesa de microscópio e iluminar a partir de baixo. Insira o eletrodo de registro no Sylgard próximo ao nervo alvo e o eletrodo de referência em uma posição próxima, mas lateral à gânglios (Figura 17A e B). Dobre o nervo alvo em torno do eletrodo de registro (Figura 17C).
- Esticar o nervo ligeiramente, para garantir o contato entre o eletrodo e do nervo e fixá-lo para o lado (F igura 17D). Fixe os cabos de força para a tabela de microscópio utilizando massa de modelar, para que fiquem na posição desejada.
- Use umcheia com geleia de petróleo e uma agulha de calibre 20 (com ponta arredondada) (Figura 17E-3) para isolar o nervo alvo a partir da solução do banho. Primeiro dab alguns vaselina na Sylgard em torno do eletrodo de registro. O resultado é uma camada de geleia de petróleo cobrindo o Sylgard na proximidade do eléctrodo de registo (Figura 17E-4). Tome cuidado para não bata diretamente no nervo e evitar bolhas de ar nesta camada.
- Fecha-se o eléctrodo de registo com geleia de petróleo a partir de todos os lados, até ao nível da superfície da solução salina (Figura 17F).
- Repita esse procedimento para todos os nervos alvo cuja actividade deve ser monitorado.
- Iniciar a gravação. Use um modo de aquisição livre contínua ou lacuna e uma taxa de amostragem de 5 kHz. Defina o amplificador extracelular com os seguintes parâmetros; ganhar para 1.000 (amplifica o sinal de 1.000 vezes, ter o cuidado de incluir esse parâmetro amplificação nas configurações do software de aquisição) umada faixa de filtro de banda de 300 Hz (baixo) a 2.000 Hz (alta corte).
Access restricted. Please log in or start a trial to view this content.
Resultados
Com as gravações extracelulares simultâneas de RS e PS, os neurônios motores de um gânglio, a atividade alternada dessas piscinas do neurônio motor, podem ser monitorados (Figura 18), o que representa o padrão de locomoção fictício.
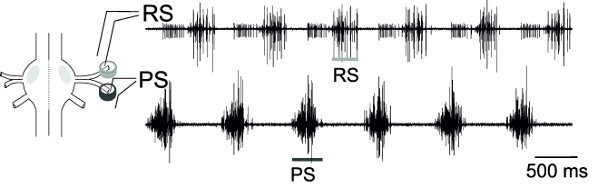
Figura 18: Esquema de um gânglio e colocação de eletrodos diferencial pin gravação Extracelular de RS neurônios motores (traço supe...
Access restricted. Please log in or start a trial to view this content.
Discussão
A anatomia de lagostins e seus gânglios abdominal tem sido descrito anteriormente 5, 18, 19, 20 e recomenda-se a familiarizar-se com eles antes da dissecção, a fim de evitar o corte de nervos importantes.
É crítico para manter a preparação, a temperaturas inferiores a 23 ° C para evitar degradação do cabo de nervo isolado. Isto pode ser facilmente conseguido por substituição da solução de banho a cada 20-30 min com solução salina fria lagostas. Nestas c...
Access restricted. Please log in or start a trial to view this content.
Divulgações
The authors declare that they have no competing financial interests.
Agradecimentos
Agradecemos Jos Burgert para ajudar com algumas das figuras. Somos gratos a Ingo Selbach (e do grupo "Edelkrebsprojekt NRW") por seus esforços para fornecer o laboratório com animais experimentais. Agradecemos a Anna C. Schneider para reler primeiras versões do manuscrito. Esta pesquisa foi apoiada por uma bolsa de SM Emmy Noether DFG 206 / 3-1 e uma subvenção de arranque da Universidade de Colônia para professores do sexo feminino.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| 4-channel extracellular amplifier: MA 102 | Amplifier | Elektroniklabor, Zoologie, Universität zu Köln, Germany | |
| air-table | Technical Manufacturing Corporation (TMC) a unit of AMETEK Ultra Precision Technologies, Peabody, MA, USA | 63-534 | |
| Axon Digidata 1440A | Digitizer | Axon Instruments, Molecular Devices Design, Union City, CA | DD1440A |
| big bucket | |||
| Clampex & Clampfit | pClamp 10, recording and analysis software | Molecular Devices Design, Union City, CA | pClamps 10 Standard |
| cold lamp source | with flexible light guide (fiber optic bundle) | Euromex microscopes holland, Arnhem, BD | LE.5211 & LE.5235 |
| computer and monitor | equipped with recording software | ||
| container and pipette for liquid waste | |||
| crayfish saline | contains (in mM): 5.4 KCl, 2.6 MgCl2, 13.5 CaCl2, and 195 NaCl, buffered with 10mM Tris base and 4.7mM maleic acid; aerated for 3 hours. Adjust at pH of 7.4. | ||
| dextran, Texas Red (3000MW, lysine fixable) | fluorescent dye, lysine fixable | Life Technologies GmbH, Darmstadt, Germany | D3328 |
| dissection dish | (l x w x h) 15x7x5 cm; linned with black silicone | ||
| faraday cage | |||
| fixing pins | |||
| forceps (biology, Dumont #5) | Forceps: Biology, tip 0.05 x 0.02 mm, length 11cm, INOX | Fine Science Tools (FST), Germany | 11252-20 |
| forceps (biology, Dumont #55) | Forceps: Biology, tip 0.05 x 0.02 mm, length 11cm, INOX | Fine Science Tools (FST), Germany | 11255-20 |
| forceps (electronic, Dumont #5) | Forceps: Standard, tip 0.1 x 0.06 mm, length 11cm, INOX | Fine Science Tools (FST), Germany | 11251-20 |
| intracellular electrode | Borosilicate glass capillaries (outer/inner diameter: 1mm/0.5mm), with filament | Sutter Instruments, Novato, CA | BF100-50-10 |
| Leica S8 Apo StereoZoom | Dissection Microscope Zoom 1x - 8x | Leica, Germany | 10446298 |
| microscope table | |||
| mirror | to illuminate preparation from below | ||
| modeling clay | |||
| Olympus SZ61 | Dissection Microscope Zoom 0.67x - 4.5x | Olympus, Germany | |
| petri dish | 94 x 16 mm; lined with clear silicone | Greiner bio-one, Germany | 633180 |
| ring scissors | ThoughCut, cutting edge: sharp/blunt, straight: 13cm | Fine Science Tools (FST), Germany | 14054-13 |
| spring scissors or alternative: Vannas spring scissors | cutting edge: 8 mm, tip diameter: 0.2mm, straight: 10cm or cutting edge 2.5 mm, tip diameter 0.075 mm, straight: 8cm | Fine Science Tools (FST), Germany | 15024-10 or 15000-08 |
| student Vannas spring scissors or alternative: Moria Spring Scissors | cutting edge: 5mm, tip diameter: 0.35mm, straight: 9cm or cutting edge: 5mm, tip diameter 0,1 mm, straight: 8 cm | Fine Science Tools (FST), Germany | 91500-09 or 15396-00 |
| sylgard | 184 Silicone Elastomer Base and Curing Agent; for black sylgard add activated carbon | Dow Corning, Midland, MI, USA | |
| syringe filled with petroleum jelly and equipped with a 20 gauche needle with rounded tip |
Referências
- Hughes, G. M., Wiersma, C. A. G. The Co-Ordination of Swimmeret Movements in the Crayfish, Procambarus-Clarkii (Girard). J Exp Biol. 37 (4), 657-670 (1960).
- Mulloney, B., Smarandache, C. Fifty Years of CPGs: Two Neuroethological Papers that Shaped the Course of Neuroscience. Front Behav Neurosci. 4, 45(2010).
- Murchison, D., Chrachri, A., Mulloney, B. A Separate Local Pattern-Generating Circuit Controls the Movements of Each Swimmeret in Crayfish. J Neurophys. 70 (6), 2620-2631 (1993).
- Mulloney, B., Hall, W. M. Functional organization of crayfish abdominal ganglia. III. Swimmeret motor neurons. J Comp Neurol. 419 (2), 233-243 (2000).
- Davis, W. J. Lobster Righting Responses and Their Neural Control. Proc R Soc Ser B-Bio. 170 (1021), 435-456 (1968).
- Mulloney, B., Smarandache-Wellmann, C. Neurobiology of the crustacean swimmeret system. Prog Neurobiol. 96 (2), 242-267 (2012).
- Huxley, T. H. The crayfish: An introduction to the study of zoology. , MIT Press. Cambridge, MA. (1980).
- Smarandache-Wellmann, C., Weller, C., Wright, T. M., Mulloney, B. Five types of nonspiking interneurons in local pattern-generating circuits of the crayfish swimmeret system. J Neurophys. 110 (2), 344-357 (2013).
- Skinner, F. K., Mulloney, B. Intersegmental coordination of limb movements during locomotion: mathematical models predict circuits that drive swimmeret beating. J Neurosci. 18 (10), 3831-3842 (1998).
- Mulloney, B. During fictive locomotion, graded synaptic currents drive bursts of impulses in swimmeret motor neurons. J Neurosci. 23 (13), 5953-5962 (2003).
- Smarandache-Wellmann, C., Grätsch, S. Mechanisms of coordination in distributed neural circuits: Encoding coordinating information. J Neurosci. 34 (16), 5627-5639 (2014).
- Mulloney, B., Hall, W. M. Local commissural interneurons integrate information from intersegmental coordinating interneurons. J Comp Neurol. 466 (3), 366-376 (2003).
- Mulloney, B., Harness, P. I., Hall, W. M. Bursts of information: Coordinating interneurons encode multiple parameters of a periodic motor pattern. J Neurophys. 95 (2), 850-861 (2006).
- Smarandache, C., Hall, W. M., Mulloney, B. Coordination of Rhythmic Motor Activity by Gradients of Synaptic Strength in a Neural Circuit That Couples Modular Neural Oscillators. J Neurosci. 29 (29), 9351-9360 (2009).
- Smarandache-Wellmann, C., Weller, C., Mulloney, B. Mechanisms of Coordination in Distributed Neural Circuits: Decoding and Integration of Coordinating Information. J Neurosci. 34 (3), 793-803 (2014).
- Chrachri, A., Neil, D., Mulloney, B. State-Dependent Responses of 2 Motor Systems in the Crayfish, Pacifastacus leniusculus. J Comp Physiol A. 175 (3), 371-380 (1994).
- Chrachri, A., Neil, D. M. Interaction and Synchronization between 2 Abdominal Motor Systems in Crayfish. J Neurophys. 69 (5), 1373-1383 (1993).
- Skinner, K. The Structure of the 4th Abdominal-Ganglion of the Crayfish, Procambarus-Clarki (Girard) II. Synaptic Neuropils. J Comp Neurol. 234 (2), 182-191 (1985).
- Skinner, K. The Structure of the 4th Abdominal-Ganglion of the Crayfish, Procambarus-Clarki (Girard) I. Tracts in the Ganglionic Core. J Comp Neurol. 234 (2), 168-181 (1985).
- Mulloney, B., Tschuluun, N., Hall, W. M. Architectonics of crayfish ganglia. Microsc Res Techniq. 60 (3), 253-265 (2003).
- Braun, G., Mulloney, B. Cholinergic modulation of the swimmeret motor system in crayfish. J Neurophys. 70 (6), 2391-2398 (1993).
- Davis, W. J. Motoneuron Morphology and Synaptic Contacts - Determination by Intracellular Dye Injection. Science. 168 (3937), 1358-1360 (1970).
- Altman, J. S., Tyrer, N. M. Filling Selected Neurons with Cobalt through Cut Axons. Neuroanatomical Techniques. Strausfeld, N. J., Miller, T. A. , Springer. New York, NY. 373-402 (1980).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados