É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
A transfecção Gene direção Células Spheroid em placas micropadronadas Cultura para Transplante de Células geneticamente modificados
Neste Artigo
Resumo
This protocol describes a cell transplantation system using genetically modified, injectable spheroids. Cell spheroids are cultured on micropatterned culture plates and recovered after gene introduction using polyplex nanomicelles. This system facilitates prolonged transgene expression from the transplanted cells in host animals while maintaining the innate function of the cells.
Resumo
Para melhorar a eficiência terapêutica do transplante de células, um sistema de transplante de geneticamente modificados, esferóides injectáveis foi desenvolvido. Os esferóides de células são preparadas num sistema de cultura em placas de micropatterned revestidos com um polímero termossensível. Uma série de esferóides são formados nas placas, correspondentes às áreas de adesão celular de 100 um de diâmetro que são regularmente dispostas de uma forma bi-dimensional, rodeado por zonas não adesivas que são revestidos por um polietileno-glicol (PEG) de matriz. Os esferóides podem ser facilmente recuperado sob a forma de uma suspensão líquida, baixando a temperatura das placas, e a sua estrutura é bem conservado, passando-os através de agulhas de injecção com um calibre suficientemente grande (mais de 27 L). A modificação genética é alcançado através de transfecção de genes utilizando o suporte original não virai de genes, nanomicelle Polyplex, que é capaz de introduzir genes em células, sem perturbar a estrutura esferóide. Para primesferóides de hepatócitos ary transfectadas com um gene que expressa luciferase, a luciferase é sustentada obtido em animais transplantados, juntamente com a função de hepatócitos preservada, tal como indicado pela expressão de albumina. Este sistema pode ser aplicado a uma variedade de tipos de células, incluindo células estaminais mesenquimais.
Introdução
Terapia de transplante de células atraiu atenção generalizada para o tratamento de várias doenças incuráveis. A actividade e semi-vida de factores bioactivos, que são secretadas pelas células transplantadas são essenciais para a melhoria da eficácia terapêutica de um sistema de transplante de células. A modificação genética das células antes de transplante é uma técnica benéfica para regular e manipular as funções celulares, incluindo a secreção dos factores bioactivos. É também importante para manter um microambiente favorável para as células para evitar a morte ou perda de actividade de célula a célula. Cultura tridimensional (3D) esferóide célula, em que as interacções célula-para-célula são bem preservada, é promissor para este fim, por exemplo, para melhorar a secreção de albumina a partir de hepatócitos primários e promover a diferenciação de várias linhagens de células estaminais mesenquimais (MSCs ) 1-7.
Neste estudo, um novo sistema de combinação de spheroid cultura e transfecção do gene é usado para servir como uma plataforma para o transplante de células modificadas geneticamente. Para a criação de células de esferóides, um sistema de cultura em placas de cultura esferóide micropatterned é usado. Nessas placas, áreas de adesão celular de 100 um de diâmetro são regularmente dispostas de forma bidimensional e estão rodeados por áreas não adesivas revestidas por uma matriz de PEG 3. Semeando um número adequado de células, esferóides de matrizes 3D de 100 um de diâmetro são formadas correspondente ao leito de cultura micropadronadas.
Os esferóides são recuperados sem perturbar a sua estrutura 3D, utilizando placas de cultura celular termossensíveis, que foram revestidos com um polímero termossensível, poli (iso-propilacrilamida) (PIPAAm) 8-10. A arquitetura micropadronadas é construído sobre as placas termossensíveis (custom-built). Por simplesmente baixando a temperatura das placas, os esferóides são separadas do leito de cultura e dispersard em tampão fosfato salino (PBS). Assim, um grande número de esferóides com um tamanho uniforme de 100 mm pode ser obtido sob a forma de uma suspensão injectável.

Figura 1. Representação esquemática do sistema de cultura de esferóide sobre uma placa micropadronadas. A modificação genética é alcançado através de transfecção de genes utilizando o transportador do gene não virai original, nanomicelle Polyplex. É composto de plasmídeo de ADN (pADN) e polietileno glicol (PEG), copolímeros de bloco -polycation 11. Estes têm uma estrutura de núcleo-shell característica que consiste em um shell de PEG e um núcleo interno de pADN condensado, permitindo introdução gene segura e eficaz em células para fins terapêuticos 11. Por favor clique aqui para ver uma versão maior do this figura.
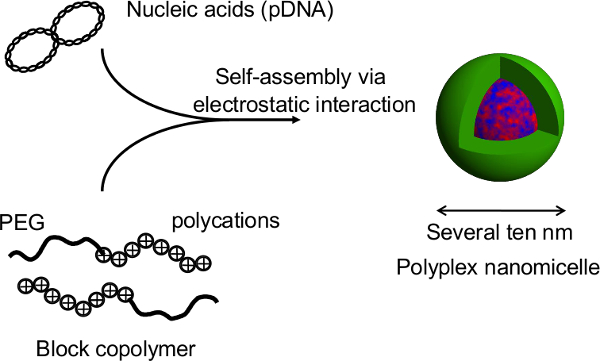
Figura 2. Estrutura do nanomicelle Polyplex formado pelo complexo de ácidos nucleicos e copolímeros de bloco de PEG-bloco-policatião. Neste estudo, a principal vantagem desta técnica é que a estrutura de esferóides não é interrompido durante a transfecção de genes pelos nanomicelles. Após as transfecções mediada por nanomicelle de esferóides de hepatócitos de rato primária, a expressão do transgene prolongada é obtida por mais de um mês, com a secreção de albumina a partir dos hepatócitos contínua a um nível comparável ao de esferóides não transfectadas 12. A expressão do transgene e a secreção de albumina a partir dos esferóides também são mantidas após recuperação a partir das placas termossensíveis. É evidente que nanomicelles pode facilitar a introdução do gene de forma segura, sem prejudicar as funções inatas do hepatocytes. Assim, a combinação de células cultivadas em placas de esferóides micropatterned termossensíveis com introdução de genes utilizando nanomicelles é uma plataforma promissora para o transplante de células geneticamente modificadas. Por favor clique aqui para ver uma versão maior desta figura.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Todos os estudos com animais foram realizados com a aprovação do Comitê de Cuidado e Uso Animal da Universidade de Tokyo, Tokyo, Japão.
1. Preparação celular
- Para hepatócitos primários, seguir o protocolo para o isolamento de hepatócitos de rato por uma de duas etapas processo de digestão de colagenase modificado 13,14.
- Anestesiar Sprague Dawley (SD) ratos (machos, 5 semanas de idade), sob anestesia inalatória com isoflurano. Colocar um rato numa câmara ligada a uma máquina de anestesia com isoflurano para proporcionar a câmara. Retire o rato depois de adormecer, e configurá-lo na mesa de operação com ventilação usando uma máscara. Controlar o fluxo de isoflurano a cerca de 0,4-0,7 L / min, verificando as condições do rato. Perfundir os fígados de ratos Sprague Dawley (SD) ratos (machos, 5 semanas de idade) a partir da veia da porta hepática, com uma solução especial composto de cloreto de sódio 8 g / L (NaCl), 400 mg / L de cloreto de potássio (KCl), 78 mg /EUdi-hidrato de di-hidrogenofosfato de sódio (NaH 2 PO 4 · 2H 2 O), 151 mg / L de fosfato dissódico dodeca-hidrogénio (Na 2 HPO 4 · 12H 2 O), 2,38 g / L de 2- [4- (2-hidroxietil) -1 piperazinil] etanossulfónico (HEPES), 190 mg / L de etileno glicol de ácido tetraacético (EGTA), 350 mg / L de carbonato de hidrogénio de sódio (NaHCO3), e 900 mg / L de glucose.
- Circular solução de colagenase através do fígado.
NOTA: A solução é composta de 500 mg / L de colagenase, 9,8 g / salina tamponada de L Hank, 2,38 g / ml de HEPES, 556 mg / hidrato de cloreto de cálcio ml (CaCl 2 H 2 O), 350 mg / L NaHCO3, e 50 mg / L de inibidor de tripsina de, com o pH ajustado para 7,2. - Remover cuidadosamente o fígado, e mediu-o suavemente em um prato usando uma lâmina de bisturi, adicionar Meio de Eagle Modificado por Dulbecco (DMEM) suplementado com 10% de soro fetal de bovino (FBS), e filtra-se a suspensão de células através de um 100 pmmalha de nylon. Para remover os detritos adicional, centrifugar a suspensão de células a 20 xg durante 1 min. Neste passo, os hepatócitos são no sobrenadante.
- Repetir o passo de centrifugação, duas vezes (de um total de três centrifugações). Finalmente, centrifugar os hepatócitos a 50 x g durante 3 minutos para recuperá-los sob a forma de um pelete.
- Re-suspender os hepatócitos a uma concentração de 4 x 10 5 culas / ml num meio de cultura especial, composto por DMEM suplementado com 10% FBS, 1% de Pen-Strep-Glut (QSP), 1% de dimetilsulfóxido (DMSO), 0,1 nmol / L dexametasona, 0,5 ug / ml de insulina, 10 mmol / L de nicotinamida, 0,2 mmol / L fosforilada ascorbato (Asc-2P), e 10 ng / ml de factor de crescimento epidérmico humano (hEGF) 15. Este meio especial é obrigatório para a preservação da função hepática em condições in vitro.
- Para a obtenção de MSCs de rato, eutanásia Sprague Dawley (SD) ratos (machos, 5 semanas de idade) por administração excessiva de isoflurane. Ressecar os fémures e as tíbias, e recolher as medulas ósseas através da inserção de uma agulha G 22, no eixo do osso para a nivelar-se com 10 ml de DMEM suplementado com FBS a 10%. Recolher as células por filtração através de uma malha de nylon de 100 um.
- Semente as células sobre 10 cm pratos de cultura utilizando DMEM contendo 10% de FBS e 1% de penicilina / estreptomicina. Para as experiências de esferóides, utilizar as MSCs a 5 passagens.
2. Preparação de esferóides de células 3D
- Comercialmente obter placas de cultura de micropatterned, em que as zonas adesivas células são regularmente dispostas a 100 um de diâmetro, de forma bidimensional, rodeado por zonas não adesivas revestidas pela matriz de PEG.
NOTA: Para o transplante de células, um revestimento adicional com o polímero termossensível PIPAAm é necessário para permitir a separação celular por as placas de arrefecimento (ver passo 5.1). As flutuações de temperatura pode induzir alterações na química deste polímero8-10. A 37 ° C, PIPAAm é ligeiramente hidrofóbica, permitindo que as células a ser cultivadas sob condições normais. Uma diminuição na temperatura abaixo de 32 ° C resulta em rápida hidratação do polímero, levando ao desprendimento espontâneo das células. - Semente os hepatócitos ou MSC em placas de 12 poços micropatterned a uma densidade de 4 x 10 5 células / poço andincubate-los a 37 ° C numa atmosfera humidificada contendo 5% de CO 2. As células irá acumular-se nas áreas de adesão micropatterned e gradualmente formar esferóides redondas em 2 dias.
NOTA: Para a preparação de células de controlo numa cultura em monocamada, utilizar placas de 12 poços normais e semear as células a uma densidade idêntica, seguindo um procedimento semelhante ao descrito acima.
3. Preparação de Polyplex Nanomicelles
- Sintetizar um copolímero de bloco de PEG-PSAP (DET) (poli [N '- [N - (2-aminoetil) -2-aminoetil] aspartamida]) (PEG Mw = 12,000, grau de polimerização (DP) do segmento PSAP (DET) = 59), e um homopolímero que é composta de apenas o segmento catiónico [PSAP (DET)] (DP = 55), seguindo os procedimentos anteriormente descritos pelos autores 11, 16, 17.
- Prepara-se uma solução mista do (DET) copolímero em bloco PEG-PSAP e o PSAP (DET) homopolímero em uma proporção molar igual de grupos amino residuais, em HEPES 10 mM (pH 7.3) por ajuste da concentração de polímero de 33,3 ^ g / ml e 19,1 ug / ml, respectivamente.
NOTA: As concentrações de polímero descritos acima são os valores representativos para a preparação de nanomicelles com uma razão molar residual do total de grupos amino nos dois polímeros para os grupos fosfato no (relação N / P) de ADNp de 10. A relação N / P pode variar dependendo do tipo de célula e da finalidade (para mais detalhes, ver discussão). A utilização combinada dos dois polímeros pode atingir tanto PEG blindagem eficaz e funcionamento do PSAP (DET) para melhorar endossomalescapar (para detalhes, ver Discussão) 18. - Prepara-se o ADNp que codifica a luciferase Gaussia, GL4 de luciferase, ou eritropoietina por clonagem do segmento de expressar os respectivos genes no plasmídeo pCAG-GS (http://www.cdb.riken.jp/pcs/protocol/vector/map/m36.html ) para se obter a expressão sob o CAG promotor / potenciador usando um kit comercial de acordo com o protocolo do fabricante. Amplificar o pDNA em uma cepa Escherichia coli competente e purificá-la usando um plasmídeo sistema de purificação de ADN livre de endotoxina. Determinar a concentração de ADNp a uma absorvância de 260 nm para se obter uma solução / ml 150 ug em tampão HEPES 10 mM (pH 7,3).
- Para preparar as nanomicelles poliplex, homogeneiza-se a solução de ADNp (150 ug / ml em tampão HEPES 10 mM) e a solução pré-misturada dos dois polímeros numa proporção de 2: 1 (em volume).
4. Gene transfecção em esferóides
- Incubar as células (hepatócitosou MSC) durante 72 horas após a sementeira em placas micropatterned para permitir a formação de esferóides maduros. Para a transfecção de genes, adicionar 100 uL da solução Polyplex nanomicelle (contendo 10 ug de ADNp) a cada poço após a substituição do meio de cultura com 1 ml de meio fresco. Continuar a incubação com a solução nanomicelle durante 24 horas.
- Para um controlo usando um reagente de transfecção à base de lípidos, misturar soluções pADN com o reagente em uma proporção em peso de reagente / pDNA de 3. Ajustar a dose final de pADN para ser igual, tanto para o reagente à base de lípidos e métodos nanomicelle.
5. Recuperação e Transplante de esferóides celulares
- Substituir o meio de cultura com 200 ul de PBS arrefecido e colocar as placas em gelo.
NOTA: De um modo geral, os esferóides podem separar em cerca de 15 min e pode ser recuperada na forma de uma suspensão para o transplante. - Suavemente aspirar as células em 200 ul dosuspensão utilizando uma seringa com uma 23 G ou 27 G agulha para injeções in vivo.
6. Avaliação da Transgene Expression
- Para a avaliação in vitro da expressão de luciferase Gaussia segregada no meio de cultura, recolher 50 - 100 ul do meio de precisamente 24 horas após a substituição com meio fresco. Estimar a expressão da luciferase utilizando um sistema de ensaio de luciferase de Renilla comercial e um luminómetro de acordo com o protocolo do fabricante.
NOTA: A luciferase Gaussia permanece estável no meio de cultura durante mais de uma semana. Assim, para avaliar a eficiência em tempo real da expressão do transgene, substituir o meio com um meio fresco antes da recolha do meio da amostra. O momento da mudança de meio pode ser flexível. - Para a avaliação in vivo de expressão do transgene em animais hospedeiros, após o transplante de células, anestesiar ratos BALB / c nu (fêmea; 7 semanasidade), sob anestesia inalatória com isoflurano.
- Colocar um rato numa câmara ligada a uma máquina de anestesia com isoflurano para proporcionar a câmara. Retire o mouse depois de adormecer, e configurá-lo na mesa de operação com ventilação usando uma máscara. Controlar o fluxo de isoflurano a cerca de 0,2-0,5 L / min, verificando as condições do mouse.
- Injectar 200 ul da suspensão de células contendo esferóides transfectadas com os ADNp que expressam luciferase GL4 (como descrito em 4.1) para dentro do tecido subcutâneo da região abdominal.
- Imediatamente após a injecção de D-luciferina (150 mg / kg; via intravenosa), medir a expressão de luciferase utilizando o sistema de imagiologia IVIS de acordo com o protocolo do fabricante.
- Para avaliar os efeitos terapêuticos do transplante de células, injectar 200 ul da suspensão de células contendo esferóides transfectadas com os ADNp que codifica para a eritropoietinatecido subcutâneo da região abdominal.
- Coletar amostras de sangue por sangramento submandibular obter cerca de 200 l de sangue 19. Medir a hemoglobina e hematócrito usando um analisador de amostra de sangue.
NOTA: O número de células para transplante é regulada pelo número semeadas nas placas. Infelizmente, é difícil determinar o número de células exactos, porque o número dentro de esferóides não pode ser medido.
- Coletar amostras de sangue por sangramento submandibular obter cerca de 200 l de sangue 19. Medir a hemoglobina e hematócrito usando um analisador de amostra de sangue.
- Depois de experiências, os ratinhos colocar sobre uma almofada de aquecimento ligada a um controlador de temperatura até que o despertar da anestesia.
Access restricted. Please log in or start a trial to view this content.
Resultados
Gene transfecção do Gaussia que expressam a luciferase de ADNp foi realizada nos esferóides formadas pelos hepatócitos ou MSC, utilizando nanomicelles poliplex ou o reagente de transfecção baseada em lípidos de controlo 12. Os nanomicelles induzida quase nenhuma alteração na estrutura esferóide comparação com esferóides não transfectadas nas placas micropatterned, ao passo que o reagente de controlo perturbado significativamente a estrutura de um dia após a transfecção (Fig...
Access restricted. Please log in or start a trial to view this content.
Discussão
Neste protocolo, é fundamental a manutenção da estrutura 3D de esferóides durante os passos de introdução de gene e recuperação esferóide. É essencial manter uma microambientes favoráveis para as células para evitar a morte ou perda de actividade de célula a célula. Por exemplo, a secreção de albumina, uma função representativa inato de hepatócitos, é bem preservada nos esferóides de hepatócitos, enquanto que os hepatócitos em cultura em monocamada convencionais perdem rapidamente a sua capa...
Access restricted. Please log in or start a trial to view this content.
Divulgações
The authors declare that they have no competing financial interests.
Agradecimentos
Nós apreciamos profundamente Dr. Takeshi Ikeya e pessoal técnico em Toyo Gosei, Tokyo, Japão por fornecer placas de cultura de micropadronadas termossensíveis, bem como os pareceres científicos. Agradecemos também Ms. Satomi Ogura, Ms. Sae Suzuki, Ms. Asuka Miyoshi e Ms. Katsue Morii de assistência técnica com experiências em animais. Este trabalho foi apoiado financeiramente em parte pela JSPS KAKENHI Grant-in-Aid para a Investigação Científica, o Centro de Inovação Programa (COI) eo programa de inovação S- da Agência de Ciência e Tecnologia do Japão (JST), ea JSPS Core- para-Core Programa, A. avançadas redes de pesquisa.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| Pen-Strep-Glut | GIBCO | ||
| Dexamethasone | Wako Pure Chemical Industries | 041-18861 | |
| Nicotinamide | Wako Pure Chemical Industries | 141-01202 | |
| Hank’s buffered salt and L-ascorbic acid 2-phosphate (Asc-2P) | Sigma-Aldrich | A8960 | |
| Human epidermal growth factor (hEGF) | Toyobo | PT10015 | |
| Cell-able multi-well plates | Toyo Gosei | PP-12 | |
| Thermosensitive cell culture plates (Upcell) | CellSeed Inc | The micropatterned architecture is constructed on the thermosensitive plates (custom-built by Toyo Gosei) | |
| Lipid-based transfection reagent (FuGENE HD) | Promega | E2311 | |
| Renilla Luciferase Assay System | Promega | E2810 | |
| pGL4 Luciferase Reporter Vector | Promega | E6651 | |
| pDNA expressing Gaussia luciferase | New England BioLabs | N8082S | |
| Mouse erhthropoietin-expressing vector | Origene | MC208445 | |
| pCAG-GS | Kindly provided by Laboratory for Pluripotent Cell Studies, Center for Developmental Biology, RIKEN | ||
| Escherichia coli DH5α competent cells | Takara | 9057 | |
| Endotoxin-free plasmid DNA purification system | Nippon Genetics | NucleoBond Xtra EF | |
| Collagenase | Wako Pure Chemical Industries | 639-00951 | |
| Trypsin inhibitor | GIBCO | R-007-100 | |
| Luminometer | Promega | GloMax™ 96 Microplate Luminometer | |
| IVIS Imaging System | Xenogen Corp. | Xenogen IVIS Spectrum in vivo imaging system | |
| Blood sample analyzer | Sysmex | pocH-100i Automated Hematology Analyzer |
Referências
- Landry, J., Bernier, D., Ouellet, C., Goyette, R., Marceau, N. Spheroidal aggregate culture of rat liver cells: histotypic reorganization, biomatrix deposition, and maintenance of functional activities. J Cell Biol. 101 (3), 914-923 (1985).
- Yuasa, C., Tomita, Y., Shono, M., Ishimura, K., Ichihara, A. Importance of cell aggregation for expression of liver functions and regeneration demonstrated with primary cultured hepatocytes. J Cell Physiol. 156 (3), 522-530 (1993).
- Otsuka, H., et al. Two-dimensional multiarray formation of hepatocyte spheroids on a microfabricated PEG-brush surface. Chembiochem. 5 (6), 850-855 (2004).
- Wang, W., et al. 3D spheroid culture system on micropatterned substrates for improved differentiation efficiency of multipotent mesenchymal stem cells. Biomaterials. 30 (14), 2705-2715 (2009).
- Bartosh, T. J., et al. Aggregation of human mesenchymal stromal cells (MSCs) into 3D spheroids enhances their antiinflammatory properties. Proc Natl Acad Sci U S A. 107 (31), 13724-13729 (2010).
- Frith, J. E., Thomson, B., Genever, P. G. Dynamic three-dimensional culture methods enhance mesenchymal stem cell properties and increase therapeutic potential. Tissue Eng Part C Methods. 16 (4), 735-749 (2010).
- Nakasone, Y., Yamamoto, M., Tateishi, T., Otsuka, H. Hepatocyte spheroids underlayered with nonparenchymal cells for biomedical applications. IEICE Transactions on Electronics. E94, 176-180 (2011).
- Nishida, K., et al. Corneal reconstruction with tissue-engineered cell sheets composed of autologous oral mucosal epithelium. N Engl J Med. 351 (12), 1187-1196 (2004).
- Ohashi, K., et al. Engineering functional two- and three-dimensional liver systems in vivo using hepatic tissue sheets. Nat Med. 13 (7), 880-885 (2007).
- Sekine, H., et al. Cardiac cell sheet transplantation improves damaged heart function via superior cell survival in comparison with dissociated cell injection. Tissue Eng Part A. 17 (23-24), 2973-2980 (2011).
- Itaka, K., Kataoka, K. Progress and prospects of polyplex nanomicelles for plasmid DNA delivery. Curr Gene Ther. 11 (6), 457-465 (2011).
- Endo, T., Itaka, K., Shioyama, M., Uchida, S., Kataoka, K. Gene transfection to spheroid culture system on micropatterned culture plate by polyplex nanomicelle: a novel platform of genetically-modified cell transplantation. Drug Deliv and Transl Res. 2 (5), 398-405 (2012).
- Howard, R. B., Christensen, A. K., Gibbs, F. A., Pesch, L. A. The enzymatic preparation of isolated intact parenchymal cells from rat liver. J Cell Biol. 35 (3), 675-684 (1967).
- Berry, M. N., Friend, D. S. High-yield preparation of isolated rat liver parenchymal cells: a biochemical and fine structural study. J Cell Biol. 43 (3), 506-520 (1969).
- Tateno, C., Yoshizato, K. Long-term cultivation of adult rat hepatocytes that undergo multiple cell divisions and express normal parenchymal phenotypes. Am J Pathol. 148 (2), 383-392 (1996).
- Kanayama, N., et al. A PEG-based biocompatible block catiomer with high buffering capacity for the construction of polyplex micelles showing efficient gene transfer toward primary cells. ChemMedChem. 1 (4), 439-444 (2006).
- Itaka, K., Ishii, T., Hasegawa, Y., Kataoka, K. Biodegradable polyamino acid-based polycations as safe and effective gene carrier minimizing cumulative toxicity. Biomaterials. 31 (13), 3707-3714 (2010).
- Uchida, S., et al. PEGylated Polyplex With Optimized PEG Shielding Enhances Gene Introduction in Lungs by Minimizing Inflammatory Responses. Mol Ther. 20 (6), 1196-1203 (2012).
- Golde, W. T., Gollobin, P., Rodriguez, L. L. A rapid, simple, and humane method for submandibular bleeding of mice using a lancet. Lab Anim (NY). 34, 39-43 (2005).
- Uchida, S., et al. An injectable spheroid system with genetic modification for cell transplantation therapy. Biomaterials. 35 (8), 2499-2506 (2014).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados