É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Monitoramento em tempo real de Reações realizada utilizando processamento de fluxo contínuo: A Preparação de 3-Acetylcoumarin como Exemplo
Neste Artigo
Resumo
Monitoramento em tempo real permite a otimização rápida de reações realizadas utilizando o processamento de fluxo contínuo. Aqui, a preparação de 3-acetylcoumarin é utilizado como um exemplo. O aparelho para a realização in situ de monitorização de Raman está descrito, assim como os passos necessários para a optimização da reacção.
Resumo
Ao utilizar a monitorização em linha, é possível optimizar as reacções realizadas utilizando o processamento contínuo de fluxo de uma maneira simples e rápida. Também é possível assegurar uma qualidade de produto consistente ao longo do tempo utilizando esta técnica. Nós aqui mostrar como a interface de uma unidade de fluxo disponível comercialmente com um espectrômetro Raman. A célula de fluxo de Raman é colocado após o regulador de contra-pressão, o que significa que ele pode ser operado à pressão atmosférica. Além disso, o facto de a corrente de produto passa através de um comprimento de tubagem antes de entrar na célula de fluxo significa que o material é, à TA. É importante que os espectros são adquiridas sob condições isotérmicas uma vez que a intensidade do sinal de Raman é dependente da temperatura. Tendo reunido o aparelho, que em seguida mostram como monitorar uma reacção química, a síntese catalisada por piperidina de 3-acetylcoumarin de salicilaldeído e acetoacetato de etilo a ser utilizado como um exemplo. A reacção pode ser realizada sobre uma gama de caudais umatemperaturas D, a ferramenta de monitoramento in-situ sendo usado para otimizar as condições de forma simples e fácil.
Introdução
Ao usar o processamento de fluxo contínuo, os químicos estão descobrindo que eles podem realizar uma série de reações químicas de forma segura, eficaz e com facilidade 1,2. Como resultado, química equipamento fluxo está se tornando uma ferramenta integral para a execução de reações tanto em ambientes industriais, bem como laboratórios de pesquisa em instituições acadêmicas. Uma ampla variedade de transformações de química de síntese foram efectuadas em reactores de fluxo de 3,4. Em casos seleccionados, as reacções que não funcionam em modo descontínuo têm sido mostrados para prosseguir suavemente sob condições de fluxo contínuo 5. Para tanto optimização da reacção e o controlo de qualidade, monitorização da incorporação de reacção em conformidade com o processamento de fluxo oferece vantagens significativas. Monitoramento em linha fornece uma análise contínua com resposta em tempo real às condições reais de amostra. Isto é mais rápido e, em alguns casos, mais fiável do que as técnicas comparáveis off-line. Um número de técnicas de análise em linha foram interface com fbaixos reatores 7. Exemplos incluem 8,9 infravermelho, ultravioleta-visível 10,11, 12,13 RMN, espectroscopia de Raman, 14,15, 16,17 e espectrometria de massa.
Nosso grupo de pesquisa tem interagido um espectrômetro Raman com uma unidade de microondas científica 18. Usando isso, uma série de reações foram monitoradas, tanto qualitativa e quantitativa 20 19 ponto de vista. Com base neste sucesso, temos interface recentemente o nosso espectrômetro Raman com uma de nossas unidades de fluxo contínuo e empregou-o para o monitoramento de uma série de transformações orgânicas chave relevantes para a medicinalmente reacção in-line. 21 Em cada caso, foi possível monitorar o reacções e também num exemplo, por meio de uma curva de calibração, que pode determinar a conversão do produto a partir dos dados de espectroscopia Raman. Na Aqui nós descrevemos como configurar o aparelho e usá-lo para monitorar reações. Usamos a síntese catalisada por piperidina de 3-acetylcoumarin (1) a partir de salicilaldeído com acetoacetato de etilo (Figura 1) como o modelo de reacção aqui.
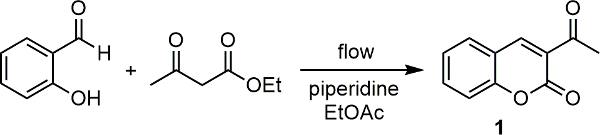
Figura 1. Base de reação catalisada condensação entre salicilalde�o e acetoacetato de etilo para produzir 3-acetylcoumarin (1). Por favor clique aqui para ver uma versão maior desta figura.
Protocolo
1. Encontre sinais adequados para monitoramento de reações
- Obter espectros Raman para todos os materiais de partida e do produto.
- Overlay espectros e identificar uma banda intensa que é exclusivo para o produto.
- Utilizar esta banda de Raman para monitorar o progresso da reacção. Uma banda em 1.608 cm-1 foi seleccionado neste caso.
2. Configure a célula de fluxo
- Obter uma célula de fluxo adequado. Aqui utilizar um com as seguintes dimensões: largura de 6,5 mm, altura de 20 mm, e um comprimento do percurso de 5 mm (Figura 2A).
- Coloque a célula de fluxo de um recipiente que fornece um ambiente livre de luz ambiente.
- Conectar tubagem para a entrada ea saída da célula de fluxo (neste caso, 1 mm ID tubagem PFA).
3. Interface do espectrômetro Raman com a célula de fluxo
- Obter um espectrómetro de Raman adequado com um conjunto óptico flexível que pode ser colocado em Cperder proximidade com a célula de fluxo.
- Colocar o conjunto óptico através de uma abertura de tamanho adequado na caixa que contém o conjunto da célula de fluxo (Figura 2B).
- Deslize o conjunto óptico até que toque a célula de fluxo e, em seguida, puxe-o de volta deixando uma lacuna de ~ 2 mm.
- Encha com a célula de fluxo de 100% de acetona.
- Ligue o espectrômetro Raman e adquirir espectros em modo contínuo-scan.
- Concentre-se o laser movendo suavemente o tubo de luz uma fração de cada vez. Mantenha mover-se do tubo de luz até que o sinal é, na sua maior intensidade e os picos são nítidas e bem definidas.

Figura 2. (A) célula de fluxo e de interface (B) Raman utilizado. Por favor clique aqui para ver uma maior version desta figura.
4. Prepare o Reagente e soluções solventes
- Adicionar salicilaldeído (6,106 g, 50 mmol, 1 equiv) e acetoacetato de etilo (6,507 g, 50 mmol, 1 equiv) para um balão volumétrico de 50 ml.
- Adiciona-se acetato de etilo para um volume total de 50 ml e, em seguida, misturar completamente os conteúdos.
- Transferir uma alíquota de 10 ml da solução de estoque a um frasco de vidro de 20 ml contendo uma barra de agitação magnética. Marque esse "reagente". Vial
- Em lugar de uma garrafa de 100 ml de 90 ml de acetato de etilo. Rotular esta garrafa "solvente". Em lugar de uma garrafa de 100 ml de 90 ml de acetona. Rotular esta garrafa "interceptar solvente".
5. Prepare o Aparelho Fluxo
- Assegure-se que a unidade de fluxo tem, pelo menos, duas bombas e classificá-los "P1" e "P2". Identificar linhas de entrada de solventes e reagentes para cada bomba. Coloque as linhas de saída do "Collect" e linhas de "resíduos" em dois individual garrafas de 100 ml rotulado "produto" e "resíduos", respectivamente.
- Como um reactor, utilizar uma bobina de 10 ml de capacidade PFA susceptível de ser aquecida.
- Ligar o tubo de saída P1 para a entrada do reactor de bobina PFA.
- Instale um três portas éter-cetona de poliéter (PEEK) T-mixer após a bobina do reator.
- Ligue o tubo de saída P2 para o tee-mixer, 180 ° do tubo de saída da bobina do reator. Conecte-se um pedaço de tubo para a terceira porta do Tee-mixer. Na outra extremidade deste tubo colocar um regulador de contra-pressão.
- Conectar uma linha a partir da saída do regulador de contra-pressão para a entrada da célula de fluxo. Conecte uma linha a partir da saída da célula de fluxo para o "/ recolha de resíduos" switch.
- Primeiro as linhas de solvente para ambos P1 e P2, bem como a linha de reagente para P1 com solvente. Mova a linha de reagente para P1 do frasco de solvente para o frasco de reagente.
- Usando P1, passar acetato de etilo através do reactorbobina a 2 ml / min, até que ela está cheia. Passe acetona através de P2, com um caudal de 2 ml / min durante 2 min.
- Ajustar as taxas de fluxo de solvente para ambos P1 e P2 para 1 ml / min. Ajuste o regulador de contra-pressão a uma pressão de 7 bar. Ajustar a temperatura da bobina do reactor até à temperatura desejada.
- Verifique a equipamento é configurado como mostrado no esquema na Figura 3.
- Uma vez que o sistema atinge a temperatura e pressão constante, verificar se há vazamentos e, em seguida, executar a reação.
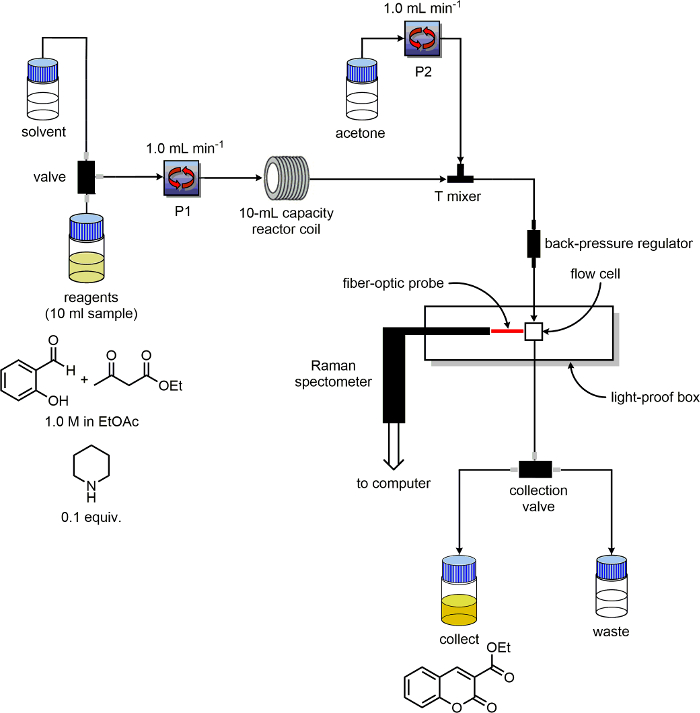
Figura 3. Diagrama esquemático da configuração do equipamento utilizado para experiências de monitoramento de reação. Por favor clique aqui para ver uma versão maior desta figura.
6. Monitorar o Reaction
- TakEA fundo de digitalização do / acetona sistema de solvente acetato de etilo, uma vez que passou através da célula de fluxo. Este será automaticamente subtraído de todas as verificações subseqüentes.
- Configurar o espectrómetro de tomar varreduras de 15 segundos cada (neste caso, o espectrómetro de Raman foi definido como um tempo de integração 10 s, vagão = 3, e a média = 1).
- Injectar piperidina (0,05 mL, 0,05 mmol, 0,1 equiv) de uma vez para dentro do frasco de vidro etiquetados "reagente".
- Depois de misturar muito bem, interruptor P1 de "solvente" para "reagente". Defina o fluxo de saída para "recolher".
- Quando todo o material está completamente carregado, interruptor P1 do "reagente" de volta para "solvente". Continue fluindo solvente através da bobina reactor durante mais 30 minutos. Uma vez transcorrido este tempo, desligar o aquecimento.
- Por sua vez, bombas P1 e P2 desligado quando a temperatura da serpentina do reactor ter arrefecido até abaixo de 50 ° C.
7. Analisar os dados
- Exportar os dados do espectrômetro Raman para uma planilha e enredo Raman intensidade em 1.608 centímetros -1 vs. Tempo.
- Para otimizar as condições, realizar a reacção através de um número de caudais e temperaturas do reactor de forma iterativa.
- Gráficos sobrepostos de Raman intensidade em 1608 centímetros -1 vs. Tempo.
Nota: Raman Superior intensidade correlaciona-se com uma conversão mais elevada do produto.
8. Execute o Reaction Usando condições otimizadas
- Tendo rastreadas várias condições (taxas de fluxo variando / temperaturas do reator), executar a reação utilizando as condições otimizadas para proporcionar o maior conversão do produto.
9. Isolar o produto
- Tome o conteúdo do frasco do produto e despeje-o em um copo contendo 100 ml de gelo e 20 ml de HCl 2 M.
- Lavar o balão de produto com uma quantidade mínima de acetato de etilo (2 ml) e transferir para a proveta.
- Mexa a mistura geladaaté que todo o gelo é completamente derretido.
- Configurar um sistema de filtração com um funil de Hirsch, frasco lateral-braço, colar de borracha e um pedaço de tubo de vácuo de borracha.
- Filtra-se o precipitado resultante sob vácuo, lavar com éter dietílico frio (10 ml) e permitir que ele para secar sob uma lâmpada de calor (2-3 h) ou O seco / N sob vácuo.
- Confirmam a identidade do produto por 1H ressonância magnética (RMN) nuclear usando CDCI3 como solvente. Para um espectrómetro de RMN de 500 MHz, os dados de 1 H RMN de 3-acetylcoumarin é como se segue: δ = 2,73 (s, 3 H) 7,31 - 7,40 (m, 2 H) 7,65 (ddd, J = 7,53, 4,37, 2,60 Hz , 2 H) 8,51 (s, 1H) ppm, 13 de dados C RMN: δ = 30,84 (CH3) 117.00 (CH), 118,56 (C), 124,86 (CH), 125,27 (CH), 130,51 (CH), 134,68 (C) 147,74 (CH) 155,64 (C), 159,52 (C), 195,77 (C) ppm.
Resultados
A preparação contínua de fluxo de 3-acetylcoumarin foi escolhido como representativo de uma reacção para a monitorização em linha. No lote, a reacção processa-se bem quando se utiliza acetato de etilo como o solvente. No entanto, o produto (1) não é completamente solúvel à temperatura ambiente. Para evitar potencial entupimento do regulador de contra-pressão, bem como minimizar o risco de ter partículas sólidas na célula de fluxo que iria perturbar a aquisição de sinal, utilizou-se um...
Discussão
A facilidade com que o espectrómetro de Raman pode ser interligado com a unidade de fluxo faz com que esta técnica valiosa para a monitorização em linha de reacção. Um certo número de variáveis de reacção pode ser sondado de modo expedito, permitindo que o utilizador chegar a condições de reacção optimizadas rápido do que quando utilizando métodos off-line. A aplicação das técnicas aqui descritas, permite também a monitorização da formação de produtos secundários, assumindo uma banda aprop...
Divulgações
The authors have nothing to disclose.
Agradecimentos
Financial support provided by National Science Foundation (CAREER award CHE-0847262. We thank Vapourtec Ltd and Enwave Optronics for equipment support, and Daniel Daleb of the University of Connecticut for his assistance in construction of the flow cell apparatus.
Materiais
| Name | Company | Catalog Number | Comments |
| Salicylaldehyde | Sigma-Aldrich | S356 | Reagent Grade, 98% |
| Ethyl acetoacetate | Acros Organics | 117970010 | 99% |
| Piperidine | Sigma-Aldrich | 104094 | Reagent Plus, 99% |
| Hydrochloric acid | Sigma-Aldrich | 320331 | ACS Reagent, 37% |
| Ethyl acetate | Sigma-Aldrich | 34858 | CHROMASOLV, for HPLC, >99.7% |
| Acetone | Sigma-Aldrich | 650501 | CHROMASOLV, for HPLC, >99.9% |
| Flow cell | Starna Cells | 583.65.65-Q-5/Z20 | |
| Flow unit | Vapourtec | E-series system | |
| Raman spectrometer | Enwave Optronics Inc | Model EZRaman-L |
Referências
- Wiles, C., Watts, P. . Micro Reaction Technology in Organic Synthesis. , (2011).
- van den Broek, S. A. M. W., et al. Continuous Flow Production of Thermally Unstable Intermediates in a Microreactor with Inline IR-Analysis: Controlled Vilsmeier–Haack Formylation of Electron-Rich Arenes. Org. Process Res. Dev. 16 (5), 934-938 (2012).
- Baxendale, I. R. The integration of flow reactors into synthetic organic chemistry. J. Chem. Technol. Biotechnol. 88 (4), 519-552 (2013).
- Malet-Sanz, L., Susanne, F. Continuous Flow Synthesis. A Pharma Perspective J. Med. Chem. 55 (9), 4062-4098 (2012).
- Hartwig, J., Metternich, J. B., Nikzad, N., Kirschning, A., Ley, S. V. Continuous flow chemistry: a discovery tool for new chemical reactivity patterns. Org. Biomol. Chem. 12 (22), 3611-3615 (2014).
- De Beer, T., et al. Near infrared and Raman spectroscopy for the in-process monitoring of pharmaceutical production processes. Int. J. Pharm. 417, 32-47 (2001).
- McMullen, J. P., Jensen, K. F. Integrated microreactors for reaction automation: New approaches to reaction development. Annu. Rev. Anal. Chem. 3, 19-42 (2010).
- Moore, J. S., Jensen, K. F. Automated multitrajectory method for reaction optimization in a microfluidic system using online IR analysis. Org. Process Res. Dev. 16 (8), 1409-1415 (2012).
- Carter, C. F., et al. ReactIR Flow Cell: A New Analytical Tool for Continuous Flow Chemical Processing. Org. Process Res. Dev. 14 (2), 393-404 (2010).
- Ferstl, W., et al. Inline Analysis in Microreaction Technology: A Suitable Tool for Process Screening and Optimization. Chem. Eng. Technol. 30 (3), 370-378 (2007).
- Benito-Lopez, F., et al. Optical fiber-based on-line UV/Vis spectroscopic monitoring of chemical reaction kinetics under high pressure in a capillary microreactor. Chem. Commun. (22), 2857-2859 (2005).
- Gökay, O., Albert, K. From single to multiple microcoil flow probe NMR and related capillary techniques: a review. Anal. Bioanal. Chem. 402 (2), 647-669 (2012).
- Jones, C. J., Larive, C. K. Could smaller really be better? Current and future trends in high-resolution microcoil NMR spectroscopy. Anal. Bioanal. Chem. 402 (1), 61-68 (2012).
- Mozharov, S., et al. Improved Method for Kinetic Studies in Microreactors Using Flow Manipulation and Noninvasive Raman Spectrometry. J. Am. Chem. Soc. 133 (10), 3601-3608 (2011).
- Chaplain, G., Haswell, S. J., Fletcher, P. D. I., Kelly, S. M., Mansfield, A. Development and evaluation of a Raman flow cell for monitoring continuous flow reactions. Aust. J. Chem. 66 (2), 208-212 (2013).
- Browne, D. L., et al. Continuous flow reaction monitoring using an on-line miniature mass spectrometer. Rapid Comm. Mass. Spectrosc. 26 (17), (1999).
- Koster, S., Verpoorte, E. A decade of microfluidic analysis coupled with electrospray mass spectrometry: An overview. Lab Chip. 7 (11), 1394-1412 (2007).
- Leadbeater, N. E., Schmink, J. R., Hamlin, T. A., de la Hoz, A., Loupy, A. Tools for Monitoring Reactions Performed Using Microwave Heating. Microwaves in Organic Synthesis. 1, 327-376 (2012).
- Leadbeater, N. E., Schmink, J. R. Use of Raman spectroscopy as a tool for in situ. monitoring of microwave-promoted reactions. Nature Protoc. 3 (1), 1-7 (2008).
- Schmink, J. R., Holcomb, J. L., Leadbeater, N. E. Use of Raman spectroscopy as an In Situ. Tool to Obtain Kinetic Data for Organic Transformations. Chem. Eur. J. 14 (32), 9943-9950 (2008).
- Hamlin, T. A., Leadbeater, N. E. Raman spectroscopy as a tool for monitoring mesoscale continuous-flow organic synthesis: Equipment interface and assessment in four medicinally-relevant reactions. Beilstein J. Org. Chem. 9, 1843-1852 (2013).
- Kelly, C. B., Lee, C., Leadbeater, N. E. An approach for continuous-flow processing of reactions that involve the in situ. formation of organic products. Tetrahedron Lett. 52 (2), 263-265 (2011).
- Wren, S. N., Donaldson, D. J. Glancing-angle Raman spectroscopic probe for reaction kinetics at water surfaces. Phys. Chem. Chem. Phys. 12, 2648-2654 (2010).
- Leadbeater, N. E., Smith, R. J. Real-Time Monitoring of Microwave-Promoted Suzuki Coupling Reactions Using in Situ. Raman Spectroscopy. Org. Lett. 8 (20), 4589-4591 (2006).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados