Method Article
In Situ Ca 2+ Imagem do Sistema Nervoso Entérico
Neste Artigo
Resumo
The enteric nervous system (ENS) is a network of neurons and glia located in the gut wall that controls intestinal reflexes. This protocol describes methods for recording the activity of enteric neurons and glia in live preparations of ENS using Ca2+ imaging.
Resumo
Reflex behaviors of the intestine are controlled by the enteric nervous system (ENS). The ENS is an integrative network of neurons and glia in two ganglionated plexuses housed in the gut wall. Enteric neurons and enteric glia are the only cell types within the enteric ganglia. The activity of enteric neurons and glia is responsible for coordinating intestinal functions. This protocol describes methods for observing the activity of neurons and glia within the intact ENS by imaging intracellular calcium (Ca2+) transients with fluorescent indicator dyes. Our technical discussion focuses on methods for Ca2+ imaging in whole-mount preparations of the myenteric plexus from the rodent bowel. Bulk loading of ENS whole-mounts with a high-affinity Ca2+ indicator such as Fluo-4 permits measurements of Ca2+ responses in individual neurons or glial cells. These responses can be evoked repeatedly and reliably, which permits quantitative studies using pharmacological tools. Ca2+ responses in cells of the ENS are recorded using a fluorescence microscope equipped with a cooled charge-coupled device (CCD) camera. Fluorescence measurements obtained using Ca2+ imaging in whole-mount preparations offer a straightforward means of characterizing the mechanisms and potential functional consequences of Ca2+ responses in enteric neurons and glial cells.
Introdução
O sistema nervoso entérico (ENS) está organizado em dois plexos ganglionados embutidas na parede do trato digestivo 1. Estes circuitos neurais intramusculares, o plexo mientérico (MP) e plexo submucosa (PMS), são compostas de neurónios e células da glia entérico (Figura 1) 2. O MP e SMP regular gastrointestinais (GI) funções tais como a motilidade intestinal e absorção epitelial e secreção, respectivamente 3. Glia Entérico estão localizados em estreita proximidade com os neurônios dentro gânglios mas populações de glia entérico também existem dentro interligando tratos de fibras e porções extra-ganglionares da parede do intestino 3,4. Glia entéricos foram originalmente acreditado para fornecer apenas suporte nutritivo para os neurônios. No entanto, estudos recentes sugerem fortemente que as interações neurônio-glia são essenciais para ENS funciona 5,6. Por exemplo, os dados mostram que as células da glia entérico "ouvir" a actividade neuronal 7e modulam circuitos neuronais 6,8, proteger os neurônios entéricos de estresse oxidativo 9 e são capazes de gerar novos neurônios entéricos em resposta à lesão 10,11. O protocolo apresentado nesta revisão técnica fornece um método simples e robusta para examinar a complexa interação entre neurônios e células gliais entéricas usando in situ Ca2 + intracelular de imagem.
Ca 2+ é uma molécula de sinalização onipresente em células excitáveis e desempenha um papel essencial em eventos de sinalização sináptica no sistema nervoso 12. Excitação de neurônios ou células gliais entéricas provoca uma elevação na concentração citoplasmática de Ca2 + ou pelo influxo através de canais de Ca2 + -permeable ou Ca 2+ liberação dos estoques intracelulares de cálcio. Imagem Ca 2 + transientes em neurônios e células gliais com corantes fluorescentes é uma técnica amplamente utilizada para estudar a organização funcional e dinâmica do estabelecido ea 13-17 ENS. Ca 2+ de imagem tem se mostrado uma ferramenta importante no estudo de segmentos de tecido GI intactas para elucidar a propagação da excitabilidade por meio de redes de marcapasso ICC 18 e intestino músculo liso 19,20. Ele permite que os pesquisadores para investigar um amplo espectro de parâmetros fisiológicos e fornece informação sobre as sua distribuição espacial e dinâmica temporal. As células podem ser eficientemente manchado de forma minimamente invasiva por meio de indicadores fluorescentes à membrana permeável e protocolos de coloração otimizados 21. Isto oferece a oportunidade de monitorizar um grande número de neurónios e células da glia entérico em preparações funcionalmente conservados 14-16,22, bem como in vivo 23. Whole mount-preparações de tecido são granel carregado com um corante indicador de afinidade elevada de Ca 2+, tais como Fluo-4 que aumenta a sua fluorescência quando ligados a Ca 2+. Mudanças na fluorescência são registradas por uma câmera CCD e analisadas digitalmente 6. O advento da Ca 2+ proporcionou a oportunidade de acompanhar de neurônios e células glia interações, a capacidade de resposta a vários estímulos, e o envolvimento desses tipos de células em processos gastrointestinais em tempo real.
In situ Ca 2+ imaging rendeu grande visão sobre os mecanismos de sinalização de neurônios entéricos e glia e possui diversas vantagens em relação aos modelos de cultura de células 6,24. Primeiro, in situ preparações manter o ambiente da matriz nativa de neurônios e células gliais e deixar a maior parte de suas conexões para atingir tecido intacto. Em segundo lugar, a genética e morfologia da glia entérico culta é significativamente alterada em comparação com in vivo 6,24. Terceiro, muitas interacções heterotípicos são perdidos em cultura de células primárias e estabelecer limites, que avaliam as interacções célula-célula. Embora as células cultivadas são bem adequados para a investigação de propriedades fundamentais, a sua usefulness para o estudo de interações complexas entre glia e neurônios entéricos é limitado. Investigando interação neurônio-glia utilizando uma abordagem in situ é mais fisiologicamente relevante como as vias sinápticas permanecem intactos 25. Em comparação com as abordagens de cultura de células, uma abordagem em situ oferece melhores condições para compreender sistematicamente as interações complexas entre neurônios e glia entérico. Além disso, a organização planar do plexo ganglionados em preparações inteiras de montagem é ideal para imagens fluorescentes de Ca 2+ intracelular transientes e esta técnica fornece uma abordagem simples para avaliar a atividade do neurônio-glia na ENS.
Protocolo
NOTA: Os procedimentos a seguir que envolvem o tecido de animais de laboratório são consistentes com as Diretrizes AVMA para a eutanásia de animais para 2013 e foram aprovados com antecedência pela Michigan State University IACUC.
1. Preparação do Tecido
- Anestesiar pesquisa animal numa câmara contendo 2,5% de isoflurano em oxigénio ou colocando 3-5 ml de isoflurano líquido sobre um material absorvente sobre o chão da câmara, assegurando que uma barreira física impede os animais de um contacto directo com o isoflurano. Teste para a profundidade da anestesia, apertando a pata.
NOTA: A profundidade da anestesia é considerado apropriado quando não há reflexo de retirada do membro posterior. Uma vez devidamente anestesiados, sacrificar o mouse por deslocamento cervical - Colocar o animal em decúbito dorsal e limpar a pele abdominal com etanol 70%. Use uma pinça para beliscar a pele abdominal na linha média e usar uma tesoura cirúrgica para fazer uma media 6 centímetrosl incisão ao longo da linha alba para expor órgãos digestivos internos.
- Use uma pinça sem corte para localizar e expor o íleo dentro do peritônio. Corte o mesentério ileal / cólon com uma tesoura e começar a desvendar o intestino.
- Uma vez que o comprimento do intestino delgado é adequadamente desvendados, cortar o intestino distai para o estômago e proximal do ceco para uma preparação de íleo. Para uma grande preparação intestino, cortar o cólon distai ao ceco e proximal ao recto.
- Remover rapidamente o segmento intestinal e colocá-lo num copo com meio DMEM / F12 suplementado com cloridrato nicardipine 3? M e 1 PM cloridrato de escopolamina (doravante referida como "media") em gelo. A adição destes inibidores facilita microdissection e imagem posterior por paralisar o músculo liso do intestino.
- Cortar segmento de interesse (por exemplo, jejuno, íleo, cólon distai ou proximal) com base em marcadores anatómicos estabelecidos. Normalmente utilize tecido do íleo terminal ou o cólon distai. No entanto, utilize o mesmo procedimento básico para isolar, de carga e de imagem neurônios mioentéricos e glia em todas as regiões intestinais.
- Retirar um pequeno segmento (4-6 cm) do segmento de intestino desejada e coloque em uma placa de Petri Sylgard revestido preenchido com media gelada.
- Fixar as extremidades proximal e distal do segmento intestinal com os pinos de insetos e abrir o tubo intestinal, por fazer uma sequência no sentido do comprimento cortado ao longo da fronteira mesentérica.
- Tecido Pin plana sob tensão luz com o lado mucosa e dissecar cuidadosamente afastado camada mucosa usando uma pinça fina (# 5 e # 5/45 trabalho melhor) e tesoura primavera muito finas.
NOTA: A remoção da mucosa pode ser bastante traumático para o ENS se não for feita correctamente. Para as preparações de qualidade, tome cuidado para limitar a remoção abrupta da mucosa por descamação ou raspagem. A melhor prática é para levantar a mucosa e cortar por baixo com uma tesoura fina. - Corte o tecido em preparação menors (aproximadamente 0,5 cm 2) e pinos em placas de imagem (4 cantos com camada muscular circular voltada para cima) colocados no gelo com meio fresco.
- Dissecar cuidadosamente afastado músculo circular por provocando distante com uma pinça fina para expor o plexo mioentérico. Evitar o alongamento excessivo.
- Coloque imaging prato de volta no gelo e na mudança solução por meio fresco.
- Prepare a 2 ml de mistura de enzima por prato [Dispase 1 U / ml (4,48 mg / 8 ml), colagenase tipo II 150 U / ml (5,45 mg / 8 ml) em meio].
- Retirar pratos de gelo e adicione a mistura de enzimas a partir do passo 1.13.
- Incubar pratos à TA durante 15 min com 5% de CO2 / 95% ar.
- Preparações de tecido lavar com mídia 3 vezes e cantos re-pin.
2. Carregando Fluo-4 Dye
NOTA: Evite a fotodegradação, trabalhando com luz limitada durante o manuseio de corantes fluorescentes e tecidos carregados com corantes indicadores.
- Prepare 4 uM Fluo-4 solução de carregamento.
- Adicionar 1,5 ml de mídia e 1,2 l de um estoque probenecida 250 mm a uma alíquota de 1,5 mL de 4 mM Fluo-4 estoque. 4 mM de Fluo-4 é preparada por adição de 11,4 ul de Pluronic F-127 (20% em DMSO; suplementado com 0,25% cremaphor-EL) a 50 ug de Fluo-4, AM.
- Incubar preps em Fluo-4 solução de carga durante 45 min numa incubadora de escuro a 37 ° C.
- Remover da incubadora e lave preparações à mídia 3 vezes.
- Meios de troca para meio contendo 200 uM de probenecid e incubar 15 min a 37 ° C antes de imagem.
NOTA: Probenecid é uma droga que inibe transportadores multirresistência em neurônios. A adição desta droga inibe a capacidade dos neurónios para extrudir corantes e aumenta a marcação neuronal. -Carregamento a granel de Ca 2+ corantes indicadores na ausência de probenecida produz célula de carga, principalmente glial. A adição de probenecid permite a visualização das respostas neuronais e gliais. - Prepare Modificado Kretampão bs.
- Adicione um tampão de Krebs modificada de tal modo que as concentrações finais (em mm) dos componentes são como se segue: 121 de NaCl, 5,9 de KCl, 2,5 de CaCl2, 1,2 de MgCl2, 1,2 de NaH 2 PO 4, 10 HEPES, 21,2 NaHCO3, 1 pirúvico e ácido 8 glicose (pH ajustado para 7,4 com NaOH). Adiciona-se 3 uM de nicardipina e 1 uM escopolamina para inibir as contracções musculares durante Ca 2+ imagiologia e todo o monte dissecações.
3. Imagem e Análise
NOTA: Utilize pelo menos um equipamento básico de imagem com uma fonte de luz fluorescente, microscópio, uma câmera CCD qualidade e software de aquisição apropriado. Variar a adição de outros componentes, dependendo da fonte de luz e da aplicação específica. A roda de filtros e do obturador deve ser usado com uma fonte de luz xenon arco tradicional. No entanto, fontes de luz LED e sistemas de iluminação não requerem esses componentes.
- Posicione o recording câmara sob o microscópio e utilizando um sistema de perfusão de escoamento por gravidade, com vários reservatórios de seringas aquecidas estabelecer uma taxa de perfusão contínua de 2-3 ml / min de 37 ° C tampão de Krebs. Certifique-se para impedir a formação de bolhas de ar em ambas as linhas de entrada e de sucção ligada a um sifão de vácuo.
- Traga o plexo desejados em foco sob iluminação de campo claro. Evitar overexposing tecido, o que pode levar a foto branqueamento.
- Examine o Fluo-4 loading dentro de gânglios e selecione gânglios saudável para a imagem latente. / Gânglios danificadas insalubres irá apresentar autofluorescência ou pontuada morfologia e não deve ser usada para imprimir.
- Uma vez gânglio é selecionado, desviar a trajetória da luz para a câmera e obter uma imagem ao vivo com software de aquisição de imagem. Certifique-se de que gânglio está em foco e definir a taxa de aquisição de imagens e tempos de exposição.
NOTA: as taxas de aquisição de imagem e tempos vão variar de acordo com os eventos investigadores deseja gravar. Para a maioria dos experimentos, imagenssão tradicionalmente adquiridas a 0,5-1 Hz para as células gliais e até 10/02 Hz para os neurônios, porque as respostas glial Ca 2+ não são tão rápido como Ca 2+ transientes em neurônios. - Comece a experiência e estabelecer actividade de base por 30 s.
- Aplicar drogas pré-aquecidas de interesse, tais como agonistas e antagonistas utilizando o sistema de perfusão de fluxo por gravidade a um caudal de 2-3 ml / min. Siga aplicação de agonistas / antagonistas de retorno a uma perfusão de tampão normal e permitir um período de lavagem / recuperação de pelo menos 10 min.
NOTA: Os tempos de aplicação de drogas pode variar dependendo do composto individual e desenho experimental. Em geral, uma aplicação de 20-30 seg agonista é suficiente para activar a proteína G de receptores acoplados em neurónios e células gliais. Entretanto, os canais iónicos dependentes de ligante (como receptores nicotínicos de acetilcolina) exigem épocas de aplicação de, no máximo, 5-10 seg. As exposições da duração causará canais iônicos ligando fechado para dese rapidamentensitize. Antagonistas deve ser aplicada durante aproximadamente 3-15 minutos para assegurar o bloqueio completo das vias do receptor. No entanto, esta é uma generalização grosseira e os investigadores devem sempre otimizar qualquer droga experimental em seu paradigma particular. - Parar a gravação e exibição de filme de lapso de tempo do experimento. Selecionar cuidadosamente regiões de interesse (de ROI) usando o software de análise de imagem adequada.
- Use software para normalizar e comparar ROI intensidade de fluorescência contra o seu valor fluorescente linha de base inicial. Alterações na fluorescência normalizada são directamente proporcionais às variações na [Ca 2+].
- Utilize uma modificação de um método descrito anteriormente 26 utilizando Af / F = ((F 1 - 0 F) / F 0) ROI - ((F 1 - F 0) / 0 F) do fundo, em que F1 é a fluorescência em qualquer ponto e F0 é a fluorescência de base, para melhorar a precisão de avaliação. Isso ajuda a modificaçãona redução do ruído a partir de alterações de fluorescência em preparações de tecidos que apresentam movimento da camada muscular subjacente ao plexo mioentérico.
Resultados
A utilização adequada desta técnica permite aos investigadores para medir com precisão de Ca2 + intracelular [Ca2 +] i transientes em neurônios entéricos e glia em todo o monte preparações de tecido. Um exemplo representativo de um evocou-agonistas Ca 2+ respostas em glia dentro de um gânglio myenteric do cólon do rato é mostrado no vídeo 1. Os resultados a seguir são destinadas a ilustrar alguns resultados representativos temos obtidos utilizando este método. Em primeiro lugar, a Figura 2 ilustra os resultados de uma experiência de medição da glia entérico [Ca 2+] i alterações em resposta à estimulação por ATP dentro do cólon de cobaia longitudinal do plexo mientérico do músculo (PMLM preparações). Especificamente, esta figura mostra o método de análise apropriada do protocolo experimental listadas acima, incluindo o contorno do gânglio e asteriscos denotam a localização dos neurónios entéricos mientérico analisados. Estes resultados também illustrate a dose ideal de cem ATP micromolar sobre a mobilização de [Ca2 +] i em cobaias glia myenteric. Esta resposta pode ser utilizado para calibrar a estimulação da glia entérico e normalizar as respostas a estímulos testar. A seguir, a figura 3 elucida como seleccionar adequadamente as regiões de interesse (ROI) que envolve as células gliais, mostrado com circundante círculos amarelos. Estes resultados também mostram que as alterações de fluorescência desejadas em condições basais e em resposta a estímulos farmacológicos. Finalmente, a Figura 4 mostra as considerações espaciais para a escolha de glia entérico e neurônios para [Ca2 +] i respostas em preparações Todo-mount.
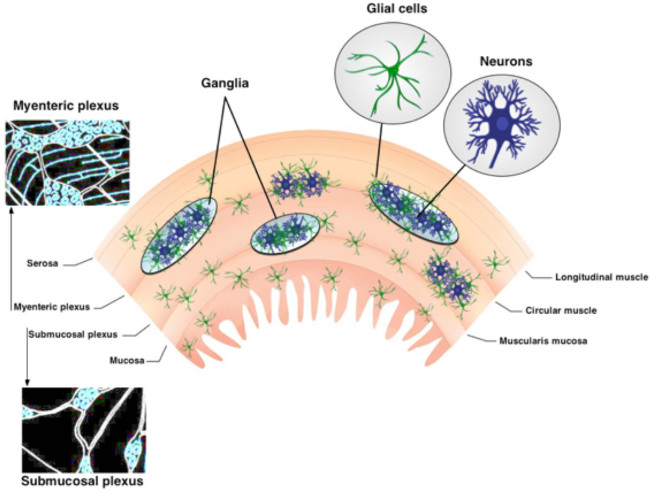
Figura 1. Organização das ENS. A ENS contém dois principais plexos ganglionados. O plexo mioentérico está localizado entre o lcamadas musculares ongitudinal e circulares. O plexo submucosa está situado entre a mucosa e da camada muscular circular. A ENS é exclusivamente composta de neurônios e células gliais entérico. Tratos de fibras do nervo conectar os gânglios. Por favor, clique aqui para ver uma versão maior desta figura.
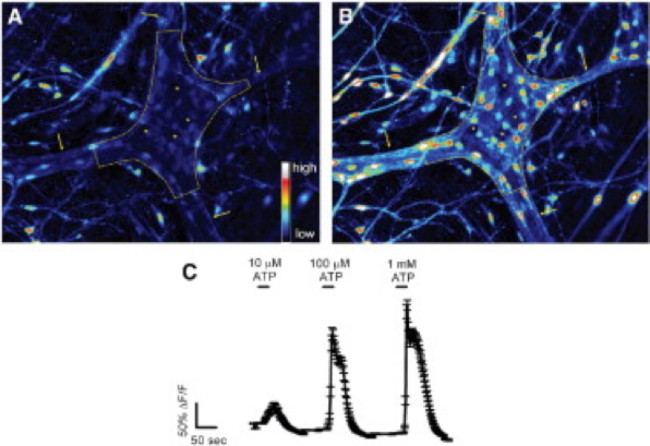
Figura 2. Entérico glia na cobaia colônica plexo mioentérico respondem ao ATP in situ. (A) Fluo-4 fluorescência em um gânglio myenteric (delineado pela linha tracejada) em condições basais. As setas apontam para feixes de fibras interganglionic espessura. (B) Após a estimulação com 100 mmol / L ATP, as células gliais, mas não neurônios, aumentar rapidamente Fluo-4 fluorescência indicando um aumento da [Ca 2+] i. Note-se que as células que respondem são pequenos e rodear os neurónios muito maiores (espaços escuros marcados por asteriscos). (C) glia entérico responder ao ATP de um modo dependente da dose com 1 mmol / L eliciar respostas máximas de 24. Por favor clique aqui para ler um versão maior desta figura.
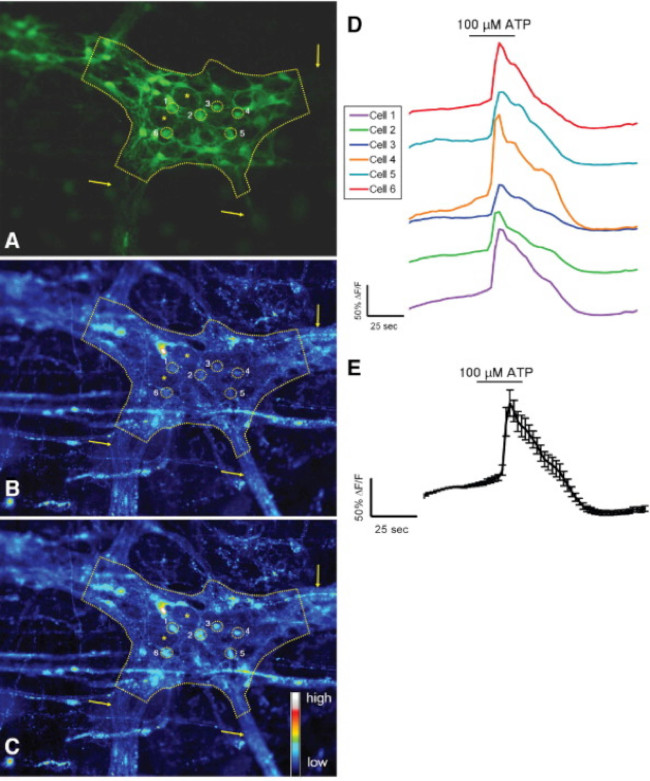
Figura 3. Murino células S-100-GFP + no cólon respondem plexo mientérico de ATP in situ. (A) células gliais (verde) em um rato do cólon gânglio mientérico S-100-GFP + (descritos pela linha tracejada). Seis regiões de interesse (ROI) que envolve as células gliais dentro do gânglio são mostrados como círculos amarelos. As setas indicam tratos de fibras grossas que levam até o gânglio. Os asteriscos dlocalização enote de 2 neurônios entéricos. (B) Same gânglio mostrando Rhod-2 de fluorescência em condições basais. (C) Após a estimulação com 100 mmol / L ATP, as células gliais responder com aumento [Ca2 +] i, como mostrado pelo aumento Rhod- 2 de fluorescência. (D) Traces correspondente a cada ROI mostrado na A-C. (E) resposta média (média ± SEM) das 6 ROIs mostrados na D 24. Por favor, clique aqui para ver uma versão maior desta figura.
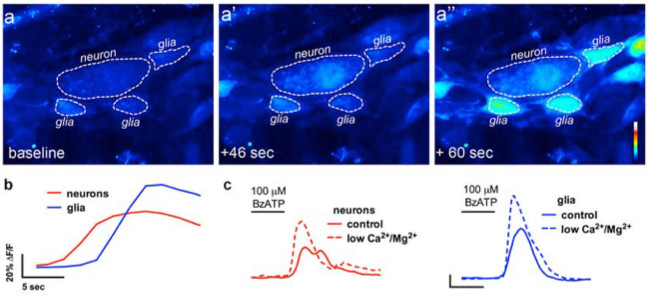
Figura 4. Em imagiologia in situ de comunicação entérico neurónio-glia-a. (A) (Imagens representativas pseudocolored) a partir de uma experiência de imagem Ca 2+ onde um todo-mountpreparação de plexo mientérico foi desafiado com o agonista do receptor P2X7 neuronal BzATP (100 pM, 30 s). Note-se que o agonista neuronal provoca um aumento na fluorescência Fluo4 no neurónio (A '), antes de as células gliais circundantes entéricos (A "). (B) Análise da alteração na fluorescência ao longo do tempo em células da glia (azul) e os neurónios (vermelho ) após a aplicação do agonista neuronal, BzATP. (C) neuronal e da glia respostas de BzATP em tampão normais (linhas sólidas) e em tampão com baixo Ca 2+ e Mg 2+ (linhas tracejadas) para potenciar receptores P2X7 neuronais 13. Por favor clique aqui para ver uma versão maior desta figura.
Vídeo 1. evocada pelo agonista Ca 2+ em resposta glia entéricositu. Este vídeo mostra um gânglio myenteric do cólon distal do rato carregado com o Ca 2+ corante indicador, Fluo-4. O agonista de células da glia, ADP, é adicionado ao banho, quando indicado. ADP provoca um aumento intracelular de Ca2 + em glia entérico como observado pela elevação transitória em Fluo-4 fluorescência. Por favor clique aqui para ver este vídeo.
Discussão
The methodologies described in this manuscript provide a consistent approach to effectively study neurons and enteric glia in the ENS. Although imaging neurons and enteric glia in culture has yielded a wealth of insight into the function of individual cells, studying these cells in their native, multi-cellular environment is crucial for our understanding their physiology and pathophysiology. Fluorescence microscopy is a crucial technique for assessing multidirectional interactions of cells in the ENS. Loading cells of the ENS with selective fluorescent markers and image acquisition with high-resolution microscopy permits quantitative observations of cellular activity in the ENS. Imaging live tissue samples of the ENS is performed relatively quickly and generates large amounts of in-depth functional and spatial data. Mouse myenteric and submucosal plexus preparations used in these experiments allow for molecular and genetic manipulation approaches. Ca2+ imaging in whole-mount preparations provides a useful tool for the assessment of neuron-glia interactions.
In advanced experimental paradigms, several probes can be combined to obtain information about different events within the cells. Fluorescence microscopy can record images with enhanced contrast of specific molecules, if an appropriate fluorescent label is used. Fluo-4 was chosen because it possesses a large dynamic range. Sufficient incubation time is vital when using the AM dyes in ENS. Dye concentration and loading method may need to be adjusted to achieve best results. Ideal preparations should be loaded with sufficient dye to visualize changes in fluorescence but not so much so that the dye chelates the target ions and interferes with intracellular signaling. Exposure to fluorescent light should be limited to prevent phototoxicity in cells and photobleaching of dyes.
Investigators must be careful with several steps of this experiment, especially solution and tissue preparation. Particular care has to be taken during processing and dissection of ENS tissue in order to maintain cellular functions. The GI tract contains several layers and tissue varieties, which pose challenges for dissection and imaging quality in these whole-mount preparations 27. Furthermore, the interconnecting fiber tracts of the MP are wider and ganglia are larger than those of the SMP 2. The neuronal density of the myenteric plexus is higher compared to that of the submucosal plexus 28. Slow and imprecise dissections will have detrimental effects on the quality of the plexus preparations and thus the overall success of the experiments. Therefore, clean/undamaged tools, practice and manual dexterity are critical to this procedure.
In whole-mount tissue preparations, careful consideration should be taken when drawing the regions of interest (ROI) to correctly assess the kinetics and degree of observed change in fluorescence intensity of the desired cell type. As the ganglia are located on a contractile muscle layer, motion artifacts caused by gut motility are a primary concern during in situ imaging. Thus, suppressing these motion disturbances through re-pinning tissue preparations after incubation with enzymes and the addition of pharmacological inhibition (nicardipine/scopolamine) to buffers permits clear and reliable image acquisition. Aside from pharmacology and mechanical approaches to prevent tissue movement, recent studies illustrate the application of advanced software methodologies and cell type response characteristics to correct for residual tissue movement in the recordings and improve the accuracy of analysis 29. Barring these technical hurdles, this method provides physiologically relevant conditions to assess morphologic and quantitative characteristics of neurons and enteric glia in the ENS.
Divulgações
The authors have nothing to disclose.
Agradecimentos
This work was supported by grants from the Pharmaceutical Research and Manufacturers Association of America (PhRMA) Foundation (to B. Gulbransen), National Institutes of Health (Building Interdisciplinary Research Careers in Women’s Health) grant K12 HD065879 (B. Gulbransen) and start-up funds from Michigan State University (B. Gulbransen).
Materiais
| Name | Company | Catalog Number | Comments |
| BubbleStop Syringe Heater | AutoMate Scientific | 10-4-35-G | |
| CaCl2 | Sigma | C3306 | |
| Collagenase, Type II, powder | Gibco | 17101-015 | |
| Dispase | Sigma-Aldrich | 42613-33-2 | |
| Dissection tools | Roboz | ||
| DMSO | Sigma-Aldrich | D5879 | |
| Fixed-stage microscope | Olympus | BX51WI | |
| Fluo-4 AM dye | Invitrogen | F-14201 | |
| Glucose | Sigma | G8270 | |
| Insect pins | Fine Science Tools | Minutien Pins | |
| iQ Live Cell Imaging Software | Andor | Andor iQ3 | |
| KCl | Sigma | P3911 | |
| MgCl2 | Sigma | M9272 | |
| NaCl | Sigma | S9888 | |
| NaH2PO4 | Sigma | S8282 | |
| NaHCO3 | Sigma | S6014 | |
| Neo sCMOS camera | Andor | Neo 5.5 sCMOS | |
| Nicardipine | Sigma | N7510 | |
| Perfusion chamber | Custom | ||
| Peristaltic pump | Harvard Apparatus | Model 720 | |
| Pluronic F-127 | Invitrogen | P3000MP | |
| Probenecid | Molecular Probes | P36400 | |
| Scopolamine | Sigma | S1013 | |
| Sutter Lambda DG-4 | Sutter | DG-4 | |
| Sylgard | Dow Corning | 184 | |
| Temperature Controller | Warner Instruments | TC-344C |
Referências
- Furness, J. B. Types of neurons in the enteric nervous system. Journal of the Autonomic Nervous System. 81 (1-3), 87-96 (2000).
- Furness, J. B. The organization of the autonomic nervous system: peripheral connections. Neuroscience. 130 (1-2), 1-5 (2006).
- Pham, T. D., Gershon, M. D., Rothman, T. P. Time of origin of neurons in the murine enteric nervous system: sequence in relation to phenotype. Journal of Comparative Neurology. 314 (4), 789-798 (1991).
- Nasser, Y., et al. Role of enteric glia in intestinal physiology: effects of the gliotoxin fluorocitrate on motor and secretory function. Am J Physiol Gastrointest Liver Physiol. 291, G912-927 (2006).
- . Glial cells in the gut. Neurogastroenterology & Motility. 17 (6), 777-790 (2005).
- Broadhead, M. J., Bayguinov, P. O., Okamoto, T., Heredia, D. J., Smith, T. K. Ca2+ transients in myenteric glial cells during the colonic migrating motor complex in the isolated murine large intestine. J. Physiol. 590, 335-350 (2012).
- Gulbransen, B. D., Bains, J. S., Sharkey, K. A. Enteric glia are targets of the sympathetic innervation of the myenteric plexus in the guinea pig distal colon. J. Neurosci. 30, 6801-6809 (2010).
- McClain, J. L., et al. Ca2+ Responses in Enteric Glia Are Mediated by Connexin-43 Hemichannels and Modulate Colonic Transit in Mice. Gastroenterology. 146 (2), 497-507 (2014).
- Chandrasekharan, B., et al. Colonic motor dysfunction in human diabetes is associated with enteric neuronal loss and increased oxidative stress. Neurogastroenterology & Motility. 23 (2), e131-e126 (2011).
- Abdo, H., et al. Enteric glial cells protect neurons from oxidative stress in part via reduced glutathione. FASEB J. 24, 1082-1092 (2010).
- Aube, A. C., et al. Changes in enteric neurone phenotype and intestinal functions in a transgenic mouse model of enteric glia disruption. Gut. 55, 630-637 (2006).
- Berridge, M. J., Lipp, P., Bootman, M. D. The versatility and universality of calcium signalling. Nature Reviews Molecular cell biology. 1 (1), 11-21 (2000).
- Gulbransen, B. D., et al. Activation of neuronal P2X7 receptor-pannexin-1 mediates death of enteric neurons during colitis. Nat Med. 18, 600-604 (2012).
- Bayguinov, P. O., Hennig, G. W., Smith, T. K. Calcium activity in different classes of myenteric neurons underlying the migrating motor complex in the murine colon. J Physiol. 588, 399-421 (2010).
- Okamoto, T., Bayguinov, P. O., Broadhead, M. J., Smith, T. K. Ca(2+) transients in submucous neurons during the colonic migrating motor complex in the isolated murine large intestine. Neurogastroenterol Motil. 24 (8), 769-778 (2012).
- Kunze, W. A., Clerc, N., Furness, J. B., Gola, M. The soma and neurites of primary afferent neurons in the guinea-pig intestine respond differentially to deformation. J Physiol. 526, 375-385 (2000).
- Schemann, M., Michel, K., Peters, S., Bischoff, S. C., Neunlist, M. Imaging and the gastrointestinal tract: mapping the human enteric nervous system. Am J Physiol. 282, G919-G925 (2002).
- Hennig, G. W., et al. Visualization of spread of pacemaker activity in through ICC in guinea-pig antrum. Neurogastro Motil. 14, 575 (2001).
- Stevens, R. J., Publicover, N. G., Smith, T. K. Induction and organization of Ca2+ waves by enteric neural reflexes. Nature. 399, 62-66 (1999).
- Stevens, R. J., Publicover, N. G., Smith, T. K. Propagation and neural regulation of calcium waves in longitudinal and circular muscle layers of guinea-pig small intestine. Gastroenterology. 118, 982-984 (2000).
- Jessen, K. R., et al. Astrocyte-like glia in the peripheral nervous system: an immunohistochemical study of enteric glia. Journal of Neuroscience. 3 (11), 2206-2218 (1983).
- Gulbransen, B. D., Sharkey, K. A. Novel functional roles for enteric glia in the gastrointestinal tract. Nat Rev Gastroenterol Hepatol. 9, 625-632 (2012).
- Gomes, P., et al. ATP-dependent paracrine communication between enteric neurons and glia in a primary cell culture derived from embryonic mice. Neurogastroenterology & Motility. 21 (8), e870-e862 (2009).
- Gulbransen, B. D., Sharkey, K. A. Purinergic neuron-to-glia signaling in the enteric nervous system. Gastroenterology. 136, 1349-1358 (2009).
- Ren, J., Bertrand, P. P. Purinergic receptors and synaptic transmission in enteric neurons. Purinergic Signal. 4, 255-266 (2008).
- Takahashi, A., Camacho, P., Lechleiter, J. D., Herman, B. Measurement of intracellular calcium. Physiol Rev. 79, 1089-1125 (1999).
- Dongcheng, Z., et al. Neural crest regionalisation for enteric nervous system formation: implications for Hirschsprung's disease and stem cell therapy. Developmental Biology. 339 (2), 280-294 (2010).
- Gershon, M. D. Behind an enteric neuron there may lie a glial cell. J Clin Invest. 121, 3386-3389 (2011).
- Boesmans, W., et al. Imaging neuron-glia interactions in the enteric nervous system. Frontiers in Cellular Neuroscience. 7, (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados