Method Article
Análise do Cardiomyocyte Desenvolvimento utilizando imunofluorescência em Embryonic Coração do rato
Neste Artigo
Resumo
Mutations that lead to congenital heart defects benefit from in vivo investigation of cardiac structure during development, but high-resolution structural studies in the mouse embryonic heart are technically challenging. Here we present a robust immunofluorescence and image analysis method to assess cardiomyocyte-specific structures in the developing mouse heart.
Resumo
Durante o desenvolvimento do coração, da geração de unidades estruturais e funcionais específicas do miocárdio incluindo sarcolema, miofibrilas contrácteis, discos intercalados, e exige a montagem costâmeros coordenada de múltiplos componentes em tempo e espaço. Perturbação na montagem desses componentes leva a defeitos cardíacos de desenvolvimento. Técnicas de coloração de imunofluorescência são usados comumente em cardiomiócitos cultivados para sondar maturação miofibrila, mas esta abordagem ex vivo é limitada pelo grau em que os miócitos vai diferenciar totalmente na cultura, a falta de in vivo entradas mecânicas normais, e ausência de pistas do endocárdio. Aplicação de técnicas de imunofluorescência para o estudo do desenvolvimento do coração do rato é desejável, mas tecnicamente mais desafiadora, e métodos muitas vezes a falta de sensibilidade e resolução suficiente para visualizar sarcômeros em estágios iniciais de desenvolvimento do coração. Aqui, descrevemos um método robusto e reprodutível para co-imunocoloração muproteínas ltiple ou a co-visualizar uma proteína fluorescente com coloração de imunofluorescência no coração embrionário mouse e usar esse método para analisar myofibrils desenvolvimento, discos intercalares e costâmeros. Este método pode ser aplicado mais para avaliar as alterações estruturais dos cardiomiócitos causadas por mutações que levam a malformações cardíacas desenvolvimento.
Introdução
Durante o desenvolvimento, contrações do coração começar logo após cardiomiócitos migrar para a linha média e formar o tubo de 1,2 coração linear. O sarcômero é a unidade contrátil básica dentro dos cardiomiócitos; esta estrutura citoesquelética altamente organizada contém filamentos de actina ancorados ao Z-disco por sarcomérica α-actinina (s-α-actinina) e fibras de miosina ancorada na linha M (Figura 1). Como o cardiomyocyte amadurece, sarcômeros montar em série para formar myofibrils que se estendem pelo celular. Miofibrilas são ancoradas às extremidades do cardiomiócitos pelo disco intercalado, a estrutura de junção célula-célula que contém uma junção de transição com um subconjunto de elementos de Z-disco, tais como s-α-actinina 3, proteínas de junções aderentes, tais como N-caderina e β catenina, proteínas de junções de hiato, e desmossomas (Figura 1) 4. Ao longo da membrana longitudinal, os Z-discos de miofibrilas periféricas tambémanexar à membrana celular através de costâmeros; essas adesões focais especializados proporcionar uma âncora entre o miofibrilar, membrana de plasma, e matriz extracelular para proporcionar apoio estrutural adicional ao cardiomiócito (Figura 1) 4. No início do desenvolvimento do coração, os cardiomiócitos são dispostos em projeções semelhantes a dedos, conhecidas como trabeculae que se projetam no espaço ventricular e contêm myofibrils relativamente maduros 5. Como o desenvolvimento do coração prossegue, os cardiomiócitos na região do sub-epicardial proliferam para formar o miocárdio compacto que compreende as paredes do ventrículo, mas sarcomere e montagem miofibrila estão atrasadas em comparação com miocárdio trabecular 5,6.
Todos os modelos de sarcômero e montagem miofibrila vêm em grande parte a partir de estudos de imunofluorescência em cardiomiócitos cultivados 7-10, que são simples, mas não têm um ambiente tridimensional, o fluxo de sangue, e contatos com outras células cardíacass presente in vivo. estudos estruturais de alta resolução usando imunofluorescência no coração embrionário do mouse são tecnicamente desafiador, e poucos estudos exploraram o surgimento de discos intercalares e costâmeros durante rato desenvolvimento cardíaco. A proteína adherens junção β catenina parece localizar a discos intercalados por dia embrionário (E) 17,5 11, N-caderina localiza a estruturas lineares que podem representar discos intercalados por E18.5 12 versus pós-natal dia 0 13, e costâmeros tenham sido detectadas na E18.5 14, mas estas proteínas exibir distribuição membrana difusa e mais contínua em anteriores momentos de desenvolvimento 11-13.
Aqui, descrevemos um método simples e reprodutível para immunostaining e microscopia de fluorescência de rato seccionado corações embrionárias que permite a análise detalhada da miofibrila e desenvolvimento de cardiomiócitos, incluindo o surgimento de intercalated discos como cedo como E12.5 e costâmeros nascentes na E16.5. Este protocolo pode ser útil para sondar os efeitos das mutações na formação sarcomere bem como miofibrilar e cardiomiócitos maturação.
Protocolo
NOTA: Todos os procedimentos experimentais foram aprovados pelo Comitê Animal Care and Use a UCSF Institucional.
1. Criopreservação e Fixação de Embrionárias corações do rato.
1.1) Snap-congelamento corações embrionárias
- Encha uma placa de Petri de 3,5 centímetros e sete milímetros cryomolds com Optimal temperatura de corte (OCT) médio (ver Tabela de Materiais). Em uma capa de química, Cool 2-metilbutano em nitrogênio líquido.
- Dispensar 30 ml de solução salina de fosfato tamponada (PBS) em placas de petri 10 centímetros, 10 ml de PBS 3,5 centímetros em pratos de petri, e colocar todas as placas de petri em gelo. Prepare um prato de 10 cm e vários pratos de 3,5 centímetros por rato grávida.
- Isolar os embriões como anteriormente descrito 15, realizando a dissecção em PBS gelado.
- Resumidamente, a eutanásia a mulher grávida usando CO 2 narcose e luxação cervical.
- Faça uma incisão no abdômen, dissecar o útero cortando os vasos along a curvatura interna do útero, e transferir o útero para uma placa de Petri contendo 10 centímetros de PBS gelado.
- Cortar o útero entre cada embrião e transferência de mais 3,5 cm de placa individuais de Petri contendo PBS gelado. Isolar cada embrião como descrito 15.
- Abra a cavidade pericárdica usando uma pinça fina, retire o coração longe dos pulmões e vasculatura pelo corte na aorta, veia cava inferior, e as veias pulmonares, e transferir para o prato 3,5 cm petri contendo outubro
- Deixe o coração equilibrar em outubro por alguns segundos, em seguida, transferir o coração no molde 7 milímetros contendo outubro Orientar a parede anterior do coração para o fundo do molde.
- Delicadamente, coloque o molde em líquido refrigerado a nitrogênio 2-metilbutano. Tome cuidado para não permitir que o líquido de 2 metilbutano para tocar o PTU ou coração. Congelar até o outubro é sólido branco, em seguida, transferir o molde para um balde de gelo contendo gelo seco. Mover para a próxima embrião.
- Wrap cryomolds em papel alumínio e armazenar a -80 ° C até que esteja pronto para cryosectioning.
1.2) Alternativa: paraformaldeído (PFA), que fixa, crioprotetora e outubro incorporação corações embrionárias
- Encha as cavidades de uma placa de cultura de tecido de 12 poços com 4% de PFA em PBS 1x.
- Dissecar os corações embrionárias como descrito em 1.1.3. Coloque cada coração em um poço contendo 4% PFA e corrigir a 4 ° CO / N.
- Crioproteção: usando uma pipeta de transferência de plástico, mover cada coração para um tubo de microcentrífuga de 1,5 ml contendo 1,5 ml de sacarose a 15% em PBS e agitar suavemente a 4 ° C até que o coração afunda para o fundo do tubo (várias horas a O / N ). Transferir cada coração para um tubo de microcentrífuga de 1,5 ml contendo 1,5 ml de sacarose a 30% em PBS e agitar suavemente a 4 ° C de novo até que o coração afunda para o fundo do tubo (várias horas a O / N).
- Usando uma pipeta de plástico, coloque o coração cryoprotected em outubro e deixá-lo equilibrardurante vários minutos para remover o excesso de sacarose, em seguida, transferir o coração para dentro do molde 7 milímetros contendo outubro Orientar a parede anterior do coração para o fundo do molde.
- Congelar o coração em OCT, colocando o molde em qualquer líquido 2-metilbutano arrefecido em azoto ou gelo seco.
- Enrole cryomolds em folhas e armazenar a -80 ° C até que esteja pronto para cryosectioning.
2. cryosectioning
- Ajuste a temperatura cryostat até -17 ° C.
- Local cryomolds para dentro da câmara criostato e equilibrar a temperatura durante 15-20 min.
- Inverta a cryomold e usar uma leve pressão para expulsar o bloco de coração a partir do molde. Orientar a parede anterior do coração para o topo do bloco de tecido moldado.
- Coloque uma grande queda de outubro para o mandril, e montar o bloco de coração para a queda de outubro para congelar para o chuck. Manter a orientação tal que a parede anterior do coração é mais afastada do mandril.
- Coloque o chuck e montado elearte bloco no suporte do cryostat objeto. Ajuste de modo a que o ângulo da lâmina é de 3-5 ° em relação à amostra.
- Recolha 10 um secções em lâminas de microscópio que foram pré-tratados com um revestimento de carga positiva (ver Tabela de Materiais). Deixar secar completamente antes de guardar a -80 ° C.
3. Imunofluorescência
- Para seções snap-congelados, corrigir e permeabilizar tecido em acetona durante 10 min em um exaustor na RT.
- Para as secções de encaixe congelados e PFA-fixos, incubar em PBS-0,1% de Triton X-100 durante 20 min para remover outubro e para permeabilizar secções PFA-fixos.
- Bloco durante 45 minutos em 1x tampão de bloqueio, diluído em PBS.
- Se utilizando um anticorpo primário gerado em ratinho, incubar em burro ou de cabra anti-IgG de ratinho (H + L) fragmento Fab monovalente diluído 1: 100 em PBS-Tween 20 0,1% durante 45 min à temperatura ambiente (ver discussão).
- Incubar em anticorpo primário ou anticorpos diluídos em tampão de bloqueio 1x durante 2 h à TA ouO / N a 4 ° C (ver Tabela de materiais / equipamentos para diluições específicos).
- Lave os cortes em 1x PBS três vezes durante 10 min à TA.
- Incubar em Alexa Fluor-anticorpo secundário conjugado diluído 1: 500 em tampão de bloqueio durante 2 horas à temperatura ambiente, protegida da luz.
- Lave os cortes em 1x PBS três vezes durante 10 min à temperatura ambiente, protegida da luz.
- Opcional: Incube em corante Hoechst diluído 1: 2000 em PBS a RT (protegido da luz) para rotular núcleos, em seguida, enxaguar com PBS.
- Pós-fix secções marcado em 1% de PFA durante 1 min à temperatura ambiente.
- Monte desliza em meio anti-desbotamento (núcleos com DAPI se não estão já identificadas), colocando duas gotas de meio em cada extremidade da lâmina e, em seguida, cobrindo com uma lamela. Seal lamelas com unha polonês. Conservar ao abrigo da luz a 4 ° C até estar pronto para a imagem.
4. Imagem Confocal e Análise de Imagem
- Ligue os comprimentos de onda apropriados a laser, máquina fotográfica e confocal inc microscópioluding mover palco e motor z. Lançamento do programa de software de imagem. Use os 405, 488, e 561 comprimentos de onda do laser para a imagem latente Hoechst-, Alexa 488, e Alexa seções 568-manchadas, respectivamente.
NOTA: Ver Tabela de Materiais para nossas especificações de hardware e software. - Monte a lâmina de controlo (lamela para baixo por um microscópio invertido) no palco slide.
- Usando o objetivo 4X (ver Tabela de Materiais), encontrar a amostra e área de interesse. Capturar a imagem para usar como um mapa na obtenção de imagens em alta ampliação.
- Retire o slide, fazendo ajustes mínimos para o palco slide. Mude para a objetiva de imersão 60x de óleo (ver Tabela de Materiais), coloque uma pequena gota de óleo sobre o objectivo, e substituir o slide (lamela para baixo) para o palco slide.
- Encontre amostra novamente. Definir a potência do laser, tempo de exposição, e criação de faixas para os níveis desejados para cada canal.
NOTA: Nós usamos geralmente potência do laser de 0,8, tempo de exposição da câmera de 100 ms, e binning de 2 (see Tabela de Materiais para as especificações de hardware e software); configurações óptimas devem ser determinadas empiricamente para cada experimento.- Uma vez que as configurações ideais são determinados, usar as mesmas configurações para todos os cortes de tecidos dentro do experimento. Utilize o histograma intensidade notar a faixa de intensidade ideal para cada canal (esta informação será utilizada para análise).
- Gerar pilha az usando a função de aquisição: selecionar os canais adequados de laser, em seguida, escolha os limites superiores e inferiores da pilha z. Escolha tamanho az passo pilha que é metade do valor da espessura do corte óptico fornecido pelo software. Clique em "Executar" para coletar as imagens.
- Use Fiji 16 ou um programa semelhante para análise de imagens. Dentro de Fiji, abra o arquivo de pilha z com opção de modo de cor personalizada e os canais divididos em janelas separadas. Abra o "Ajuste de Brilho / Contraste" ferramenta a partir do menu suspenso Imagem; dentro de cada canal, set a gama do histograma da intensidade óptima especificada em 4.5.1. Aplicar estas gamas de canal para todas as pilhas z sendo analisado.
- Mesclar os canais individuais em uma única imagem composta usando Imagem-> menu suspenso Color.
- Criar uma pilha z achatada da imagem composta usando o Imagem-> Stacks-> menu do projeto z. Esta imagem será significativamente mais brilhante do que a imagem em 3D; ajustar o intervalo de intensidade histograma para a amostra de controlo para evitar a saturação excessiva, e aplicar as mesmas configurações para o experimental achatada z pilha.
- Para gerar uma imagem 3D, primeiro use o Imagem-> Stacks-> menu do projeto 3D 17. Escolha ou o eixo-x ou eixo-y de rotação. Definir o espaçamento fatia como o mesmo número de micra como o tamanho z passo pilha. Escolha a rotação total desejado e definir o incremento ângulo de rotação a 1. Em seguida, abra a imagem J 3D Viewer os Plugins menu suspenso. Escolha a imagem composta gerada em 4.8, display de Volume, e definir o Refactor de amostragem de 1 ou 2.
Resultados
Figuras 2 a resultados típicos 6 espetáculos co-coloração das proteínas diferentes em um coração snap-congelado e fixo-acetona. O anticorpo contra a s-α-actinina Z-discos marcados de forma reprodutível e discos intercalados com elevada especificidade e fundo mínima (Figuras 2A, 3A, 4A, 5A, 6A e 6C); A Figura 6 demonstra que o anti-IgG de ratinho (H + L) monovalente Fab fragmento efetivamente bloqueia a ligação do rato endógena IgG por anticorpos secundários anti-rato. O anticorpo contra a proteína aderente junção β catenina ligado a membrana de ambos os cardiomiócitos e células não-cardiomiócitos, e co-localização com s-α-actinina ocorreu em discos intercalados presumidos em E16.5 (Figura 2C e D), como esperado a partir da β padrão de coloração catenina no coração adulto 18. β1 imunofluorescência integrina no coração embrionário é especialmente desafiador e muitas vezes não consegue identificar adesões focais 14, mas β1 coloração integrina nestes estudos revelaram sinal com a mesma periodicidade, como Z-discos s-α-marcado com Actinina, refletindo possivelmente costâmeros nascentes que formam a E16.5 (Figura 3D).
No E12.5, s-α-actinina e tropomyosin (sarcomere fina proteína filamento) imunofluorescência revelou um padrão de coloração com periodicidade regular em cardiomiócitos trabecular consistentes com myofibrils maduros nessas células (Figuras 4A e 5A para s-α-actinina; Figura 4B para tropomyosin). Coloração N-caderina em cardiomiócitos trabecular na E12.5 corações tendiam a colocalize com áreas de coloração s-α-actinina intensa (Figura 5B - D e Figura 6-A - C), possivelmente representando discos intercalares. Emcontrastar a miócitos trabecular, s-α-actinina na zona compacta foi pontuada mais do que linear, tropomiosina e coloração foi em vez de difusa linear (Figura 4A e 4B). Assim, a montagem sarcómero pode ocorrer mais tarde no compacta em relação ao miocárdio trabecular. Além disso, os padrões diferenciais de s-α-actinina e tropomiosina na zona compacta sugerem que s-α-actinina organiza em pontos lacrimais e Z-discos imaturos precoces, enquanto tropomiosina incorporação no filamento fino pode ser um evento mais tarde em conjunto miofibrilar.
Figura 7, Filme 1, Filme 2 e demonstrar os resultados típicos de um coração embrionário PFA-fixo E12.5. Nestes exemplos, um embrião transgénico LifeAct-RFPruby foi utilizado para imagiologia; o transgene LifeAct-RFPruby 19 rótulos actina filamentosa, mas requer PFA fixação. Z-discos marcados com s-α-actinina eram fáceis de visualizar na maioria das áreas, mas a relação de sinal-para-ruído foi Decré ASED comparação com o snap-congelados seções coração (Figura 7a); este sinal era típico para imunofluorescência s-α-actinina-PFA em tecido fixo, em que os epitopos podem ser mascarados por ligações cruzadas de proteína. A Figura 7B mostra a co-visualização de actina filamentosa e immunolabeled s-α-actinina dentro miofibrilas (pontas de setas) e actina filamentosa no interior das células do endocárdio adjacentes aos miócitos trabecular (setas). Tridimensional reconstrução de imagem revelou detalhes adicionais: cardiomiócitos individuais foram mais facilmente discernido, miofibrilas dentro de um de cardiomiócitos foram aproximadamente paralelos um ao outro, mas cardiomiócitos individuais foram orientadas em ângulos diferentes uns aos outros (Figura 7C e D, um filme, e 2 do filme ). A estreita aproximação entre as células do endocárdio e cardiomiócitos foi melhor apreciado nas vistas tridimensionais também.
">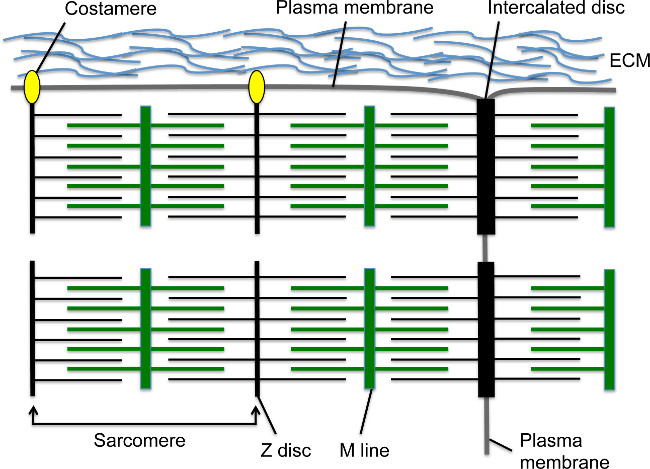
Figura 1. sarcômeros cardiomiócitos, discos intercalares e costâmeros. O disco-Z ancora filamentos de actina, enquanto a linha M ancora fibras de miosina, que se sobrepõem os filamentos de actina. O sarcômero compreende uma Z-disc - linha M - unidade Z-disco. Várias sarcômeros em série criar uma miofibrila. A extremidade lateral da miofibrila insere na fronteira transversal da cardiomiócitos em uma estrutura juncional célula-célula especializada, chamada de disco intercalar. Myofibrils periféricos conectar-se à membrana plasmática cardiomyocyte longitudinal via costâmeros, que formam adesões focais com a matriz extracelular entre cardiomiócitos. Por favor, clique aqui para ver uma versão maior desta figura.
pload / 52644 / 52644fig2.jpg "/>
Figura 2. s- α -actinina e β catenina imunofluorescência no dia embrionário 16,5. O coração foi retirado, congelado rapidamente, criosseccionada, e marcadas usando (A) clone monoclonal EA53 anticorpo contra s-α-actinina fixo-acetona, que cardiomyocyte marcado Z-discos e discos intercalados, e (B) coelho de anticorpos contra a proteína polycloncal adherens junção β catenina. (C) Mesclado imagens mostram s-α-actinina e coloração β catenina. (D) Magnified área de interesse a partir do painel C ; marca asteriscos presume discos intercalados com co-localização de s-α-actinina e β catenina. As imagens foram obtidas a partir da parede do ventrículo esquerdo periférica de miocárdio ou compacto, com a camada de epicárdico no canto superior esquerdo de painéis AC. Intensidade histograma faixa de exibição 460-1600 (fora of possível 0-65535), tanto para os s-α-actinina / 488 nm e β catenina / 561 canais de laser nm. Barra de escala de 10 um. Por favor, clique aqui para ver uma versão maior desta figura.
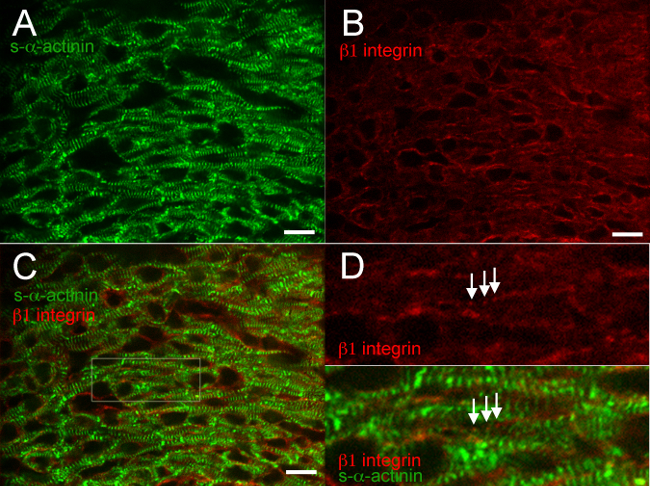
Figura 3. s- α -actinina e β 1 integrina imunofluorescência no dia embrionário 16,5. O coração foi retirado, congelado rapidamente, criosseccionada, acetona-fixados, e marcadas usando (A) clone monoclonal EA53 anticorpo contra s-α-actinina e de anticorpos (B) de cabra policlonal contra a proteína de adesão focal β1 integrina. (C) fusionado imagens mostram integrina β1 em cardiomiócitos, bem como as células não-cardiomiócitos. Nota poluição difusa epontuada β1 sinal integrina em cardiomiócitos (D) área de interesse a partir do painel C. Nota pontuada, integrina β1 coloração periódica (setas), com periodicidade similar à próxima s-α-actinina-coloração em Z-discos ampliada.; estas estruturas podem representar costâmeros. As imagens foram obtidas a partir do miocárdio ventricular esquerdo compacto. Intensidade histograma faixa de exibição 460-1200 (de possível 0-65535) para o s-α-actinina / 488 canal de laser nm e 460-600 para o canal de laser nm β1 integrina / 561. Barra de escala de 10 um. Por favor, clique aqui para ver uma versão maior desta figura.
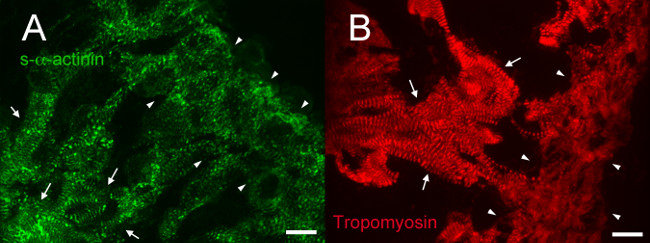
Figura 4. s- α -actinina e imunofluorescência tropomyosin no dia embrionário 12,5: organização miofibrilar em trabecular e do miocárdio compacto. Corações de embriões da mesma ninhada foram excisadas, congeladas rapidamente, criosseccionada, acetona-fixados, e marcadas usando (A) clone monoclonal EA53 anticorpo contra s-α-actinina e (B) anticorpo monoclonal contra a miofibrila filamento fino tropomyosin proteína (estudos de desenvolvimento Hybridoma Banco CH1). Trabecular (setas) e no miocárdio compacto (pontas de seta) estão indicados. Nota coloração s-α-actinina linear com periodicidade regular no miocárdio trabecular, em comparação com uma gama de padrões de coloração, incluindo pontos lacrimais, bem como a coloração linear na camada compacta (A). Nota também coloração tropomyosin linear com periodicidade regular no miocárdio trabecular mas coloração mais difusa no miocárdio compacto. Intensidade histograma faixa de exibição 460-1,400 (de possível 0-65535) para o canal de s-α-actinina e 460-1,000 para o canal tropomyosin. Barra de escala 10? M.Target "https://www.jove.com/files/ftp_upload/52644/52644fig4large.jpg" = "_ blank"> Clique aqui para ver uma versão maior desta figura.
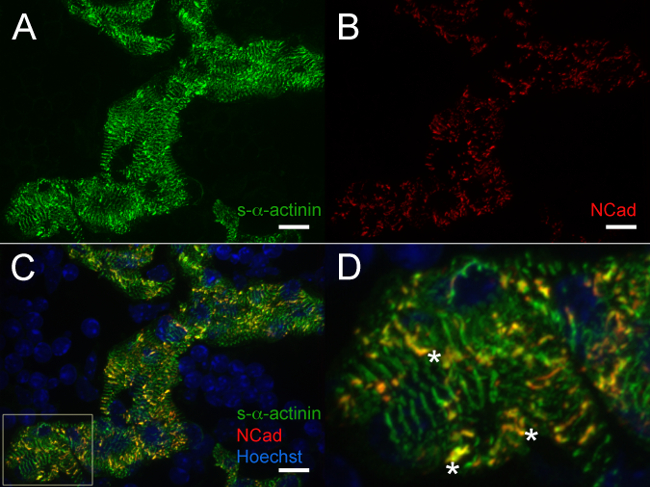
Figura 5. s- α -actinina e imunofluorescência N-caderina no dia embrionário 12,5:. Miofibrilas e discos intercalados em cardiomiócitos trabecular O coração foi retirado, congelado rapidamente, criosseccionada, acetona-fixados, e marcadas usando (A) clone monoclonal EA53 anticorpo contra S-α-actinina e anticorpo policlonal (B) de coelho contra a proteína de adesão focal de N-caderina. 0,2 mm fatias ópticos foram coletados como az pilha e pilhas z foram achatados para gerar as imagens. (C) stacks achatadas mescladas mostrar tanto N-caderina e coloração s-α-actinina dentro cardiomiócitos trabecular como well como núcleos marcados com corante Hoechst (D) Ampliadas área de interesse a partir do painel C.; asteriscos marcar discos intercalados com co-localização de s-α-actinina e N-caderina. Intensidade histograma faixa de exibição 470-1,200 (de possível 0-65535) para o / 405 canal de laser nm Hoechst e 470-2,000 tanto para o s-α-actinina / 488 nm e N-caderina / 561 canais de laser nm. Barra de escala de 10 um. Por favor, clique aqui para ver uma versão maior desta figura.
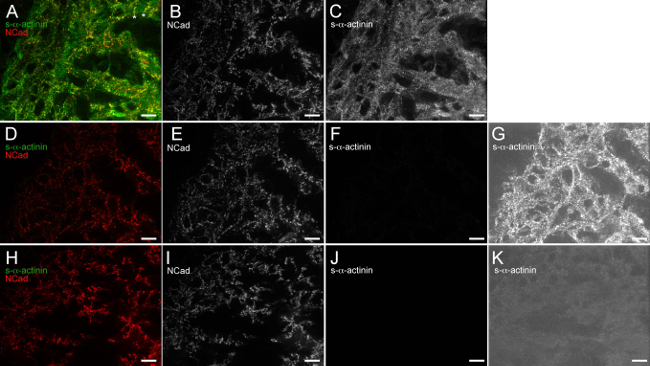
Figura 6. Anti-IgG de ratinho (H + L) monovalente Fab fragmento bloqueia eficazmente ratinho endógeno pela ligação de anticorpos secundários anti-IgG de ratinho. O coração embrionário E12.5 foi excisado, congelado rapidamente, criosseccionada, fixadas em acetona-e imunocoradas. (AC) As secções foram bloqueadas com tampão de bloqueio 1x seguido de anti-IgG de ratinho fragmento Fab monovalente, exposta à clone monoclonal de ratinho contra o anticorpo primário EA53 s-α-actinina e anticorpo primário de coelho policlonal contra o N-caderina, lavado, e expostos a Alexa Fluor 488 anti-rato e Alexa Fluor anticorpos secundários 586 anti-coelho. (A) imagem mesclada com intensidade histograma faixa de exibição 480-2500 (de possível 0-65535). Regiões blocos asteriscos na qual o sinal N-caderina é restrito à extremidade transversal de cardiomiócitos trabecular, o que provavelmente representa discos intercalados nascentes. (B) N-só-caderina do histograma da intensidade de canal utilizando a faixa de exibição 480-2,500. (C) s-α -actinina somente canal usando intensidade histograma faixa de exibição 480-2,500. (DG) secções foram bloqueadas com 1x tampão de bloqueio apenas (sem anti-IgG monovalente Fab fragmento etapa de bloqueio), expostos a policlonal de coelhoanticorpo primário contra N-caderina apenas (sem rato anticorpo primário monoclonal), lavado e exposto a Alexa Fluor 488 anti-rato e Alexa Fluor anticorpos secundários 586 anti-coelho. (D) Mesclado imagem usando intensidade histograma faixa de exibição 480-2500. (E) N-só-caderina canal usando intensidade histograma faixa de exibição 480-2500. (F) do canal utilizando intensidade histograma faixa de exibição 480-2,500 s-α-somente actinina. (G) do canal utilizando s-α-only-actinina de alta sensibilidade do histograma da intensidade intervalo de visualização 480-530, que revela a detecção de IgG de ratinho endógeno fundo, na ausência do anti-IgG de ratinho fragmento Fab monovalente passo de bloqueamento. (HK) As secções foram bloqueadas com tampão de bloqueio 1x seguido de anti-IgG de ratinho fragmento Fab monovalente, expostos a anticorpo primário de coelho policlonal contra o N-caderina (sem anticorpo primário monoclonal de rato), lavado, e expostos a Alexa Fluor 488 anti-rato e Alexa Fluor anticorpos secundários 586 anti-coelho. (H) Mesclado imagem usando faixa de exibição intensidade histograma 480-2,500. (I) N-só-caderina canal usando intensidade histograma faixa de exibição 480-2,500. (J) s-α-actinin- único canal usando intensidade histograma faixa de exibição 480-2,500. (K) s-α-only-actinina canal usando de alta sensibilidade faixa de exibição histograma intensidade 480-530, o que demonstra a falta de fundo endógena detecção de IgG quando o anti-IgG monovalente Fab fragmento etapa de bloqueio é usado. Por favor, clique aqui para ver uma versão maior desta figura.
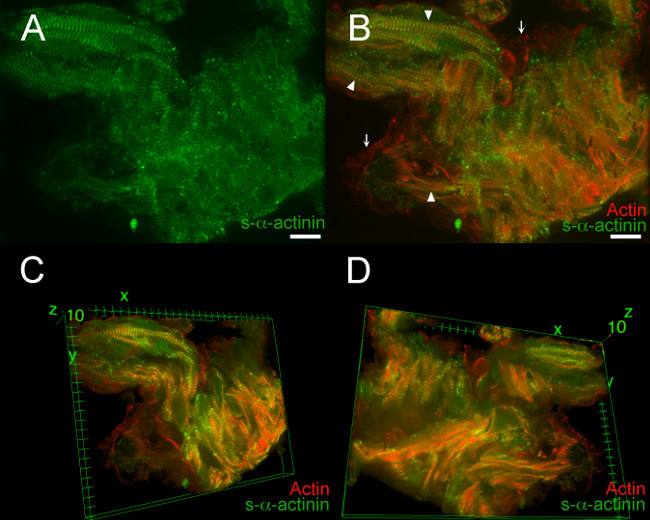
Figura 7. s- α -actinina e organização da actina no cardi trabecularomyocytes no dia embrionário 12,5. A linha de ratinhos transgénicos LifeAct-RFPruby foi usada para visualizar a actina filamentosa 19, enquanto que o clone de anticorpo monoclonal de ratinho contra EA53 s-α-actinina foi utilizado para marcar Z-discos e discos intercalares. Os embriões foram fixados-PFA. 0,2 mm fatias ópticos foram coletados como az pilha (A) pilha achatado z mostra que s-α-actinina marcação foi mais difusa no tecido PFA-fixo do que em snap-congelado e acetona fixo seções (Figuras 2-5).. (B ) Achatado pilha z mostra tanto actina filamentosa e s-α-actinina. Fluorescência actina filamentosa localizada entre Z-discos dentro miofibrilas (setas). Actina filamentosa fluorescência também foi visto em células do endocárdio que revestem os miócitos trabecular (setas). (C) vista tridimensional dos cardiomiócitos trabecular, como vista a partir do topo da pilha. (D) vista tridimensional deos cardiomiócitos trabecular, como visto a partir do fundo da pilha. Histogramas de intensidade de intervalo de visualização 470-900 (de possível 0-65535), tanto para o canal de laser de 488 nm e 561 nm para o canal de laser em A e B; faixa de exibição 460-800 para ambos os canais em C e D. Barra de escala de 10 um. Por favor, clique aqui para ver uma versão maior desta figura.
Filme 1. 360 ° vista 3D de rotação do s- α -actinina e organização de actina em cardiomiócitos trabecular no dia embrionário 12,5. A pilha de imagens a partir da Figura 6 foi rendido em três dimensões usando a Imagem J visualizador 3D plug-in dentro do programa de análise de imagem Fiji. Intensidade histograma faixa de exibição 470-800 (de possível 0-65535), tanto para os canais de 488 nm e 561 nm a laser.
Filme 2. Visualizações 3D selecionado de s- α -actinina e actina organização em cardiomiócitos trabecular no dia embrionário 12,5. A pilha de imagens a partir da Figura 6 foi rendido em três dimensões usando a Imagem J visualizador 3D plug-in dentro do programa de análise de imagem Fiji. Pequenas rotações em torno dos x, y, z e machados mostrou relativamente myofibrils alinhado dentro cardiomiócitos, mas mau alinhamento entre a maioria dos cardiomiócitos. Pequenas rotações também demonstrou a estreita aproximação das células do endocárdio faltam s-α-actinina torno de cardiomiócitos. Intensidade histograma faixa de exibição 470-800 (de possível 0-65535), tanto para a 488 nm e 561 nm canais de laser.
Discussão
A técnica de fixação do tecido ideal e diluição deve ser determinada empiricamente para cada anticorpo. Nas nossas mãos, snap-congelamento é superior ao PFA fixação para vários antigénios de cardiomiócitos, incluindo s-α-actinina, β-catenina, β1-integrina, tropomiosina, a talina (não mostrado) e N-caderina; em contraste, a PFA fixação produz resultados superiores para a quinase de adesão focal (não mostrado). As ligações cruzadas de proteínas formadas pela PFA pode mascarar epitopos e anticorpos limite vinculativo; recuperação de antigénios pode ser necessário, em tais casos, e métodos para a recuperação de antigénios pode ser encontrada em outras posições 20. Concentração PFA ou o comprimento de fixação pode ser reduzida para reduzir epitopo de mascaramento, com condições óptimas determinadas empiricamente para cada anticorpo e em cada fase de desenvolvimento. Controlos negativos apropriados devem ser utilizados na caracterização de um novo anticorpo ou mutante cardíaca, incluindo o soro pré-imune como controlo anticorpo primário e um "sem anticorpo primário" control. A utilização de ratinhos knockout é um controle negativo ideal, mas a letalidade precoce impede a sua utilização para muitos dos produtos de genes aqui estudadas.
O uso de volumes suficientes para submergir completamente lâminas experimental e controle no mesmo bloqueio de imunofluorescência, anticorpo, e soluções de lavagem foi importante como era suave balanço de slides durante a incubação para garantir a exposição uniforme das seções para as soluções. Esta abordagem minimizado variabilidade técnica na coloração entre as seções e slides dentro de um experimento. Quando custo limita o volume da solução de anticorpo, usar uma caneta para limitar o fluxo de Papanicolaou de soluções para além das secções de tecido e manter as lâminas numa câmara humidificada durante incubações longas. Se um anticorpo monoclonal primário - e, portanto, um anticorpo secundário anti-mouse - está sendo usado, uma segunda etapa de bloqueio para cobrir imunoglobulinas endógenas do mouse será necessário (passo 3.4) para diminuir sinal de fundo inespecífica.
Técnicas de microscopia e de processamento de imagem adequados são fundamentais para a obtenção de informações biologicamente precisas 21. O histograma intensidade indica a distribuição de pixels em cada nível de intensidade (0-65535 níveis de uma imagem de 16 bits para) para cada cor. Background, brilho e contraste pode ser ajustado através da criação de uma faixa de exibição intensidade que ladeia o pico do histograma; para fazer comparações válidas entre as condições, as mesmas configurações entre o controle e as condições experimentais devem ser usados.
Este protocolo fornece um método confiável para analisar a maturação e desenvolvimento de cardiomiócitos no coração nativo rato embrionário. Enquanto imunofluorescência de proteínas específicas do cardiomiócitos é muitas vezes usado para marcar cardiomiócitos durante o desenvolvimento, alguns estudos empregam técnicas que permitem a análise de alta resolução da estrutura miofibrilar e o surgimento de discos intercalares e costâmeros 12-14,22,23. Esta técnica pode ser utilizado para em vavaliação ivo de mutações que causam defeitos cardíacos de desenvolvimento, como um meio de identificar alterações na maturação dos cardiomiócitos que possam lançar luz sobre os mecanismos de anormalidades estruturais.
Divulgações
The authors have nothing to disclose.
Agradecimentos
The authors would like to thank Drs. Hilary Clay, Stephen Wilson, Anna Payne-Tobin, and James Smyth for helpful discussions. Microscopy was done at the Cardiovascular Research Institute Imaging Core at the University of California, San Francisco. This work was supported by NIH K08 HL105657 (LDW) and NIH HL65590 (SRC).
Materiais
| Name | Company | Catalog Number | Comments |
| Cryomold, Disposable Base Mold, 7x 7 mm | Richard-Allen Scientific | 58949 | This size not available from Fisher Scientific |
| Cryomold, Disposable Base Mold, 15 x 15 mm | Fisher Scientific | 22-050-159 | Also available from Richard-Allen Scientific, catalog number 58950 |
| Tissue-Tek Optimal Cutting Temperature (OCT) medium 4583 | VWR | 25608-930 | |
| 2-methyl butane | Sigma | M32631 | |
| Paraformaldehyde | Fisher Scientific | T353-500 | Use fresh 4% solution in 1x PBS, pH 7.2-7.4. |
| Sucrose | Sigma | S0389 | Use 15% and 30% solutions in 1X PBS. |
| Disposable transfer pipette | Fisher Scientific | S30467-1 | |
| Superfrost Plus slides | Fisher Scientific | 12-550-15 | "Plus" indicates positively-charged coating and is critical for maintaining tissue adherence to the slide. |
| Acetone | Sigma | 179124 | |
| Triton X-100 | Sigma | X100 | |
| Western Blocking Agent | Roche | 11921673001 | Blocking buffer for immunofluorescence, when secondary antibodies are from different species. Dilute to 1x in PBS. |
| Tween 20 | Sigma | P9416 | |
| Donkey Anti-mouse IgG (H+L) monovalent Fab fragment | Jackson ImmunoResearch | 715-007-003 | Goat Anti-mouse IgG (H+L) also available. For blocking endogenous immunoglobulins. |
| Anti-s-α-actinin antibody | Sigma | A7811 | Mouse monoclonal, clone EA53. Dilute 1:400 for snap-frozen/acetone-fixed sections, dilute 1:300 for PFA-fixed sections. Before incubation on mouse tissue, block endogenous mouse immunoglobulins with anti-mouse IgG (H+L) monovalent Fab fragment. |
| Anti-βcatenin antibody | Cell Signaling | 9587s | Rabbit polyclonal. Requires snap-freezing/acetone fixation. Dilute 1:400. |
| Anti-β1 integrin antibody | R&D | AF2405 | Goat polyclonal. Dilute 1:200. Snap-frozen/acetone-fixed tissue staining is superior to PFA-fixed tissue. |
| Anti-tropomyosin antibody | Developmental Studies Hybridoma Bank, University of Iowa | CH1 | Mouse monoclonal. Requires snap-freezing/acetone fixation. Dilute 1:200. Before incubation on mouse tissue, block endogenous mouse immunoglobulins with anti-mouse IgG (H+L) monovalent Fab fragment. |
| Anti-N-cadherin antibody | Santa Cruz | sc-7939 | Rabbit polyclonal. Dilute 1:200. Snap-frozen/acetone-fixed tissue staining is superior to PFA-fixed tissue. |
| Anti-talin antibody | Sigma | T3287 | Mouse monoclonal, clone 8d4. Requires snap-freezing/acetone fixation. Dilute 1:200. Before incubation on mouse tissue, block endogenous mouse immunoglobulins with anti-mouse IgG (H+L) monovalent Fab fragment. |
| Anti-phosphotyrosine 397 focal adhesion kinase antibody | Invitrogen | 700255 | Rabbit monoclonal antibody. Requires PFA fixation. Dilute 1:500. |
| Alexa Fluor 488 Donkey Anti-Mouse IgG (H+L) Antibody | Life Technologies | A-21202 | |
| Alexa Fluor 568 Donkey Anti-Rabbit IgG Antibody | Life Technologies | A10042 | |
| Alexa Fluor 488 Goat Anti-Mouse IgG (H+L) Antibody | Life Technologies | A-11001 | |
| Alexa Fluor 568 Goat Anti-Rabbit IgG (H+L)Antibody | Life Technologies | A-11011 | |
| Hoechst 33342 dye | Life Technologies | H3570 | Nuclear stain |
| Vectashield | Vector labs | H-1000 | |
| Coverslips | Fisher Scientific | 12-548-5M | |
| MLC 400B Monolithic Laser Combiner Laser box | Keysight (formerly Agilent) | ||
| Clara Interline CCD camera | Andor | ||
| Eclipse Ti inverted microscope | Nikon | ||
| CSU-X1 Spinning disk confocal scanner unit | Yokogawa | ||
| CFI Plan Apochromat 4X air objective | Nikon | Numerical aperture (NA) 0.2, Working distance (WD) 15.7 mm | |
| CFI Plan Apochromat VC 60x oil immesion objective (MRD01602) | Nikon | NA 1.4, WD 0.13 mm | |
| NIS Elements Imaging Software | Nikon | http://nikon.com/products/instruments/lineup/bioscience/img_soft/index.htm | |
| Image analysis software | Fiji | http://fiji.sc/Fiji |
Referências
- Risebro, C. A., Riley, P. R. Formation of the ventricles. The Scientific World Journal. 6, 1862-1880 (2006).
- Ji, R. P., et al. Onset of cardiac function during early mouse embryogenesis coincides with entry of primitive erythroblasts into the embryo proper. Circulation research. 92, 133-135 (2003).
- Bennett, P. M., Maggs, A. M., Baines, A. J., Pinder, J. C. The transitional junction: a new functional subcellular domain at the intercalated disc. Molecular biology of the cell. 17, 2091-2100 (2006).
- Sparrow, J. C., Schock, F. The initial steps of myofibril assembly: integrins pave the way. Nature reviews. Molecular cell biology. 10, 293-298 (2009).
- Kastner, P., et al. Vitamin A deficiency and mutations of RXRalpha, RXRbeta and RARalpha lead to early differentiation of embryonic ventricular cardiomyocytes. Development. 124, 4749-4758 (1997).
- Zhang, W., Chen, H., Qu, X., Chang, C. P., Shou, W. Molecular mechanism of ventricular trabeculation/compaction and the pathogenesis of the left ventricular noncompaction cardiomyopathy (LVNC). American journal of medical genetics Part C, Seminars in medical genetics. 163C, 144-156 (2013).
- Kim, Y. Y., et al. Cellular localization of alpha3beta1 integrin isoforms in association with myofibrillogenesis during cardiac myocyte development in culture. Cell adhesion and communication. 7, 85-97 (1999).
- Lu, M. H., et al. The vinculin/sarcomeric-alpha-actinin/alpha-actin nexus in cultured cardiac myocytes. The Journal of cell biology. 117, 1007-1022 (1992).
- Schultheiss, T., et al. Differential distribution of subsets of myofibrillar proteins in cardiac nonstriated and striated myofibrils. The Journal of cell biology. 110, 1159-1172 (1990).
- Samarel, A. M. Costameres, focal adhesions, and cardiomyocyte mechanotransduction. American journal of physiology. Heart and circulatory physiology. 289, H2291-H2301 (2005).
- Sinn, H. W., Balsamo, J., Lilien, J., Lin, J. J. Localization of the novel Xin protein to the adherens junction complex in cardiac and skeletal muscle during development. Developmental dynamics : an official publication of the American Association of Anatomists. 225, 1-13 (2002).
- Lu, S., Borst, D. E., Horowits, R. N-RAP expression during mouse heart development. Developmental dynamics : an official publication of the American Association of Anatomists. 233, 201-212 (2005).
- Hirschy, A., Schatzmann, F., Ehler, E., Perriard, J. C. Establishment of cardiac cytoarchitecture in the developing mouse heart. Developmental biology. 289, 430-441 (2006).
- Whitman, S. A., et al. Desmoplakin and talin2 are novel mRNA targets of fragile X-related protein-1 in cardiac muscle. Circulation research. 109, 262-271 (2011).
- Kalaskar, V. K., Lauderdale, J. D. Mouse embryonic development in a serum-free whole embryo culture system. Journal of visualized experiments : JoVE. , (2014).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature. 9, 676-682 (2012).
- Schmid, B., Schindelin, J., Cardona, A., Longair, M., Heisenberg, M. A high-level 3D visualization API for Java and ImageJ. BMC. 11, 274 (2010).
- Swope, D., Cheng, L., Gao, E., Li, J., Radice, G. L. Loss of cadherin-binding proteins beta-catenin and plakoglobin in the heart leads to gap junction remodeling and arrhythmogenesis. Molecular and cellular biology. 32, 1056-1067 (2012).
- Riedl, J., et al. Lifeact mice for studying F-actin dynamics. Nature. 7, 168-169 (2010).
- Shi, S. R., Shi, Y., Taylor, C. R. Antigen retrieval immunohistochemistry: review and future prospects in research and diagnosis over two decades. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society. 59, 13-32 (2011).
- North, A. J. Seeing is believing? A beginners' guide to practical pitfalls in image acquisition. The Journal of cell biology. 172, 9-18 (2006).
- Risebro, C. A., et al. Prox1 maintains muscle structure and growth in the developing heart. Development. 136, 495-505 (2009).
- Ehler, E., Rothen, B. M., Hammerle, S. P., Komiyama, M., Perriard, J. C. Myofibrillogenesis in the developing chicken heart: assembly of Z-disk, M-line and the thick filaments. Journal of cell science. 112 (Pt 10), 1529-1539 (1999).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados