Method Article
Engenharia 3D celularizados Colágeno Gel para Vascular Regeneração Tecidual
Neste Artigo
Resumo
In this work, we present a technique for the rapid fabrication of living vascular tissues by direct culturing of collagen, smooth muscle cells and endothelial cells. In addition, a new protocol for the mechanical characterization of engineered vascular tissues is described.
Resumo
Os materiais sintéticos são conhecidos para iniciar complicações clínicas tais como inflamação, estenose, e infecções quando implantado como substitutos vasculares. O colagénio tem sido extensivamente utilizado para uma vasta gama de aplicações biomédicas e é considerado uma alternativa válida para os materiais sintéticos, devido à sua biocompatibilidade inerentes (isto é, baixa antigenicidade, inflamação e respostas citotóxicas). No entanto, as propriedades mecânicas limitadas ea mão baixa-capacidade de géis de colágeno relacionados têm dificultado o seu uso como materiais de andaime para engenharia de tecido vascular. Portanto, a lógica por trás deste trabalho foi a primeira a projetar géis de colágeno celularizados em uma geometria em forma de tubular e segundo para aprimorar células musculares lisas reorganização conduzida de matriz de colagénio para obter tecidos duros o suficiente para ser manuseado.
A estratégia aqui descrita baseia-se na montagem directa de colagénio e células do músculo liso (construção) num cyli 3Dgeometria ndrical com a utilização de uma técnica de moldagem. Este processo requer um período de maturação, durante o qual as construções são cultivadas num biorreactor em condições estáticas (sem restrições mecânicas dinâmicas externa aplicada) para 1 ou 2 semanas. O "biorreator estático" fornece um ambiente estéril monitorados e controlados (pH, temperatura, troca gasosa, o fornecimento de nutrientes e remoção de resíduos) para as construções. Durante o período de cultura, as medições de espessura foram realizados para avaliar a remodelação da matriz de colagénio-células impulsionadas, e consumo de glucose e as taxas de produção de lactato foram medidos para monitorizar a actividade metabólica das células. Finalmente, as propriedades mecânicas e viscoelásticas foram avaliadas para as construções tubulares resultantes. Para este fim, os protocolos específicos e um know-how concentrado (manipulação, segurar, que trabalha em ambiente hidratado, e assim por diante) foram desenvolvidas para caracterizar os tecidos de engenharia.
Introdução
Engenharia de tecido vascular prevê diferentes estratégias que visam a fabricação de vasos de engenharia, incluindo enxertos sintéticos baseados em andaimes, vasos sanguíneos engenharia de tecidos à base de folha de celular (TEBVs) e matriz extracelular (MEC) TEBVs componentes baseados. Entre essas abordagens, polímeros sintéticos apresentam boas propriedades mecânicas, mas compartilham uma desvantagem comum, pois falta uma bioatividade. O método baseia-camada de células permite a produção de substitutos vasculares artificiais, com altas propriedades mecânicas, mas o tempo necessário para produzir tais enxertos é de aproximadamente 28 semanas 2. Biopolímeros naturais da ECM, tais como colagénio, elastina, fibrina 3 ou uma combinação dos mesmos, continuam a ser os materiais padrão de ouro para andaimes para engenharia de tecidos. Isto é principalmente pela razão de que estes materiais possuem geralmente uma boa biocompatibilidade ao ser capaz de induzir respostas celulares funcionais 4-5. Entre estes biopolímeros, colagénio do tipo I é uma das proteínas de suporte de carga mais abundante e predominante da ECM em muitos tecidos, como a pele, vasos sanguíneos e dos tendões. Um trabalho extensivo tem sido realizados sobre as propriedades mecânicas do colágeno 6-8, mas tem havido poucos estudos sobre remodelamento celular de géis de colágeno durante a maturação estática. Remodelamento celular refere-se às modificações estruturais da matriz de colágeno induzida por células que poderiam afetar a estabilidade da rede de fibrilas de colágeno 9. Como um andaime natural, relativamente grandes quantidades de colagénio do tipo I pode ser isolado, esterilizado e armazenado a partir de diferentes fontes, tais como os tendões da cauda de ratos-10. Compreender interacções celulares com colagénio e os comportamentos relacionados mecânicas globais dos andaimes de colagénio celularizados (construções) é um passo essencial para a construção de tecidos. TEBVs à base de colagénio pode ser processado através da mistura de células directamente com colagéniodurante a preparação do gel e moldado em formas mais específicas tais como tubular e plana 11. Células vasculares no interior dos géis proliferar e tipo I colágeno remodelação 12. Assim, este método evita a necessidade de macroporosidade específico que representa um dos problemas significativos no desenvolvimento de andaimes para aplicações de engenharia de tecidos. No entanto, as principais desvantagens de géis de colagénio são as suas propriedades mecânicas baixas em comparação com materiais sintéticos 13.
Neste estudo, um tecido viável, com uma distribuição homogénea de células foi manipulada por mistura directa de colagénio com células em um processo de um só passo. "estáticas" bioreactores foram usadas para o 1 ou 2 semanas de maturação estática dos géis de colagénio celularizados (sem restrições mecânicas dinâmicas externas aplicadas). Durante a cultura, a remodelação da matriz de colagénio ocorreu, proporcionando assim o reforço estrutural para as construções. Além disso, estas construções foram rEady para ser transferido para um biorreactor de parede rotativa e um endotélio homogénea foi alcançado. Além disso, neste trabalho um protocolo específico testes mecânicos também é proposto o fornecimento de uma nova abordagem adequada na caracterização das propriedades mecânicas dos tecidos moles tubulares.
Em resumo, este trabalho apresenta um método para a fabricação e a maturação dos tecidos vasculares que são suficientemente fortes para serem tratadas, não só para caracterizações biológicas e mecânicas, mas também para outras condicionado mecânica num biorreactor dinâmico, o que é considerado essencial uma rápida in vitro passo na regeneração de tecidos.
Protocolo
1. Fabricação e Montagem do biorreator estática
- Fabricação do Reservatório
- Preparar 50 ml de tubos de centrífuga como um reservatório de meio de cultura para o bioreactor.
- Adicione duas portas através da perfuração de dois diâmetros de orifícios 5 milímetros, a 20 mm a partir do fundo e o topo do reservatório, respectivamente. Em seguida, insira dois acessórios luer em tubos de silicone comprimento 5 mm. Press-fit estes acessórios luer através dos orifícios, e selar todas as ligações com cola de silicone de grau médico.
- Inserir um filtro para o orifício superior do reservatório (Figura 1A) de 0,22 um.
- Inserir um septo luer na porta inferior do reservatório (Figura 1A).
- Mandril-cap Assembléia
- Perfurar um furo de 4,5 milímetros de diâmetro no centro da tampa do tubo de ventilação do reservatório, sem danificar a membrana de filtro que cobre os furos de arejamento.
- Prepare uma barra de agitação (diâmetro = 4.5 mm, comprimento = 100 mm) Como um mandril para a construção.
- Prepare duas rolhas cónicas silicone (comprimento = 10 mm, diâmetro furo médio = 4.5 mm).
- Montar o mandril e a tampa (complexo de mandril-tampão) como descrito na Figura 1B.
- Press-fit do mandril para dentro do buraco. Inserir as duas rolhas sobre o mandril, de modo que a tampa é montada entre eles. Ajustar a posição do mandril de modo a que o seu comprimento útil é de 78 mm.
- Aplicar um primário e, em seguida, cola de silicone de grau médico para as superfícies que irão estar em contacto antes de se juntar a tampa e as rolhas cónicas silicone juntos. Remova o excesso de cola na tampa.
- Deixe secar em temperatura ambiente por 1-3 dias.
- Fabricação de gaze-apertos
- Prepare três tubos de silicone (tubo 1: diâmetro interno = 6,4 mm, comprimento = 5 mm; Tubo 2: diâmetro = 6,4 mm, comprimento = 10 mm, e o tubo 3: diâmetro = 3,1 mm, comprimento = 12 mm).
- Monte as gaze-apertos como descreverd na Figura 1C.
- Cut tubo 1 longitudinalmente, e abri-lo ao longo do tubo 2. Stick-los juntamente com a cola de silicone.
- Corte gaze cirúrgica esterilizada 5 cm x 7 centímetros folha e, em seguida, enrole firmemente a gaze sobre o tubo 3 ao longo do lado mais longo da gaze. Insira o tubo 1 tubo 2 complexo sobre a gaze.
- Adicionar cola de silicone para furar a gaze em conjunto, o tubo de um complexo de tubo 2 e o tubo 3. Cortar a gaze com um comprimento de 8 mm.
- Assembléia e Esterilização
- Monte o complexo mandril-tampão e os gaze-apertos como descrito na Figura 2.
- Brasão do mandril com graxa de grau médico (Figura 2A). Coloque as pegas de gaze sobre o mandril (Figura 2B). Distanciar os apertos no valor fixo de 35 mm a partir de cada outro.
- Preparar um molde tubular, removendo a parte inferior de uma seringa de 10 ml utilizando uma serra de mesa (último comprimento = 8 mm) ( Figura 2B).
- Insira o molde sobre o conjunto de mandril-tampão de gaze apertos equipada (complexo de habitação de molde), que se encaixam no molde sobre a rolha de silicone (Figura 2C).
- Autoclave do reservatório e do complexo de habitação de molde.
Nota: Tenha cuidado para segurar a rolha de silicone com força ao inserir o molde para evitar o seu desprendimento.
- Monte o complexo mandril-tampão e os gaze-apertos como descrito na Figura 2.
2. Engenharia de células musculares lisas Construções baseados em gel de colágeno e estático Maturação
- As construções de engenharia
- Expandir as células porcinas aórticas de músculo liso (pSMCs) em 175 cm2 frascos de cultura cheio com 20 ml de meio de cultura completo consistindo de Dulbecco Modified Eagle Médium suplementado com 10% (v / v) de soro de porcino (PS), 10% (v / v ) de soro fetal de bovino (FBS), 1% (v / v) de penicilina-estreptomicina (pen-strep).
- No ≈90% de confluência, retire pSMCs (passagem 2-4), removendo o meio de cultura a partir dobalão de pSMCs, a adição de 5 ml de solução de tripsina (1x em solução salina tamponada com fosfato, PBS) e incubação durante 10 min (T = 37 ° C, 5% de CO2, 100% de humidade).
- Ressuspender as pSMCs a uma concentração de 4 x 10 6 células / ml em meio de cultura completo.
- Preparar a solução de colagénio, tal como descrito anteriormente 10.
- Extrair e coletar feixes de colágeno de tendões rato-cauda em uma solução PBS.
- Colocar as fibras de colagénio, posteriormente, em acetona (5 min), isopropanol a 70% (v / v) (5 min) e ácido acético (0,02 N, 48 h, 4 ° C) de soluções.
- Mistura-se a solução viscosa e congelamento a -20 ° C durante 3 dias.
- Liofilizar a solução congelada para obter esponjas de colagénio.
- Solubiliza-se as esponjas de colagénio em solução de ácido acético (0,02 N) a uma concentração de 4 g / L e centrifuga-se a 29.581 g durante 45 min vigor.
- Esterilizar a solução de colágeno através de processo de diálise contra s subsequentesolutions de ácido acético (0,02 N, 1 h), clorofórmio a 1% (v / v, 1 hora) e ácido acético (0,02 N, solução estéril mudado a cada 2 dias, durante 1 semana).
- Recolher a solução esterilizada de colagénio (4 g / L) num capuz de cultura de células estéril.
- Prepare géis de colagénio celularizados como mostrado na Figura 3.
- Preparar 50 ml de solução tampão estéril através da mistura de 35 ml de DMEM (5x), 4 ml de tampão HEPES (1 N), 3 ml de NaOH (1 N) em 8 ml de água desionizada estéril.
- Preparar células e mistura de gel de colagénio em um recipiente colocado em gelo por mistura de 50% (v / v) de solução estéril de colagénio (4 g / L de ácido acético 0,02 N) com 25% (v / v) de solução tampão e 25% (v / v) de a suspensão de pSMCs em meio de cultura completo.
- Medir o pH da mistura e assegurar que é entre 7,0 e 7,4.
- Despeje delicadamente 9 ml de mistura de células-e-colágeno na / complexo acima indicado habitação molde (passo 1.4.3, Figura 3A-B ).
- Deixe que gelificar à temperatura ambiente durante 1 h, sob o capuz de cultura de células (Figura 3B).
- Maturação in Static Bioreactor
- Retirar o molde (Figura 3C) e transferir cuidadosamente o construto para o reservatório, que contém 35 ml de meio de cultura (Figura 3D).
- Incubar a construção (T = 37 ° C, 5% de CO2, 100% de humidade) em posição vertical para 1 ou 2 semanas de maturação estática.
- Instalar uma webcam (selada, a fim de garantir o isolamento) no interior da incubadora em frente do construto.
- Mudar o meio de cultura a cada 2 dias, aspirando o meio antigo a partir do porto Luer septo e re-enchimento do reservatório com uma quantidade equivalente de meio de cultura fresco.
- Medição da Espessura e metabólica Actividade de SMC-colagénio Constructos gel à base durante a cultura estática
- Coloque o interferômetro de varredura a laser para a cultu celularre capuz e lançá-lo a partir da vertical para a posição horizontal utilizando um nível de bolha.
- Transferir o biorreactor dentro do capuz de cultura de células e remover a construção do reservatório.
- Transferir o construto (ainda montado no mandril) para a via de o feixe de laser, e colocá-la estritamente ortogonal em relação ao eixo do feixe (como mostrado na Figura 4).
- Ler o valor exibido no ecrã da digitalização interferómetro laser, que corresponde ao diâmetro externo do construto.
- Calcula-se a espessura da parede da construção com base no seu diâmetro externo e interno (ou seja, o diâmetro do mandril).
Nota: Repita os passos 2.3.1 a 2.3.5 a cada hora para a primeira 12 horas e depois a cada 24 horas. - Use 1 ml de meio de cultura de idade (amostrado ao mudar o meio de cultura, passo 2.2.4) para a medição das concentrações de lactato e de glucose com o analisador de gás do sangue.
- Use 1 ml dameio de cultura fresco como um nível de linha de base para as medições de concentrações de glucose e lactato 14.
Nota: Repita os passos 2.3.6 e 2.3.7 a cada 2 dias após o meio de cultura de mudança.
- Construir colheita para Mais mecânico e biológico Ccharacterizations
- Após 1 ou 2 semanas de período de maturação estática, transferir o biorreactor estática dentro do capuz de cultura de células.
- Transferir suavemente a construção madura a partir do seu mandril (carta de vídeo 1) para uma placa de 100 mm de diâmetro de Petri contendo 40 ml de meio de cultura fresco (Figura 5 e Figura 7A).
3. Caracterização mecânica das construções nas direcções longitudinal e direcções circunf erencial
- Instalar o conjunto experimental constituído pelo verificador micromecânica equipado com uma célula de 5 ou 10 N de carga e um banho contendo PBS a 37 ° C para manter as amostras de umt condições pseudo-fisiológico (Figura 6).
- Balanço da célula de carga eo extensômetro.
Nota: O balanceamento é uma função integrada no testador micromecânica que consiste em repor o valor da extensão exibida eo valor da carga exibido quando nenhuma amostra é montado na máquina. Esta função permite definir a referência para ambas as medições. - Montagem das construções tubulares para o aparato mecânico: sentido longitudinal.
Nota: Executar testes de fadiga longitudinais diretamente sobre a totalidade das construções tubulares. Use embutido-casas dispositivos de aperto para ligar as pegas de gaze das construções para a célula de carga e para a base do banho de PBS.- Monte o tubular construir sobre os dispositivos de aperto (Figura 7b), seguindo o procedimento de colheita (seção 2.4).
- Enrole os dispositivos de aperto e as pegas de gaze em conjunto com a fita de teflon para evitar qualquer deslizamento dos apertos de gaze durante o ensaio.Monte a amostra para o testador micromecânica (Figura 7C).
- Montagem das construções em forma de anel para o aparato mecânico: direcção circunferencial.
Nota: Executar testes de fadiga circunferenciais em espécimes em forma de anel seccionados das construções tubulares. Use duas barras de aço inoxidável como alças para a fixação das amostras.- Monte o tubular construir em um tubo de plástico como um suporte marcado com lacunas cinco milímetros (Figura 7B), na sequência da colheita (seção 2.4).
- Cortar 10 milímetros anéis da construção tubular.
- Medir o comprimento da amostra, utilizando um paquímetro para as análises posteriores.
- Montar o modelo em forma de anel sobre as barras de aço inoxidável do testador de micromecânica (Figura 7C). Certifique-se de colocar a amostra no centro das barras.
Nota: O tubo de plástico no passo 3.4.1, e um sistema de corte, conforme mostrado na Figura 7B são utilizadas para evitar quaisquer danos para a construção durante o corte.
- Ensaio de fadiga em constructos na direcção longitudinal ou circunferencial.
- Estique a construção de seu comprimento de medida inicial.
- Manter a construção nesta posição durante 10 minutos em ambiente de pseudo-fisiológica.
- Aplicar 10% de deformação cíclica do comprimento de medida inicial (30 ciclos) para a construção de 5% da taxa de deformação / seg.
- Repetir o passo 3.5.3 em passos incrementais de 10% de deformação cíclica até falha da amostra.
Nota: O uso do meio de pseudo-fisiológicas requer tomando em consideração a flutuação e a inércia do sistema de preensão que afectam a medição da carga aplicada. - Grave o fundo da seguinte forma:
- Mova o quadro de carga para o comprimento de medida inicial.
- Repetir o 3.5.3 e 3.5.4 passos sem qualquer amostra montada, e manter os dispositivos de preens ligados à célula de carga (apenas 1 ciclo é requivermelho).
4. Luminal Endotelização de construções
Nota: Após seguir o protocolo de colheita (secção 2.4), as construções de suportar o manuseamento para ser montado na parede do biorreactor-rotação adicional para o endotelização.
- Girando-parede biorreator projeto
- Perfurar um furo de 4,5 milímetros de diâmetro no centro da tampa do tubo de ventilação do reservatório, sem danificar a membrana de filtro que cobre os furos de arejamento.
- Encaixe à pressão de um mandril (diâmetro = 4.5 mm, comprimento = 40 mm) no furo e fixar o mandril conforme descrito no passo 1.1.2.
- Prepare o apoio de dois silicone em forma de C para o diâmetro externo construção = 14 mm; diâmetro interno = 8 mm).
- Posicionar um motor em rotação em uma extremidade do biorreactor-parede e um rolamento rotativo sobre a outra extremidade (Figura 8B).
- Lumen Endotelização
- Expandir umbílicos humanoai veia células endoteliais (HUVECs) em 25 centímetros 2 frascos de cultura com 5 ml de meio de cultura M199 suplementado com 10% (v / v) de PS, 10% (v / v) de FBS, 1% (v / v) pen-strep na placa de Petri dentro de uma incubadora (T = 37 ° C, 5% de CO2, 100% de humidade) até 90% de confluência.
- Prepare a 1,5 ml da solução de revestimento de proteína por construção necessário para a adesão celular óptima por diluição da mistura de concentrado de proteína de 10,5 ng / ml em meio de cultura de células endoteliais sem soro.
- Medir o comprimento da construção utilizando uma craveira.
- Calcular o volume da luz V e a área luminal A do construto como: V = D em 2 L / 4 e A = D em L, respectivamente, (em que D é o diâmetro interno correspondente ao diâmetro do mandril, e L é o comprimento da construção).
- Posicionar o construto no centro do reservatório de acordo com o procedimento de colheita (secção 2.4).Usar o suporte de silicone em forma de C para fixar o construto em ambas as extremidades para o reservatório (Figura 8A).
- Encha o reservatório com 35 ml de meio de cultura.
- Encher 75% do volume da luz calculado da construção (V) com a solução de revestimento de proteína preparada no passo 4.2.2. Fechar ambas as extremidades do construto para evitar qualquer fuga de solução de revestimento de proteína (Figura 8A).
- Monte o sistema de biorreator-parede rotativa dentro da capa de cultura de célula.
- Inserir o biorreactor em um temperatura de 37 ° C incubadora e iniciar a rotação do bioreactor a 4,02 x 10 -5 força g durante 1 h para permitir que o revestimento do lúmen, como mostrado na Figura 8B.
- Abrir a extremidade superior do constructo e aspirar a solução de revestimento de proteína a partir do lúmen.
- Retire HUVEC (passagem 2-3) através da remoção do meio de cultura do frasco de células HUVEC e a adição de 3 ml da solução de tripsina (em PBS 1x). EUncubate durante 5 minutos (T = 37 ° C, 5% de CO2, 100% de humidade).
- Ressuspender as células HUVEC a uma concentração de 4 x 10 6 células / ml em meio de cultura M199 suplementado.
- No interior do capuz de cultura de células, células HUVEC sementes para o lúmen da construção com uma densidade de 1000 células / cm 2 15. Fechar as extremidades superiores do construto para evitar qualquer fuga de solução de HUVECs.
- Incubar as construções (T = 37 ° C, 5% de CO2, 100% de humidade) alojado na parede do biorreactor-rotação (Figura 8B) e a cultura durante 2 dias a uma rotação constante de 4,02 x 10 -5 g força.
- Recolher as construto após 2 dias de cultura em condições estéreis e prepará-la para posterior caracterização biológica como descrito na secção 2.4.
Resultados
Este trabalho descreve a fabricação de construções à base de colágeno tubulares modificadas contendo células vasculares. Já depois de 1 hora de início de gelificação, mistura de células-colagénio e foi montada directamente em uma geometria tubular 3D, com o diâmetro externo igual ao diâmetro do molde correspondente (cerca de 14 mm). Ao longo de toda a maturação estática, medições revelaram a rápida redução do diâmetro externo das estruturas celularizados tubulares, como mostrado na Tabela 1. O diâmetro dos géis de colagénio celularizados encolhido de cerca de 60% do seu valor inicial após 1 dia de cultura estática, e de quase 85% no prazo de 7 dias (Supplemental Vídeo 2). SMC dentro das construções são responsáveis pela observada encolhimento e o reforço mecânico relacionados, como este fenómeno não ocorre em andaimes de colagénio não celularizados. Note-se que nenhum gradiente de qualquer tipo (térmica, bioquímica, mecânica, ou outros) foi aplicada. As células-driven compactação resultou em um material com maior densidade de colágeno, que pode ser tratada e subjugado às solicitações mecânicas (Vídeos Suplementar 3 e 4).
Para relacionar a remodelação células orientado para as propriedades mecânicas e viscoelásticas gerais, ensaios de fadiga foram realizados nas construções (Vídeos complementares 5 e 6). Estes testes consistiram no ciclismo os constructos (30 vezes) em diferentes estirpes constantes (10%, 20%, e 30% do comprimento do calibre inicial) e para gravar o stress como a resposta das construções para a solicitação mecânica ao longo do tempo. Os resultados representativos para uma construção são mostrados na Figura 9. A construção suportou tensões mais elevadas na direcção longitudinal (75 kPa) do que na direcção periférica (16 kPa) quando sujeito à mesma gama de tensão (30% de deformação). Enquanto isso, em cada ciclo, o valor pico de tensão alcançou o tatensão máxima rgeted diminuiu ao longo do tempo. Este comportamento é típico das elevadas propriedades viscoelásticas, exibida por estas construções à base de colagénio.
A actividade biológica das construções de celularizados foi avaliada durante a maturação estática. Assim, a actividade metabólica das SMCs foi avaliada através da medição do consumo de glucose e produção de lactato durante a cultura estática. O meio de cultura foi amostrado a cada 2 dias e glicose e concentrações de lactato foram medidos usando um analisador de gases no sangue. O aumento constante de consumo de glucose e produção de lactato combinados para a diminuição importante das construções, atestam a actividade SMCs ao longo de toda a cultura estática (Figura 10).
O aumento da estabilidade mecânica devida à remodelação conduzido de células permitiu a manipulação das construções e o processo endotelização subsequente. Coloração tricromo de Masson realizada nas construções endothelializedmostrou um endotélio altamente homogénea. SMC exibiram uma morfologia fusiforme e apareceu como homogeneamente disperso através da parede, enquanto HUVECs apareceu bem distribuídos no lado luminal (Figura 11).
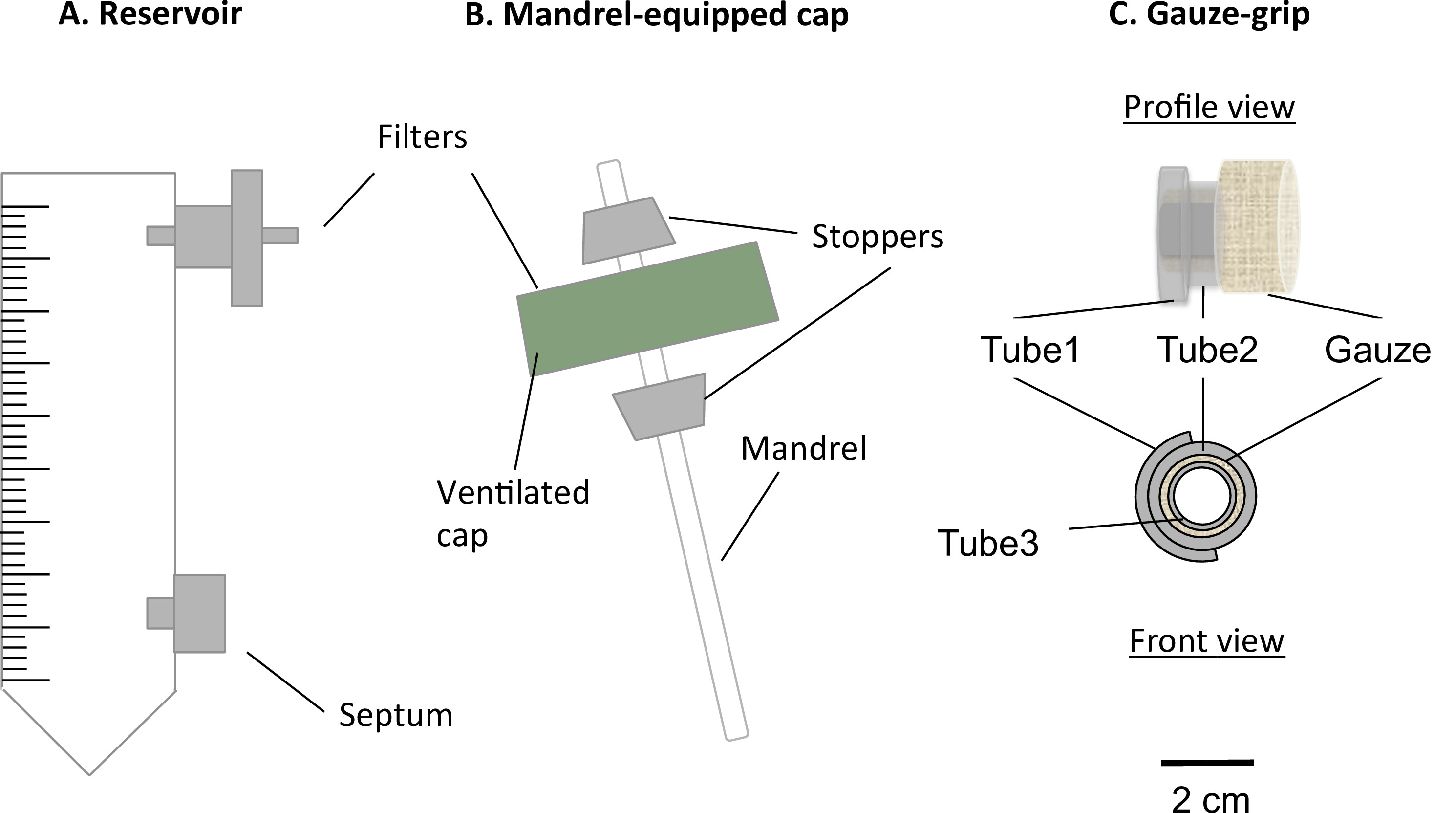
Figura 1:. Os componentes do bioreactor O bioreactor estática estático consistiu de um tubo de 50 ml de centrífuga modificado (A) e uma tampa equipada mandril (B). O tubo serviu como reservatório de meio, e foi equipado com uma porta para um filtro de 0,22 um, para a troca de gás, e um septo, por meio de amostragem e a mutação. Um mandril presente na tampa ventilada permitiu a fabricação de construções em forma tubular. As pegas de gaze (C) foram concebidos e fabricados para suportar a gelificação das construções sobre o mandril. Além disso, estesapertos permitiu que os construtos de ser tratado após a maturação estática e para ser fixo ao aparelho mecânico. O diâmetro externo do mandril era de 4,7 mm.
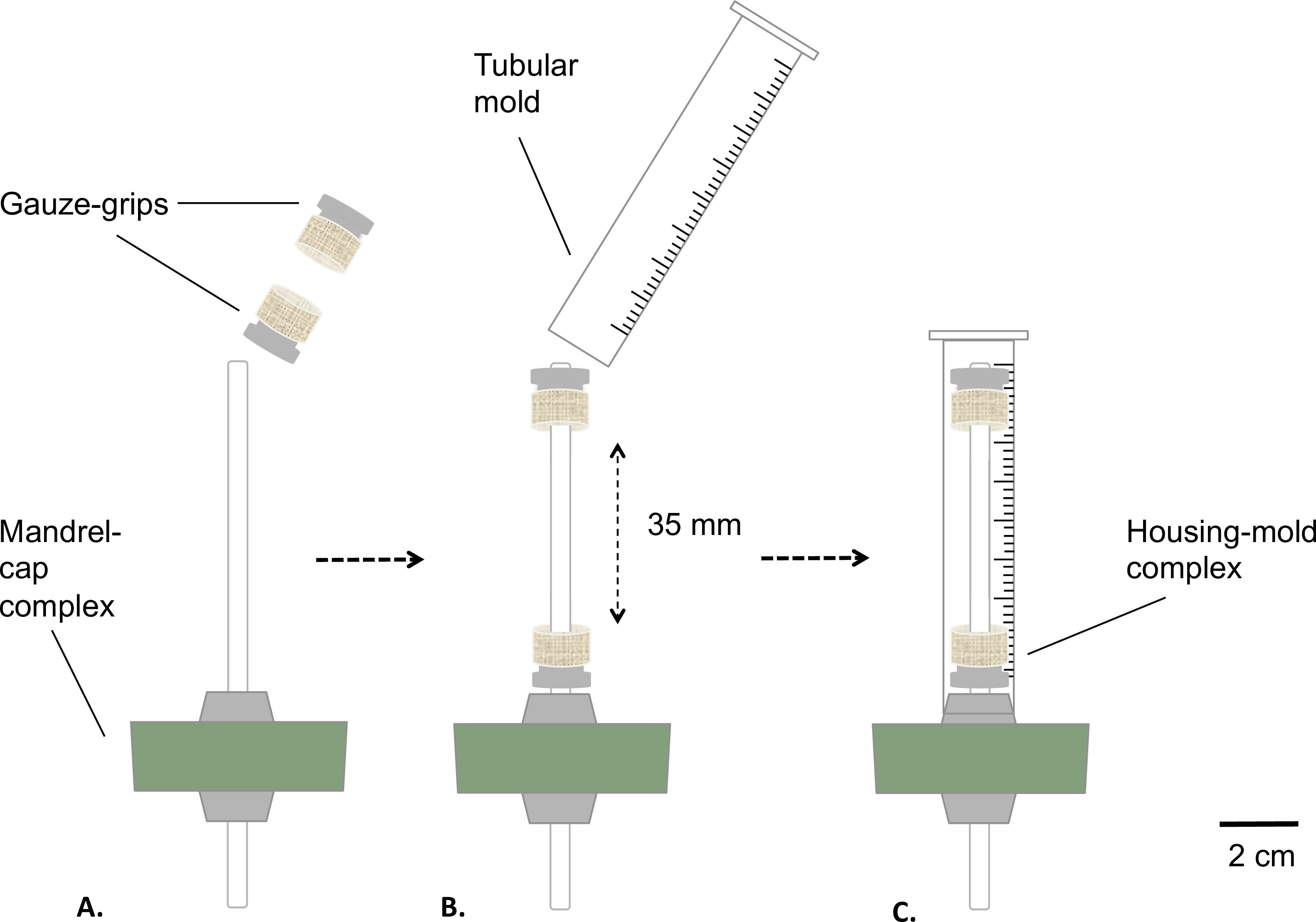
Figura 2: Montagem do biorreactor estática fases de montagem do bioreactor antes da esterilização.. As pegas de gaze foram montadas no mandril (A) a uma distância fixa. Um molde foi inserido (B) e firmemente fixo à rolha de silicone (C). O diâmetro externo do mandril era de 4,7 mm.
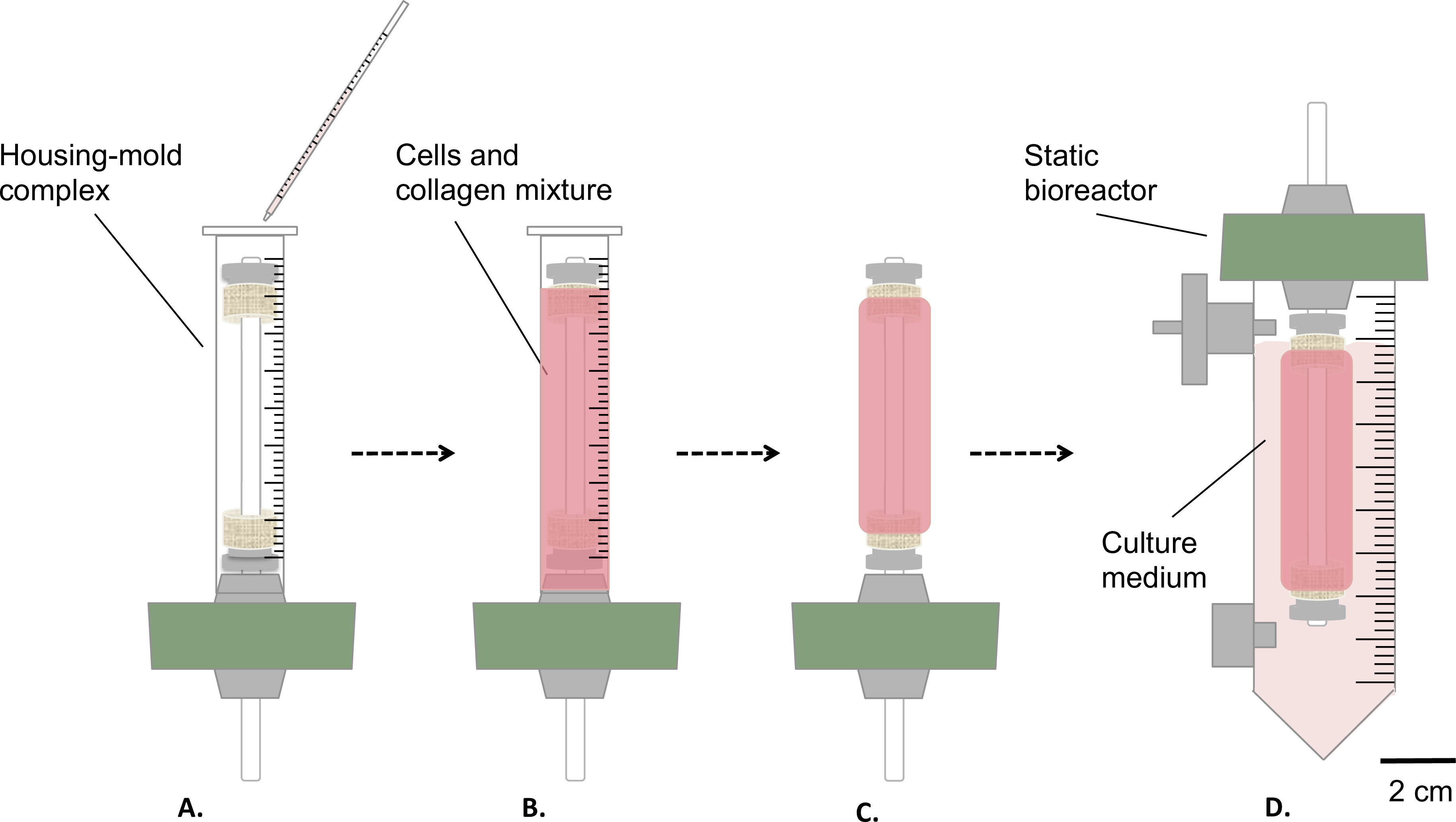
Figura 3:. Fabricação das construções em condições estéreis as células e colagénio mistura foi vertida para o molde de alojamento complexo- (A), e deixar de gel durante 1 hora à temperatura ambiente (B). Em seguida, o molde foi removido (C), o bioreactor foi montado estática (D) e transferidos para dentro de um reservatório para a maturação estática da construção na incubadora (T = 37 ° C, 5% de CO2, 100% de humidade). O diâmetro externo do mandril era de 4,7 mm.

Figura 4:. Medição da espessura / diâmetro externo das construções Um interferómetro de varrimento a laser usado para efectuar a medição dos diâmetros externos das construções. A construção foi colocado no percurso do feixe de laser e gerado uma sombra. A largura da sombra, o que corresponde ao diâmetro exterior da construção, foi então medida e apresentada no ecrã.

Figura 5:. Aparência morfológica da construção colhidas (A), logo após a gelificação e (B) depois de células-conduzida remodelação estática durante a maturação durante 2 semanas.

Figura 6: Montagem experimental para caracterizações mecânicas Consistia do testador de micromecânica equipado com uma célula de 5 ou 10 N de carga e um banho contendo PBS a 37 ° C para manter as amostras em condições pseudo-fisiológica..
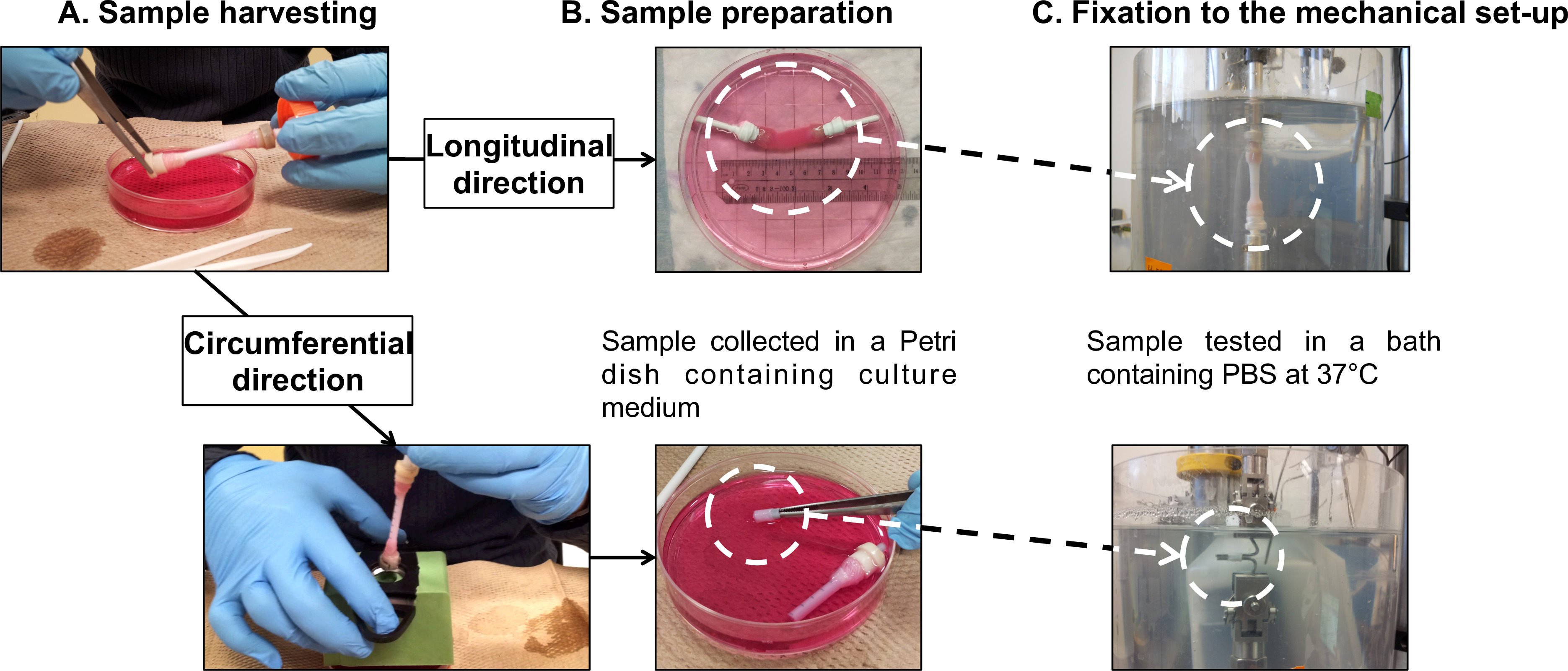
Figura 7: A preparação da amostra f ou caracterizações. mecânicas de colheita de amostra (A) e preparação de (B) para os testes de fadiga realizados nas direcções longitudinal e as direcções circunf erencial (C). O diâmetro externo do mandril era de 4,7 mm.
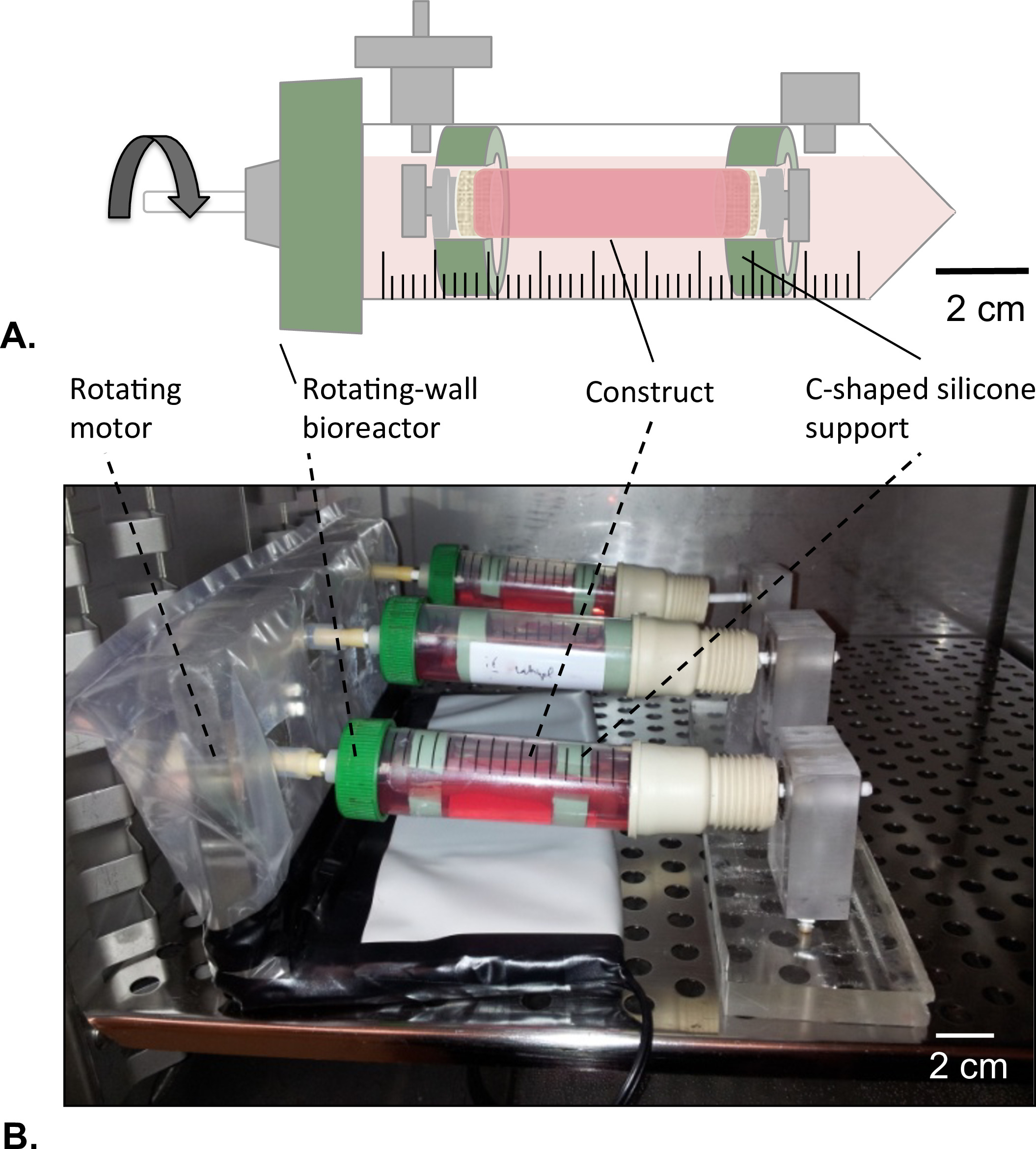
Figura 8: biorreactor-parede rotativa (A) As construções tubulares foram montadas no centro do reservatório com a ajuda do suporte de silicone em forma de c.. Ambas as extremidades da construção foram fechadas para evitar qualquer fuga de solução de HUVECs. (B) As construções foram cultivadas em incubadora (T = 37 ° C, 5% de CO2, 100% de humidade) em rotação a 4,02 x 10 -5 g força durante 2 dias.
2 / 52812fig9highres.jpg "width =" 700 "/>
Figura 9:.. Caracterizações mecânicas Os resultados dos testes de fadiga realizados em construções em longitudinal (A) e (B) circunferenciais direções depois remodelação orientada por celular Por favor, clique aqui para ver uma versão maior desta figura.
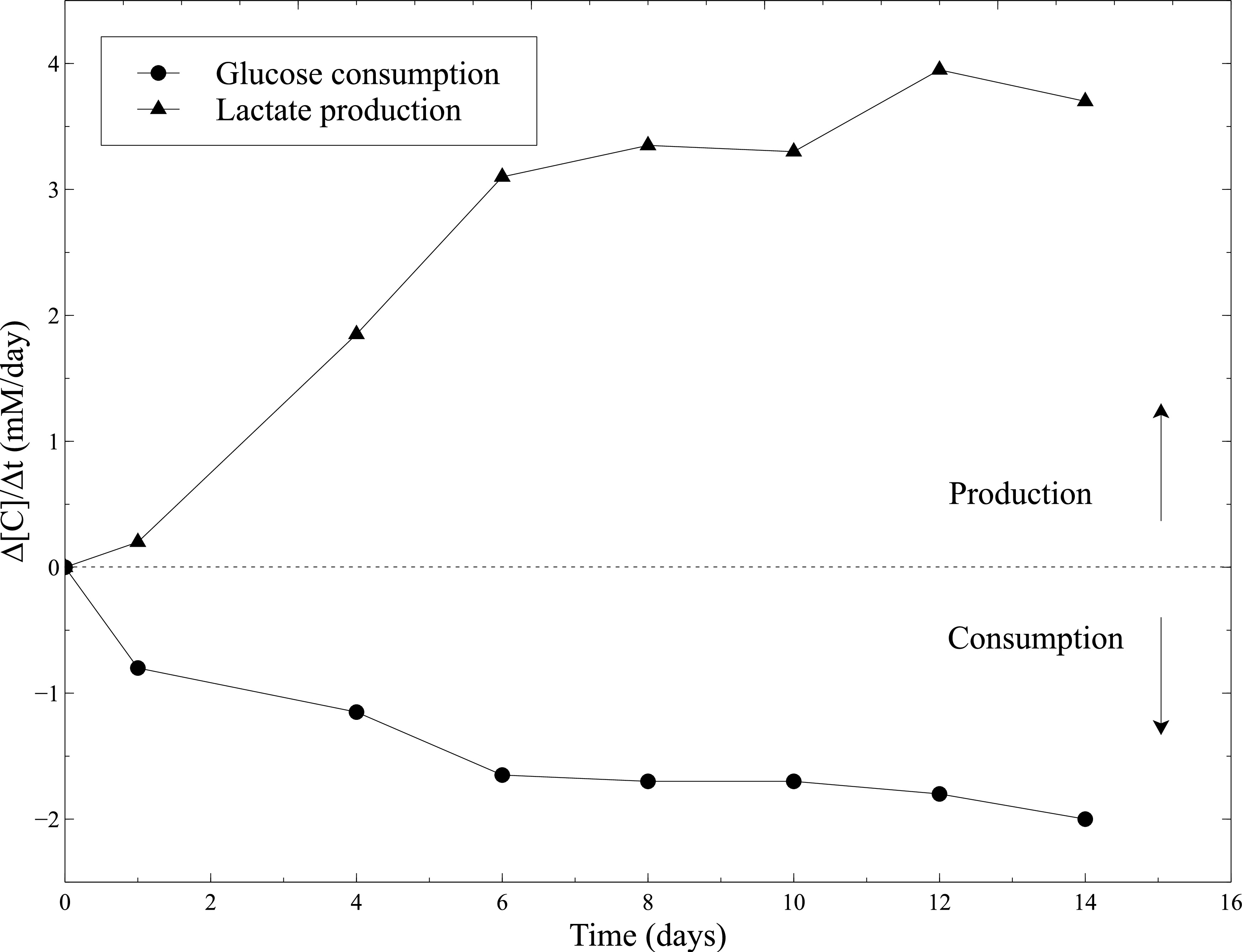
Figura 10:. A actividade metabólica das SMCs dentro dos géis de colagénio As medições da taxa de consumo de glucose e taxa de produção de lactato foram realizadas com o analisador de gás do sangue a cada 2 dias, após a mudança de meio de cultura. Meio de cultura fresco foi usado como um nível de linha de base para as medições de glucose e concentrações de lactato.
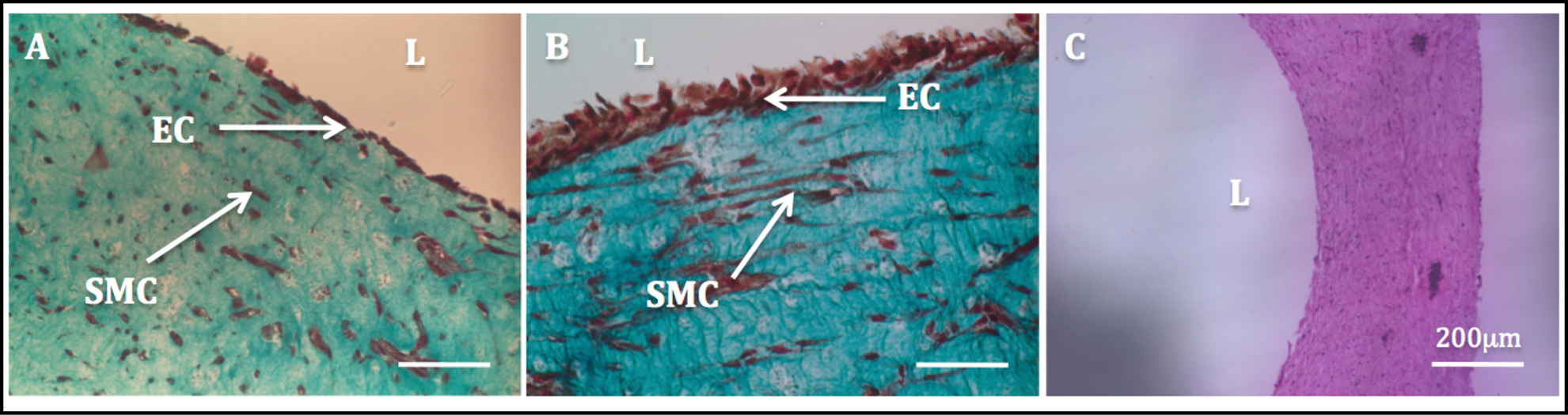
Figura 11: Lumen Endotelização imagens histológicas das secções transversais radiais de construções tubulares.. Tricoma coloração de construções tubulares de Masson estaticamente cultivadas durante 1 semana (A) e 2 semanas (B). H & E coloração de uma construção tubular (C).
| Tempo | Espessura (mm) | Compactação (%) |
| 0 hr | 4,83 ± 0,02 | 0 ± 0 |
| 2 hr | 4,26 ± 0,02 | 12 ± 0 |
| 4 hr | 4,21 ± 0,03 | 13 ± 1 |
| 6 hr | 4,06 ± 0,10 | 16 ± 2 |
| 12 hr | 3,16 ± 0,07 | 35 ± 1 |
| 1 dia | 2,08 ± 0,11 | 57 ± 2 |
| 1 semana | 0,68 ± 0,07 | 86 ± 1 |
| 2 semanas | 0,36 ± 0,00 | 93 ± 0 |
Tabela 1: compactação rápida construção de diâmetro durante a maturação estática A espessura da parede das construções e a taxa de compactação, como uma função do tempo de cultura estática.. A compactação foi medida por determinação do diâmetro externo das construções tubulares com um interferómetro laser de varredura (Série 183b, LaserMike 136). Após 24 h, as construções compactado para 57% ± 2% das suas dimensões moldadas. Os dados são expressos como média ± SD (n = 3). A presença ea atividade das células musculares lisas viver era o único responsável por essas grandes mudanças.
Supplemental Vídeo 1:. colheita dos géis não remodelado colágeno tubular Por favor clique aqui para ver este vídeo.
Suplementar Video 2:. Impulsionadas Células-compactação de géis de colágeno tubulares Por favor clique aqui para ver este vídeo.
Suplementar Video 3:. Manipulação dos géis não remodelado colágeno tubular Por favor clique aqui para ver este vídeo.
Suplementar Video 4:. A manipulação das células-remodelados géis de colágeno tubular Por favor clique aqui para ver thé vídeo.
Suplementar Vídeo. 5: ensaio de fadiga Longitudinal (em 30%) em células-remodelados géis de colágeno tubular Por favor clique aqui para ver este vídeo.
Suplementar Vídeo. 6: teste de fadiga circunferencial (em 30%) em células-remodelados géis de colágeno tubular Por favor clique aqui para ver este vídeo.
Discussão
Entre a comunidade de engenheiros de tecidos vasculares, enormes esforços têm sido feitos para reproduzir a camada de túnica média responsável pela estabilidade mecânica dos vasos sanguíneos 16. Desde o trabalho pioneiro de Weinberg e Bell 17, colagénio tem sido amplamente utilizado como um andaime para engenharia de tecido vascular devido a sua biocompatibilidade, propriedades não imunogénicas e disponibilidade. No entanto, a utilização de colagénio representa um grande desafio para os investigadores, como este material não é fácil de manusear, devido à falta de rigidez intrínseca mecânica. Manipulações durante a preparação do andaime pode danificar os andaimes, comprometendo-los para uso posterior.
A técnica descrita neste trabalho permite: i) para a engenharia géis de colagénio em celularizados uma geometria de forma tubular, ii) para a engenharia de tecidos biológicos suficientemente forte para ser manuseado após um curto período de maturação estática (uma ou duas semanas), iii) como apropriedades mecânicas e viscoelásticas sess de tais tecidos biológicos em forma tubular em duas direcções. As células no gel desempenhar um papel-chave na remodelação da matriz de colagénio. Durante o período de maturação, SMCs contráteis levou à compactação dos géis produzindo uma construção com maior estabilidade mecânica que poderiam ser avaliados nas direções longitudinais e circunferenciais. Em seguida, células HUVEC semeadas no lado luminal das construções gerado um endotélio homogénea e viável, demonstrando assim a adequação dos géis de colagénio para aplicações de engenharia de tecidos vasculares.
O biorreator apresentada neste trabalho foi projetado especificamente para fornecer um ambiente ideal para o crescimento celular durante a maturação estática. Além disso, os dispositivos desenvolvidos para a caracterização das propriedades mecânicas e viscoelásticas das construções foram concebidos com o objectivo de reduzir qualquer dano potencial inerente à manipulação detais materiais delicados. Assim, o biorreactor foi estático equipado de um filtro de 0,22 um e uma membrana de filtro na tampa (passo 1.1.2, Figura 1A e B) que permitiu a troca gasosa entre o meio de cultura no interior do reservatório e da incubadora, mantendo um ambiente de cultura estéril. O septo luer na parte inferior foi usada como uma porta de amostragem de meio de cultura e durante a cultura estática mudando. Alguns passos críticos têm de ser considerados durante a fabricação construção e caracterizações. Todas as manipulações realizadas no (passo 2.1.1 e nos passos subsequentes) que podem alterar a esterilidade do sistema foram realizados numa hote estéril biológica. Células e gel de colágeno preparação mistura foi tratada com gelo, a fim de retardar o processo de gelificação (passos 2.1.4 a 2.1.7). No passo 2.1.7, quaisquer bolhas de ar aprisionadas na mistura antes da gelificação são zonas de concentração de tensões potenciais que podem comprometer a slucratividade das construções. Portanto, a remoção de tais bolhas de ar requer um pouco agitando a montagem ou usando médicos de vácuo durante 3 minutos para Desgasificação em condições estéreis. Por último, as garras foram concebidos especificamente para manter o eixo do mandril central no molde tubular durante a gelificação e para permitir a manipulação delicada dos construtos durante a colheita (remoção do mandril, secção 2.4), para endotelização, e para facilitar a montagem sobre o sistema mecânico (testes longitudinais).
O presente protocolo propõe uma abordagem original e fácil de processo alternativo de reforço de géis de colágeno construções com base no potencial inerente contrátil natural de PMEs. As técnicas comuns de matrizes de colagénio reforço envolvem o uso de agentes de reticulação físicas e químicas que podem ter efeitos nocivos sobre as interacções de células-matriz 18-20. A técnica de fabricação apresentado emeste trabalho permite dirigir este processo de remodelação células orientado para produzir uma construção de engenharia de tecidos, com propriedades mecânicas em causa sem qualquer tratamento físico ou químico.
Caracterização de propriedades mecânicas e viscoelásticas de géis de colágeno hidratado é um grande desafio. Nesta perspectiva, o presente protocolo descreve um método simples e eficiente original para avaliar as propriedades mecânicas dos tecidos moles tubulares. Esta caracterização pode ser realizada não só na direcção periférica, mas também na direcção longitudinal, directamente em toda a estrutura tubular. Durante a caracterização mecânica, temperatura, ambiente aquoso, pH e força iónica são alguns dos factores ambientais que são conhecidos por afectar drasticamente o comportamento mecânico dos tecidos biológicos 21. Assim, o presente trabalho sugere um set-up e protocolo original para a caracterização mecânica dos tecidos biológicos em um ambiente altamentepseudo-reprodutível ambiente fisiológico (solução salina a 37 ° C e pH 7,4). Para o melhor de nosso conhecimento, este tipo de caracterização nunca foi relatado em outros lugares.
Em conclusão, a técnica proposta neste trabalho demonstra o elevado potencial de mistura directa de células com colagénio para aplicações de engenharia de tecidos vasculares. Este método, juntamente com o processo de caracterização mecânica e endotelização constituem protocolos polivalentes elevados. Assim, através de ligeiras modificações das set-ups e protocolos, mantendo o mesmo raciocínio, os principais requisitos para a engenharia de equivalentes de tecidos vasculares podem ser abordados, como o processamento rápido e sem complicações, incluindo Endotelização, ea possibilidade de ser transposto para uma ampla gama de suave tecidos com vários comprimentos e diâmetros. Além disso, diferentes tipos de células aderentes, proteínas da MEC e geometrias moldados podem ser investigados quanto a um número de applicati segmentadosons, tais como tendões de engenharia, enxertos de pele, manchas cardíacas, nervos, entre outros. Embora as propriedades mecânicas das construções são encorajadores, eles são ainda mais baixos do que os de tecidos nativos. Neste contexto, acreditamos fortemente que um período de maturação estática muito curto é um passo crucial para a estimulação dinâmica em um biorreator, conduzindo assim a uma maior integridade estrutural e estabilidade mecânica. No entanto, a possibilidade de produzir rapidamente celularizados construções à base de colágeno engenharia de tecidos adequados para mecânica e análises histológica faz com que o biorreator estática aqui descrita uma ferramenta útil e promissor para fornecer informações sobre a interação entre células e ECM durante o crescimento e remodelação, ou mesmo para ser utilizada como um modelo para as terapias e sistemas de entrega de drogas.
Divulgações
Nenhum financiamento foi recebido de organizações ou agências com potencial conflito de interesses.
Agradecimentos
Esta pesquisa foi financiada pela Ciência Natural e do Conselho de Investigação do Canadá Engenharia, do Instituto Canadense de Pesquisa em Saúde e do CHU de Québec Centro de Pesquisa.
Materiais
| Name | Company | Catalog Number | Comments |
| CellTreat 50 ml Bio-Reaction tubes | CELLTREAT Scientific Products | 229-475 | Centrifuge tube |
| Male luer with lock ring x 1/8" hose barb. PP. 25/pk | Cole Parmer | RK-45503-04 | Luer fittings for "gas-exchange port" |
| Female luer x 1/8" hose barb adapter. PP. 25/pk | Cole Parmer | RK-45500-04 | Luer fittings for the "medium sampling port" |
| Masterflex platinum-cured silicone tubing L/S 17. 25 ft. | Cole Parmer | RK-96410-17 | Tube 1 and 2 for the gauze grippers |
| Masterflex platinum-cured silicone tubing L/S 16. 25 ft. | Cole Parmer | RK-96410-16 | Tube 3 for the gauze grippers |
| Silastic Medical adhesive silicone, type A | Dow Corning | - | Silicon glue for the fabrication of the static bioreactor |
| Polyvent 4 Vessel venting filters | Whatman | 6713-0425 | Filter for "gas exchange port" |
| Rod. PP. stirring. 8’’ | Scienceware | 377660008 | Mandrel |
| Stopper silicone rubber 00 PK12 | VWR | 59590-084 | Stopper for the insertion of the mandrel to the vented cap of the centrifuge tube |
| Krytox PFPE/PTFE Greases | Dupont | GPL 202 | Medical grade grease for covering the mandrel |
| Trypsin-EDTA (0.5%) | Gibco | 15400-054 | Cell culture |
| Xiameter RTV-4130-J base and curing agent | Dow Corning | - | C-shaped silicone support for endothelialization |
| Dulbecco’s modified Eagle medium, DMEM, high glucose, pyruvate | Gibco (Life Technology) | 11995-065 | Cell culture |
| Pure acetone (99%) | Laboratoire Mat Inc. | AP0102 | Chemical for collagen extraction |
| Isopropyl alcohol (HPLC grade, 99.9%) | Fisher Scientific | AC610080040 | Chemical for collagen extraction |
| 0.02 N acetic acid (glacial acetic acid, HPLC grade, 99%) | Fisher Scientific | FL070494 | Chemical for collagen extraction |
| Chloroform solution (99%) | Laboratoire Mat Inc. | CR 0179 | Chemical for collagen extraction |
| Hepes | Sigma-Aldrich | 163716 | Chemical for construct preparation |
| NaOH | Laboratoire Mat Inc. | SR-0169 | Chemical for construct preparation |
| LaserMike 136 | LaserMike | Series 183B | Scanning laser interferometer |
| ElectroPulse MicroTester | Instron Corporation | - | Micromechanical Tester |
| HyClone Media M199/EBSS, 500 ml | GE Healthcare Life Sciences | SH30253.01 | Component of cell culture medium |
| Fetal bovine serum HI - 500 ml | Gibco | SH 30396.03 | Component of cell culture medium |
| Porcine serum (PS) | Sigma-Aldrich | P9783 | Component of cell culture medium |
| Penicillin-Streptomicin | Gibco | 15140-122 | Component of cell culture medium |
| Phosphate buffered saline (PBS) | Fisher Scientific | BP661-50 | Saline solution |
| Tissue culture flask T17CN Vent Cap Red | Sarstedt Inc. | 83.1812.002 | Cell culture |
| ColorpHast- pH-indicator strips (pH = 6.5-10.0) | EMD | 9583 | pH measurements |
| Matrigel Basement Membrane Matrix Growth Factor Reduced, 5 ml vial | BD Biosciences - Discovery Labware | 356230 | Concentrate protein mixture for endothelialization process |
| LifeCam VX-3000 | Microsoft | - | Thickness measurement |
| Biochemical analyzer, DxC600 | Beckman Coulter Unicell Synchron | - | Glucose and lactate concentrations measurements |
| Collagen fibers | Rat tails | - | Collagen was extracted in the laboratory |
| Porcine smooth muscle cells (pSMCs) | Porcine aortas | - | pSMCs were isolated in the laboratory |
| Human umbilical vein endothelial cells (HUVECs) | Human umbilical veins | - | HUVECs were isolated in the laboratory |
Referências
- Kim, B. S., Nikolovski, J., Bonadio, J., Smiley, E., Mooney, D. J. Engineered smooth muscle tissues: regulating cell phenotype with the scaffold. Experimental cell research. 251, 318-328 (1999).
- Heureux, N., McAllister, T. N., de la Fuente, H. L. Tissue-engineered blood vessel for adult arterial revascularization. The New England journal of medicine. 357 (14), 1451-1453 (2007).
- Syedain, Z. H., Meier, L. A., Bjork, J. W., Lee, A., Tranquillo, R. T. Implantable arterial grafts from human fibroblasts and fibrin using a multi-graft pulsed flow-stretch bioreactor with noninvasive strength monitoring. Biomaterials. 32 (3), 714-722 (2011).
- Lee, C., Singla, A., Lee, Y. Biomedical applications of collagen. International journal of pharmaceutics. 221 (1-2), 1-22 (2001).
- Couet, F., Rajan, N., Mantovani, D. Macromolecular biomaterials for scaffold-based vascular tissue engineering. Macromolecular bioscience. 7 (5), 701-718 (2007).
- Christiansen, D. L., Huang, E. K., Silver, F. H. Assembly of type I collagen: fusion of fibril subunits and the influence of fibril diameter on mechanical properties. Matrix Biology. 19 (5), 409-420 (2000).
- Eppell, S. J., Smith, B. N., Kahn, H., Ballarini, R. Nano measurements with micro-devices: mechanical properties of hydrated collagen fibrils. Journal of the Royal Society, Interface / the Royal Society. 3 (6), 117-121 (2006).
- Lai, V. K., Lake, S. P., Frey, C. R., Tranquillo, R. T., Barocas, V. H. Mechanical behavior of collagen-fibrin co-gels reflects transition from series to parallel interactions with increasing collagen content. Journal of biomechanical engineering. 134 (1), 011004 (2012).
- Seliktar, D., Nerem, R. M., Galis, Z. S. The Role of Matrix Metalloproteinase-2 in the Remodeling of Cell-Seeded Vascular Constructs Subjected to Cyclic Strain. Annals of Biomedical Engineering. 29 (11), 923-934 (2001).
- Rajan, N., Habermehl, J., Coté, M. -. F., Doillon, C. J., Mantovani, D. Preparation of ready-to-use, storable and reconstituted type I collagen from rat tail tendon for tissue engineering applications. Nature protocols. 1 (6), 2753-2758 (2006).
- Kumar, V. A., Caves, J. M., et al. Collagen-Based Substrates with Tunable Strength for Soft Tissue Engineering. Biomaterials science. 1 (11), 1193-1202 (2013).
- Li, S., Van Den Diepstraten, C., D’Souza, S. J., Chan, B. M. C., Pickering, J. G. Vascular smooth muscle cells orchestrate the assembly of type I collagen via alpha2beta1 integrin, RhoA, and fibronectin polymerization. The American journal of pathology. 163 (3), 1045-1056 (2003).
- Badylak, S. F., Freytes, D. O., Gilbert, T. W. Extracellular matrix as a biological scaffold material: Structure and function. Acta biomaterialia. 5 (1), 1-13 (2009).
- Engbers-Buijtenhuijs, P., Buttafoco, L., et al. Biological characterisation of vascular grafts cultured in a bioreactor. Biomaterials. 27 (11), 2390-2397 (2006).
- Cheung, A. L. Isolation and culture of human umbilical vein endothelial cells (HUVEC). Current protocols in microbiology. 4, 4B (2007).
- Seifu, D. G., Purnama, A., Mequanint, K., Mantovani, D. Small-diameter vascular tissue engineering. Nature reviews. Cardiology. , (2013).
- Weinberg, C., Bell, E. A blood vessel model constructed from collagen and cultured vascular cells. Science. 231 (4736), 397-400 (1986).
- Meghezi, S., Chevallier, P., Mantovani, D. Why Mechanical Properties of Collagen Scaffolds Should Be Tested in a Pseudo-Physiological Environment. Advanced Materials Research. 409, 158-163 (2011).
- Tirella, A., Liberto, T., Ahluwalia, A. Riboflavin and collagen: New crosslinking methods to tailor the stiffness of hydrogels. Materials Letters. 74, 58-61 (2012).
- Madhavan, K., Belchenko, D., Tan, W. Roles of genipin crosslinking and biomolecule conditioning in collagen-based biopolymer: Potential for vascular media regeneration. Journal of biomedical materials research. Part A. , 16-26 (2011).
- Meghezi, S., Couet, F., Chevallier, P., Mantovani, D. Effects of a pseudophysiological environment on the elastic and viscoelastic properties of collagen gels. International journal of biomaterials. 2012, 319290 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados