Method Article
In Vitro e In Vivo modelo para estudar a adesão bacteriana para o Vaso de parede em condições de escoamento
Neste Artigo
Resumo
To study the interaction of bacteria with the blood vessels under shear stress, a flow chamber and an in vivo mesenteric intravital microscopy model are described that allow to dissect the bacterial and host factors contributing to vascular adhesion.
Resumo
A fim de causar infecções endovasculares e endocardite infecciosa, bactérias necessitam de ser capaz de aderir à parede do vaso ao mesmo tempo que exposta à tensão de corte do fluxo de sangue.
Para identificar os fatores bacterianos e do hospedeiro que contribuem para a adesão vascular de microorganismos, modelos apropriados que estudam essas interações em condições de cisalhamento fisiológicas são necessários. Aqui, nós descrevemos um modelo in vitro de fluxo na câmara que permite investigar a adesão bacteriana às diferentes componentes da matriz extracelular ou a células endoteliais, e um modelo de microscopia intravital que foi desenvolvido para visualizar diretamente a aderência inicial das bactérias para a circulação in vivo splanchnic . Estes métodos podem ser utilizados para identificar os factores bacterianas hospedeiras e necessárias para a adesão de bactérias sob fluxo. Nós ilustrar a relevância da tensão de cisalhamento e o papel do fator von Willebrand para a adesão de Staphylococcus aureus utilizando tanto in vitro e in vivo no modelo.
Introdução
To establish endovascular infections, pathogens require a mechanism to adhere to the endothelium, which lines the vessel wall and the inner surface of the heart, and to persist and establish an infection despite being exposed to the shear stress of rapidly flowing blood. The most frequent pathogen causing life-threatening endovascular infections and infective endocarditis is Staphylococcus aureus (S. aureus)1.
Various bacterial surface-bound adhesive molecules mediate adhesion to host tissue by interacting with extracellular matrix components. These MSCRAMMs (microbial surface components recognizing adhesive matrix molecules) recognize molecules such as fibronectin, fibrinogen, collagen and von Willebrand factor (VWF). MSCRAMMs are important virulence factors of S. aureus and are implicated in the colonization and invasion of the host2. Most studies on these virulence factors have been performed in static conditions, and thus may not be representative for human infections where initial adhesion of the bacteria occurs in flowing blood.
In the case of bloodstream infections, bacteria need to overcome the shearing forces of flowing blood in order to attach to the vessel wall. Models that investigate the interaction between bacteria and endothelium or subendothelium under flow conditions are therefore of particular interest.
A recent study showed that the adhesion of S. aureus to blood vessels under shear stress is mediated by VWF3. VWF, a shear stress-operational protein, is released from endothelial cells upon activation. Circulating VWF binds to collagen fibers of the exposed subendothelial matrix. Our group reported that the von Willebrand factor-binding protein (vWbp) of S. aureus is crucial for shear-mediated adhesion to VWF4.
In this article, we present an in vitro flow chamber model where bacterial adhesion to different components of the extracellular matrix or to endothelial cells can be evaluated. To validate the findings from in vitro data, we have developed an in vivo model that visualizes and quantifies the direct interaction of bacteria with the vessel wall and the formation of bacteria-platelet thrombi in the mesenteric circulation of mice, using real-time intravital vascular microscopy.
Protocolo
As experiências com animais foram aprovados pelo Comitê de Ética da KU Leuven.
1. Bactérias Preparando in vitro perfusões e in vivo
- Nós usamos S. aureus estirpe Newman para todas as experiências descritas neste manuscrito. S. aureus Newman foi armazenado em Brain Heart Infusion (BHI) com 10% de glicerol a -80 ° C.
- Usar uma ansa estéril para raspar as bactérias congeladas fora e inocular em 5 ml de Tryptic Soy Broth (TSB) O / N a 37 ° C (OD 600> 3).
- Lavam-se as bactérias por centrifugação (2600 g, RT, 5 minutos) e ressuspender o sedimento de bactérias em 5 ml de PBS (tampão fosfato salino).
- Prepara-se uma solução de 1 mg / ml de 5 (6) éster de N-hidroxi-succinimidilo carboxi-fluoresceína (carboxi-fluoresceina) em etanol. Dilui-se a / solução 1 mg ml carboxi-f luoresceina a 150 mg / ml em água grau de laboratório (por exemplo, água MilliQ). Proteja os tubos de luzcom folha de alumínio e armazenar a -20 ° C.
- Centrifugar as bactérias (2600 xg, temperatura ambiente, 5 min). Ressuspender o sedimento bacteriano em 800 ul de PBS e adicionar 200 uL (concentração final de 30 ug / ml para experiências de perfusão) ou 400 ul (concentração final 50 ug / ml para experiências in vivo) da mL / solução de carboxi-fluoresceína 150 ug. Proteger os tubos de luz com folha de alumínio e incuba-se durante 30 min à temperatura ambiente num agitador.
- Após a marcação, o bloco com uma solução de 6% de albumina de soro bovino (BSA) em PBS.
- Dilui-se as bactérias por densitometria óptica (OD), um OD 600 de 0,65 para experiências in vitro (que corresponde a aproximadamente 3 x 10 8 unidades formadoras de colónias (CFU) / ml para S. aureus) e uma DO 600 de 1,8 para experiências in vivo ( correspondendo a cerca de 1 x 10 9 UFC / ml para S. aureus) em PBS. Proteja os tubos de luz com papel alumínio e deixe no gelo.
2. Experiments In Vitro Perfusão
- O revestimento de lamelas de vidro
- Dilui-se o factor von Willebrand (VWF) (Haemate P, a concentração de estoque de 2.400 ug / ml) em grau de laboratório água (desionizada destilada) a uma concentração final de 50 ug / ml.
- Dilui-se o colagénio em solução isotónica de glucose (solução a SKF, pH 2,7-2,9, tal como é fornecido pelo fabricante) para uma concentração final de 160 ug / ml.
- Revestimento lamelas de vidro (24 x 50 mm) com VWF ou colagénio, largando 200 ul do revestimento em parafilme e colocar a lamela por cima da gotícula. A gotícula irá espalhar ao longo da superfície da lamela.
- Incubar a lamela em um recipiente de humidif içado, durante 4 horas à temperatura ambiente. Levante cuidadosamente as lamelas do parafilm com uma agulha sem corte. Colocar a tampa na parte inferior da câmara de escoamento.
- Revestimento de plástico desliza com células endoteliais
- Deslizamentos Brasão de plástico(1-bem câmara de cultura de células APC, Sarstedt, Alemanha) com 1 ml de uma solução de gelatina a 1% em PBS e incubar durante 30 min a 37 ° C. Semear as células endoteliais da veia umbilical humana (HUVECs) sobre as folhas de plástico revestidos com gelatina e crescê-las a 70-80% de confluência. Montar o deslizamento de plástico na parte inferior da câmara de escoamento.
- Perfusão Experiment
NOTA: Uma vista geral esquemática do sistema de perfusão em vitro é representado na Figura 1.- Realiza-se em estudos in vitro a aderência de bactérias numa câmara de fluxo de placa de micro-paralela a uma tensão de cisalhamento laminar entre 2,5 dine / cm2 e 20 dine / cm 2 para simular diferentes condições de fluxo fisiológicas.
- O (in-house design) câmara de fluxo consiste numa estrutura de metal e uma câmara de perfusão feito de plexiglas (poli (metil) metacrilato (PMMA)). Ao ligá-lo a uma bomba de infusão de alta precisão (PHD 2000 Infusion, Harvard Apparatus, EUA), podemos gerar ra fluxotes entre 0,0001 mL / min e 220,82 mL / min.
- Ligue o tubo para a parte superior da câmara de fluxo e injectar meio no tubo. Suavemente colocar a parte superior da câmara de fluxo na parte superior da parte de fundo e montar a câmara de escoamento. Tenha cuidado para evitar bolhas de ar. Injectar 1 mL de meio através da câmara para se certificar de que a câmara não tem fugas e para remover o excesso de solução de revestimento. Evitar bolhas de ar.
- Colocar o rato sobre uma almofada de aquecimento controlado por termo a 37 ° C num tabuleiro de microscópio. Como este é um processo terminal, não há necessidade de procedimentos asceptic rigorosos. Realizar uma incisão perto da veia jugular, remover suavemente o lado direito do músculo do colo do útero e isolar a veia jugular a partir do tecido circundante.
- Configure a bomba de infusão e microscópio de fluorescência. Configurações de bomba de infusão depende do diâmetro de uma seringa e a vazão desejada (ver secção 2.4). A partir de agora, trabalhar em um quarto escuro.
- Revestimento de VWF:
- Encha uma seringa com bactérias fluorescente etiquetado e conectá-lo ao tubo de entrada. Evitar bolhas de ar. Iniciar a bomba de infusão durante 10 min. O tempo de infusão depende da velocidade de corte e do revestimento, as bactérias e meio utilizado e deve representar o estado estacionário de adesão.
- Após 10 minutos, lavar as bactérias não ligadas por ligação de uma seringa com PBS para o tubo de entrada e a partir da bomba de infusão.
- Tome pelo menos 15 imagens ou filmes em diferentes locais após o processo de lavagem. As bactérias são pequenos e potencialmente difícil de focar. Antes do experimento de fluxo in vitro, o plano focal apropriada pode ser obtida por colocação de uma gota de bactérias marcadas com fluorescência numa lamela e colocando a lamela na câmara de escoamento. Em seguida, procure o plano focal apropriado e salvar as configurações.
Nota: Durante a experiência de fluxo in vitro, as imagens foram capturadas durante o passo de lavagem (± 5 minutos após o início) garante que apenas osinal para as bactérias aderentes é capturado.
- O colagénio de revestimento:
- Adicionar 60 ug / ml de VWF para as bactérias marcadas com fluorescência imediatamente antes do início da perfusão. Encha uma seringa com bactérias fluorescente etiquetado ou bactérias fluorescente etiquetado suplementadas com 60 ug / ml VWF e conectá-lo ao tubo de entrada. Evitar bolhas de ar. Repita os passos 2.3.5.2 para 2.3.5.3
- As células endoteliais:
- Activa as células endoteliais por perfusão com uma solução 0,1 mM de Ca2 + A23187 -ionophore (solução de reserva 10 mM dissolvidos em dimetil sulfóxido (DMSO)) em DMEM com a mesma taxa de cisalhamento como a perfusão bacteriana durante 10 minutos por perfusão com um 0,1 mm. Repita os passos 2.3.5.2 a 2.3.5.3.
- Calcule a taxa de deformação e tensão de cisalhamento como se segue.
Taxa de corte = 6Q / wh 2
Onde: Q: taxa em ml / min, fluxo w: largura em cm, h: altura em cm
A tensão de cisalhamento (τ) = rato cisalhamentoex viscosidade (μ)
Onde μ: média: 0,01 dines x sec / cm 2, o sangue total: 0,04 dinas x sec / cm 2 - Análise de imagem
- Obter imagens ao vivo usando um microscópio de fluorescência invertido com uma câmera preto e branco e desenvolver usando software de imagem. Use o tempo de exposição de 1,5 s. Tome vários instantâneos (pelo menos 15) distribuídas aleatoriamente sobre a superfície revestida da câmara de fluxo e salvá-los no formato de arquivo apropriado.
- Realizar análise de imagem com ImageJ. Subtrair o plano para remover fundos contínuos suaves de imagem (Processo - Fundo substrato) e definir o limite para definir valores de limite inferior e superior, a segmentação de imagens em escala de cinza em características de interesse. Medir a área limitada ao limiar.
- Comparar a adesão bacteriana, expressa como a área de fluorescência, por exemplo, utilizando software de análise estatística. Comparar os grupos utilizando ANOVA one-way ou two-atado teste t de Student. Assinalar todos os valores como média ± erro padrão da média (SEM). Considere-se um valor de p <0,05 significativo (* p <0,05; ** p <0,01; *** p <0,001).
3. In Vivo Modelo de perfusão mesentérica
- Preparação / cirurgia do mouse
- Jejuar o mouse na noite antes do experimento, a fim de limitar o movimento do intestino.
- Dê um com 6-8 semanas de idade ratinho (C57BL / 6) analgesia pré-operatória de uma injecção subcutânea de buprenorfina (0,1 mg / kg de peso corporal (PC)) 20-30 minutos antes da cirurgia.
- Anestesiar o rato por injecção intra-peritoneal de cetamina (125 mg / kg de peso corporal) e xilazina (12,5 mg / kg de peso corporal). Verifique por pedal reflexo. Aplicar veterinário pomada para evitar o ressecamento.
- Colocar o rato sobre uma almofada de aquecimento controlado por termo a 37 ° C num tabuleiro de microscópio. Uma vez que este é um procedimento de terminais, não há necessidade de estrita asceptic procedimentos. Realizar uma incisão perto da veia jugular, remover suavemente o lado direito do músculo do colo do útero e isolar a veia jugular a partir do tecido circundante.
- Inserir um cateter 2 French intravenosa na veia jugular direita para a infusão de bactérias marcadas com fluorescência ou outras soluções. Abra a cavidade peritoneal através de uma incisão na linha média abdominal e usar cotonetes para espalhar o mesentério e visualizar a arteriolar mesentérica e circulação venular.
- Posicione o mouse no lado direito em uma placa transparente e segurar a cânula com fita adesiva. Use um pacote quente para evitar a hipotermia. Para prevenir a desidratação do tecido, gota 500 ul de NaCl a 0,9% sobre os intestinos.
- A microscopia de fluorescência de adesão bacteriana à circulação mesentérica
- Trabalhar em um quarto escuro. Use cotonetes para imobilizar os navios e visualizá-los sob um microscópio invertido.
- Topicamente aplicar 5 ul de uma solução 10 mM de Of o Ca2 + A23187 -ionophore dissolvido em DMSO. Após 10 s, injectar 100 ul bactérias marcadas (veja o passo 1) através do cateter jugular. Tome imagens de lapso de tempo. Após o experimento for concluída, a eutanásia o mouse de acordo com as directrizes aprovadas institucionais.
- Análise de Imagem
- Obter imagens ao vivo usando um microscópio de fluorescência invertido, capturado usando uma câmera preto e branco e desenvolvido usando qualquer software de imagem. Aplicar o tempo de exposição automática e optimização de contraste específico para o equipamento utilizado.
- Adquirir imagens de lapso de tempo usando a ferramenta 'Aquisição' na barra de ferramentas (Aquisições multidimensionais - Time) utilizando 40 ciclos de 1.000 imagens / seg. Salve as imagens em um formato de arquivo de imagem apropriado.
- Processar imagens usando software de análise ImageJ para medir a área de sinal fluorescente por imagem. Definir o limite para definir valores de limite inferior e superior, segmentando imagens de escala de cinza para features de interesse. Identificar a região de interesse (vaso sanguíneo) e medir a área limitada para o limiar e a região de interesse. Compare a adesão bacteriana, expressa em área fluorescente usando qualquer software de estatística ou gráficos.
Resultados
S. aureus adesão ao VWF, matriz subendotelial e células endoteliais é um fenômeno dependente tensão de cisalhamento
Para enfatizar o papel da tensão de cisalhamento na interação entre S. aureus e VWF, foi realizada ao longo de VWF perfusões lamelas revestidas com diferentes taxas de corte (uma vista geral esquemática do modelo de perfusão in vitro é apresentado na Figura 1. A adesão de S. aureus para o vWF aumentou com o aumento das taxas de cisalhamento de 250 s-1 para 2000 s-1 (Figura 2), indicando que as forças de cisalhamento elevadas, mas não inibem a reforçar a adesão de bactérias a VWF.
A fim de investigar a contribuição de VWF a aderência bacteriana ao colagénio, o principal componente da matriz subendotelial, que perfundido marcado fluorescentemente S. aureus ao longo do colagénio na presença ou ausência de VWF. Na ausência do vWF, adesão de S. umaUreus ao colágeno diminuiu com o aumento das taxas de cisalhamento. No entanto, quando VWF estava presente no meio, a adesão de S. aureus aumentou com o aumento da velocidade de cisalhamento (Figura 3).
O modelo de fluxo in vitro também nos permite verificar a adesão das bactérias às células endoteliais sob fluxo. Nós perfundidos com HUVECs marcado fluorescentemente S. aureus a taxas de corte de 500 a 2000 s-1. Onde indicado, células HUVEC foram activadas com um Ca 2+ -ionophore, para provocar a libertação de VWF. Ativação de células endoteliais ea liberação subseqüente VWF, aumento da adesão de S. aureus (Figura 4A), que se formou padrões típicos de "cadeia" como-marcado por fluorescência de agregados bacterianos alinhadas na direcção da força de corte (Figura 4B), sugerindo a ligação das bactérias ao longo de uma molécula de VWF esticado linear.
Inicial in vivoa aderência de bactérias nas veias splanchnic é mediada por VWF
Desde S. aureus é capaz de aderir a VWF, utilizou-se ratinhos de tipo selvagem (vWF + / +) e ratinhos deficientes em VWF (vWF - / -) para investigar a aderência de bactérias à parede do vaso activadas in vivo. Videomicroscopia em tempo real de veias esplâncnicas permitiu a visualização in vivo de circular marcado fluorescentemente S. aureus (vista geral esquemática do sistema de perfusão in vivo é representado na Figura 5).
Depois da activação farmacológica do endotélio por Ca 2+ -ionophore, observou-se uma rápida acumulação local de bactérias individuais e agregados das bactérias à parede do vaso de ratinhos WT (suplementar vídeos 1 e 2). Quase nenhuma aderência de bactérias foi observada na parede do vaso de vWF activado -deficient ratinhos (suplementar Vídeo 3) em comparação com a adesão em ratinhos WT (Figura 6). A ausência de VWF diminui a capacidade de S. aureus para aderir à parede do vaso activado.
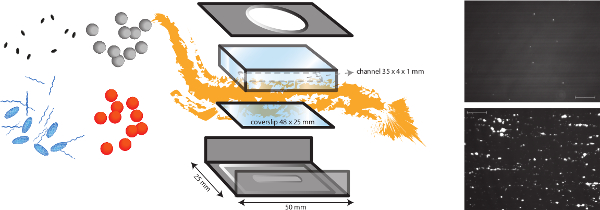
Figura 1. Uma representação esquemática do modelo de fluxo in vitro. O modelo de fluxo em um modelo in vitro é multifuncional, que permite o estudo de diferentes mecanismos dependentes de cisalhamento, tal como a adesão bacteriana à matriz subendotelial, mas também a formação de trombos. A câmara de fluxo micro-paralelo é colocada sobre uma lamela (plástico ou vidro) com diferentes revestimentos de proteínas e células endoteliais. A adesão de bactérias diferentes (laranja e pontos cinzentos) podem ser analisados, e o impacto da presença de proteínas do plasma, plaquetas e sangue total pode ser avaliada. Marcadores fluorescentes para plaquetas (azul) ou ovais fibrinogbr (cordas azul) pode ser utilizado em combinação com inibidores de diferentes formas ovais (pretas) para distinguir factores bacterianos e hospedeiros. Imagens representativas de adesão bacteriana de S. aureus para revestimento de colágeno na presença (parte inferior) ou ausência (superior) do VWF são mostradas (barra de escala é de 100 mm). Por favor clique aqui para ver uma versão maior desta figura.
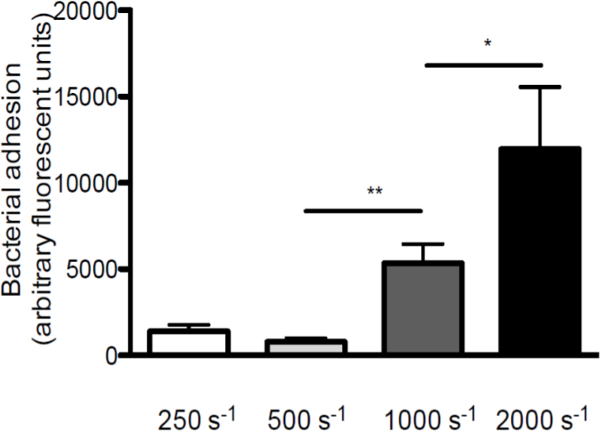
Figura 2. Adesão de S. aureus para VWF aumenta com o aumento da velocidade de cisalhamento. perfusão micro-câmara de fluxo paralelo através revestido de VWF (50 ug / ml) com marcado fluorescentemente S. aureus Newman a taxas de corte de 250 a 2000 s -1 (seg-1) em meio (n> 5). Todos os resultados são expressos como média ± SEM. * P <0,05, ** p <0,01.
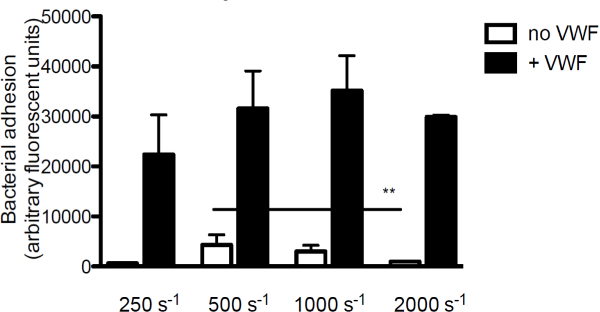
Figura 3. Adesão de S. aureus ao subendotélio é cisalhamento e VWF dependente. perfusão câmara de fluxo Micro-paralelo sobre colágeno revestido (160 ug / ml) com fluorescente etiquetado S. aureus Newman a taxas de corte de 250 a 2000 s -1 em média (n> 5). VWF (60 ug / ml) estava presente no meio onde indicado. Todos os resultados são expressos como média ± SEM. ** P <0,01.
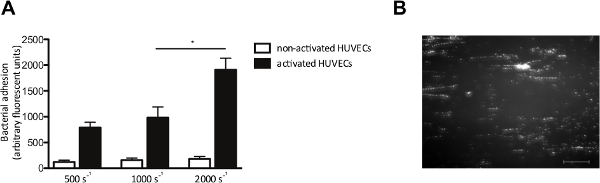
Figura 4. A adesão de S. aureus às células endoteliais activadas é perfusão câmara de fluxo de cisalhamento dependente. Micro-paralela sobre as células endoteliais. (A) As células endoteliais da veia umbilical humana foram activadas com o Ca2 + Uma -ionophore23187 (0,1 mM) seguido de uma perfusão de 10 minutos marcado por fluorescência S. aureus Newman a taxas de corte de 500 a 2000 s -1 em média (n> 5). Todos os resultados são expressos como média ± SEM. * P <0,05. (B) Imagem de micro-câmara de fluxo paralelo perfusão sobre HUVECs activadas com S. aureus a uma taxa de cisalhamento de 1,000 sec -2. S. aureus forma cordas de comprimento ± 200 microns, o que sugere adesão a multímeros VWF (barra de escala é de 100 mm). Por favor clique aqui para ver uma versão maior desta figura.

Figura 5. Uma visão esquemática do modelo de perfusão mesentérica in vivo. Um cateter na veia jugular direita (linha amarela) é inserido para a administração de fluorbactérias escently marcados (pontos laranja), anestésicos ou outros componentes adicionais tais como inibidores farmacêuticas e anticorpos. A cavidade peritoneal é aberto e o mesentério é espalhado para visualizar os vasos sanguíneos (venosas e arteriais) sob um microscópio de fluorescência. Depois da activação farmacológica do endotélio por uma -ionophore Ca2 +, o que induz a libertação de VWF, as bactérias podem ser injectados através do cateter da veia jugular. Microscopia vídeo intravascular em tempo real permite a visualização in vivo de circulação de bactérias fluorescente etiquetado e conseqüente formação de bactérias em plaquetas trombos. Por favor clique aqui para ver uma versão maior desta figura.
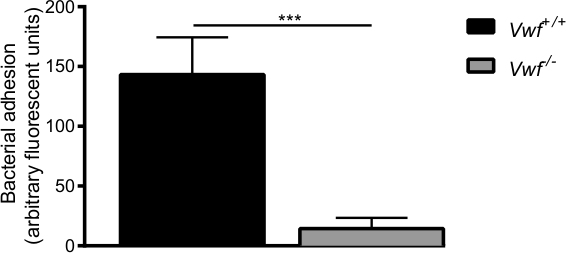
Figura 6. A adesão inicial de S. aureusao endotélio activado in vivo é mediada por VWF In vivo modelo de perfusão venosa mesentérica com C57Bl / 6- VWF + / + e C57Bl / 6- VWF -. / - ratos. A adesão das marcado fluorescentemente S. aureus para a parede do vaso activados localmente é significativamente mais baixa em vWF - / - ratos. Todos os resultados são expressos como média ± SEM. *** P <0,001, n> 7.
Vídeo 1: aderência em tempo real de S. aureus à parede do vaso ativado em VWF + / + camundongos. Por favor clique aqui para ver este vídeo.

Vídeo 2: em tempo real a formação de agregados e embolização de S. aureus em VWF + / + camundongos. Por favor clique aqui para ver este vídeo.

Vídeo 3: adesão em tempo real de S. aureus à parede do vaso ativado em VWF - In vivo modelo de camundongos perfusão mesentérica com VWF + / + e VWF - - /. / - ratos. Cinco ul de uma Ca 2+ -ionophore (10 mM) foi aplied à região do leito vascular visualizada. Uma suspensão de carboxi-fluoresceína-rotulados S. aureus foi injectada através do cateter da jugular. A circulação mesentérica foi visualizada sob um microscópio invertido. Por favor clique aqui para ver este vídeo.
Discussão
A tensão de cisalhamento é um fator crucial para a adesão bacteriana início à parede do vaso e para a geração subseqüente de endovascular ou vegetações endocárdicas e infecções metastáticas 4,5. Descrevemos complementar in vitro e em modelos in vivo para estudar a patogénese de infecções endovasculares sob tensão de corte fisiológicas. Estes modelos nos permitiram identificar proteína de ligação do fator de von Willebrand (vWbp) como o principal S. proteína aureus para interagir sob fluxo com uma parede vascular lesada expondo VWF 4.
Infecções endovasculares, e endocardite infecciosa em particular, são motivo de preocupação não só devido à falência de órgãos induzida pela sepse e morte, mas também por causa de metastáticos ('') complicações locais e distantes. Para causar endocardite infecciosa e infecções metastáticas, as bactérias têm a aderir à parede do vaso e, portanto, resistir à tensão de corte do fluxo de sangue. Maisestudos sobre factores de virulência bactérias foram realizados em condições estáticas. No entanto, essas interações estabelecidas podem não resistir a forças de cisalhamento e estudos em condições de escoamento pode revelar novos fatores, previamente desconhecidos em interação bactéria-hospedeiro.
Utilizando a câmara de fluxo micro-Paralelamente, e outros mostraram a importância de VWF para adesão vascular. Sob tensão de cisalhamento, VWF desenvolve-se progressivamente a partir de sua estrutura globular de descanso, e expõe o domínio A1 que interage com as plaquetas através de seu receptor GPIb 6. Câmaras de fluxo têm sido amplamente utilizados para estudar a função plaquetária 7.
Notavelmente, também S. aureus adesão sob fluxo requer VWF, e em particular o domínio A1 que está exposto em cima de cisalhamento. Identificamos vWbp para mediar a ligação VWF. vWbp é uma coagulase que contribui para S. aureus fisiopatologia pela ativação da protrombina do hospedeiro. Staphylothrombin, os resulting complexo de um coagulase bacteriana e protrombina, converte fibrinogênio em fibrina insolúvel 8,9. Os nossos estudos demonstraram que vWbp não se limita a activar a protrombina, mas provoca a formação de agregados-bactérias para a fibrina das plaquetas, o que melhora a adesão aos vasos sanguíneos sob fluxo 4,10,11.
O modelo de câmara de fluxo in vitro permite estudar os diferentes intervenientes na adesão bacteriana aos componentes celulares ou matriz. Factores de virulência da bactéria pode ser estudada usando mutantes ou bactérias inofensivas que expressam proteínas de superfície específicas. Em alternativa, os inibidores farmacológicos ou anticorpos de bloqueio podem ser adicionados ao meio na câmara de escoamento. O papel dos factores do hospedeiro, tais como diferentes constituintes da matriz extracelular podem ser estudados utilizando lamelas com diferentes revestimentos. As lamelas pode também ser coberta com células endoteliais, dos quais o estado de activação podem ser modulados pela adição de estimuladores específicos. Apata a partir da parede vascular, a contribuição das células do sangue do hospedeiro e proteínas do plasma pode ser estudado através da adição destes factores para o meio que se escoa. Assim, diferentes condições de complexidade crescente podem ser estudadas em condições padronizadas de fluxo laminar para desvendar as interacções que permitem que as bactérias de aderirem à parede vascular in vivo.
Interacções identificados no modelo in vitro são posteriormente estudado num modelo animal para testar a sua relevância num organismo complexo. Outros modelos in vivo para estudar interacções dinâmicas sob fluxo foram descritas, tais como a dobra cutânea câmara de hamster dorsal 12 e o modelo cremaster 13. Em comparação, o modelo de perfusão mesentérica descrito aqui oferece várias vantagens devido à sua facilidade de utilização, a possibilidade de variar acolher fundo genético dos ratos e para avaliar as intervenções farmacológicas.
Em conclusão, os modelos descritosoferecer a possibilidade de estudar proteínas de superfície não só de S. aureus, mas de muitos outros microorganismos em diferentes contextos de acolhimento, para entender melhor a patogênese das infecções vasculares.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi financiado pelo Fonds voor Wetenschappelijk Onderzoek (FWO) Vlaanderen G0466.10, 11I0113N; "Eddy Merckx Research Grant" eo "Sporta pesquisa Grant" para Cardiologia Pediátrica, UZ Leuven, Bélgica (JC); o Center for Molecular e Biologia Vascular é suportado pelo KU Leuven Programmafinanciering (PF / 10/014), pela "Geconcentreerde Onderzoeksacties" (GOA 2009/13), da Universidade de Leuven e uma bolsa de investigação da Boehringer Ingelheim-.
Materiais
| Name | Company | Catalog Number | Comments |
| Brain Heart Infusion (BHI) | BD Plastipak | 237500 | |
| Tryptic Soy Broth (TSB) | Oxoid | CM0129 | |
| Phosphate Buffered Saline (PBS) | Invitrogen | 14190-169 | D-PBS |
| 5(6)-carboxy-fluorescein N-hydroxysuccinimidyl ester | Sigma-Aldrich | 21878-25MG-F | fluorescent labeling |
| Bovine Serum Albumin Fraction V (BSA) | Roch | 10 735 086 001 | |
| Haemate-P | CSL Behring | PL 15036/0010 | VWF |
| Horm collagen | Takeda | 10500 | collagen |
| 1-well PCA cell culture chambers | Sarstedt | 94.6140.102 | plastic slips |
| Temgesic | Reckitt Benckiser | 283716 | bruprenorphine |
| Anesketin (Ketamin hydrochloride 115 mg/ml (100 mg/ml ketaminum)) | Eurovet | BE-V136516 | ketamin |
| XYL-M 2% (xylazine hydrochloride 23.32 mg/ml (20 mg/ml xylazine)) | VMD Arendonk | BE-V170581 | xylazine |
| 2 french intravenous catheter green | Portex | 200/300/010 | |
| 0,9% Sodium chloride (NaCl) | Baxter Healthcare | W7124 | |
| cotton swabs | International Medical Product | 300230 | |
| Ca2+-ionophore solution A23187 | Sigma-Aldrich | C7522-10 MG | |
| 26 gauge 1 ml syringe | BD Plastipak | 300013 | |
| 26 gauge 1 ml syringe with needle | BD Plastipak | 300015 | intra-peritoneal injection |
| Centrifuge 5810-R | Eppendorf | 5811 000.320 | |
| Glass cover slips (24x50) | VWR | BB02405A11 | Thickness No, 1 |
| PHD 2000 Infusion | Harvard Apparatus | 702100 | High-accuracy Harvard infusion pump |
| Axio-observer DI | Carl-Zeiss | Inverted fluorescence microscope | |
| ImageJ | National Institute of Health | Analysis software | |
| Graphpad Prism 5,0 | Graphpad Software | Analysis software | |
| AxioCam MRm | Carl-Zeiss | Black and white camera |
Referências
- Vanassche, T., Peetermans, W. E., Herregods, M. C., Herijgers, P., Verhamme, P. Anti-thrombotic therapy in infective endocarditis. Expert Rev Cardiovasc Ther. 9 (9), 1203-1219 (2011).
- Heying, R., van de Gevel, J., Que, Y. A., Moreillon, P., Beekhuizen, H. Fibronectin-binding proteins and clumping factor A in Staphylococcus aureus experimental endocarditis: FnBPA is sufficient to activate human endothelial cells. Thromb Haemost. 97 (4), 617-626 (2007).
- Pappelbaum, K. I., et al. Ultralarge von Willebrand factor fibers mediate luminal Staphylococcus aureus adhesion to an intact endothelial cell layer under shear stress. Circulation. 128 (1), 50-59 (2013).
- Claes, J., et al. Adhesion of Staphylococcus aureus to the vessel wall under flow is mediated by von Willebrand factor–binding protein. Blood. 124 (10), 1669-1976 (2014).
- Thiene, G., Basso, C. Pathology and pathogenesis of infective endocarditis in native heart valves. Cardiovasc Pathol. 15 (5), 256-263 (2006).
- Sixma, J. J., Schiphorst, M. E., Verweij, C. L., Pannekoek, H. Effect of deletion of the A1 domain of von Willebrand factor on its binding to heparin, collagen and platelets in the presence of ristocetin. Eur J Biochem/FEBS. 196 (2), 369-375 (1991).
- Theilmeier, G., Lenaerts, T., Remacle, C., Collen, D., Vermylen, J., Hoylaerts, M. F. Circulating activated platelets assist THP-1 monocytoid/endothelial cell interaction under shear stress. Blood. 94 (8), 2725-2734 (1999).
- Bjerketorp, J., Jacobsson, K., Frykberg, L. The von Willebrand factor-binding protein (vWbp) of Staphylococcus aureus is a coagulase. FEMS Microbiol Lett. 234 (2), 309-314 (2004).
- Friedrich, R., et al. Staphylocoagulase is a prototype for the mechanism of cofactor-induced zymogen activation. Nature. 425 (6957), 535-539 (2003).
- Vanassche, T., et al. Fibrin formation by staphylothrombin facilitates Staphylococcus aureus-induced platelet aggregation. Thromb Haemost. 107 (6), 1107-1121 (2012).
- Vanassche, T., et al. The role of staphylothrombin-mediated fibrin deposition in catheter-related Staphylococcus aureus infections. J Infect Dis. 208 (1), 92-100 (2013).
- Buerkle, M. A., Lehrer, S., Sohn, H. Y., Conzen, P., Pohl, U., Krötz, F. Selective inhibition of cyclooxygenase-2 enhances platelet adhesion in hamster arterioles in vivo. Circulation. 110 (14), 2053-2059 (2004).
- Kim, K. H., Barazia, A., Cho, J. Real-time imaging of heterotypic platelet-neutrophil interactions on the activated endothelium during vascular inflammation and thrombus formation in live mice. J Vis Exp. 2 (74), (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados