É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Orthotopic Implantação e Acompanhamento Peripheral Imune celular no Modelo II-45 Rat Singênico mesotelioma
Neste Artigo
Resumo
A geração de um modelo de rato ortotópico de mesotelioma pleural maligno por implantação de II-45 células de mesotelioma na cavidade pleural de ratos imuno-competentes é apresentado. Um método de citometria de fluxo para analisar sete subconjuntos de células imunitárias em animais a partir destes uma amostra de sangue de 25 uL é também descrito.
Resumo
O enorme aumento do interesse em tratamentos de base imunológica para o cancro, tais como vacinas e inibidores de checkpoint imunes, e o aumento da compreensão do papel do microambiente do tumor, em resposta ao tratamento, apontar em conjunto para a necessidade de modelos ortotópicos imuno-competentes para testes pré-clínicos destas novas terapias. Este artigo demonstra como criar um modelo de rato imuno-competente orthotopic de mesotelioma maligno pleural. Monitorizar a progressão da doença em modelos ortotópicos é confundida com a localização interna dos tumores. Para monitorar a progressão da doença longitudinalmente e seu efeito sobre as células imunitárias, neste e noutros modelos de rato de cancro circulantes, fluir um único tubo de ensaio de citometria requerendo apenas 25 ul de sangue total é descrita. Isto proporciona a quantificação precisa de sete parâmetros imunológicos: linfócitos totais, neutrófilos e monócitos, bem como os subconjuntos de células T CD4 e CD8, as células B e as células assassinas naturais. Diferentes subsETS destes parâmetros são úteis em diferentes circunstâncias e modelos, com a proporção de linfócitos para neutrófilos com a maior utilidade para a monitorização progressão da doença no modelo de mesotelioma. Analisando os níveis de células imunológicas que usam este método único tubo pode também auxiliar no acompanhamento da resposta aos tratamentos de base imunológica e compreender os mecanismos subjacentes que levam ao sucesso ou fracasso do tratamento em circulação.
Introdução
Mesotelioma maligno (MM) é um tumor maligno agressivo que surge a partir de células transformadas, em que a membrana (mesotélio) que reveste o pulmão e cavidades abdominais, coração e órgãos reprodutivos internos, e é o tumor primário mais comum do pulmão ou cavidade pleura 1,2 . A exposição a fibras de amianto é responsável por 80% de todo o MM, e enquanto a proibição de utilização de amianto foram introduzidos há décadas na maioria dos países ocidentais, a sua utilização generalizada na comunidade deixou um legado mortal. A Organização Mundial de Saúde estima que 107.000 pessoas no mundo morrem anualmente de doenças relacionadas ao amianto, com taxas de mortalidade continuam a aumentar. Uma nova onda de incidência não-ocupacional também está surgindo e há pouca compreensão de quando, e em que nível este atingirá o pico 3.
A maioria das pessoas com MM são diagnosticados tardiamente, quando a quimioterapia sistêmica representa uma das únicas opções viáveis 4. Maioria effective quimioterapia e "padrão de cuidado" atual (pemetrexed em combinação com cisplatina 5) foi identificado mais de 10 anos atrás. No entanto falha deste tratamento é inevitável e não há opções de segunda linha comprovadas, deixando os pacientes com um prognóstico sombrio e sobrevida média de apenas 12 meses 2. Portanto, existe uma necessidade não satisfeita urgente de tratamentos mais eficazes. Apesar do exame de uma série de novas terapias em ensaios clínicos nenhum resultou em mudanças na prática. Isto é devido, em parte, à baixa (5%) transferência dos resultados pré-clínicos, geralmente realizados em modelos de xenoenxerto de ratinho, para definir o clínico 6-8. Tais modelos não recapitular fielmente os aspectos complexos do microambiente do tumor que ocorre em locais não-fisiológicos, frequentemente, na ausência de um sistema imune funcional 9.
Modelos ortotópicos sing�icos criar um ambiente de tumor significativamente mais realista do que o commonly usado modelos de xenotransplante subcutâneos como os tumores ocorrem no local fisiológica correta com um 10,11 sistema imunológico intacto. Quanto maior o tamanho do rato aumenta a sua utilização como um modelo de doença de roedores, especialmente em estudos de drogas onde o sangue de série empates são necessários para avaliar a resposta ao tratamento e toxicidade 12. Além disso, em modelos nos quais monitorar a progressão da doença é difícil, devido à localização dos tumores (tal como na cavidade pleural), a capacidade de monitorizar a progressão da doença utilizando factores encontrados na circulação é extremamente atraente. A geração de um modelo ortotópico singeneicos de mesotelioma pleural utilizando ratos imuno-competentes é descrito. Além disso, um método fácil e relativamente não invasivo para monitorizar a progressão da doença pleural medindo circulantes células do sistema imunológico, também é descrito.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Todos os procedimentos que envolvem animais foram realizados em conformidade com as recomendações contidas no Código de Prática australiano para o Cuidado e Utilização de animais para fins científicos. O protocolo deste estudo foi aprovado pelo Comitê Animal Care e Hospital de Ética da Royal North Shore. Feminino ratos Fischer 344 (F344, 150-200 g) foram mantidos no Centro de Kearns, Instituto Kolling em condições padrão (12 horas de luz / ciclos escuros e livre acesso a comida e água).
Nota: Um diagrama de fluxo para todos os procedimentos experimentais é apresentada na Figura 1.
1. Preparação de células para Implantação
- Cultura do mesotelioma rato linha celular de II-45 (também conhecida como IL-45; derivados por introdução peritoneal de amianto crocidolite) em meio RPMI 1640 (RPMI) meio suplementado com soro a 10% de bovino fetal (FBS) e crescer em condições padrão (37 ° C incubadora humidificada com 5% de CO 2). Maintaem por passagens e sub-cultura, a cerca de 1:50 duas vezes por semana num frasco de 75 cm 2.
- Preparar reagentes para cultura de células e as alíquotas quente a 37 ° C. Reagentes necessários incluem meios RPMI isento de soro (SFM), RPMI com FBS a 10%, solução salina tamponada com fosfato (PBS) e 0,5% de tripsina-EDTA.
- Células de cultura para a implantação, aproximadamente, 70-80% de confluência. Isto assegura que eles estão em fase de crescimento linear.
- Células colheita descartando os meios de comunicação, lavando uma vez com 5 ml de PBS estéril e, em seguida, adição de 3 ml de 0,5% de tripsina-EDTA.
- Retorno frascos à incubadora durante aproximadamente 5 min até que todas as células tornam-se não aderentes.
- Uma vez que as células são não aderentes, adicionar 3 ml de meio RPMI com FBS a 10% para inactivar a tripsina. Coletar e centrifugar células a 300 xg por 3 min.
- Lava-se a pelete de células em 10 ml de SFM e centrifugar novamente a 300 xg durante 3 min.
- Lave o peletizado de células novamente com 10 ml de SFM e centrifugar como acima.
- Ressuspender as células em 10 ml de SFM e executar uma contagem de células utilizando um hemocitómetro ou instrumentação semelhante.
- Dilui-se as células de modo que de 100 ul contém a quantidade de células a serem implantadas.
Nota: O crescimento do tumor foi demonstrada em uma dose tão baixa quanto 100 células em 100 ul, mas uma dose padrão é de 500.000 células em 100 ul. - Preparar células em meios suficientes para o número de ratos para ser implantado (por exemplo, 100 uL / rato) e de pelo menos 0,5 ml extra para compensar as perdas de priming e o volume morto da agulha.
- Prepare suficiente SFM (sem células) a serem implantados em ratos de controlo (isto é, 100 ul / rato) e de pelo menos 0,5 ml adicional.
Nota: As células e SFM agora está pronto para implantação. Eles devem ser mantidos a 37 o C e implantou dentro de 2 horas de colheita para manter a viabilidade.
2. Ensaios in vivo implantação de células
- Colocar o rato F344 (> 13 semanas de idade) na câmara de indução e anestesiar usando 1,4% inalação de isoflurano (ou o método em uso na instalação). Uma vez que o rato parece ser jogada no sono-la da câmara para um cone de nariz (com 1,4% de isoflurano fluir), coloque-o em suas costas com o peito virado para cima (vista ventral). Isto permite que os órgãos internos para resolver distância da cavidade torácica. Verificar reflexos de acordo com protocolos institucionais para assegurar o rato é completamente anestesiados.
- Raspar a área certa regio costalis (peito) para remover a pele.
- Limpar a área rapada com 80% v / v de etanol.
- Identificar o local da injecção: no lado direito, encontrar a segunda glândula começando craniana. O local de injecção é de 0,5 cm proximal a este, entre os dias 3 e 4 da nervura da extremidade caudal da caixa torácica. (Figura 2A).
- Misture delicadamente as células II-45 para voltar a suspender. Desenhar lentamente a suspensão de células (ou SFM para ratos controle) para um 1 ml &# 160; seringa sem agulha acoplada. Se uma agulha é ligado para a elaboração de células existe o potencial para as células a crescer ao longo da linha de injecção com agulhas. Anexar um 23G x 1 ¼ agulha. Primeiro a agulha e remover as bolhas de ar.
- Uma vez que a seringa ea agulha estão prontos, coloque a 20 mm de comprimento e 5 mm de diâmetro espaçador sobre o eixo da agulha. Isto é utilizado para evitar que a agulha de penetrar muito profundamente na cavidade pleural durante a injecção. Aproximadamente 5 mm-12 mm de agulha exposta é suficiente para a penetração através das nervuras, sem danificar qualquer dos órgãos.
- Insira lentamente a agulha entre as costelas, chamar de volta na seringa para garantir um vaso sanguíneo foi perfurado (o sangue não deve aparecer na seringa), em seguida, injectar 100 ul células ou SFM. (Figura 2B).
- Remova a agulha e rolar suavemente o rato de lado a lado para espalhar células na cavidade torácica.
- Coloque o rato em uma gaiola e verificar se há recuperação. ºe rato deve ser acordado dentro de 1 min e começando a se movimentar.
- Repetir para cada rato, utilizando uma agulha nova. Reutilizar a mesma agulha vai resultar no crescimento celular ao longo da linha de injecção da agulha.
- Monitorar o bem-estar dos animais diariamente.
- Eutanásia dos animais nos pontos de extremidade eticamente definidos como regido pelo comitê de ética institucional animais. Os pontos finais para os ratos éticos nestas experiências foram perda de peso superior a 10% ou respiração ofegante.
3. Colheita de sangue da veia da cauda
- Se o sangue deve ser coletado imediatamente pós-implante de células, manter o rato anestesiado. Se a amostragem de sangue em outro ponto do tempo, anestesiar o rato usando 1,4% inalação de isoflurano. Verificar reflexos de acordo com protocolos institucionais para assegurar o rato é completamente anestesiados.
- Colocar o rato para o lado e localizar uma veia lateral da cauda.
- Esterilizar a cauda com etanol 80% e rotular um 0,5 ml EDTA ctubo ollection.
- Para a coleta de sangue, sempre começar na extremidade caudal da cauda (cerca de um terço do caminho ao longo). Isto permite que novas tentativas mais perto da extremidade craniana da cauda no caso da primeira tentativa não for bem sucedida. Nunca resample caudal pois isso pode causar um coágulo de sangue.
- Posicione um 23G x 1 ¼ agulha paralela à veia lateral e deslize-o para dentro da veia em um ângulo raso para que ele penetra aproximadamente 10 mm (Figura 3A).
- Nota: Se a veia foi perfurado com sucesso sangue será visível na extremidade de fixação da agulha (Figura 3B).
- Uma gota de sangue irá formar na cauda no local da punção. Recolha este sangue com uma pipeta e transferido para as rotulados 0,5 ml (ou menor) tubo de coleta de EDTA. Para o ensaio de células imunitárias 25 uL é suficiente. Aplique gaze com pressão para perfurar site até o sangramento parar.
- Flick o tubo de sangue para misturar o sangue e EDTA a prcoagulação do evento. Manter o tempo entre a recolha de sangue e de mistura com o EDTA o mais curto possível para evitar a coagulação.
- Quando recolha de sangue a partir de múltiplas lojas ratos amostras EDTA-sangue em um rack em temperatura ambiente, até a análise. Processo de sangue dentro de 2 horas da coleta.
4. Preparação de Amostras para Immune Profiling celular Usando o método baseado no Bead
Nota: Este método baseia-se na plataforma única usando tubos de contagem absoluta disponível comercialmente que têm um número conhecido de grânulos para cada amostra. Estes tubos contêm grânulos liofilizado que se dissolvem durante a preparação da amostra, liberando as contas. Os grânulos são marcado por fluorescência e por gating na população de esferas, as contagens absolutas podem ser calculados.
- Verifique se o EDTA amostra de sangue total é bem misturado, colocando-o num misturador rotativo lento por vários minutos. Rotular um tubo de contagem absoluta para cada amostra. Uma pelete que contém as esferas deve ser visível por baixo tele titular talão de metal no fundo do tubo.
- Transferir 25 uL de EDTA sangue completo num tubo de contagem absoluta marcado. O sedimento talão irá dissolver-se após a adição do sangue.
- Para cada tubo de adicionar 20 ul de coquetel / B / Natural Killer (NK) de células T anti-rato, 10 ul de anti-rato CD8a PE, 10 ul de anti-rato CD4 (domínio 1) com FITC e 10 ul de anti-rato CD45 PE / Cy7 (Figura 4A). Os fluoróforos estão definidos na Tabela 1.
- Centrifugar brevemente o tubo (300 xg) para assegurar que os anticorpos e as células estão no fundo do tubo e não preso ao lado do tubo. Vortex para misturar e incubar durante 15 min à temperatura ambiente.
- Para lisar as células vermelhas do sangue adicionar 400 ul de Tris 10 mM, tampão de cloreto de amónio 0,15 M (pH 7,5) e agitar com vortex para misturar. Lise é completa quando a amostra aparece translúcida e não nublado (Figuras 4B e C). A falha para lisar completamente a amostra irá conduzir a um aumentofundo d e conta falsamente elevados na análise por citometria de fluxo.
5. Citometria de Fluxo de Processamento de Amostras
Nota: Executar em uma cor de 4 citômetro de fluxo.
- Abra o software em modo de aquisição e um novo modelo com 8 lotes conforme representado na Figura 5.
- Ajustar as configurações do aparelho com os listados na Tabela 1 e configurar portão R1 (FITC [FL-1] versus APC [FL-4]), Figura 5AI) para contar as partículas fluorescentes. As outras portas não são tão importantes nesta fase de aquisição, mas vai ser necessário para análise. As contas de contagem absolutos utilizados neste protocolo contêm corantes fluorescentes e pode ser detectado em qualquer canal embora são mais fracos no canal de azul.
- Usando uma amostra de sangue de controlo preparado, vortex e depois carregar no citômetro e correr a uma velocidade baixa (12 mL / min) no modo de configuração de modo portões de aquisição de dados pode ser ajustado.
- Defina a aquisição derecolher 10.000 eventos no portão talão R1.
- Configure uma pasta para gravar dados e definir o número de arquivos e arquivo de amostra etiqueta no menu de aquisição.
- Carregar a amostra a ser analisada para a citómetro e ajustar a taxa de fluxo para o meio (35 ul / min). Executar cada amostra com a mesma taxa de fluxo. A taxa de fluxo pode necessitar de ser variado para baixo (12 ul / min) ou alta (60 ^ l / min), mas forma é geralmente apropriada. A este ritmo que leva cerca de 90 a 120 segundos para adquirir 10.000 eventos talão para cada amostra.
- Uma vez que a amostra é carregado ver os gráficos de dispersão para garantir que os eventos estão aparecendo no portão talão R1. Inicialmente pode haver alguma instabilidade na pressão da amostra causando tração nos gráficos de dispersão. Aguarde por esta estabilize.
- Uma vez estabilizado, clique em adquirir e permitir exemplo para executar. Uma vez que o citômetro terminou aquisição de 10.000 eventos de talão em R1 o citômetro vai parar de adquirir e guardar todos os dados.
- Retirar a amostra e descartar fluir tuser. O citômetro agora está pronto para a próxima amostra. Executar todas as amostras e depois prosseguir para o modo de análise.
6. Análise de células imunitárias
Nota: estratégias de propagação e álgebra booleana são usados para definir cada população de células. Álgebra booleana é um método de análise lógica base que permite a várias operações em uma única definição. O software de análise de citometria de fluxo da (por exemplo, BD CELLQuest) permite a utilização de álgebra booleana. As equações são usadas para explicar activamente para a reactividade negativa significativa que auxilia a definir a célula para identificar mais especificamente cada população de células. "Regiões" são usados para definir uma "porta". Regiões definir um espaço tridimensional 2 Considerando portas pode ser composto por numerosas regiões ligadas por operadores algébricas (+, *, -, definidos na Tabela 2).
- Mude o modo de software para análise. Um modelo de análise deve ser gerada para corresponder Figura 5 com as parcelas e portas mostrados.
- Analise cada arquivo individual (ou seja, cada amostra individual) separadamente. Configure portas R1 a R9 e, em seguida, para configurar os algoritmos para cada tipo de célula, tal como definido na Tabela 2 (também mostrado na Figura 5).
- Utilizar o contador para calcular as estatísticas de células de populações de células individuais definidas por portões e algoritmos (Tabela 2 e Figura 5). Os algoritmos irá ajustar automaticamente o número de células no contador de estatísticas de células.
- Calcular subconjuntos de células com a seguinte equação:
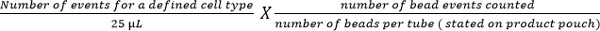
Nota: Número de eventos celulares contadas (por exemplo, eventos de células CD4 T) é enumerado usando a equação acima para dar o número de células por mL de sangue. Exemplos são mostrados na Figura 5.
Access restricted. Please log in or start a trial to view this content.
Resultados
O método utilizado neste trabalho para a geração de um modelo ortotópico de mesotelioma pleural utilizando células II-45 resultou em animais sucumbindo ao mesotelioma em um prazo reprodutível e rápida, sem ratos morrendo devido ao método de implantação. A titulação do número de células implantadas determinado que 1x 10 3 células foi o número mínimo requerido para um modelo totalmente penetrante (100% enxerto). O número diferente de células implantadas nos ratos alterou o curso de tempo da d...
Access restricted. Please log in or start a trial to view this content.
Discussão
Este artigo apresenta um método para a geração de um modelo de rato singeneico ortotópico de mesotelioma pleural e um método simples para monitorizar a progressão da doença através de amostragem de sangue longitudinal.
O modelo II-45 foi desenvolvido expondo 344 ratos Fischer às fibras de amianto 13. Embora esta exposição representa a verdadeira dinâmica de interações do sistema-host-imune amianto para mesotelioma patogênese, tem um tempo de latência longo (levando...
Access restricted. Please log in or start a trial to view this content.
Divulgações
The authors have nothing to disclose.
Agradecimentos
The syngeneic rat mesothelioma II-45 cell line was a kind gift from A/Prof. Emanuela Felley-Bosco, Zurich University.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| EDTA Collection tube (0.5 ml) | Greiner Bio One GmbH | 450480 | |
| Rat T/B/NK Cell cocktail | BD Pharmingen | 558509 | anti-Rat CD3 APC (IgM clone 1F4), anti-Rat CD45RA Fitc (IgG1 clone OX-33), anti-Rat CD161a PE (IgG1 Clone 10/78) |
| anti-RAT CD8a PE | Biolegend | 200608 | (IgG1vClone G28) |
| anti-Rat CD4 FITC (Domain 1) | Biolegend | 203406 | (IgG1 Clone OX-38) |
| anti-Rat CD45 PE/Cy7 | Biolegend | 202214 | (IgG1 Clone OX-1) |
| TruCount Tubes | Becton Dickinson | 340334 | Box of 50 absolute counting tubes |
| RPMI 1640 media | Life Technologies | 11875-119 | |
| foetal bovine serum (FBS) | Scientifix | FBS500-S (lot# 010101-1) | |
| trypsin-EDTA | Life Technologies | 15400-054 | |
| PBS tablets | Medicago AB | 09-9400-100 | |
| 23Gx1¼ Needle | Becton Dickinson | 302008 | |
| 1 ml Syringe | Becton Dickinson | 302 100 | |
| Fischer 344 Rat | Animal Resources Centre, Perth Australia | F344 | |
| I.S.O (Isoflurane USP) | Veterinary Companys Australia (VCA) | B7058 | |
| II-45 Rat Mesothelioma line | Zurich University | Note: The cell line was given as a gift and is not commercially available at the ATCC | |
| FACSCalibur 4 color | Becton Dickinson | 342975 | |
| TRIS-HCL | SIGMA | T3253 | |
| Ammonium Chloride | SIGMA | 9718 | |
| Anaesthetic Machine (The stinger) | Advanced Anaesthesia specialists | #00449 |
Referências
- Kao, S. C., et al. Malignant mesothelioma. Intern Med J. 40 (11), 742-7450 (2010).
- Zucali, P. A., et al. Advances in the biology of malignant pleural mesothelioma. Cancer Treat Rev. 37 (7), 543-558 (2011).
- Olsen, N. J., et al. Increasing incidence of malignant mesothelioma after exposure to asbestos during home maintenance and renovation. Med J Aust. 195 (5), 271-274 (2011).
- Zucali, P. A., et al. Thymidylate synthase and excision repair cross-complementing group-1 as predictors of responsiveness in mesothelioma patients treated with pemetrexed/carboplatin. Clin Cancer Res. 17 (8), 2581-2590 (2011).
- Vogelzang, N. J., et al. Phase III study of pemetrexed in combination with cisplatin versus cisplatin alone in patients with malignant pleural mesothelioma. J Clin Oncol. 21 (14), 2636-2644 (2003).
- Lowenstein, P. R., Castro, M. G. Uncertainty in the translation of preclinical experiments to clinical trials. Why do most phase III clinical trials fail? Curr Gene Ther. 9 (5), 368-374 (2009).
- Kamb, A. What's wrong with our cancer models. Nat Rev Drug Discov. 4 (2), 161-165 (2005).
- Yakisich, J. S. An Algorithm for the Preclinical Screening of Anticancer Drugs Effective against Brain Tumors. ISRN Pharmacol. 2012, 513580(2012).
- Basu, D., Herlyn, M. Defining microenvironments within mouse models that enhance tumor aggressiveness. Cancer Biol Ther. 8 (4), 380-381 (2009).
- Abolhassani, M., et al. Screening of well-established drugs targeting cancer metabolism: reproducibility of the efficacy of a highly effective drug combination in mice. Invest New Drugs. 4 (4), 1331-1342 (2011).
- Hudson, A. L., et al. Establishing a panel of chemo-resistant mesothelioma models for investigating chemo-resistance and identifying new treatments for mesothelioma. Sci Rep. 4, 6152(2014).
- Iannaccone, P. M., Jacob, H. J. Rats! Dis Model Mech. 2 (5-6), 206-210 (2009).
- Craighead, J. E., et al. Characteristics of tumors and tumor cells cultured from experimental asbestos-induced mesotheliomas in rats. Am J Pathol. 129 (3), 448-462 (1987).
- Hunter, S. D., et al. Lymphocyte subset analysis by Boolean algebra: a phenotypic approach using a cocktail of 5 antibodies and 3 color immunofluorescence. Cytometry. 15 (3), 258-266 (1994).
- Brando, B., et al. Cytofluorometric methods for assessing absolute numbers of cell subsets in blood. European Working Group on Clinical Cell Analysis. Cytometry. 42 (6), 327-346 (2000).
- Schnizlein-Bick, C. T., et al. Evaluation of TruCount absolute-count tubes for determining CD4 and CD8 cell numbers in human immunodeficiency virus-positive adults. Clin Diagn Lab Immunol. 7 (3), 336-343 (2000).
- Gajkowska, A., et al. Flow cytometric enumeration of CD34+ hematopoietic stem and progenitor cells in leukapheresis product and bone marrow for clinical transplantation: a comparison of three methods. Folia Histochem Cytobiol. 44 (1), 53-60 (2006).
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: the next generation. Cell. 144 (5), 646-674 (2011).
- Kao, S. C., et al. High blood neutrophil-to-lymphocyte ratio is an indicator of poor prognosis in malignant mesothelioma patients undergoing systemic therapy. Clin Cancer Res. 16 (23), 5805-5813 (2010).
- Kao, S. C., et al. Validation of prognostic factors in malignant pleural mesothelioma: a retrospective analysis of data from patients seeking compensation from the New South Wales dust diseases board. Clin Lung Cancer. 14 (1), 70-77 (2013).
- Burt, B. M., et al. Circulating and tumor-infiltrating myeloid cells predict survival in human pleural mesothelioma. Cancer. 117 (22), 5234-5244 (2011).
- Weir, C., et al. Streptavidin: a novel immunostimulant for the selection and delivery of autologous and syngeneic tumor vaccines. Cancer Immunol Res. 2 (5), 469-479 (2014).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados